Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.2 La Plata jun. 2016
HEMOSTASIA Y TROMBOSIS
Validación de un ensayo automatizado para determinar la actividad de cofactor de ristocetina del factor von Willebrand
Validation of an automated assay to determine activity of ristocetin cofactor of von Willebrand factor
Validação de um teste automatizado para determinar a atividade de cofator de ristocetina do fator von Willebrand
Cristina Duboscq1a, Marta Martinuzzo2b, Juan Manuel Ceresetto3a, Juan Carlos Otaso4b, Luis Barrera4b, José María Oyhamburu4b, Germán Stemmelin3a
1 Dra. en Ciencias Químicas. UBA.
2 Dra. en Ciencias Fisiológicas de la Universidad de Buenos Aires.
3 Médicos.
4 Bioquímicos.
a Servicio de Hematología del Hospital Británico de Buenos Aires.
b Grupo Bioquímico. Laboratorio Central del Hospital Italiano de Buenos Aires, Argentina.
CORRESPONDENCIA DRA. CRISTINA DUBOSCQ Servicio Hematología. Hospital Británico de Buenos Aires Solís 2171, CIUDAD AUTÓNOMA DE BUENOS AIRES E-mail: cduboscq58@hotmail.com
Resumen
La enfermedad de von Willebrand (EvW) se debe a un defecto, cuali o cuantitativo de la molécula del factor von Willebrand (VWF). Bajos niveles de VWF:Ag sugieren la EvW pero no distinguen los subtipos, por lo cual es necesario determinar también la funcionalidad del VWF para completar el diagnóstico. El método de referencia para estudiar la función del VWF es el ensayo del cofactor de ristocetina (VWF:RCo), basado en la habilidad del VWF para inducir la aglutinación de las plaquetas en presencia de ristocetina. Recientemente se han desarrollado métodos automatizados para determinar la actividad de cofactor de ristocetina. El objetivo fue evaluar el comportamiento del ensayo inmunoturbidimétrico automatizado VWF:RCo con el ensayo de actividad de VWF (VWF:Act) utilizado como screening de la EvW y con el ensayo tradicional de VWF:RCo por agregometría. La precisión intraensayo fue 3,1% y la precisión interensayo evaluada con el control normal fue de 3,2% mientras que con el control patológico se obtuvo un coeficiente de variación de 5,1%. Cuando se compararon los resultados de VWF:Act y VWF:RCo inmunoturbidimétrico en 60 pacientes, el coeficiente de correlación fue 0,96 con un bias -3,5%. En un subgrupo de 30 pacientes se comparó el VWF:Rco determinado por agregación y automatizada, y se obtuvo una correlación de 0,90 con un bias de 18,9%. Los valores de vWRCO obtenidos fueron, con un error total máximo permitido de 15%, estadísticamente comparables con aquellos determinados por el método VWF:Act y los valores de VWF:RCo obtenidos por agregometría en los pacientes estudiados.
Palabras clave: Factor von Willebrand; Cofactor de ristocetina; Factor von Willebrand antigénico; Métodos automatizados.
Summary
Von Willebrand disease (VWD) is caused by a defective qualitative or quantitative von Willebrand factor (VWF) molecule. Low VWF:Ag suggests but does not distinguish VWD subtypes. Therefore, it is also necessary to determine the functionality of VWF to complete the diagnosis. The reference method to study VWF function is the ristocetin cofactor assay (VWF:RCo) based on the VWF ability to induce platelet aggregation in the presence of ristocetin. Recently, automated methods for determining the activity of ristocetin cofactor have been developed. The aim of this study is to evaluate the performance of VWF:RCo automated immunoturbidimetric assay: with VWF activity assay (VWF:Act ) used as a screening of VWD and the traditional VWF:RCo test by aggregometry. Intra-assay precision was 3.1% and interassay precision was: 3.2% in normal control and 5.1% low control: When VWF:Act and immunoturbidimetric VWF:RCo results were compared in 60 patients, the correlation coefficient was 0.96 with a -3.5% bias. In a subset of 30 patients VWF:Rco was compared, determined by aggregation and in an automated manner, yielding a correlation of 0.90 with an 18.9% bias. VWO:Rco values obtained were –with a 15% allowable total error– statistically comparable with those determined by the VWF:Act method, and the VWF:RCo values determined by aggregometry in the patients studied.
Key words: Von Willebrand factor; Ristocetin cofactor assay; Automated methods.
Resumo
A doença de von Willebrand (DvW) ocorre devido a um defeito, qualitativo ou quantitativo da molécula do fator von Willebrand (VWF). Baixos níveis de VWF:Ag sugerem a EvW, mas não distinguem os subtipos, portanto é necessário determinar também a funcionalidade do VWF para completar o diagnóstico. O método de referência para estudar a função do VWF é o teste do cofator de ristocetina (VWF:RCo), baseado na habilidade de VWF para induzir a aglutinação das plaquetas em presença de ristocetina. Recentemente foram desenvolvidos métodos automatizados para determinar a atividade de cofator de ristocetina. O objetivo foi avaliar o comportamento do teste imunoturbidimétrico automatizado VWF:RCo com o teste de atividade de VWF (VWF:Act) utilizado como screening da EvW e com o ensaio tradicional de VWF:RCo por agregometria. A precisão intra-teste foi de 3,1% e a precisão inter-teste avaliada com o controle normal foi de 3,2% ao passo que com o controle patológico foi obtido um coeficiente de variação de 5,1%. Quando foram comparados os resultados de VWF:Act e VWF:RCo imunoturbidimétrico em 60 pacientes, o coeficiente de correlação foi de 0,96 com um Bias -3,5%. Num subgrupo de 30 pacientes se comparou o VWF:Rco determinado por agregação e automatizada, obtendo uma correlação de 0,90 com um bias de 18,9%. Os valores de VWF:Rco obtidos foram, com um erro total máximo permitido de 15%, estatisticamente comparáveis com aqueles determinados pelo método VWF:Act e os valores de VWF:RCo obtidos por agregometria nos pacientes estudados
Palavras-chave: Fator von Willebrand; Cofator de ristocetina; Fator von Willebrand antigênico; Métodos automatizados.
Introducción
La enfermedad de von Willebrand(EvW), descripta por Erik von Willebrand, es la alteración hemorragípara más frecuente (1)(2). Sus principales síntomas son sangrados muco-cutáneos como sangrado de nariz, del tracto gastrointestinal, sangrado por encías, menorragia y excesivo sangrado post trauma o post cirugía. Esta enfermedad se debe a un defecto, cuali o cuantitativo de la molécula del factor von Willebrand (VWF) (1-3). El VWF es una proteína multimérica compuesta por subunidades idénticas que presentan varios dominios funcionales: A1 que contiene el sitio de unión a la glicoproteína Ib (GPIb) plaquetaria; A3: sitio de unión al colágeno, C1 sitio de interacción con las integrinas y D-D3 sitio de unión al FVIII (4). Las principales funciones del VWF son promover la adhesión plaqueta-plaqueta y plaqueta sub endotelio (hemostasia primaria) así como unir y estabilizar al FVIII. La concentración plasmática de VWF en un momento está dada por un equilibrio complejo entre su velocidad de síntesis y su almacenamiento/ secreción en los gránulos de Weibel-Palade, la velocidad de proteólisis controlada por la ADAMTS 13 y la velocidad de depuración (5). Existen muchos otros factores que influencian la concentración de VWF como el stress, la inflamación y el ejercicio físico, que producen aumento de los niveles plasmático de VWF. Los individuos del grupo O presentan valores de VWF significativamente menores que los no O (6)(7).
La enfermedad de von Willebrand se clasifica en 6 tipos diferentes: tipo 1 (defecto parcial en la cantidad de VWF), tipo 3 (falta total del VWF) y los tipos 2A, 2B, 2M Y 2N (defectos cualitativos). Esta clasificación se basa en los hallazgos fenotípicos al medir los niveles de FVIII, antigénico (VWF:Ag) y actividad de VWF, usualmente medida como cofactor de ristocetina (VWF:RCo) o ensayo de unión al colágeno (VWF:CB). Así, si la razón VWF: RCo/ VWF: Ag es <0,7 (o 0,6) sugiere un defecto tipo 2 y si en cambio la razón VWF:RCo/VWF: Ag es >0,7 (0,6) con Ag disminuido sugiere un defecto tipo 1 (8). Estas pruebas fenotípicas pueden ser complementadas con el análisis multimérico, la aglutinación inducida por ristocetina (RIPA), el ensayo de unión de FVIII (VWF: FVIII unión), la cuantificación del nivel de propéptido (VWF:pp) que da idea de producción de VWF, y en algunos casos seleccionados, el análisis genético. Como parte del diagnóstico de esta enfermedad es necesario que el paciente tenga una historia personal de sangrado, lo cual puede establecerse en forma estandarizada utilizando algún score de sangrado (9). Los niveles de VWF:Ag inicialmente determinados por técnicas de ELISA, actualmente se realizan por ensayos inmunoturbidimétricos (VWF-LIA) automatizados con Ac monoclonales o el sistema ELFA (BioMerieux –VIDAS) que han demostrado ser confiables y más rápidos. Sin embargo, se han reportado CV entre 10 y 15% para estos métodos y existen reportes que los LIA VWF tienden a sobreestimar el valor de VWF antigénico respecto a lo hallado por ELISA. Estos métodos antigénicos difieren en las concentraciones bajas de VWF. Bajos niveles de VWF:Ag sugieren la EvW pero no distinguen los subtipos por lo cual es necesario determinar también la funcionalidad del VWF para completar el diagnóstico (8).
El método de referencia para estudiar la función del VWF es el ensayo del cofactor de ristocetina, basado en la habilidad de VWF para inducir la aglutinación de las plaquetas en presencia de ristocetina. De esta manera, permite evidenciar la unión del VWF al complejo glicoproteico Ib-IX-V de la membrana plaquetaria in vitro reconociendo la presencia de los multímeros de alto peso molecular (9). Este método consiste en enfrentar plasma del paciente, con plaquetas lavadas y fijadas en formol o liofilizadas y ristocetina y monitorear la trasmisión de luz en un agregómetro. Es un método muy variable y laborioso con un CV entre 15 a 25% además de tener un límite de detección entre 15 y 20% según diversos reportes (9-11). El problema más importante quizás sea su baja reproducibilidad con altos CV interensayo e interlaboratorio según lo muestran los distintos programas de evaluación externa de la calidad (12). Por estos inconvenientes, en los últimos años, se han desarrollado nuevos métodos algunos por ELISA y otros automatizables para estudiar la funcionalidad del VWF(13). Los primeros ensayos de ELISA utilizaban un anticuerpo contra la parte funcional del VWF, por ejemplo, la región que une la GPIb plaquetaria, pero ninguno utiliza ristocetina y han fallado en los ensayos de comparación con el método de referencia. Más recientemente estos métodos han incorporado ristocetina y Ac monoclonales contra la GPIb o GPIb inmovilizada y han demostrado buena correlación con el método de referencia (10). En los últimos años han comenzado a aparecer diferentes ensayos de actividad automatizados, como los que se mencionan a continuación: Determinación de VWF:RCo por quimioluminiscencia: el reactivo consiste en un fragmento de la GIb alfa inmovilizada a la fase solida por unión a un Ac monoclonal y un segundo Ac monoclonal anti VWF conjugado con isoluminol. Este ensayo se automatiza en el sistema AcuStar. Se ha reportado que este ensayo tiene un menor límite de detección y correlaciona bien con la prueba tradicional (14).
Determinación por inmunoturbidimetría de la actividad del VWF (Innovance VWFAC, Siemens): El reactivo consiste en partículas de poliestireno recubiertas con un anticuerpo anti GPIb que son puestas en contacto con una GPIb mutada con ganancia de función que es capaz de unirse al VWF en ausencia de ristocetina. Diversos autores han reportado que este método tiene buena reproducibilidad y precisión originando resultados comparables con el método de referencia en el rango 5-150 UI/Ml en diferentes coagulómetros automáticos (16)(17). Determinación por inmunoturbidimetría de la actividad VWF (HemosIL Activity, Instrumentation Laboratory): el reactivo consiste en partículas de latex recubiertas por un Ac monoclonal dirigido contra el sitio de la molécula de VWF responsable de la unión a la glicoproteína Ib plaquetaria. El grado de aglutinación del reactivo de látex es directamente proporcional a la actividad del VWF en la muestra y se mide por el descenso de la transmitancia. En trabajos previos se ha encontrado en concordancia con otros autores una buena correlación (R>0,92 entre este método y el VWF:RCo por agregación en el plasmas de 112 individuos) (18-20).
Determinación de VWF:RCo por citometría de flujo: Una mezcla de fluorocromo verde y rojo con plaquetas fijadas en formol se incuba con plasma del paciente en presencia de ristocetina. Se ha reportado que este método es simple, preciso y reproducible y muy sensible a lo EvW tipo 2; el inconveniente es que hay que disponer de un citómetro (21). Determinación inmunoturbidimétrica de VWF:RCo: Es una prueba recientemente desarrollada en la cual el reactivo consiste en partículas de látex recubiertas con GPIb recombinante capturadas con Ac monoclonal que orienta la GPIB alfa recombinante a interactuar con el VWF en presencia de ristocetina. Se ha reportado que este método muestra buena linealidad hasta 130 UI/mL, con CV de 4% para el control normal y 2,68% para el control patológico. Además demostró una buena concordancia con el ensayo tradicional (22)(23).
El objetivo de este trabajo fue evaluar el comportamiento del ensayo inmunoturbidimétrico VWF:RCo con el ensayo de actividad de VWF utilizado en este laboratorio como screening de la EvW y con el ensayo tradicional de VWF:RCo.
Materiales y Métodos
Población: Se estudiaron 60 muestras de pacientes que concurrieron al laboratorio de Hemostasia para evaluar una posible enfermedad de von Willebrand, 34 mujeres; edad 35 años (rango 18–65). Los pacientes firmaron consentimiento informado y el estudio fue aprobado por el Comité de Ética del Hospital Británico de Buenos Aires. Las muestras fueron extraídas luego que los pacientes esperaran durante 30 minutos sentados después de haber llegado al hospital. La sangre fue extraída por punción venosa y anticoagulada en proporción 9 partes de sangre, 1 de citrato de sodio 3,2%. Los ensayos coagulables fueron realizados antes de 4 h de extraída la muestra.
Determinación de FVIII: Se realizó por método coagulable en una etapa en tres diluciones en un coagulómetro de detección foto óptica automatizado (HemosIL factor VIII deficiente plasma, HemosIL Synthasil, Instrumentation Laboratory).
Determinacion de VWF:ag: Fue medida por un método inmunoturbidimétrico con partículas de látex recubiertas por un Ac monoclonal anti VWF (HemosIL von Willebrand factor antigenic, Instrumentation Laboratory).
Determinacion de VWF: Actividad (VWF:Act): se realizó a través de una inmunoturbidimetría con partículas de latex recubiertas por un Ac monoclonal dirigido específicamente contra el sitio receptor de GPIb plaquetaria presente en la molécula de VWF (HemosIL von Willebrand Factor Activity, Instrumentation Laboratory).
Determinacion de VWF:RCo por agregometria: se realizó por el método de agregación de transmisión de luz utilizando plaquetas liofilizadas y Ristocetina a una concentración final de 1 mg/mL (Helena Laboratories). Las determinaciones fueron realizadas en un agregómetro de transmisión de luz (Dual Chanel Chrono Log).
Determinación de VWF:RCo por inmunoturbidimetria: utilizando partículas de latex recubiertas con GIb recombinante y ristocetina (von Willebrand Factor Ristocetin Cofactor Activity, Instrumentation Laboratory) Todos los ensayos fueron realizados en un coagulómetro automatizado (ACL TOP 500, IL). Todas las calibraciones se realizaron con plasma calibrador (HemosIL Calibration plasma, Instrumentation Laboratory) calibrado vs. el estándar internacional 07/316. Las curvas fueron validadas utilizando un control normal (CN, Normal Control Assay, Instrumentation Laboratory) y un control patológico (CP, Special test 2, Instrumentation Laboratory). Estadística: La precisión fue calculada de acuerdo al EP15 A2 de la CLSI procesando 2 niveles de control por triplicado durante cinco días (24). Se utilizó el EP Evaluator versión 10.0 para realizar el método alternativo de comparación de métodos. El rango de medición analítica (AMR) se evaluó según la norma EP-6 a través de seis diluciones considerando un ET de 15% (25).
Resultados
PERFORMANCE ANALÍTICA DEL ENSAYO VWF:Rco POR INMUNOTURBIDIMETRÍA
Precisión intraensayo: la precisión intraensayo fue evaluada repitiendo 5 muestras de plasmas 10 veces cada una, obteniéndose un resultado de 3,1%.
Precisión interensayo: la precisión interensayo evaluada con CN fue de 3,2%, media 102% y con el CP se obtuvo un CV 5,1% con una media de 33,4%. Los resultados están de acuerdo a lo descripto en trabajos previos
Evaluación de la linealidad: se evaluó diluyendo una muestra 218% de actividad con diluyente de factores. La Figura 1 muestra que el test es lineal hasta 150%, pero utilizando el test de nivel alto la linealidad puede extenderse a 320% (datos no mostrados).
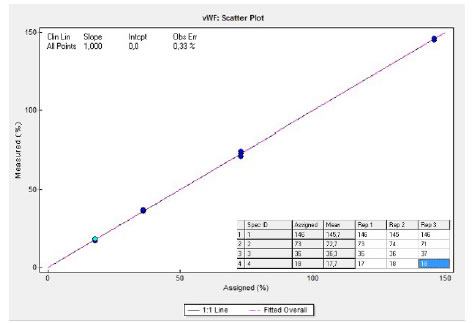
Figura 1. Determinación del rango analítico de medición (RAM). El ensayo es lineal entre 0 y 150% de actividad de cofactor de ristocetina. (Captura de pantalla)
EVALUACIÓN DE LA CORRELACIÓN CON EL TEST DE HEMOSIL VWF ACTIVITY
Se compararon los resultados de VWF:Act y VWF:RCo inmunoturbidimétrico, procesados en paralelo, de 60 muestras de pacientes empleando la comparación alternativa de métodos que utiliza la regresión de Deming. La media fue de 93,5% (rango: 19 a 176) por el método VWF:Act y 90,3% (14-168) por el método automatizado VWF:RCo (Fig. 2 A) obteniéndose una pendiente de 0,954 (95% IC 0,886 a 1,022), ordenada al origen de 1,1(95% IC -5,7 a 7,8), un desvío estándar de 9,2 y un coeficiente de correlación de 0,96. El Bias obtenido fue de - 3,5% (Fig. 2B). Considerando un ET de 15% los resultados obtenidos por ambas metodologías fueron estadísticamente equivalentes en el rango evaluado.
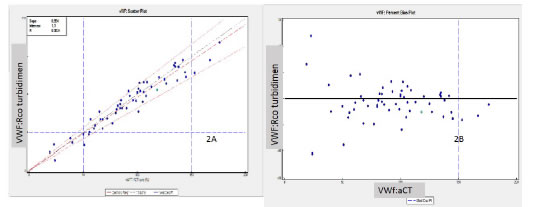
Figura 2. Comparación Actividad de VWF vs. la actividad de cofactor de ristocetina automatizado (n=60). 3A: Regresión de Deming, 3B: Porcentaje de Bias entre ambos métodos. (Captura de pantalla)
EVALUACIÓN DE LA CORRELACIÓN VWF:Rco INMUNOTURBIDIMÉTRICO CON VWF:Rco POR AGREGOMETRÍA
Se compararon los resultados de VWF:Rco por inmunoturbidimetría y VWF:RCo realizado por la técnica tradicional de agregación de 30 pacientes empleando la comparación métodos alternativa que utiliza la regresión de Deming. La media fue de 71,5% (rango: 10 a 159) por el método tradicional y 86,3% (14-151) por el método automatizado de cofactor de Ristocetina (Fig. 3A) obteniéndose una pendiente de 1,114 (95% IC 0,925-1,304), ordenada al origen de 6,7 (95% IC -8,5 a 21,9), un desvío estándar de 18,4 y un coeficiente de correlación de 0,90.

Figura 3. Comparación de la técnica de cofactor de ristocetina determinada por agregometría vs. el cofactor de ristocetina automatizada (n=30) 3A: Regresión de Deming, 3B: Porcentaje de Bias entre ambos métodos. (Captura de pantalla)
El Bias obtenido fue de 18,9% (Fig. 3B) pero considerando un ET de 15% los resultados obtenidos por ambas metodologías fueron estadísticamente comparables.
Discusión y Conclusiones
El diagnóstico integral de la EvW necesita de un control estricto de las variables pre analíticas en la preparación del paciente, de la toma de la muestra y de técnicas especializadas (8)(26)(27). Los laboratorios de hemostasia realizan habitualmente el dosaje de FVIII, la determinación del nivel antigénico y la actividad funcional del VWF, que se realiza tradicionalmente midiendo la capacidad de inducir la agregación plaquetaria de plaquetas normales en presencia de VWF del plasma (27). Esta técnica realizada por agregación de transmisión de luz, a pesar de ser considerada el método de referencia, presenta un error de alrededor de 25% de acuerdo a diversos programas de evaluación externa de calidad y tiene poca sensibilidad para discriminar valores por debajo de 10% de actividad del VWF (10)(13)(26)(27). Existen actualmente distintas técnicas automatizadas que utilizan Ac monoclonales que detectan el epitope de la molécula del VWF cuando tiene una estructura multimérica adecuada responsable de la unión a la GPIb plaquetaria. Si bien estos métodos han demostrado mejor precisión y sensibilidad a valores bajos que el método por agregometría fueron cuestionados porque no eran un verdadero ensayo de cofactor de ristocetina como indica la recomendación de la ISTH para diagnosticar y clasificar la EvW (26). Si bien para nosotros y otros autores los métodos VWF:Act y VWF:Rco por agregación son comparables estadísticamente, hay reportes que sugieren que métodos de actividad sobreestimarían el nivel de VWF:Rco y se los sugiere utilizar como método de screening (15-17). Recientemente se ha desarrollado un método automatizado inmunoturbidimétrico que determina la actividad de VWF utilizando partículas de látex recubiertas con GIb recombinante y ristocetina. Esta técnica utilizada en la plataforma ACL TOP 500 demostró buena precisión y linealidad. Los resultados obtenidos mostraron ser estadísticamente comparables con el VWF:Act y con los valores de VWF:Rco determinados por agregometría. Tomando un rango de normalidad de 50-150% solo 2/60 pacientes presentaron niveles normales por el método VWF:Act y disminuidos por VWF:Rco agreg (paciente 1, 51% vs. 33% y paciente 2, 55% vs. 47%). Entre los 30 pacientes estudiados por VWF:Rco inmunoturbidimétrico y VWF:RCo agreg solo 3 tuvieron nivel disminuido por agregometría y normal por el método inmunoturbidimétrico, pero en 2 de los pacientes el valor fue muy cercano al límite inferior normal.
La limitación de este estudio está dada por el hecho de que los pacientes solo pudieron ser clasificados en tipo 1, tipo 2 o tipo 3 pero no se realizaron los ensayos que permitieran definir los distintos subtipos dentro del tipo de 2. Otra limitante es el bajo número de muestras evaluadas con la metodología de VWF:RCo por agregometría que podría ser el responsable junto con la mayor variabilidad de ese método, de la menor correlación observada entre el VWF:RCo inmunoturbidimétrico y por agregometría, comparada con la hallada entre VWF:RCo y VWF:Act inmunoturbidimétricos.
1. Koutts J.A short history of diagnostic tests for von Willebrand disease: in memory of Barry Firkin (1930 to 2001) and Ted Zimmerman (1937 to 1988). Semin Thromb Hemost 2006 Jul; 32 (5): 445-55. [ Links ]
2. Berntorp E, Peake I, Budde U, Laffan M, Montgomery R, Windyga J, et al. Willebrand’s disease: a report from a meeting in the Åland islands. Haemophilia 2012 Sep;18 Suppl 6: 1-13.
3. Sadler JE. von Willebrand factor: two sides of a coin. J Thromb Haemost 2005 Aug; 3 (8): 1702-9. [ Links ]
4. Goodeve AC1, Eikenboom JC, Ginsburg D, Hilbert L, Mazurier C, Peake IR, et al. ISTH SSC Subcommittee on von Willebrand factor. A standard nomenclature for von Willebrand factor gene mutations and polymorphisms. On behalf of the ISTH SSC Subcommittee on von Willebrand factor. Thromb Haemost 2001 May; 85 (5): 929-31. [ Links ]
5. de Groot R, Lane DA, Crawley JT. The role of the ADAMTS13 cysteine-rich domain in VWF binding and proteolysis. Blood 2015 Mar 19; 125 (12): 1968-75. [ Links ]
6. Albánez S, Ogiwara K, Michels A, Hopman W, Grabell J, James P, et al. Aging and ABO blood type influence VWF and FVIII levels through interrelated mechanisms. J Thromb Haemost 2016 Feb 14. doi: 10.1111/ jth.13294. [ Links ]
7. Rabinovich O, Duboscq C, Stemmelin G, Shanley C, Ceresetto J, Doti C, et al. Relación entre los grupos ABO y los niveles plasmáticos de factor VIII y factor Von Willebrand. Efecto sobre la preparación de crioprecipitado. Rev Argent Transfusión 2008; 34: 51-6. [ Links ]
8. Sadler JE, Budde U, Eikenboom JC, Favaloro EJ, Hill FG, Holmberg L, et al. Working Party on von Willebrand Disease Classification. Update on the pathophysiology and classification of von Willebrand disease: a report of the Subcommittee on von Willebrand Factor. J Thromb Haemost 2006 Oct; 4 (10): 2103-14. [ Links ]
9. Tosetto A, Castaman G, Rodeghiero F. Bleeders, bleeding rates, and bleeding score. J Thromb Haemost 2013 Jun; (11): 142-50. [ Links ]
10. Favaloro EJ. Laboratory identification of von Willebrand disease: technical and scientific perspectives. Semin Thromb Hemost 2006 Jul; 32 (5): 456-71. [ Links ]
11. Olson JD, Brockway WJ, Fass DN, Magnuson MA, Bowie EJ. Evaluation of ristocetin-Willebrand factor assay and ristocetin-induced platelet aggregation. Am J Clin Pathol 1975 Feb; 63 (2): 210-8. [ Links ]
12. Favaloro EJ, Bonar R, Sioufi J, Hertzberg M, Street A, Lloyd J, Marsden K; RCPA Quality Assurance Program in HaematologyHaemostasis Committee. Laboratory diagnosis of von Willebrand disorder. Current practice in the southern hemisphere. Am J Clin Pathol 2003;119: 882-93. [ Links ]
13. Flood VH, Friedman KD, Gill JC, Morateck PA, Wren JS, Scott JP et al. Limitations of the ristocetin cofactor assay in measurement of von Willebrand factor function. J Thromb Haemost 2009 Nov; 7 (11): 1832-9. [ Links ]
14. Adcock DM, Bethel M, Valcour. A Diagnosing von Willebrand disease: a large reference laboratory’s perspective. Semin Thromb Hemost 2006 Jul; 32 (5): 472-9.
15. Verfaillie CJ, De Witte E, Devreese KM. Validation of a new panel of automated chemiluminescence assays for von Willebrand factor antigen and activity in the screening for von Willebrand disease. Int J Lab Hematol 2013 Oct: 35 (5): 555-65. [ Links ]
16. Dong J, Schade AJ, Romo GM, Andrews RK, Gao S, McIntire LV, et al. Novel gain-of-function mutations of platelet glycoprotein IB alpha by valine mutagenesis in the Cys209-Cys248 disulfide loop. Functional analysis under statis and dynamic conditions. J Biol Chem 2000 Sep 8; 275 (36): 27663-7. [ Links ]
17. Martinuzzo M, Barrera L, Ujhelly C, DÁdamo MA, Otaso JC, Gimenez MI, et al. Validación de una técnica de actividad de factor von Willebrand que utiliza glicoproteína Ib mutada. Acta Bioquím Clin Latinoam 2014; 48 (2): 243-8. [ Links ]
18. Duboscq C, Martinuzzo M, Cerrato G, Forastiero R. Validación del método inmunoturbidimetrico para determinar la actividad de factor von Willebrand frente a la agregometría, VIII Congreso Argentino de la Calidad en el Laboratorio Clínico Buenos Aires 2010; Acta Bioquím Clín Latinoam 2010; 44 Sup 3: 554. [ Links ]
19. Sucker C, Senft B, Scharf RE, Zotz RB.Determination of von Willebrand factor activity: evaluation of the HaemosIL assay in comparison with established procedures.Clin Appl Thromb Hemost 2006 Jul; 12 (3): 305-10. [ Links ]
20. De Vleeschauwer A, Devreese K. Comparison of a new automated von Willebrand factor activity assay with an aggregation von Willebrand ristocetin cofactor activity assay for the diagnosis of von Willebrand disease. J Thromb Haemost 2008 Feb; 6 (2): 323-30. [ Links ]
21. Chen D, Daigh CA, Hendricksen JI, Pruthi RK, Nichols WL, Heit JA, et al. A highly-sensitive plasma von Willebrand factor ristocetin cofactor (VWF:RCo) activity assay by flow cytometry. J Thromb Haemost 2008 Feb; 6 (2): 323-30. [ Links ]
22. Strandberg K, Lethagen S, Andersson K, Carlson M, Hillarp A. Evaluation of a rapid automated assay for analysis of von Willebrand ristocetin cofactor activity. Clin Appl Thromb Hemost 2006 Jan; 12 (1): 61-7. [ Links ]
23. Lasne D, Dey C, Dautzenberg MD, Cherqaoui Z, Monge F, Aouba A, et al. Screening for von Willebrand disease: contribution of an automated assay for von Willebrand factor activity. Haemophilia 2012 May; 18 (3): e158-63. [ Links ]
24. CLSI User verification for Performance and Trueness; Approved Guidelines. Second Edition. CLSI EP15A2; Wayne PA. Clinical and Laboratory Standards Institute. 2005. [ Links ]
25. CLSI Evaluation of the linearity of Quantitative Measurement Procedures Approved Guidelines Approved Guidelines CLSI EP06; Wayne PA. Clinical and Laboratory Standards Institute 2003. [ Links ]
26. Favaloro EJ. Rethinking the diagnosis of von Willebrand disease. Thromb Res. 2011 Jan;127 Suppl 2: S17-21. [ Links ]
27. CLSI Assays factor von Willebrand Antigen and Ristocetin Cofactor Activity H51- A. Wayne PA. Clinical and Laboratory Standards Institute 2002. [ Links ]
Recibido: 2 de mayo de 2016.
Aceptado: 13 de mayo de 2016.














