Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.2 La Plata June 2016
HEMOSTASIA Y TROMBOSIS
Requerimientos de calidad en hemostasia: Variabilidad biológica versus estado actual de la metodología
Quality requirements in hemostasis: Biological variability versus the state of art
Requisitos de qualidade em hemostasia: Variabilidade Biológica versus o Estado atual da metodología
María Mercedes Zirpoli1a, Yolanda Adamczuk2b, Cristina Duboscq3c
1 Bioquímica Especialista Gestión y Dirección de Instituciones de Salud.
2 Bioquímica Especialista en Bioquímica Clínica - Área Hematología Orientación Hemostasia.
3 Doctora en Química.
a Laboratorio del Hospital Universitario Austral- Pte. Perón 1500 - Derqui -Pilar-Buenos Aires Argentina.
b Laboratorio Central del Hospital General de Agudos Dr. Enrique Tornú - Combatientes de Malvinas 3002 -CABA- Argentina.
c Servicio de Hematología Hospital Británico de Buenos Aires - Perdriel 74 -CABA- Argentina.
CORRESPONDENCIA BIOQ. MARÍA MERCEDES ZIRPOLI E-mail: mmzirpoli@gmail.com
Resumen
El objetivo del trabajo fue comparar los requerimientos de calidad (RC) de Variabilidad Biológica (VB) con el Estado Actual de la Metodología (EA) en ocho analitos de hemostasia. Se determinó el EA calculando el Coeficiente de Variación promedio ponderado (CVpp) de al menos 6 evaluaciones externas: RIQAS (ET1) y CAP (ET2). Los datos de Error Total aceptable (ETa) por VB mínimo (VBm) y deseable (VBd) se calcularon a partir de los CV intra e inter individuos reportados en www.westgard.com. Los datos obtenidos: Tiempo de Protrombina (TP segundos): ETVBm 7,9%, ETVBd 5,3%, ET1 19%, ET2 13%; Tiempo parcial de tromboplastina activada: (APTT segundos): ETVBm 6,7%, ETVBd 4,5%, ET1 23%, ET2 11%. INR: ETVBm 7,9%, ETVBd 5,3%, ET1 20%, ET2 16%; Fibrinógeno: ETVBm 20,4%, ETVBd13,6%, ET1 20%, ET2 16%, FVIII: ETVBm13,3%, ETVBd 8,9%, ET1 30%, ET2 45%, FVII ETVBm16,1%, ETVBd 10,7%, ET1 31%, ET2 42%, Proteína C cromogénica (PCc) ETVBm 28%, ETVBd 18,7%, ET1 36%, ET2 25%; Proteína S libre (PSl): ETVBm 31,1%, ETVBd 20,7%, ET1 18%, ET2 28%; Antitrombina cromogénica (ATc): ETVBm 12,5%, ETVBd 8,9%, ET1 18%, ET2 28%. Los únicos analitos que cumplen con el requerimiento de calidad de VBm o VBd son: fibrinógeno, PC y PS. Si bien cada laboratorio puede decidir las especificaciones de calidad que desea aplicar, la cuestión a debatir es: “cuál es el requerimiento de calidad deseable para la utilidad clínica de estos ensayos”.
Palabras clave: Variabilidad biológica; Requisitos de calidad; Analitos de hemostasia; Error total aceptable; Estado actual de la metodología.
Summary
The aim of this work was to compare the quality requirements of biological variability (BV) with the state of the art (SA) in eight hemostasis analytes. SA was determined by calculating the weighted average coefficient of variation (CVwa) of at least 6 external evaluations: RIQAS (ET1) and CAP (ET2). Data acceptable total error (TEa) for minimum and desirable biological variability (VBm y VBd) was calculated from the coefficient of variation (CV) within-subject and between subject www.westgard.com reported. The following was the data : Prothrombin time ( PT second): ETVBm 7.9%, ETVBd 5.3%, ET1 19%, ET2 13%; Activated partial thromboplastin time (second APTT): ETVBm 6.7%, ETVBd 4.5%, ET1 23%, ET2 11%; INR: ETVBm 7.9%, ETVBd 5.3%, ET1 20%, ET2 16%; Fibrinogen: ETVBm 20.4% ETVBd 13.6% ET1 20%, ET2 16%, FVIII: ETVBm 13.3%, ETVBd 8.9%, ET1 30%, ET2 45% ; FVII: ETVBm 16.1%, ETVBd 10.7%, ET1 31%, ET2 42%; chromogenic Protein C (PCc): ETVBm 28%, ETVBd 18.7%, ET1 36%, ET2 25%; free Protein S (PSf): ETVBm 31.1% ETVBd 20.7%, ET1 18%, ET2 28%; chromogenic Antithrombin (ATc): ETVBm 12.5%, ETVBd8.9%, ET1 18%, ET2 28%.The only analytes that meet the VBm or VBd quality requirement are fibrinogen, PC and PS. While each laboratory can decide the quality specifications it wants to apply, the issue to be discussed is: “what is the desirable quality requirement for clinical usefulness of these tests?”.
Keywords: Biological variability; Quality requirements; State of the art; Hemostasis analytes; Acceptable total error; Current status of the methodology.
Resumo
O objetivo do trabalho foi comparar os requisitos de qualidade (RQ) de variabilidade biológica (VB) com o estado atual da metodologia (EA) em oito analitos de hemostasia. Foi determinada a EA através do cálculo do coeficiente de variação médio ponderado (CVmp) de pelo menos 6 avaliações externas: RIQAS (ET1) e CAP (ET2). Os dados de erro total admissível (ETa) para VB mínimo desejável (VBm) e (VBd) foram calculados a partir do CV intra e inter indivíduos reportados em www.westgard.com. Os dados obtidos: Tempo de Protrombina (TP segundos) ETVBm 7,9%, ETVBd 5,3%, ET1 19%, ET2 13% ; Tempo parcial de tromboplastina ativada (APTT segundos): ETVBm 6,7%, ETVBd 4,5%, ET1 23%, ET2 11%; INR: ETVBm 7,9%, ETVBd 5,3%, ET1 20%, ET2 16%; Fibrinogênio: ETVBm 20.4%, ETVBd 13,6%, ET1 20%, ET2 16%; FVIII: ETVBm 13,3%, ETVBd 8,9%, ET1 30%, ET2 45%; FVII: ETVBm 16,1%, ETVBd 10,7%, ET1 31%, ET2 42%; Proteína C cromogênica (PCc): ETVBm 28% ETVBd 18,7%, ET1: 36%, ET2: 25%; Proteína S livre (PSl): ETVBm: 31,1%, ETVBd 20,7%, ET1: 18%, ET2: 28%; Antitrombina cromogênica (ATc): ETVBm12,5%, ETVBd 8.9%, ET1 18%, ET2 28%. Os únicos analitos que atendem o requisito de qualidade de VBm ou VBd são: fibrinogênio, PC e PS. Embora cada laboratório possa decidir as especificações de qualidade que deseja aplicar, a questão a ser discutida é “qual é o requisito de qualidade desejável para a utilidade clínica destes testes?”.
Palavras-chave: Variabilidade biológica; Requisitos de qualidade; Última tecnologia/vanguarda; Analitos de hemostasia; Erro total admissível; Estado atual da metodología.
Introducción
La gestión de la calidad en laboratorios clínicos está, en la actualidad, sujeta a pautas nacionales o internacionales de buenas prácticas de laboratorio. Hay países que adoptan alguna versión de las normas de calidad y competencia de la Organización Internacional para la Estandarización (International Organization for Standardization “ISO”), como se encuentra descripto en ISO 15189. Orientaciones similares para la implementación de un “Sistema de Gestión de la Calidad” también se encuentran en pautas consensuadas, desarrolladas por el Clinical and Laboratory Standard Institute (CLSI), como se observa en sus documentos HS1 y GP26. Además, existen requisitos regulatorios en algunos países, como las reglas CLIA (Clinical Laboratory Improvement Amendments) en Estados Unidos, también entes de Acreditación que desarrollan pautas profesionales para acreditación e inspección, como el College of American Pathologist (CAP), Joint Commission (1). En Argentina, el Organismo Argentino de Acreditación (OAA) es un elemento central en el desarrollo de la cultura de la calidad, reconocido internacionalmente, que evalúa a los laboratorios de análisis clínicos a través de la Norma Internacional ISO 15189 (2). A nivel nacional la Fundación Bioquímica Argentina (FBA) a través de su Programa de Acreditación de Laboratorios (PAL), establece los estándares en el Manual de Acreditación MA3 (3). Otros laboratorios optan por otras normas internacionales de inspección o acreditación. Cabe destacar que en Argentina no es obligatorio que un laboratorio esté acreditado para practicar el ejercicio de la bioquímica clínica. En este contexto, establecer los requisitos de calidad (RC) para cada ensayo es una de las etapas principales del proceso.
REQUISITOS DE CALIDAD
Son especificaciones acerca de la tasa de error que puede ser permitida para un procedimiento de medida sin invalidar la utilidad clínica de resultados generados por el mismo. Se expresa como Error total aceptable expresado en % (Eta%). El ETa% puede emplearse para: a) Planificación del control estadístico interno de la calidad; b) Seguimiento del desempeño del procedimiento de medida; c) Evaluación de cambios y toma de decisiones. El RC debería ser un compromiso entre la VB del analito y la metodología disponible para su análisis, lo que se llama el EA o Estado Actual de la Metodología (EA).
La VB es la fluctuación fisiológica de los constituyentes de los fluidos orgánicos alrededor de su punto homeostático. Es una buena base para obtener especi- ficaciones de calidad analítica que satisfagan las necesidades médicas en general. Con la VB se minimiza el estandarizar la toma de las muestras. El EA es la capacidad del proceso de medida de un analito con la tecnología desarrollada hasta el momento. En el consenso de Estocolmo de 1999 se establecieron las especificaciones globales de la calidad en el laboratorio clínico, las cuales se definieron según un modelo jerárquico, en orden decreciente por el impacto en el uso clínico (4):
1. Evaluación del desempeño de las prestaciones analíticas en situaciones clínicas concretas.
2. Evaluación del efecto de las prestaciones analíticas en decisiones clínicas generales:
• Variación biológica (Base datos Sociedad Española de Química Clínica -SEQC, 370 magnitudes).
• Análisis de opiniones de los clínicos.
3. Recomendaciones de grupos de expertos profesionales (ADA; CAP; NCEP).
4. Propuestas por ley (CLIA, RILIBAK) y/o programas de evaluación externa de la calidad (EMC).
5. Especificaciones basadas en el estado actual de la metodología para cada prestación con los métodos actuales. Estos datos pueden ser extraídos de los Programa externos de la calidad (PEECs); publicaciones actuales sobre metodología (criterios estadísticos), o descriptos por fabricantes de los sistemas analíticos (5).
En Milán en noviembre de 2014, se celebró una conferencia en la cual se amplió la estrategia del Consenso de Estocolmo para definir especificaciones de la calidad, no solo en la fase analítica sino al proceso global del laboratorio. En esta conferencia se redujeron los cinco criterios de jerarquía a solo tres especificaciones concretas:
1. Opinión de expertos
2. Variación Biológica
3. Estado actual de la metodología
Como consecuencia de la Conferencia, se crearon cinco Task Force Groups con objetivos específicos a desarrollar. Uno de ellos es el TFG-BVD (Base de datos de Variación Biológica), que tiene como objetivo inicial revisar toda la bibliografía existente, que actualmente conforma la base de datos de VB de la SEQC y las especificaciones de la calidad derivadas, aplicándole una herramienta de lectura crítica que el propio grupo ha desarrollado. El objetivo final es mejorar la base de datos de VB actual, evaluando la fortaleza y consistencia de los datos incluidos, en base a la evidencia científica (5).
Como se describió anteriormente VB es una de las especificaciones de calidad analítica. La misma tiene en cuenta la VB intraindividuo e interindividuo. Este concepto ayuda a entender y reconocer los cambios que ocurren en resultados de laboratorio en un sujeto a lo largo del tiempo sin que existan modificaciones patológicas y, en consecuencia, conocer qué cambios son significativos, por ende el Error total analítico debe ser menor que el Error total aceptable (ETa) por VB. Dentro del requisito de VB, existen mínimo (VBm), deseable (VBd) y óptimo (VBo), la fórmula la compone un componente de imprecisión y otro de sesgo, según Fraser/Ricos 1997 (6):

Los valores de VB se pueden encontrar en la tabla de la Dra. Ricos publicada en www.westgard.com (7) (Tabla I), la cual ha sido actualizada en 2014, o en la página de la SEQC, pero en los parámetros de hemostasia no se han visualizado cambios con respecto a los años anteriores. Los trabajos existentes para establecer los valores de variabilidad biológica, los cuales cita la base de Ricos, se han realizado con diferentes metodologías: manual, semi automatizada y automatizada y en diferentes períodos de tiempo. Banfi et al., en 2008 publicaron datos obtenidos de variación biológica de varias fuentes con heterogeneidad de métodos, números de sujetos estudiados, e interpretación de resultados, mostrando un alto grado de Individualidad en la mayoría de los analitos de hemostasia (8).
Tabla I. Requisitos de Calidad por Variabilidad Biológica Deseable extraídos de la base de datos de la Dra. Ricos publicada en www.westgard.com

Qlan Chen, MSc 2015, en un grupo de sujetos chinos estudiaron las variaciones biológicas y analíticas de 16 parámetros relacionados con test de screening de coagulación y actividad de factores de la coagulación, trabajando con métodos automatizados. Reportaron un alto Índice de Individualidad de ambos, al igual que el trabajo de Banfi; esto implica una fuerte regulación hemostática y que los valores de referencia convencionales podrían tener una utilidad clínica limitada, particularmente para decidir si los cambios observados en un individuo son clínicamente significantes (9).
Por otra parte, en hemostasia no existen aún RC establecidos por VB para todos los analitos.
El otro criterio aceptable para establecer el RC es tener en cuenta con qué error ese analito puede ser medido con los métodos analítico vigentes, es decir a través del estado del arte o estado de la tecnología.
Así, se puede estimar un RC a partir de un conjunto de encuestas de evaluación externa de la calidad, trabajando con estadística ponderada. Para determinar el ETa% hay que determinar el CVpp del proceso de medida a partir del conjunto de las evaluaciones externas de la calidad, siempre que el número de participantes sea representativo (> 10).

El CVpp se multiplica por el factor de cobertura 3 (tres) para obtener un nivel de confianza del 99% y así obtener el RC. El objetivo de este trabajo fue comparar los RC de VB, versus el EA determinado por dos programas distintos de evaluación externos en ocho analitos de hemostasia.
Materiales y Métodos
Se determinó el EA calculando el CVpp de al menos 6 evaluaciones externas de dos programas diferentes: RIQAS (ET1) y CAP (ET2). En las Tablas II y III se muestran los promedios de participantes de CCE en ambos programas de Evaluación externo en las 6 encuestas evaluadas. Para la PC y AT se eligió el método cromogénico, para la PS libre el método inmunológico por ser estos elegidos por las guías internacionales (International Society on Thrombosis and Haemostasis y British Committee for Standards in Haematology).
Tabla II. Promedio, mínimos y máximos de participantes en el PEEC – Riqas

Tabla III. Promedio, mínimos y máximos de participantes en el PEEC - CAP

Los datos de ETa por VBm y VBd se calcularon a partir de los CV intra individuo y CV inter individuo reportados en www.westgard.com/biodatabase1.htm (7). Se utilizaron planillas de Excel para los cálculos.
Resultados
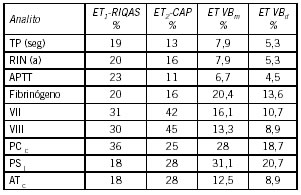
Los datos obtenidos de las 6 evaluaciones externas se muestran en la Tabla IV. El ET1-Riqas y ET2-CAP son los errores ponderados (n=6) para cada analito.
Tabla IV. Requisitos de Calidad según el Estado Actual de la Metodología (ET1 y ET2), Variabilidad biológica mínima (VBm) y deseable (VBd). El RC del RIN se asumió como el del TP.
Discusión y Conclusiones
De acuerdo al EA actual mostrado en los PEEC evaluados, los únicos analitos que cumplen con el VBd son fibrinógeno, PC y PS. El resto de las determinaciones están muy lejos de cumplirlos. Estos resultados están de acuerdo con lo reportado por otros autores cuando afirman que en muchas determinaciones del laboratorio de hemostasia no se alcanza el requerimiento de calidad fijado por VB, como sugiere la CLSI. Meijer reporta que los laboratorios participantes en el Control Externo de Calidad de la ECAT Foundation, el 80% de los participantes cumplen con el desempeño deseable por VB para PC y PS y el 72% para AT, en cambio solo el 10% de los participantes cumplen con el desempeño óptimo para AT y entre 50 y 70% para PS (11). Galotto demostró que el comportamiento del control patológico para TP y APTT no alcanzó los RC por VB deseable ni mínimos de imprecisión mensual, en cambio sí lo hizo en el 90% de los meses cuando el requerimiento se fija por CLIA (12).
En un análisis de la bibliografía existente se observa que en hemostasia hay pocos reportes referentes a los criterios de calidad que un analito debe alcanzar para que el resultado sea clínicamente útil. Si bien cada laboratorio puede decidir las especificaciones de calidad que desea aplicar, la cuestión a debatir es cuál es el RC deseable para la utilidad clínica de estos ensayos. Las empresas por un lado deberán seguir trabajando para mejorar la estabilidad de los métodos con el objetivo de lograr los RC deseados y los laboratorios deberán estandarizar sus procedimientos analíticos, considerando que se requieren más estudios con la tecnología automatizada actual.
1. James O. Westgard, Ph.D. Prácticas Básicas de Control de Calidad. 3a Edición. Capacitación en Control Estadístico de la Calidad para laboratorios Clínicos. Copyright ©2010. [ Links ]
2. Organismo Argentino de Acreditación. http//www.oaa.org.ar (Fecha de acceso 1º de marzo 2016). [ Links ]
3. Fundación Bioquímica Argentina. http//www.fba.org.ar (Fecha de acceso 1º de marzo 2016). [ Links ]
4. Sociedad Española de Bioquímica Clínica y Patología Molecular. http//www.seqc.es (Fecha de acceso 1º de marzo 2016). [ Links ]
5. Sociedad Española de Bioquímica Clínica y Patología Molecular. http://www.seqc.es/es/Actualidad/1/271Primera_reunion_del_TFG_on_Biological_Variation_Database_en_ la_sede_de_la_SEQC/ Fecha de acceso: 17 de febrero de 2015. [ Links ]
6. Fraser C. Biological Variation: from principles to practice 2001. Washington DC: American Associaton from Clinical Chemistry. [ Links ]
7. Westgard. QC. www.westgard.com (Fecha de acceso 1º de marzo 2016). [ Links ]
8. Giuseppe Banfi, Massimo Del Fabbro. Biological Variation in test of hemostasis. Semin Thromb Hemost 2008; 34(7): 635-4. [ Links ]
9. Chen Q, Shou W, Wu W, Guo Y, Zhang Y, Huang C, et al. Biological and analytical Variations of 16 parameters related to coagulation screening test and the activity of coagulation factors. Semin Thromb Hemost 2015; 41: 336-41. [ Links ]
10. http://gmigliarino.com/ (Fecha de acceso 1º de marzo 2016). [ Links ]
11. Meijer P, Haverkate F, Kluft C. Performance goals for the laboratoty testing of antithrombin, protein C an protein S. Thromb Haemost 2006; 96: 584-9. [ Links ]
12. Galotto M, Bechi, P, Paquali C., Hidalgo M, Maccallini, G. La mejora continua en el control de calidad interno en Hemostasia. Acta Bioquim Clin Latinoam 2008; Supl 1:191. [ Links ]
Recibido: 16 de mayo de 2016.
Aceptado: 26 de mayo de 2016.














