Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.3 La Plata set. 2016
BIOQUÍMICA CLÍNICA
Marcadores óseos en niños y adolescentes
Bone markers in children and adolescents
Marcadores ósseos em crianças e adolescentes
Cristina Tau1a
1 Médica Pediatra. Especialista en metabolismo cálcico y óseo.
a Asociación Argentina de Osteología y Metabolismo Mineral (AAOMM), Av. Santa Fe, 966 PB, C1059ABQ - Ciudad Autónoma de Buenos Aires
CORRESPONDENCIA Dra. CRISTINA TAU Avenida Santa Fe 966, PB CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina Tel. Cel. 011-15-6132-2559 E-mail: cristinatau1@yahoo.com.ar
Resumen
Los marcadores óseos son moléculas específicas que pueden clasificarse en dos categorías: formación y resorción óseas. Cuando se los compara con los adultos, los niños tienen muy elevadas concentraciones de los marcadores óseos debido a la elevada velocidad de crecimiento y a la rápida remodelación ósea. No solo reflejan el crecimiento (modelación esquelética y crecimiento linear), sino también la remodelación ósea. Ningún marcador es específico para cada uno de estos procesos y no son fáciles de interpretar en niños y adolescentes dado que están influenciados por varios factores fisiológicos como edad, sexo, velocidad de crecimiento y estadio puberal. Es necesario conocer la velocidad de crecimiento y el desarrollo puberal para interpretar correctamente los resultados. Además, muestran variaciones diurnas en sus concentraciones con picos por la mañana y nadir por la tarde. A la actualidad, existe una variada referencia de datos de marcadores óseos en niños y adolescentes. Se presenta una revisión de hallazgos científicos de varios marcadores séricos y urinarios que reflejan la formación y resorción óseas durante la niñez y adolescencia. Los marcadores óseos son de mucha utilidad en investigación clínica y fisiología del metabolismo óseo, sin embargo, su uso de rutina en clínica aún no está bien establecido.
Palabras clave: Marcadores óseos de formación ósea; Marcadores óseos de resorción ósea; Pediatría.
Summary
Bone markers are specific bone-derived molecules that can be classified into two categories: bone formation and bone resorption markers. Compared to adults, children have dramatically elevated bone marker concentrations due to high skeletal growth velocity and rapid bone turnover. They reflect growth (skeletal modelling) and remodelling and no marker is specific for any of the different biological processes of remodelling, modelling or epiphyseal growth. Bone turnover markers may not be easy to interpret in children as they are influenced by many physiological factors, such as age, gender, growth velocity, and pubertal stage. Knowledge of growth velocity and pubertal development is necessary to interpret the values of biological markers of bone turnover correctly. Turnover markers also show a diurnal variation, with a peak of concentrations in the morning and nadir of concentrations in the late afternoon. To date, a variety of pediatric references for bone markers have been reported. This review describes research findings on various sera and urine markers that reflect bone formation and resorption in children and adolescents. While bone markers are useful in research in the field of bone metabolism, their utility in routine clinical applications in pediatrics has not been established.
Keywords: Bone markers of formation; Bone markers of resorption; Pediatrics.
Resumo
Marcadores ósseos são moléculas específicas que podem ser classificadas em duas categorias: formação e reabsorção óssea. Em comparação com os adultos, as crianças têm concentrações altamente elevadas de marcadores ósseos devido à alta velocidade de crescimento e à remodelação óssea rápida. Não só refletem o crescimento (modelagem esquelética e crescimento linear), mas também a remodelação óssea. Nenhum marcador é específico para cada um desses processos e não são fáceis de interpretar em crianças e adolescentes visto que estão influenciados por vários fatores fisiológicos, tais como idade, sexo, velocidade de crescimento e desenvolvimento púbere. É necessário o conhecimento da velocidade de crescimento e o desenvolvimento do púbere para interpretar corretamente os resultados. Além disso, mostram variações diurnas em suas concentrações com picos de manhã e nadir pela tarde. Atualmente, existe uma variada referência de dados de marcadores ósseos em crianças e adolescentes. Apresenta-se uma revisão de achados científicos de vários marcadores séricos e urinários que refletem a formação e reabsorção ósseas em crianças e adolescentes. Embora os marcadores ósseos sejam úteis na investigação clínica e fisiologia do metabolismo ósseo, sua utilidade em aplicações clínicas de rotina ainda não foi bem estabelecida.
Palavras-chave: Marcadores ósseos de formação óssea; Marcadores ósseos de reabsorção óssea; Pediatria.
Introducción
A diferencia de los adultos en quienes los marcadores óseos sirven para evaluar la actividad de la remodelación ósea, los efectos de tratamientos que interfieren con la remodelación y la predicción del riesgo de fractura (1- 6), en pediatría la utilidad de los marcadores óseos es más compleja y difícil de interpretar. En los niños los marcadores óseos están relacionados con la edad, el sexo, la velocidad de crecimiento, estadio puberal, estado nutricional, acumulación mineral y regulación hormonal. Durante el crecimiento, el esqueleto aumenta en longitud, peso y fuerza muscular requiriendo una acción intensa y pujante. El esqueleto cambia de tamaño y forma, los huesos crecen en longitud y ancho con un rápido aumento de masa ósea hacia la adolescencia. En el crecimiento longitudinal los cartílagos de crecimiento son convertidos en tejido óseo en los extremos de los huesos largos, y para mantener la estabilidad los huesos crecen en ancho y son incesantemente remodelados y renovados. Las células responsables de la remodelación son los osteoblastos y osteoclastos que actúan de dos diferentes maneras (7): en la remodelación, unos pocos osteoclastos horadan túneles en el hueso seguido por la acción de los osteoblastos que rellenan esos túneles. La función de la remodelación es la de reparar al hueso de los pequeños defectos provocados por el uso y desgaste óseo diario, proceso que está en continua investigación. El segundo modo de acción es la modelación ósea, en la que osteoblastos y osteoclastos no están firmemente conectados como en la remodelación, sino que actúan independientemente unos de otros. El crecimiento en ancho de los huesos largos es un ejemplo; los osteoblastos agregan nuevo material en forma continua sobre la superficie externa del hueso, y simultáneamente, la cavidad de la médula ósea se agranda por la acción de los osteoclastos que quitan material de la superficie interna de la corteza ósea. La modelación permite cambios más rápidos en cantidad y distribución de hueso de lo que se obtiene por el remodelado. El proceso de modelación también ocurre en adultos, pero a diferencia de los niños, en respuesta a cambios durante la sobrecarga mecánica. La remodelación cambia notablemente con la edad. Las alteraciones de remodelación, por ejemplo en las enfermedades renales pediátricas, incluyen defectos de mineralización con elevada actividad de la remodelación por hiperparatiroidismo secundario, o supresión, por exceso de tratamientos. El metabolismo óseo en pediatría es entonces la suma de tres mecanismos fisiológicos: el crecimiento longitudinal, el aumento de circunferencia y la remodelación ósea. El crecimiento longitudinal ocurre por formación ósea endocondral, el cartílago se trasforma en tejido óseo en las metáfisis. El aumento de la circunferencia ósea se produce por el modelado que se asocia al aumento de masa ósea, los osteoclastos degradan menos tejido óseo del que los osteoblastos depositan en la superficie externa de la corteza. Durante la remodelación, en cambio, los sucesivos ciclos de resorción y formación suceden en la misma superficie ósea (8) (Fig. 1).

Figura 1. a) Vista lateral de un sitio de remodelación en hueso trabecular. Los osteoclastos horadan la superficie ósea que es rellenada por los osteoblastos. b) Sitio de modelación. Los osteoblastos y osteoclastos se hallan en sitios opuestos de la corteza ósea. Los osteoblastos agregan hueso por fuera de la corteza mientras los osteoclastos degradan hueso de la superficie interna. De este modo el hueso crece hacia afuera. El espesor de la corteza aumenta si los osteoblastos agregan más hueso del que los osteoclastos degradan. Extraído de (7).
Entonces, el metabolismo óseo en niños y adolescentes es más complejo que en adultos porque el esqueleto no solo se remodela sino que crece en longitud y los huesos cambian en ancho por la modelación ósea. Durante la modelación y remodelación óseas los osteoblastos y osteoclastos despiden productos que pueden ser cuantificados en sangre u orina, son los marcadores óseos. Los marcadores relacionados con la formación ósea y la actividad osteoblástica, son principalmente las fosfatasas alcalinas totales (FAL), la isoforma ósea o fosfatasa alcalina ósea (FAO), la osteocalcina (OC), y los propéptidos del procolágeno tipo I séricos aminoterminal (PINP) y carboxiterminal (PICP). Los marcadores de resorción ósea relacionados a la actividad osteoclástica provienen del colágeno tipo I, la hidroxiprolina urinaria (HPr), la galactosilhidroxilisina, Piridolina (Pyr), deoxipiridolina (DPyr) libre y total, los telopéptidos carboxi terminal (ICTP, CTX), el telopéptido amino terminal (NTX), las fosfatasas ácidas tartrato-resistentes 5b (TRAP), y la calciuria (Tabla I) (Fig. 2).
Tabla I.
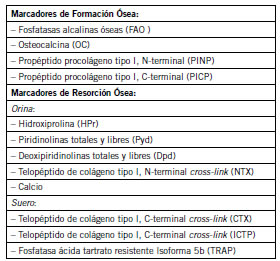
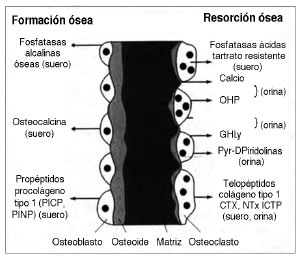
Figura 2. Marcadores óseos de formación y resorción óseas. Extraído de (9).
Marcadores de formación ósea
Las fosfatasas alcalinas totales son todavía el marcador más utilizado en la práctica clínica; presentes en la membrana de los osteoblastos, son un grupo de enzimas que catalizan la hidrólisis de los ésteres de fosfato a pH alcalino. En el suero humano, las fosfatasas alcalinas tisulares no específicas (hígado, hueso, riñón), intestinal y placentaria son codificadas por diferentes genes. La enzima tiene una vida media de 24 a 48 horas y es metabolizada en el hígado. Las dos principales isoformas de la fosfatasa alcalina, hueso e hígado, son difíciles de distinguir porque tienen secuencias de aminoácidos similares y difieren solo en la glicosilación postraduccional. Las fosfatasas alcalinas óseas son producidas por los osteoblastos y también por los condrocitos de la capa hipertrófica del cartílago de crecimiento. En los niños mayores de 4 años las fosfatasas alcalinas óseas constituyen del 75 al 90% de la fosfatasa alcalina total. Después de la pubertad disminuyen a 50% de las FAL (9)(10). Las concentraciones circulantes de FAO aumentan durante el primer año de vida y durante la pubertad a valores hasta 10 veces los niveles del adulto. Las FAL aumentan 5 veces. Presentan diferencias en relación al sexo. Durante la pubertad el pico en las niñas se produce en los estadios 2 y 3 de Tanner, y 2 años antes que en los niños (11). Luego de la pubertad las FAO disminuyen a valores del adulto (Fig. 3).

Figura 3. Valores de fosfatasas óseas (FAO) en niños. Figura superior extraída de (10), y figura inferior extraída de (23).
Las FAO están relacionadas en forma significativa con la edad, sexo, estadios de la pubertad, contenido mineral óseo y velocidad de crecimiento linear (12) (Fig. 4). Es un buen marcador en niños tratados con hormona de crecimiento (HC), ya que aumentan y se correlacionan con aumento de la densidad mineral ósea (13). Han sido descriptos varios métodos de medición de fosfatasa alcalina ósea (1): inhibición por calor, precipitación con lectina de germen de trigo, electroforesis, ELISA, IRMA y quimioluminiscencia. Existen numerosos trabajos con valores de referencia en niños (10-24), y de FAL (15)(20)(25-28).

Figura 4. Logaritmo de FAO versus logaritmo de estatura en (p) niños y (o) niñas sanos.— Línea de regresión. Extraído de (12).
La osteocalcina es la proteína no colágena más abundante de la matriz ósea producida principalmente por los osteoblastos. Es una proteína vitamina K dependiente que se deposita en la matriz extracelular. También la producen los odontoblastos. Se halla en muy pequeñas cantidades en la circulación y es excretada rápidamente por el riñón. Está relacionada a la mineralización de la matriz bajo el control de la 1,25 dihidroxivitamina D. Su rol fisiológico en el esqueleto aún no está dilucidado. Si bien se correlaciona con parámetros de formación ósea, se halla elevada en estados de alta remodelación como en la tirotoxicosis e hiperparatiroidismo, y disminuida en el hipotiroidismo e hipoparatiroidismo. Sería un marcador de remodelación más que de formación, pero se desconoce aún su utilidad clínica. Dado que los desórdenes metabólicos en niños son principalmente causados por defectos de la función osteoblástica, la OC parece ser una buena herramienta para la investigación clínica y fisiológica (10). Es niños con deficiencia de hormona de crecimiento es un buen marcador para evaluar la respuesta al tratamiento (29)(30). Si bien en adultos un tercio de la OC circulante es la molécula intacta, en los niños se desconoce la distribución de las formas circulantes. Las concentraciones séricas varían con la edad y el estadio puberal; son de 10 a 20 veces más altas en niños que en adultos (8). En las niñas aumenta a los 10 años de edad y realiza un pico dos años después, disminuyendo luego hacia los 17 a 19 años a valores del adulto (10- 15 ng/mL). En los niños aumenta hacia los 11 años de edad, con un pico hacia los 14 años con niveles mayores que en las niñas y disminuyendo terminada la pubertad a valores del adulto. Entre los 7 y 13 años de edad los valores son similares en los dos sexos (Fig. 5). Se correlaciona con la estatura, la velocidad de crecimiento, la IGF I y la testosterona (29)(31)(32).

Figura 5. Osteocalcina sérica en niños (círculos sólidos) y niñas (círculos abiertos) sanos en función de la edad. Los valores se presentan como promedio y error estándar. Extraído de (33).
La osteocalcina, IGF-I y testosterona también se han relacionado positivamente con la estatura (33). Durante la niñez, la OC tiene un ritmo circadiano con valores más elevados por la mañana (34). Se puede medir por RIA, ELISA, quimio y electroquimioluminiscencia. Todos detectan la molécula intacta excepto electroquimioluminiscencia. Existen numerosos trabajos de valores de referencia de OC en niños en la literatura (11) (13-21)(24)(26)(27)(33)(35-38). El colágeno tipo I es la proteína más abundante del hueso, comprende el 90% de las proteínas de la matriz ósea, no es exclusivo del hueso, también se halla en hígado, piel, tendones, etc. Los propéptidos aminoterminal (PINP) y carboxiterminal (PICP) son liberados del procolágeno tipo I y vertidos en la circulación antes que las moléculas de colágeno sean incorporadas a la fibrilla de colágeno. Las concentraciones séricas de ambos propéptidos están relacionadas directamente con el nuevo colágeno formado. Son rápidamente metabolizados en el hígado. Están aumentados en enfermedades hepáticas, y no están influenciados por la función renal dado que por su tamaño no se filtran por los glomérulos renales. PICP y PINP están relacionados con la edad (10), y la velocidad de crecimiento (39). El PICP se halla muy elevado en los primeros años de vida, desciende luego, y aumenta durante la pubertad solo dos veces más que los valores del adulto. Disminuyen en la etapa post-puberal al límite superior de adultos, entre 13 y 15 años en las niñas y entre 15 y 18 años en los niños (40) (Fig. 6). El aumento de PINP en la pubertad en los varones se asocia a la testosterona, al contenido mineral óseo lumbar (41) y a la velocidad de crecimiento (Fig. 7). Tienen un ritmo circadiano con mayores valores durante la mañana y más bajos por la tarde.

Figura 6. Valores de PICP en niños sanos. Extraído de (10).

Figura 7. Arriba: Concentraciones de PINP en 155 niños de 8,8 a 15,7 años y de 151 niñas de 8,2 a 14 años en relación al estadio puberal. Abajo: relación de la velocidad de crecimiento con el estadio puberal. Extraído de (18).
El PICP, disponible desde 1990, ha sido analizado en la población pediátrica. Es un marcador sensible de la formación ósea. Se ha utilizado para monitorear la respuesta al tratamiento con hormona de crecimiento (42), y está disminuido en niños con asma y enfermedad intestinal crónica tratados con corticoides (43) (44). EL PICP se mide por RIA, ELISA, y el PINP también por electroquimioluminiscencia. Existen numerosos trabajos en la literatura de valores de referencia en niños de PICP (10)(11)(13)(16) (18)(20)(27)(36)(38)(40)(41)(45-48), y de PINP (18) (20)(27)(41).
Marcadores de resorción ósea
La resorción ósea es más elevada en niños que en adultos. La hidroxiprolina urinaria (HPr) proviene de la triple hélice de todos los tipos de colágeno. Es liberada a la circulación en forma libre y unida a otros péptidos. El 90% se metaboliza en el hígado, el resto se excreta en orina. Puede ser medida por colorimetría y HPLC. Ha sido utilizada por más de cuarenta años, actualmente en desuso ya que existen marcadores más útiles en la práctica clínica. Se han descrito valores de referencia para HPr en la literatura (25)(38)(49)(50).
Las piridolinas (Pyr) y deoxipiridolinas (DPyr) provienen de la maduración de las fibrillas de colágeno. En el proceso de resorción, las moléculas de colágeno liberan Pyr y DPyr a la circulación, se excretan por orina en forma libre (40%) o unidas a los telopéptidos N o C terminal (60%) (8). La concentración de Pyr es mayor que la de DPyr. La Pyr se halla también en el cartílago articular mientras que la DPyr es más específica de hueso aunque puede existir en pequeñas cantidades en tendones, ligamentos y sinovia. La producción de Pyr y DPyr no está influenciada por la dieta, presenta variaciones diurnas, con aumento por la mañana y disminución por la tarde (51), siendo útil la recolección de la primera orina de la mañana. Ambas Pyr y DPyr son más sensibles que la HPr a pequeños cambios de la remodelación ósea y su excreción está incrementada especialmente durante la lactancia y adolescencia. Realizan un pico al comienzo de la adolescencia que en las niñas coincide con el estadío 2 de Tanner (52). Los niveles prepuberales son 4 a 5 veces más altos que en los adultos, alcanzando los valores del adulto al final de la pubertad (Fig. 8) (Fig. 9). Los valores de Pyr y DPyr cambian en función de la edad, sexo y pubertad, y la excreción urinaria de ambas moléculas se halla correlacionada a la velocidad de crecimiento (53) (54). Pueden ser marcadores útiles en la evaluación de desórdenes metabólicos óseos y para monitorear la respuesta a tratamientos antiresortivos. Se miden por quimioluminiscencia y HPLC. Se hallan datos de valores de referencia en la literatura de niños nacidos prematuros (48), de bebés (26) (36)(47), y de niños y adolescentes, la mayoría de mediciones realizadas por HPLC (11)(12)(17)(18)(20)(24) (25)(38)(50)(52-57).

Figura 8. Valores individuales de excreción de DPyr urinaria en niños sanos. Extraído de (52).

Figura 9. Excreción de DPyr urinaria en 176 niños sanos en relación con el estadio puberal. Extraído de (52).
Los telopéptidos N y C terminales son marcadores específicos y sensibles de la resorción ósea. La excreción urinaria de NTX o N-telopéptido del colágeno tipo I, es elevada en el niño recién nacido con un pico en el segundo mes de vida, disminuyendo luego hasta los 3 años de edad (47)(58)(59)(60) (Fig. 10). Se mantienen estables durante la niñez con valores de cuatro a cinco veces más elevados que en los adultos, y presentan un segundo pico en la pubertad (Fig. 11). En las niñas los valores aumentan en los estadios 1 a 3 de Tanner, mientras en los niños son más elevados en los estadios 4 y 5 (52). Tiene un ritmo circadiano con valores más elevados durante la mañana disminuyendo por la tarde, igual al ritmo circadiano de la hormona de crecimiento, los niveles de NTX se correlacionan con la velocidad de crecimiento. Después de la pubertad los marcadores disminuyen a valores del adulto. Puede ser medido en suero u orina. Su medición en orina necesita ser ajustada a la concentración de creatinina y se mide por ELISA. En la literatura se han informado valores de referencia de NTX en bebés (47)(59)(60) y de niños y adolescentes (20)(25)(27)(52)(58).
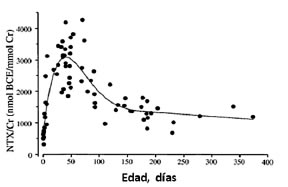
Figura 10. Valores individuales de NTX/Cr urinarios en 70 bebés sanos nacidos de término, desde el nacimiento hasta 1 año de vida. Extraído de (60).

Figura 11. Valores individuales de NTX/Cr urinarios en muestras de orina de 176 niños sanos de 4 a 20 años de edad. Extraído de (52).
El ICTP o C-telopéptido del colágeno tipo I es liberado durante la degradación del colágeno y ha sido asociado a estados patológicos de degradación ósea como en la lisis ósea, mientras NTX es más efectivo en el monitoreo de cambios de actividad osteoclástica como en osteoporosis y sus tratamientos. Los valores de ICTP igual que los demás marcadores realizan un pico durante los dos primeros años de vida y luego durante la adolescencia (Fig. 12). Durante la pubertad, los valores de ICTP alcanzan los valores del pico de los primeros años de vida (40). El aumento de ICTP en la pubertad en los varones se asocia a la testosterona y al contenido mineral óseo lumbar (41). Su medición sérica se realiza por RIA. Se hallan valores de referencia de ICTP en la literatura de bebés (48)(61), y de niños y adolescentes (11)(16) (18)(20)(21)(27)(40)(41)(46). El CTX se halla en formas alfa y beta. La forma "alfa" es más abundante en niños y adolescentes, se mide en orina, su descenso postpuberal es más pronunciado que la isoforma "beta". Sin embargo, no hay estudios comparativos de las dos isoformas de CTX (8). Los valores prepuberales de CTX séricos son cuatro a cinco veces más elevados que en los adultos. Igual que los demás marcadores óseos realizan un pico durante la adolescencia, en las niñas dos años antes que en los niños (Fig. 13)(Fig. 14). El CTX alfa se mide en orina por ELISA y el CTX beta se mide en suero por ELISA y electroquimioluminiscencia. Se hallan valores de referencia de CTX beta en la literatura en bebés prematuros (62), de CTX alfa en orina (47)(62), y de CTX beta sérico en niños y adolescentes (20-22)(27)(63)(64).

Figura 12. Concentraciones de ICTP en suero (RIA) en 572 niños (300 niños y 272 niñas) de 2 meses a 18 años. Extraído de (21).

Figura 13. Concentraciones de CTX séricos en niños prepuberales. Extraído de (64).

Figura 14. Concentraciones de CTX en suero (ELISA) en 572 niños (300 niños y 272 niñas) de 2 meses a 18 años de edad. Extraído de (21).
Las fosfatasas ácidas tartrato resistentes 5b (TRAP) están presentes en los osteoclastos y se relacionan con la degradación de la matriz ósea. Son consideradas un marcador específico de la diferenciación de los osteoclastos. Se miden en suero y son más de dos veces más elevadas en niños si se comparan con adultos (Figs. 15) (Fig. 16). El uso de este marcador es limitado. Se han publicado valores de referencia en niños, y están relacionados a la velocidad de crecimiento (11)(20)(21)(23)(25)(65)(66). Se mide en suero por RIA y ELISA.
Además de los compuestos provenientes del colágeno tipo 1, los marcadores de resorción ósea incluyen también la disolución de las sales de calcio. Existen valores de referencia de calciuria en niños en la literatura (47)(57)(67)(68).

Figura 15. Concentraciones de TRAP en suero (RIA) en 404 niños sanos (225 niños y 179 niñas) de 0 a 17 años de edad expresadas como promedio y error estándar. Extraído de (66).

Figura 16. Concentraciones de TRAP en suero (RIA) en 424 niños sanos de 0 a 21 años de edad. Extraído de (23).
RELACIÓN DE LOS MARCADORES CON LA EDAD Y EL DESARROLLO HORMONAL DURANTE EL CRECIMIENTO
Los marcadores óseos están muy elevados en los niños al nacer y disminuyen luego hasta la edad de 3 años coincidiendo con el enlentecimiento del crecimiento linear. La excreción urinaria de los marcadores de resorción coincide con las curvas de crecimiento linear. Los valores de los marcadores se incrementan cuando un niño crece rápido durante el primer año de vida o durante la adolescencia (8)(52). Se mantienen estables y similares en ambos sexos entre los 4 y 10 años, con valores más altos que los del adulto. Realizan un segundo pico en la pubertad. El brote puberal se produce más tarde en los varones y dura más tiempo que en las mujeres. Los valores más elevados de marcadores óseos en la pubertad se producen en los estadios 2 y 3 en las niñas y en los estadios 4 y 5 en los niños (11)(41). Van der Sluis et al. hallaron un aumento puberal de los marcadores óseos a los 12 años de edad en las niñas y 2,5 años después en los varones (27).
La máxima velocidad de crecimiento en las niñas se produce en el estadio 3 de Tanner y en los varones y a variaciones circadianas e intraindividuales. Por dificultades en la recolección de orina de 24 horas, a menudo se prefiere la primera orina de la mañana, aún sabiendo que hay escasa correlación entre las dos formas de recolección (67). Los marcadores urinarios se expresan en relación a la creatinina urinaria. Sin embargo, la expresión por la creatinina tiene sus limitaciones. La creatinina está relacionada a la masa muscular. Aumenta en los recién nacidos que reciben creatinina de la madre, disminuyendo los valores de los marcadores, y a la inversa, si la creatinina disminuye, por ejemplo en casos de hipotonía muscular o tratamiento con corticoides, los valores de los marcadores aumentan. También la variación circadiana de la creatinina con aumento diurno influye en los resultados de una recolección de 24 h versus una muestra aislada. En las adolescentes además hay variaciones de la creatinina durante el ciclo menstrual, y finalmente, la creatinina urinaria depende de la dieta y de factores técnicos como la alcalinización de la orina almacenada.
Otra manera de expresar correctamente los valores de los marcadores urinarios sería por kilo de peso o por metro cuadrado de superficie corporal. Sin embargo, en los obesos se sobrestiman los resultados, y al contrario en los sujetos muy delgados se subestiman. Ningún marcador tiene un 100% de especificidad. Existe una relativa pobre precisión de los ensayos así como en las variaciones de niveles día a día. La mediciones en orina de 24 horas obvian las variaciones circadianas pero no las variaciones día a día. Por la variación diurna, se sugiere tomar las muestras en condiciones estándar.
PROBLEMAS PRÁCTICOS ASOCIADOS A LOS MARCADORES
Existen problemas prácticos relacionados con la medición de la excreción urinaria de marcadores óseos en niños y adolescentes asociados a la recolección de orina y a variaciones circadianas e intraindividuales. Por dificultades en la recolección de orina de 24 horas, a menudo se prefiere la primera orina de la mañana, aún sabiendo que hay escasa correlación entre las dos formas de recolección (67). Los marcadores urinarios se expresan en relación a la creatinina urinaria. Sin embargo, la expresión por la creatinina tiene sus limitaciones. La creatinina está relacionada a la masa muscular. Aumenta en los recién nacidos que reciben creatinina de la madre, disminuyendo los valores de los marcadores, y a la inversa, si la creatinina disminuye, por ejemplo en casos de hipotonía muscular o tratamiento con corticoides, los valores de los marcadores aumentan. También la variación circadiana de la creatinina con aumento diurno influye en los resultados de una recolección de 24 h versus una muestra aislada. En las adolescentes además hay variaciones de la creatinina durante el ciclo menstrual, y finalmente, la creatinina urinaria depende de la dieta y de factores técnicos como la alcalinización de la orina almacenada. Otra manera de expresar correctamente los valores de los marcadores urinarios sería por kilo de peso o por metro cuadrado de superficie corporal. Sin embargo, en los obesos se sobrestiman los resultados, y al contrario en los sujetos muy delgados se subestiman. Ningún marcador tiene un 100% de especificidad. Existe una relativa pobre precisión de los ensayos así como en las variaciones de niveles día a día. La mediciones en orina de 24 horas obvian las variaciones circadianas pero no las variaciones día a día. Por la variación diurna, se sugiere tomar las muestras en condiciones estándar.
LIMITACIONES DE LOS MARCADORES ÓSEOS EN PEDIATRÍA
El crecimiento óseo y la modelación en niños son responsables de valores elevados de los marcadores comparados con los valores del adulto, pero las mediciones en sangre y orina no se relacionan en forma directa con la ganancia de hueso acumulado durante el crecimiento (8).
Ningún marcador tiene los criterios de un marcador ideal y ningún marcador óseo en pediatría es específico para cada uno de los tres procesos biológicos de remodelación, modelación y crecimiento epifisario (9)(21). Los cambios de los marcadores óseos reflejan cambios en la velocidad de crecimiento linear y las concentraciones pueden ser iguales en un niño con alta remodelación ósea y baja velocidad de crecimiento, y en un niño con crecimiento normal. La sensibilidad de los marcadores es pobre, de ahí que en pediatría debe controlarse además el crecimiento longitudinal, la acumulación ósea y el desarrollo puberal para interpretar los resultados (70). En niños de mismo sexo y edad puede haber diferencias en la edad esquelética y estadio puberal. Otra limitación para la interpretación de los resultados es que no representan un sitio especial del esqueleto sino al esqueleto total. Casi todos los marcadores tienen variaciones diurnas con concentraciones elevadas en la mañana y bajas por la tarde. Existe correlación entre todos los marcadores. Los marcadores se segregan durante las diferentes etapas de formación, resorción o crecimiento óseo, y pueden tener diferente eliminación y vida media.
APLICACIÓN CLÍNICA
Mientras los marcadores parecen ser útiles en investigación del metabolismo óseo en niños, su uso clínico de rutina aún no está comprobado (8). En general, un solo marcador es impreciso para tomar decisiones clínicas (50). A menudo se usan para evaluar el desorden metabólico y la remodelación ósea en las enfermedades óseas. Los niños con enfermedades crónicas se asocian a un crecimiento pobre, masa ósea baja y acumulación ósea pobre, y los marcadores óseos están disminuidos para edad y sexo y con frecuencia se asocian a baja masa ósea, baja modelación y lento crecimiento linear. La remodelación ósea está disminuida en los niños desnutridos. El bajo peso se acompaña de baja superficie corporal y disminución de la masa muscular con disminución de la creatinina urinaria y un aumento artificial de los marcadores óseos de resorción que estarían más suprimidos en estos niños. Al corregir la desnutrición aumenta el peso, y aumenta la remodelación ósea. En los niños prematuros y en los nacidos a término de bajo peso, los marcadores de formación OC y FAO están disminuidos (71), y estarían relacionados a la actividad reducida de la hormona del crecimiento e IGF-I. Luego aumentan en los primeros días de vida y en varias semanas igualan a los recién nacidos a término. Los marcadores de resorción están aumentados en los niños prematuros y continúan aumentando luego del nacimiento. Esta disociación entre baja formación y alta resorción explica la osteopenia del prematuro (72).
Los pacientes con déficit de hormona de crecimiento tienen estatura pequeña y retraso de la edad ósea, y los marcadores óseos están disminuidos (53). La masa ósea está disminuida y los huesos son más pequeños. La lenta acumulación de masa ósea forma parte de la disminución de la remodelación ósea. El tratamiento con HC estimula la secreción de IGF-I e IGFBP-3 con activación de la remodelación ósea. Los marcadores óseos aumentan con ganancia de estatura y del contenido mineral óseo (35)(73). El PICP aumenta a la semana, la DPyr al mes y la OC a los tres meses de tratamiento. Las FAL siguen siendo el marcador más usado en la práctica clínica, y los cambios de las FAO después de 3 meses de tratamiento es el mejor predictor de la velocidad de crecimiento (42)(74). En osteogénesis imperfecta (OI) tipo I se han hallado valores bajos de PICP (75). Se ha sugerido que se podría utilizar la medición de PICP para distinguir OI del niño golpeado y a los portadores de la enfermedad. En contraste, el NTX se ha hallado elevado en los tres tipos de OI no letales. Los bisfosfonatos son usados en las osteogénesis imperfecta y osteoporosis secundarias causadas por enfermedades crónicas y tratamientos que aumentan el riesgo de fracturas en niños. Los bisfosfonatos inhiben la actividad osteoclástica y por ende la resorción ósea, y los marcadores de resorción disminuyen rápidamente, siendo usados comúnmente para monitorear el tratamiento. Los marcadores de formación disminuyen a medida que se suprime el proceso de remodelación (76).
Los corticoides reducen la remodelación ósea, el crecimiento longitudinal y la masa ósea en niños. En los niños tratados con corticoides, se enlentece el crecimiento y la formación ósea está inhibida. La administración oral es más deletérea para la masa ósea que la administración por inhalación. El PICP está inhibido después de 1 a 2 semanas de tratamiento con corticoides orales en niños con enfermedad inflamatoria intestinal (12) (77). En la enfermedad de Crohn, las FAO están disminuidas y la DPyr elevada. Los pacientes tienen elevadas las citoquinas como el TNF y la interleuquina 6 que estimulan la proliferación y diferenciación osteoclástica (12). En los niños con asma y tratamiento endovenoso con corticoides, el PICP disminuye a las 48 horas de tratamiento. Los marcadores óseos para evaluar en niños tratados con corticoides varían y no estarían correlacionados con la velocidad de crecimiento.
Conclusión
Los marcadores óseos durante la niñez y adolescencia reflejan cambios fisiológicos del crecimiento óseo y de acumulación ósea durante la infancia (modelación ósea). El metabolismo óseo es muy activo en los lactantes y disminuye hacia los tres años de edad. Se mantienen estables en el período prepuberal y aumentan al comenzar el brote puberal. Después de la pubertad disminuyen a valores del adulto. En los niños el aumento puberal es más tardío, pronunciado y duradero que en las niñas, correspondiendo a mayor crecimiento y acumulación ósea. Los niveles de los marcadores se correlacionan mejor con el crecimiento linear que con la acumulación mineral. Es necesario conocer la velocidad de crecimiento y el desarrollo puberal para interpretarlos correctamente. La regulación hormonal aún no está bien comprendida y los marcadores óseos serían de utilidad para elucidar estos mecanismos. Los marcadores de formación y resorción óseas permiten valorar la remodelación ósea en la fisiopatología del esqueleto en crecimiento y de las enfermedades durante la niñez. Sin embargo, las concentraciones de los marcadores no están directamente relacionadas a la cantidad de hueso ganado durante el crecimiento ni al hueso perdido en la edad adulta. Mientras los marcadores óseos parecen ser de utilidad en investigación del metabolismo óseo en pediatría, el uso de rutina en clínica aún no está establecido.
1. Seibel MJ. Biochemical markers of bone remodeling. Endocrinol Metab Clin North Am 2003; 32: 83-113. [ Links ]
2. Garnero P, Darte C, Delmas P. A model to monitor the efficacy of alendronate treatment in women with osteoporosis using a biochemical marker of bone turnover. Bone 1999; 24: 603-9. [ Links ]
3. Cremers S, Garnero P. Biochemical markers of bone turnover in the clinical development of drugs for osteoporosis and metastatic bone disease: potential uses and pitfalls. Drugs 2006; 66: 2031-58. [ Links ]
4. Eastell R, Barton I, Hannon RA, Chines A, Garnero P, Delmas PD. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate. J Bone Miner Res 2003; 18 (3): 1051-6. [ Links ]
5. Ross PD, Kress BC, Parson RE, Wasnich RD, Armour KA, Mizrahi IA. Serum bone alkaline phosphatase and calcaneus bone density predict fractures: a prospective study. Osteoporosis Int 2000; 11: 76-82. [ Links ]
6. Bjarnason NH, Sarkar S, Duong T, Mitlak B, Delmas PD, Christiansen C. Six and twelve month changes in bone turnover are related to reduction in vertebral fracture risk during 3 years of raloxifene treatment in postmenopausal osteoporosis. Osteoporosis Int 2001; 12 (11): 922-30. [ Links ]
7. Rauch F. Watching bone cells at work: what we can see from bone biopsies. Pediatr Nephrol 2006; 21: 457- 62. [ Links ]
8. Szulc P, Seeman E, Delmas PD. Biochemical measurements of bone turnover in children and adolescents. Osteoporosis Int 2000; 11: 281-94. [ Links ]
9. Schonau E, Rauch F. Markers of bone and collagen metabolism-problems and perspectives in paediatrics. Horm Res 1997; 48 (suppl 5): 50-9. [ Links ]
10. Tsai KS, Jang MH, Hsu SH, Cheng WC, Chang MH. Bone alkaline phosphatase isoenzyme and carboxy-terminal propeptide of type-I procollagen in healthy Chinese girls and boys. Clin Chem 1999; 45: 136–8.
11. Blumsohn A, Hannon RA, Wrate R, Barton J, Al-Dehaimi AW, Colwell A, et al. Biochemical markers of bone turnover in girls during puberty. Clin Endocrinol 1994; 40: 663–70.
12. Tuchman S, Thayu M, Shults J, Zemel BS, Burnham JM, Leonard MB. Interpretation of biomarkers of bone metabolism in children: impact of growth velocity and body size in healthy children and chronic disease. J Pediatr 2008; 153: 484–90.
13. Tobiume H, Kanzaki S, Hida S, Ono T, Moriwake T, Yamauchi S, et al. Serum bone alkaline phosphatase isoenzyme levels in normal children and children with growth hormone (GH) deficiency: a potential marker for bone formation and response to GH therapy. J Clin Endocrinol Metab 1997; 82: 2056–61.
14. Pittard WB, Geddes KM, Hulsey TC, Hollis BW. Osteocalcin, skeletal alkaline phosphatase, and bone mineral content in very low birth weight infants: a longitudinal assessment. Pediatr Res 1992; 31: 181–5.
15. Magnusson P, Hager A, Larsson L. Serum Osteocalcin and Bone and Liver Alkaline Phosphatase Isoforms in Healthy Children and Adolescents. Pediatr Res 1995; 38: 955–61.
16. Tommasi M, Bacciottini L, Benucci A, Brocchi A, Passeri A, Saracini D, et al. Serum biochemical markers of bone turnover in healthy infants and children. Int J Biol Markers 1996; 11: 159–64.
17. Mora S, Pitukcheewanont P, Kaufman FR, Nelson JC, Gilsanz V. Biochemical markers of bone turnover and the volume and the density of bone in children at different stages of sexual development. J Bone Miner Res 1999; 14: 1664–71.
18. van Coeverden SC, Netelenbos JC, de Ridder CM, Roos JC, Popp-Snijders C, Delemarre-van de Waal HA. Bone metabolism markers and bone mass in healthy pubertal boys and girls. Clin Endocrinol (Oxf) 2002; 57: 107–16.
19. Chailurkit LO, Suthutvoravut U, Mahachoklertwattana P, Charoenkiatkul S, Rajatanavin R. Biochemical markers of bone formation in Thai children and adolescents. Endocr Res 2005; 31 (3): 159–69.
20. Liju Yang, Vijaylaxmi Grey, Liju Yang, Vijaylaxmi Grey. Pediatric reference intervals for bone markers. Clin Biochem 2006; 39: 561–8.
21. Rauchenzauner M, Schmid A, Heinz-Erian P, Kapelari K, Falkensammer G, Griesmacher A, et al. Sex- and age-specific reference curves for serum markers of bone turnover in healthy children from 2 months to 18 years. J Clin Endocrinol Metab 2007; 92: 443–9.
22. Leger J, Mercat I, Alberti C, Chevenne D, Armoogum P, Tichet J, et al. The relationship between the GH/IGF-I axis and serum markers of bone turnover metabolism in healthy children. Eur J Endocrinol 2007; 157: 685–92.
23. Fischer DG, Mischek A, Wolf S, Rahn A, Salweski B, Kundt G, et al. Paediatric reference values for the C-terminal fragment of fibroblast-growth factor-23, sclerostin, bone-specific alkaline phosphatase and isoform 5b of tartrate-resistant acid phosphatase. Ann Clin Biochem 2012; 49: 546–53.
24. Stevenson DA, Rudser K, Kunin-Batson A, Fung EB, Viskochil D, Shapiro E, et al. Biomarkers of Bone Remodeling in Children with Mucopolysaccharidosis Types I, II, and VI. J Pediatr Rehabil Med 2014; 7 (2): 159–65.
25. Weaver C M, Peacock M, Martin BR, McCabe GP, Zhao J, Smith DL, et al. Quantification of biochemical markers of bone turnover by kinetic measures of bone formation and resorption in young healthy females. J Bone Miner Res 1997; 12: 1714–20.
26. de Toro Salas A, Dueñas Díez JL, de Jaime Revuelta E. Concentraciones de calcio y de marcadores de remodelamiento óseo en sangre de cordón umbilical y en orina del recién nacido en el parto. An Esp Pediatr 2001; 54: 290–6.
27. Van der Sluis IM, Hop WC, van Leeuwen JPTM, Pols HAP, de Muinck Keizer-Schrama SMPF. A cross-sectional study on biochemical parameters of bone turnover and vitamin D metabolites in healthy dutch children and young adults. Horm Res 2002; 57: 170–9.
28. Ridefelt P, Gustafsson J, Aldrimer M, Hellberg D. Alkaline phosphatase in healthy children: reference intervals and prevalence of elevated levels. Horm Res Paediatr 2014; 82: 399–404.
29. Delmas PD, Chatelain P, Malaval L, Bonne G. Serum bone Gla-protein in growth hormone deficient children. J Bone Miner Res 1986; 4: 333–8.
30. Johansen JS, Jensen SB, Riis BJ, Rasmussen L, Zachmann M, Christiansen C. Serum bone Gla protein: a potential marker of growth hormone (GH) deficiency and the response to GH therapy. J Clin Endocrinol Metab 1990; 71: 122–6.
31. Nielsen HK, Jorgensen JOL, Brixen K, Christiansen JS. Serum osteocalcin and bone isoenzyme alkaline phosphatase in growth hormone-deficient patients: dose– response studies with biosynthetic human GH. Calcif Tissue Int 1991; 48: 82–7.
32. Stamoyannou L, Karachaliou F, Giourelie E, Voskaki E, Mengreli C, Barsocas CS. Effect of growth hormone therapy on bone metabolism of growth hormone deficient children. Eur J Pediatr 1997; 156: 592–6.
33. Johansen JS, Giwercman A, Hartwell D, Nielsen G, Price P, Christiansen C, et al. Serum bone gla-protein as a marker of bone growth in children and adolescents: correlation with Age, height, serum insulin-like growth factor I, and serum testosterone. J Clin Endocrinol Metab 1988; 67: 273–8.
34. Heuck C, Skjaerbaek C, Wolthers OD. Diumal rhythm of serum osteocalcin in normal children. Acta Paediatr 1998; 87: 930–2.
35. Kanzaki S, Hosoda K, Moriwake T, Tanaka H, Kubo T, Inoue M, et al. Serum propeptide and intact molecular osteocalcin in normal children and children with growth hormone (GH) deficiency: A potential marker of bone growth and response to GH therapy. J Clin Endocrinol Metab 1992; 75: 1104–9.
36. Lieuw-A-Fa M, Sierra RI, Specker BL. Carboxy-terminal propeptide of human type I collagen and pyridinium cross-links as markers of bone growth in infants 1 to 18 months of age. J Bone Miner Res 1995; 10: 849–53.
37. Cioffi M, Molinari AM, Gazzerro P, Di Finizio B, Frata M, Deufemia A, et al. Serum osteocalcin in 1634 healthy children. Clin Chem 1997; 43: 543–5.
38. Manjón Llorente G, Fernández-Espuelas C, González López JM, Ruiz-Echarri MP, Baldellou Vázquez A. Valores normales de los marcadores del recambio óseo durante la infancia. An Pediatr (Barc) 2004; 60 (4): 330–6.
39. Kikuchi T, Hashimoto N, Kawasaki T, Kataoka S, Takahashi H, Uchiyama M. Plasma levels of carboxy terminal propeptide of type I procollagen and pyridinoline cross-linked telopeptide of type I collagen in healthy school children. Acta Paediatr 1998; 87: 825–9.
40. Kubo T, Tanaka H, Inoue M, Kanzaki S, Seino Y. Serum levels of carboxyterminal propeptide of type I procollagen and pyridinoline crosslinked telopeptide of type I collagen in normal children and children with growth hormone (GH) deficiency during GH therapy. Bone 1995; 17: 397–401.
41. Jurimae J, Pomerants T, Tillmann V, Jurimae T. Bone metabolism markers and ghrelin in boys at different stages of sexual maturity. Acta Pædiatr 2009; 98: 892–6.
42. Crofton PM, Stirling HF, Schonau E, Kelnar CJ. Bone alkaline phosphatase and collagen markers as early predictors of height velocity response to growth-promoting treatment in short normal children. Clin Endocrinol 1996; 44: 385–94.
43. Birkebaek NH, Esberg G, Andersen K, Wolthers O, Hassager C. Bone and collagen turnover during treatment with inhaled dry powder budesonide and beclomethasone dipropionate. Arch Dis Child 1995; 73: 524–7.
44. Hyamas JS, Treem WR, Carey DE, Wyzga N, Eddy E, Goldberg D, et al. Comparison of collagen propeptide as growth markers in children with inflammatory bowel disease. Gastroenterology 1991; 100: 971–5.
45. Saggese G, Bertelloni S, Baroncelli GI, Di Nero G. Serum levels of carboxyterminal propeptide of type I procollagen in healthy children from 1st year of life to adulthood and in metabolic bone diseases. Eur J Pediatr 1992; 151: 764–8.
46. Crofton PM, Wade JC, Taylor MR, Holland CV. Serum concentrations of carboxyl-terminal propeptide of type I procollagen, amino-terminal propeptide of type III procollagen, cross-linked carboxyl-terminal telopeptide of type I collagen, and their interrelationships in schoolchildren. Clin Chem 1997; 43: 1577–81.
47. Zanze M, Souberbielle JC, Kindermans C, Rossignol C, GarabedianM. Procollagen propeptide and pyridinium cross-links as markers of type I collagen turnover: sex- and age-related changes in healthy children. J Clin Endocrinol Metab 1997; 82: 2971–7.
48. Crofton PM, Shrivastava A, Wade JC, Stephen R, Kelnar CJ, Lyon AJ, et al. Bone and collagen markers in preterm infants: relationship with growth and bone mineral content over the first 10 weeks of life. Pediatr Res 1999; 46: 581–7.
49. Beardsworth LJ, Eyre DR, Dickson IR. Changes with Age in the Urinary Excretion of Lysyl - and hydroxylysylpyridinoline, two new markers of bone collagen turnover. J Bone Miner Res 1990; 5 (7): 671–6.
50. Rauch F, Georg M, Stabrey A, Neu C, Blum WF, Remer T, et al. Collagen markers deoxypyridinoline and hydroxylysine glycosides: pediatric reference data and use for growth prediction in growth hormone-deficient children. Clin Chem 2002; 48: 315–22.
51. Fujimoto S, Kubo T, Tanaka H, Miura M, Seino Y. Urinary pyridinoline and deoxypyridinoline in healthy children and in children with growth hormone deficiency. J Clin Endocrinol Metab 1995; 80: 1922–8.
52. Mora S, Prinster C, Proverbio MC, Bellini A, de Poli SCL, Weber G, et al. Urinary markers of bone turnover in healthy children and adolescents: age-related changes and effect of puberty. Calcif tissue Int 1998; 63: 369–74.
53. Marowska J, Kobylinska M, Lukaszkiewicz J, Talajko A, Rymkiewicz-Kluczynska B, Lorenc RS. Pyridium crosslinks of collagenas a marker of bone resorption rates in children and adolescents: normal values and clinical application. Bone 1996; 19 (6): 669–77.
54. Rauch F, Schonau E, Woitge H, Remer T, Seibel M. Urinary excretion of hydroxy-pyridinium crosslinks of collagen reflects skeletal growth velocity in normal children. Exp Clin Endocrinol 1994; 102: 94–7.
55. Rauch F, Rauch R, Woitge HW, Seibel MJ, Schonau E. Urinary immunoreactive deoxypyridinoline in children and adolescents: variations with age, sex and growth velocity. Scand J Clin Lab Invest 1996; 56: 715–9.
56. Kraenzlin ME, Kraenzlin CA, Meier C, Giunta C, Steinmann B. Automated HPLC assay for urinary collagen cross-links: effect of age, menopause, and metabolic bone diseases. Clin Chem 2008; 54 (9): 1546–53.
57. Linglart A, Marchand I, Djavidi A, Senez C, Benigni I, Rothenbuhler A, et al. Osteoporosis in children with cerebral palsy. Arch Pediatr 2009; 16: 614–5.
58. Bollen AM, Eyre DR. Bone resorption rates in children monitored by the urinary assay of collagen type I crosslinked peptides. Bone 1994; 15: 31–4.
59. Mora S, Prinster C, Bellini A, Weber G, Proverbio MC, Puzzovio M, et al. Bone turnover in neonates: changes of urinary excretion rate of collagen type I cross-linked peptides during the first days of life and influence of gestational age. Bone 1997; 20: 563–6.
60. Lapillonne A, Travers R, DiMaio M, Salle BL, Glorieux FH. Urinary excretion of cross-linked N-telopeptides of type 1 collagen to assess bone resorption in infants from birth to 1 year of age. Pediatrics 2002; 110: 105–9.
61. Mora S, Cella D, Puzzovio M, Cairella R, Chiumello G. Radioimmunoassay for a new bone resorption marker and results for pediatric subjects. Clin Chem 1993; 39 (8): 1745–7.
62. Kilpelainen L, Ivaska KK , Kuiri-Hanninen T, Vaananen HK, Rehfeld JF, Goetze JP, et al. Urinary osteocalcin and serum pro-C-type natriuretic peptide predict linear catch-up growth in infants. J Bone Miner Res 2012; 27: 1528–35.
63. Crofton PM, Evans N, Taylor MR, Holland CV. Serum CrossLaps: pediatric reference intervals from birth to 19 years of age. Clin Chem 2002; 48: 671–3.
64. Herrmann D, Intemann T, Lauria F, Mårild S, Molnár D, Moreno LA, et al. Reference values of bone stiffness index and C-terminal telopeptide in healthy European children. Int J Obes 2014; 38: S76–S85.
65. Laron Z, Epstein-Halberstadt B. Activity of acid phosphatase in the serum of normal infants and children. Pediatrics 1960; 26: 281–4.
66. Chen CJ, Chao TY, Janckila AJ, Cheng SN, Ku CH, Chu DM. Evaluation of the activity of tartrate-resistant acid phosphatase isoform 5b in normal Chinese children–a novel marker for bone growth. J Pediatr Endocrinol Metab 2005; 18: 55–62.
67. Alconcher LF, Castro C, Quintana D, Abt N, Moran L, Gonzalez L, et al. Urinary calcium excretion in healthy school children. Pediatr Nephrol 1997; 11: 186–8.
68. So NP, Alexies V. Osorio AV, Simon SD, Alon US. Normal urinary calcium/creatinine ratios in African-American and Caucasian children. Pediatr Nephrol 2001; 16: 133–9.
69. Cadogan J, Blumsohn A, Barker ME, Eastell R. A longitudinal study of bone gain in pubertal girls: anthropometric and biochemical correlates. J Bone Miner Res 1998; 13: 1602–12.
70. Jurimae J. Interpretation and application of bone turnover markers in children and adolescents. Curr Opin Pediatr 2010; 22: 494–500.
71. Namgung R, Tsang RC, Specker BL, Sierra RI, Ho ML. Reduced serum osteocalcin and 1,25-dihydroxyvitamin D concentrations and low bone mineral content in small for gestational age infants: evidence of decreased bone formation rate. J Pediatr 1993; 122: 269–75.
72. Tsukahara H, Takeuchi M, Fujisawa K, Miura M, Hata K, Yamamoto K, et al. High-turnover osteopenia in preterm infants: determination of urinary pyridinium cross-links of collagen. Metabolism 1998; 47: 333–5.
73. Schonau E, Westermann F, Rauch F, Stabrey A, Wassmer G, Keller E, et al. A new and accurate prediction model for growth response to growth hormone treatment in children with growth hormone deficiency. Eur J Endocrinol 2001; 144: 13–20.
74. de Ridder CM, Delemarre-van de Waal HA. Clinical utility of markers of bone turnover in children and adolescents. Curr Opin Pediatr 1998; 10: 441–8.
75. Brenner RE, Schiller B, Vetter U, Ittner J, Teller WM. Serum concentrations of procollagen I C-terminal propeptide, osteocalcin and insulin-like growth factor-I in patients with non-lethal osteogenesis irnperfecta. Acta Paediatr 1993; 82: 764–7.
76. Rauch F, Munns C, Land C, Glorieux FH. Pamidronate in children and adolescents with osteogenesis imperfecta: effect of treatment discontinuation. J Clin Endocrinol Metab 2006; 91: 1268–74.
77. Hyams JS, Moore RE, Leichtner AM, Carey DE, Goldberg BD. Relationship of type I procollagen to corticoid therapy in children with inflammatory bowel disease. J Pediatr 1988; 112: 893–8.
Recibido: 12 de octubre de 2015
Aceptado: 6 de mayo de 2016














