Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.3 La Plata Sept. 2016
BIOQUÍMICA CLÍNICA
Ácido úrico y riesgo cardiovascular en adultos sedentarios y con actividad física regular*
Uric acid and cardiovascular risk in sendentary adults with regular physical activity
Ácido úrico e risco cardiovascular em adultos sedentários e com atividade física regular
Susan Rojas1, Marvin Querales2, Marniet Rodríguez1, Yaniret Rodríguez1
1 Licenciada en Bioanálisis.
2 Magíster en Estadística.
* Departamento de Bioquímica. Escuela de Ciencias Biomédicas y Tecnológicas. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela.
CORRESPONDENCIA MARVIN QUERALES Av. Bolívar Norte, Sector La Ceiba Callejón Peña-Pérez, Edif. Somos, Apto. 6-1 VALENCIA, Venezuela. Fono. +58 [241] 8380810. Fax: +58 [241]8561200. Email: marvinquerales@hotmail.com
Resumen
El ácido úrico (producto final del metabolismo de las purinas) ha sido asociado con la enfermedad cardiovascular, aún y cuando no se ha considerado como un factor independiente de la misma. Esta molécula posee acciones paradójicas, pues su elevación contribuye a la capacidad antioxidante en plasma. En vista de que el ejercicio físico contribuye a incrementos en la concentración de este marcador, el objetivo de este estudio fue evaluar sus niveles séricos y su relación con factores de riesgo cardiovascular en adultos con actividad física regular y su comparación con individuos sedentarios. Fueron evaluados 94 individuos, 51 sedentarios y 43 físicamente activos, a los cuales se les determinó índice de masa corporal, circunferencia de cintura, ácido úrico, glicemia, triglicéridos y colesterol total y fraccionado. No se observaron diferencias estadísticamente significativas en los niveles de ácido úrico entre los grupos en estudio, pero sí se observó una frecuencia baja de hiperuricemia (<20%). En ambos grupos, el ácido úrico se relacionó positivamente con el índice de masa corporal y la circunferencia abdominal, mientras que en el grupo sedentario se obtuvo, además, relación con las concentraciones de glicemia y triglicéridos. No se observaron diferencias en cuanto a la frecuencia de las alteraciones bioquímicas y antropométricas evaluadas según los niveles de ácido úrico. En conclusión, los niveles de ácido úrico y su asociación con los factores clásicos de riesgo cardiovascular son similares tanto en individuos sedentarios como con actividad física regular, lo que sugiere la realización de nuevos estudios que involucren otros marcadores cardiometabólicos.
Palabras clave: Ácido úrico; Factores de riesgo cardiovascular; Actividad física regular; Sedentarismo.
Summary
Uric acid (final product of purine metabolism) has been associated with cardiovascular disease, even if it was not considered an independent factor. This molecule has paradoxical actions since its increase contributes to plasma antioxidant capacity. Given that physical exercise contributes to a rise in the concentration of this marker, the aim of this study was to evaluate serum levels and their relation to cardiovascular risk factors in adults with regular physical activity and compared to sedentary individuals. A total of 94 individuals were evaluated, 51 of them being sedentary and 43 physically active, to which body mass index, waist circumference, uric acid, glucose, triglycerides and total and fractionated cholesterol were determined. No statistically significant differences in the levels of uric acid between the study groups were found and a low frequency of hyperuricemia (<20%) was observed. In both groups, uric acid was positively associated to body mass index and abdominal circumference, while in the sedentary group there was also an association regarding serum glucose and triglycerides. No differences in the frequency of anthropometric and biochemical alterations evaluated according to uric acid levels were observed. In conclusion, the levels of uric acid and their association with traditional cardiovascular risk factors are similar in both sedentary individuals and in those with regular physical activity, suggesting further studies involving other cardiometabolic markers.
Keywords: Uric acid; Cardiovascular risk factors; Regular physical activity; Sedentary.
Resumo
O ácido úrico (produto final do metabolismo das purinas) tem sido associada com a doença cardiovascular, mesmo quando não foi considerada como um fator independente dela. Esta molécula tem acções paradoxais porque a sua elevação contribui para a capacidade antioxidante em plasma. Dado que o exercício físico contribui para aumentar a concentração deste marcador, o objetivo deste estudo foi avaliar seus níveis séricos e sua relação com fatores de risco cardiovascular em adultos com atividade física regular e comparada com indivíduos sedentários. Foram avaliados 94 indivíduos, 51 sedentários e 43 fisicamente ativos, aos quais lhes foi determinado índice de massa corporal, circunferência da cintura, ácido úrico, glicemia, triglicérides e colesterol total e fracionado. Não foram observadas diferenças estatisticamente significativas nos níveis de ácido úrico entre os grupos de estudo, além de uma baixa freqüência de hiperuricemia (<20%). Em ambos os grupos, o ácido úrico foi positivamente associado com o índice de massa corporal e circunferência abdominal, enquanto que o grupo sedentário também foi obtida relação com as concentrações de glicemia e triglicérides. Não houve diferença na frequência das alterações antropométricas e bioquímicas avaliadas de acordo com os níveis de ácido úrico Em conclusão, os níveis de ácido úrico e sua associação com os fatores clássicos de risco cardiovascular são similares tanto em indivíduos sedentários quanto em aqueles com atividade física regular, sugerindo mais estudos que envolvam outros marcadores cardiometabólicos.
Palavras-chave: Ácido úrico; Fatores de risco cardiovascular; Atividade física regular; Sedentarismo.
Introducción
El ácido úrico es el producto final del catabolismo de las purinas producido mediante la acción de la enzima xantino oxidasa (1). Los niveles de ácido úrico sérico (AUS) varían como resultado de una serie de factores que disminuyen su excreción o incrementan su generación, tales como dietas altas en purinas, consumo de alcohol, estados con alto recambio celular o defectos enzimáticos en el metabolismo de las purinas (2). En la literatura ha sido relatada ampliamente la relación entre el AUS y factores de riesgo cardiovascular como la hipertensión (3) y el síndrome metabólico (SM) (1), además de su papel en enfermedades coronarias y vasculares (4)(5). No obstante, por el momento no se ha considerado como un factor independiente de riesgo cardiovascular, sino más bien como un factor asociado a condiciones como la obesidad, dislipidemia, hipertensión, uso de diuréticos o resistencia a la insulina (6) que potencian la génesis de las enfermedades cardiovasculares (ECV). De hecho, elevaciones del AUS han sido extensamente consideradas como un hallazgo sin significado específico, a no ser que involucre condiciones como la gota o la litiasis renal (7). A pesar de esto, algunas publicaciones han aportado evidencia sobre una posible asociación entre el AUS y las ECV, como la hiperuricemia asociada con el infarto del miocardio en individuos con insuficiencia renal (8) y con el inicio de la diabetes en pacientes hipertensos con hipertrofia ventricular izquierda (9).
Cabe destacar que el AUS posee efectos beneficiosos que aún no están del todo claros, pues existen evidencias de una acción paradójica sobre el sistema cardiovascular debido a sus propiedades antioxidantes que posiblemente se deban a su capacidad de contrarrestar la presencia de especies reactivas de oxígeno durante el ejercicio (10). En este sentido, la elevación en los niveles plasmáticos de ácido úrico han sido asociadas con el incremento, en un 60%, de la actividad antioxidante expresada a través de la medición de la capacidad antioxidante en plasma (FRAP) (11).
En vista de que la producción de AUS se ve fuertemente afectada por el ejercicio, es probable que sus niveles en personas físicamente activas se encuentren ligeramente superiores a los obtenidos en personas sedentarias en estado basal, tal como lo reportado por Beavers et al (12). Sin embargo, son escasos los estudios que indican cómo es la relación entre los niveles de ácido úrico con los factores cardiometabólicos en individuos con actividad física regular. De ahí que el objetivo de la presente investigación fue evaluar las concentraciones de este marcador y su relación con factores clásicos de riesgo cardiovascular en un grupo de adultos físicamente activos, y su comparación con un grupo de adultos sedentarios, como base para investigaciones futuras que busquen dilucidar el rol del ácido úrico en las ECV.
Materiales y Métodos
Se realizó un estudio no experimental de tipo descriptivo y transversal, que contó con dos grupos de individuos adultos mayores de 18 años: uno de personas con actividad física regular, representado por usuarios regulares de un gimnasio ubicado en el municipio Naguanagua, y otro de personas sedentarias, pertenecientes a las comunidades ubicadas en la zona norte A del municipio San Diego, ambos en el estado Carabobo, Venezuela, durante el período febrero-julio de 2014. La muestra fue no probabilística de tipo intencional, donde la selección de los sujetos se realizó en base a criterios previamente establecidos por los investigadores. Para el caso de los pacientes con actividad física regular, la toma de muestra y datos fue realizada en las instalaciones del gimnasio, considerando aquellos individuos que habían realizado durante un mínimo de 3 meses entrenamientos en gimnasios y acumulado, por lo menos, 150 minutos semanales de actividad física moderada combinada con ejercicios de fortalecimiento del aparato locomotor 3 veces a la semana (13).
Por su parte, para la selección de los pacientes sedentarios, se consideraron aquellos sujetos que refirieron no realizar ningún tipo de actividad física regular ni trabajos forzosos y que acudieron de forma voluntaria a jornadas de despistaje de factores de riesgo cardiovascular realizadas en un módulo de atención primaria del Municipio San Diego. En ambos casos, fueron excluidos aquellos pacientes con embarazo o que presentaran alguna enfermedad crónica subyacente. Para la toma de muestra, los participantes acudieron a las jornadas después de 12 horas de ayuno, sin haber ingerido alcohol en las 48 horas previas. Se consideraron las normas éticas establecidas por la Organización Mundial de la Salud para trabajos de investigación en seres humanos y la declaración de Helsinki, ratificada por la 52ª Asamblea General, Edimburgo, 2000 (14), razón por la cual las evaluaciones se realizaron previo consentimiento informado de los participantes. Inicialmente se aplicó una encuesta mediante la cual se obtuvieron datos personales, antecedentes personales y familiares en primer grado de consanguinidad de diabetes mellitus y de enfermedades cardiovasculares (HTA, enfermedad cardíaca isquémica, accidente cerebrovascular), condición de salud, hábitos tabáquico y alcohólico y tratamiento farmacológico. Se definió como fumador aquel participante que fumaba al momento de la evaluación o que hubiese abandonado el hábito dentro de los cinco años previos a ésta (15).
Los investigadores llevaron a cabo las mediciones de peso, talla, y perímetro de cintura o circunferencia abdominal siguiendo los protocolos recomendados (16). Para pesar se utilizó una balanza Health o Meter Professional (Health o meter® Professional Scales, McCook, Illinois, EE.UU.), previamente calibrada (precisión=0,1 g); la talla se midió con ayuda del estadiómetro de la balanza (precisión=1 mm); la circunferencia de cintura (CC) se determinó con una cinta métrica no extensible (precisión= 1 mm) colocándola a la altura del punto medio entre la última costilla y la cresta ilíaca, con el sujeto en bipedestación al final de la espiración no forzada. Las mediciones antropométricas se realizaron sin zapatos y con ropa mínima. Se calculó el índice de masa corporal (IMC) mediante la fórmula: peso (kg)/(talla)2 (m). Se clasificaron los individuos según el IMC como normopeso (18,5- 24,9), sobrepeso (25-29,9) y obeso (≥30) (17). Se definió obesidad abdominal cuando la CC se encontró ≥102 cm en hombres y ≥88 cm en mujeres. Se extrajo una muestra de sangre (8 mL) por punción venosa en el pliegue del codo. Se determinaron en suero, el mismo día de la toma de muestra, los siguientes parámetros: Ácido úrico (determinación por uricasa) con valores de referencia: mujeres 2,6-6,0 mg/dL y hombres 3,5-7,2 mg/dL, glucosa, colesterol total y triglicéridos (método enzimático-colorimétrico utilizando el equipo comercial Wiener Lab); colesterol unido a la lipoproteína de alta densidad (HDLc) después de precipitación con fosfotungstato. El colesterol unido a la lipoproteína de baja densidad (LDLc) se calculó a través de la fórmula de Fridewald (18). El equipo de lectura utilizado fue un espectrofotómetro StatFax 1904 Plus (Awareness Technology, Palm City, Florida, EE.UU.). Los criterios diagnósticos adoptados fueron: glucosa elevada, valores ≥126 mg/dL; colesterol elevado, valores >200 mg/dL, HDLc baja, valores <40 mg/dL en hombres y <50 mg/dL en mujeres, LDLc elevada, valores ≥160 mg/dL y triglicéridos elevados, valores ≥150 mg/dL (19).
Los datos obtenidos fueron procesados a través del programa estadístico SPSS versión 18, siendo representados en tablas y gráficos para su mejor interpretación. Las variables cuantitativas se expresaron como media aritmética y desviación estándar, mientras que las cualitativas, como porcentajes. Se evaluó la normalidad de la data aplicando la prueba de Shapiro-Wilk. Para la comparación de las variables continuas se empleó la prueba t de Student o U-Mann Whitney. Para el análisis de correlación se utilizó la correlación de Pearson o Spearman. La asociación entre las variables se probó mediante el test chi cuadrado(c2) o prueba exacta de Fisher según fuese el caso. Se consideró significativo p<0,05.
Resultados
Fueron evaluados 94 pacientes, de los cuales 51 (54,3%) eran personas con hábitos sedentarios, mientras que 43 (45,7%) realizaban actividad física regular. Para el grupo de los sedentarios, las edades oscilaban entre los 20 y 70 años (51,4±17,0 años), mientras que los que realizaban actividad física se encontraban en el rango de 20 a 68 años (40,9±12,6 años). Las frecuencias observadas relacionadas con los hábitos tabáquicos y alcohólicos se muestran en la Figura 1.

Figura 1. Frecuencia (%) de los hábitos tabáquicos y alcohólicos en los individuos evaluados. (*) Significativo p<0,05.
Se muestra que en ambos grupos, la frecuencia de fumadores, no fumadores y ex fumadores fue similar, en donde la proporción de fumadores no superó el 26%. Por su parte, el hábito alcohólico fue estadísticamente superior en el grupo de los individuos sedentarios, cuya frecuencia (47%) fue el doble a lo encontrado en el grupo con actividad física regular (Chi-cuadrado=9,372; p=0,006). La distribución de los valores de ácido úrico se muestra en la Figura 2. Se observa que las concentraciones evaluadas en ambos grupos siguen una distribución similar con valores superpuestos, aun cuando se muestre que los niveles de ácido úrico para el caso del grupo con actividad física regular se agrupen en mayor cantidad a valores por encima de la mediana, teniendo de hecho 3 valores atípicos superiores. No obstante, no se encontraron diferencias estadísticamente significativas entre ambos grupos (Z=-0,273; p=0,785). Para el grupo de los sedentarios, los cuartiles de ácido úrico obtenidos fueron: cuartil 1 (Q1)= 3,5 mg/dL, cuartil 2 (Q2)= 4,4 mg/dL, cuartil 3 (Q3)=5,7 mg/dL y cuartil 4 (Q4)= 7,7 mg/dL.

Figura 2. Niveles de ácido úrico sérico encontrados en la muestra en estudio.
Para el caso del grupo con actividad física regular, los cuartiles fueron Q1=3,2 mg/dL, Q2= 3,9 mg/dL, Q3=5,2 mg/dL y Q4=10,1 mg/dL. En base a los valores de los cuartiles obtenidos se establecieron 2 rangos de los valores de ácido úrico, en los cuales se evaluaron los valores promedio de los demás indicadores bioquímicos y antropométricos medidos. La Tabla I muestra los resultados de las variables según el rango de ácido úrico en el grupo de individuos sedentarios. Se observan diferencias estadísticamente significativas entre los grupos tan sólo en los casos de índice de masa corporal, circunferencia abdominal, glicemia y triglicéridos, cuyos valores fueron más elevados en el grupo con concentraciones de ácido úrico por encima del Q2. Por su parte, la Tabla II muestra los resultados de las variables según el rango de ácido úrico en el grupo de individuos con actividad física regular. Se observan diferencias estadísticamente significativas entre los grupos tan sólo en los valores de índice de masa corporal y circunferencia abdominal, donde los valores promedios tienden a ser más elevados a partir del Q2 del valor de ácido úrico. Para el resto de las variables no se observaron diferencias estadísticamente significativas entre los grupos. La correlación entre los valores de ácido úrico con las variables medidas se presenta en la Tabla III. Se observa una relación lineal media, positiva y ascendente entre los niveles de ácido úrico y las cifras de índice de masa corporal y circunferencia abdominal en ambos grupos en estudio. Para el grupo de los sedentarios, además, se obtuvo una relación significativa con los valores de glicemia, siendo la tendencia de la misma de carácter intermedio.
Tabla I. Valores promedio de las variables bioquímicas y antropométricas según el rango de ácido úrico en el grupo de individuos sedentarios.

Tabla II. Valores promedio de las variables bioquímicas y antropométricas según el rango de ácido úrico en el grupo de individuos con actividad física regular.

Tabla III. Correlación entre los niveles de ácido úrico sérico y demás variables bioquímicas y antropométricas.

La Figura 3 presenta el porcentaje de individuos con hiperuricemia en ambos grupos en estudio. Fueron escasos los individuos con niveles elevados de ácido úrico, ubicándose en 16% para los físicamente activos, y 8% para el caso de los sedentarios, no habiendo diferencias estadísticamente significativas entre ellos.
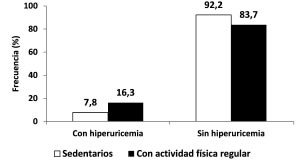
Figura 3. Frecuencia (%) de hiperuricemia en la muestra en estudio.
Las frecuencias en las alteraciones de las variables de riesgo cardiovascular evaluadas en el grupo sedentario son mostradas en la Tabla IV. Se observaron proporciones muy elevadas de HDLc baja en todos los grupos, al igual que de obesidad abdominal y sobrepeso. Las frecuencias de obesidad aumentan conforme se incrementen los niveles de ácido úrico, teniendo frecuencias bajas en el primer grupo (14%) y más elevadas en el segundo grupo (40%). Hecho similar fue observado en los casos de hipercolesterolemia, con diferencias igualmente significativas. Por su parte, las frecuencias en las alteraciones de las variables de riesgo cardiovascular evaluadas en el grupo con actividad física regular, se muestran en la Tabla V. Las alteraciones encontradas fueron menos frecuentes que en el grupo sedentario, no observándose casos con hipercolesterolemia ni con LDLc baja. Las cifras de obesidad, sobrepeso y HDLc disminuida no superaron el 45%, siendo, sólo en el caso de obesidad, superiores estadísticamente las frecuencias en el grupo 2.
Tabla IV. Frecuencia de las alteraciones de las variables medidas en el grupo sedentario, según los niveles de ácido úrico.

Tabla V. Frecuencia de las alteraciones de las variables medidas en el grupo con actividad física regular, según los niveles de ácido úrico.

Discusión y Conclusiones
El ácido úrico representa uno de los marcadores emergentes que pudiera presentar alguna asociación con los factores convencionales de riesgo cardiovascular. Sin embargo, su papel no está del todo dilucidado pues aún existen controversias en su papel sinérgico en la génesis de las ECV o su actividad beneficiosa como antioxidante (20). De ahí la importancia de este trabajo en evaluar su comportamiento en individuos sedentarios y con actividad física regular. En ambos grupos se obtuvieron frecuencias bajas de hiperuricemia, cuyas cifras no superaron el 20%. Si bien no hay reportes actualizados en Venezuela, los resultados encontrados coinciden con investigaciones internacionales como las realizadas en Perú, Reino Unido y Estados Unidos, en donde los valores elevados de ácido úrico oscilan entre el 15 y el 20% (21-23). Además, no se observaron diferencias estadísticamente significativas en sus concentraciones entre el grupo sedentario y el de actividad física regular, contrastando lo que indican Beaver et al (12), sobre los ligeros aumentos de los niveles de ácido úrico en personas con buena actividad física.
En cuanto a las concentraciones de los indicadores evaluados, tanto en el grupo sedentario como en el grupo con actividad física regular, se observó que aquellos con un índice de masa corporal y circunferencia abdominal elevada, tienden a tener valores más altos de ácido úrico. Resultados similares fueron reportados por Ruiz et al (24) en un grupo de mujeres con exceso de peso, donde los niveles de ácido úrico se relacionaron de forma directa con el sobrepeso y la obesidad. De la misma forma, esta relación coincide con una investigación tailandesa que asociaba niveles elevados de ácido úrico con factores que definen el síndrome metabólico, incluyendo alteraciones antropométricas (25). Estudios en ratones de experimentación han revelado que el tejido adiposo puede secretar ácido úrico y que la producción del mismo tiende a aumentar en la obesidad (26). Uno de los posibles mecanismos que argumenta estos resultados está relacionado con la hipoxia del tejido adiposo en individuos obesos. Diversas investigaciones han reportado que el tejido adiposo en obesos es hipóxico, y dicha hipoxia induce una disfunción celular, tal como desregulación de adipocitoquinas, un bajo grado de inflamación crónica y un incremento de la actividad de la enzima xantina oxidasa (26) (27). Otro de los mecanismos está relacionado con la lipogénesis y/o lipólisis. El tejido adiposo se caracteriza por presentar una síntesis activa de ácidos grasos, la cual está fuertemente relacionada con la síntesis de novo de los nucleótidos de purina a través de la estimulación de la vía de las pentosas (26)(28). Esta estimulación continua de la vía de las pentosas traería consigo una sobreproducción de nucleótidos de purina y con ello un aumento en la actividad de la xantina oxidasa y una posterior secreción de ácido úrico. No obstante, se mantiene la hipótesis de que el ácido úrico no es un predictor independiente de riesgo cardiovascular en individuos obesos y con sobrepeso (4).
Para el caso del grupo con actividad física, los niveles de ácido úrico guardan relación directa con los indicadores antropométricos. Sin embargo, para el grupo sedentario, se observó, además, correlación con los niveles de glicemia y triglicéridos, pudiendo ser esto explicado por el efecto beneficioso que tiene la actividad física sobre estos metabolitos. Una relación positiva entre los niveles de ácido úrico y alteraciones en el metabolismo de la glucosa ha sido reportada en varios estudios (9)(29). Recientemente se observó que el ácido úrico tiene un impacto directo sobre las células â-pancreáticas a través de la activación del factor de transcripción NF-êB y la subsecuente producción de ácido nítrico por la sintasa inducible de ácido nítrico (iNOS) (30). La activación de la vía de señalización NF-κB-iNOS-NO ha sido sugerida como una ruta que induce la citotoxicidad y apoptosis en las células â tanto en la diabetes tipo 1 como en la tipo 2 (31).
En cuanto a los triglicéridos, los resultados obtenidos coinciden con lo reportado por Carranza et al (27) y Ruiz et al (28). El mecanismo mediante el cual el ácido úrico pudiera estar asociado con la síntesis de triglicéridos no está del todo dilucidado. Sin embargo, aparentemente, la vía pudiera estar mediada por el estrés oxidativo intracelular y mitocondrial dependiente de ácido úrico (32). Aunque esta molécula sea un potente antioxidante en el ambiente extracelular, cuando entra a la célula a través de un transportador de aniones en el órgano específico, induce un estallido oxidativo que ha sido observado en las células del músculo liso vascular, células endoteliales, adipocitos, células túbulo-renales y hepatocitos (33). La inducción del estrés oxidativo en la mitocondria produce una reducción en la actividad aconitasa del ciclo de Krebs, resultando en una acumulación de citrato que es transportado al citoplasma, induciendo la síntesis de ácidos grasos a través de la actividad de las enzimas acetil-CoA carboxilasa y citrato sintasa (32). Otras hipótesis plantean una alteración en el metabolismo de la fructosa y su relación con la resistencia a la insulina que trae como consecuencia un aumento en la producción de triglicéridos (6).
En el presente trabajo se obtuvieron limitantes, asociadas principalmente con el tamaño de la muestra, lo que impide tener un mayor número de datos para una mejor evaluación de los niveles de ácido úrico con una distribución percentilar más amplia, además de permitir realizar una clasificación por género en los grupos evaluados. En conclusión, no se observaron diferencias estadísticamente significativas en los niveles de ácido úrico ni su asociación con los indicadores antropométricos en los grupos con actividad física regular y sedentaria. No obstante, en estos últimos se presentó asociación con los niveles de triglicéridos y glicemia. Se sugiere realizar nuevas investigaciones donde se evalúen otros parámetros bioquímicos de riesgo cardiovascular.
1. Soltani Z, Rasheed K, Kapusta D, Reisin E. Potential role of uric acid in metabolic syndrome, hypertension, kidney injury, and cardiovascular diseases: is it time for reappraisal? Curr Hypertens Rep 2013; 15: 175–81.
2. Jin M, Yang F, Yang I, Yin Y, Jun Luo J, Wang H, et al. Uric acid, hyperuricemia and vascular diseases. Front Biosci 2012; 17: 656–69.
3. Sedaghat S, Hoorn E, van Rooij F, Hofman A, Franco O, Witteman J, et al. Serum uric acid and chronic kidney disease: the role of hypertension. PLoSOne 2013; 8: e7682. [ Links ]
4. Skak-Nielsen H, Torp-Pedersen C, Caterson I, Van Gaa L, James W, Pietro A, et al. Uric acid as a risk factor for cardiovascular disease and mortality in overweight/ obese individuals. PLoS ONE 2013; 8: e59121. [ Links ]
5. Qin L, Yang Z, Gu H, Lu S, Shi Q, Xing Y, et al. Association between serum uric acid levels and cardiovascular disease in middle-aged and elderly chinese individuals. BMC Cardiovasc Dis 2014; 14: 26-33. [ Links ]
6. Johnson R, Nakagawa T, Sanchez-Lozada G, Shafiu M, Sundaram S, Le M, et al. Sugar, uric acid, and the etiology of diabetes and obesity. Diabetes 2013; 62: 3307-15. [ Links ]
7. Jalal D, Chonchol M, Chen W, Targher G. Uric acid as a target of therapy in CKD. Am J Kidney 2013; 61: 134–46.
8. Brodov Y, Chouraqui P, Goldenberg I, BoykoV, Mandelzweig L, Behar S. Serum uric acid for risk stratification of patients with coronary artery disease. Cardiology 2009; 114: 300-5. [ Links ]
9. Wiik BP, Larstorp AC, Høieggen A, Kjeldsen SE, Olsen MH, Ibsen H, et al. Serum uric acid is associated with new-onset diabetes in hypertensive patients with left ventricular hypertrophy: The LIFE Study. Am J Hypertens 2010; 23: 845-51. [ Links ]
10. Waring WS, Convery A, Mishra V, Shenkin A, Webb DJ, Maxwell SR. Uric acid reduces exercise-induced oxidative stress in healthy adults. Clin Sci (Lond) 2003; 105: 425-30. [ Links ]
11. Reyes AJ. The increase in serum uric acid concentration caused by diuretics might be beneficial in heart failure. Eur J Heart Fail 2005; 7: 461-67. [ Links ]
12. Beavers K, Hsu F, Serra M, Yank V, Pahor M, Nicklas B. The effects of a long-term physical activity intervention on serum uric acid in older adults at risk for physical disability. Aging Phys Act 2014; 22: 25–33.
13. Escalante Y. Actividad física, ejercicio físico y condición física en el ámbito de la salud pública. Rev Esp Salud Pública 2011; 84: 325-8. [ Links ]
14. De Abajo F. La declaración de Helsinki VI. Rev Esp Salud pública 2001; 7. [ Links ]
15. Rodríguez-Larralde A, Mijares ME, Nagy E, Espinosa R, Ryder E, Diez M, et al. Relación entre el nivel socioeconómico y hábitos de vida, con el fibrinógeno y el factor von Willebrand en venezolanos sanos y con cardiopatía isquémica. Invest Clin 2005; 46: 157-68. [ Links ]
16. Ferrante D, Virgolini M. Encuesta nacional de factores de riesgo 2005: resultados principales: prevalencia de factores de riesgo de enfermedades cardiovasculares en la Argentina. Rev Argent Cardiol 2007; 75: 20-9. [ Links ]
17. Lohman TG, Roche AF, Martorell R. Anthropometric standardization reference manual. Champaign, IL: Human Kinetics Books; 1988. [ Links ]
18. Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972; 18: 499–502.
19. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult treatment panel III) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. JAMA 2001; 285: 2486-97. [ Links ]
20. Alcaíno H, Greig D, Castro P, Verdejo H, Mellado R, García L, et al. Ácido úrico: una molécula con acciones paradójicas en la insuficiencia cardiaca. Rev Med Chile 2011; 139: 505-15. [ Links ]
21. Loza E. Epidemiología de la gota. Reumatol Clin Supl 2010; 5: 2-6. [ Links ]
22. Molina P, Beltrán S, Ávila A, Escudero V, Górriz J, Alcoy E, et al. ¿Es el ácido úrico un factor de riesgo cardiovascular?, ¿cuál es su implicación en la progresión de la enfermedad renal crónica? Nefrologia Sup Ext 2011; 2: 131-9. [ Links ]
23. Carranza A, Benavides E, Peña C, Huarcaya M, Quispe J, Florentini A. Ácido úrico y factores de riesgo asociados al síndrome metabólico en una población adulta de la ciudad de Junín. Ciencia e Investigación 2011; 14: 34-40. [ Links ]
24. Ruíz N, Espinoza M, González J, Leal U, Reigosa A. LDL oxidada circulante y anticuerpos contra LDL oxidada según niveles de ácido úrico en mujeres con exceso de peso. Arch Cardiol Mex 2011; 81: 188-96. [ Links ]
25. Jaipakdee J, Jiamjarasrangsri W, Lohsoonthorn V, Lertmaharit S. Prevalence of metabolic syndrome and its association with serum uric acid levels in Bangkok Thailand. Southeast Asian J Trop Med Public Health 2013; 44: 512-22. [ Links ]
26. Tsushima Y, Nishizawa H, Tochino Y, Nakatsuji H, Sekimoto R, Nagao H, et al. Uric acid secretion from adipose tissue and its increase in obesity. J Biol Chem 2013; 288: 27138-49. [ Links ]
27. Sun K, Kusminski C, Scherer P. Adipose tissue remodeling and obesity. J Clin Invest 2011; 121: 2094–101.
28. Greenberg A, Coleman R, Kraemer F, McManaman J, Obin M, Puri V, et al. The role of lipid droplets in metabolic disease in rodents and humans. J Clin Invest 2011; 121: 2102–10.
29. Forman J, Choi H, Curhan G. Uric acid and insulinsensitivity and risk of incident hypertension. Arch Intern Med 2009;169: 155-162. [ Links ]
30. Jia L, Xing J, Ding Y, Schen Y, Shi X, Ren W, et al. Hyperuricemia causes pancreatic β-cell death and dysfunction through NF-êB signaling pathway. PLoS ONE 2013; 8: e78284.
31. Cai K, Qi D, Hou X, Wang O, Chen J. Deng B, et al. MCP-1 upregulates amylin expression in murine pancreatic beta cells through ERK/JNK-AP1 and NF-kappaB related signaling pathways independent of CCR2. PLoSOne 2011; 6: e19559. [ Links ]
32. Sanchez-Lozada LG, Choi YJ, Cicerchi C, Kanbay M, Roncal-Jimenez CA, et al. Uric acid induces hepatic steatosis by generation of mitochondrial oxidative stress: potential role in fructose-dependent and -independent fatty liver. J Biol Chem 2012; 287: 40732–44.
33. Yu M, Sánchez L, Johnson R, Kang D. Oxidative stress with an activation of the renin-angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction. J Hypertens 2010; 28: 1234–42.
Recibido: 4 de septiembre de 2015
Aceptado: 22 de febrero de 2016














