Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.4 La Plata dic. 2016
TOXICOLOGÍA
Efecto radioprotector del piruvato de etilo, solo o como coadyuvante de la amifostina
Radioprotective effect of ethyl pyruvate alone or as a coadyuvant of amifostine
Efeito radioprotetor do piruvato de etila, sozinho ou como um coadjuvante de amifostina
María Eugenia Maciel1ac, Leandro Néstor Quintans1ac, María Isabel Díaz Gómez2ac, Martín Hernán Costantini3ac, Florencia Formosa Lemoine4a, María Montalto de Mecca2a, Gabriel Diego López5b, José Alberto Castro2ac, Gerardo Daniel Castro2ac
1 Dr. en Ciencia y Tecnología Mención Química.
2 Dr. en Ciencias Químicas.
3 Analista Químico Industrial.
4 Técnica en Histología.
5 Técnico Mecánico.
a Centro de Investigaciones Toxicológicas (CEITOX-UNIDEF). CITEDEF. Juan B. de La Salle 4397, Villa Martelli, Argentina.
b Laboratorio de Ensayos No Destructivos, Departamento Cabezas de Combate. CITEDEF. Juan B. de La Salle 4397, Villa Martelli, Argentina.
c Instituto de Investigación e Ingeniería Ambiental. UNSAM. Av. 25 de Mayo y Francia, San Martín, Argentina.
CORRESPONDENCIA Dr. GERARDO D. CASTRO Centro de Investigaciones Toxicológicas (CEITOX-UNIDEF). CITEDEF Juan B. de La Salle 4397, VILLA MARTELLI, Argentina. E-mail: gcastro@citedef.gob.ar
Resumen
Entre los radioprotectores con uso clínico se destaca la amifostina (WR- 2721), eficaz pero con efectos secundarios que impiden su uso repetitivo. Es interés de los autores desarrollar radioprotectores menos tóxicos, por sí mismos o como coadyuvantes de amifostina. Ratas machos o hembras se expusieron a una dosis de rayos X de 2 Gy. Se ensayó el piruvato de etilo, solo o conjuntamente con amifostina. Cuarenta y ocho horas después de la exposición a la radiación, se realizó el recuento de eritrocitos, de leucocitos y la fórmula leucocitaria. Los efectos genotóxicos se evaluaron en leucocitos de sangre mediante el ensayo Cometa. Se realizaron también estudios de supervivencia a 60 días post-irradiación. En los animales irradiados disminuyeron los eritrocitos, y el recuento de leucocitos se redujo drásticamente respecto al control, presentando además una fórmula alterada. El tratamiento con piruvato de etilo resultó en una protección de los eritrocitos en ambos sexos. El daño genético disminuyó significativamente por el tratamiento con piruvato de etilo solo o combinado con amifostina, y en hembras se observó una mayor supervivencia solo con el tratamiento combinado. El piruvato de etilo mostró una acción radioprotectora significativa, que podría mejorarse aumentando la dosis o el tiempo de tratamiento, ya que tiene muy baja toxicidad.
Palabras clave: Radioprotección; Piruvato de etilo; Amifostina; Radiación X.
Summary
Among the currently available radioprotectors, only amifostine (WR-2721) has shown in clinical trials to reduce radiation-induced toxicity. This compound is an efficient radioprotector but it exhibits some undesirable side effects which prevent its repetitive use. Efforts are directed to develop radioprotective agents with lower toxicity, with their own protective potential or suitable as coadyuvants of amifostine. The present study describes the results obtained by repetitive oral administration of ethyl pyruvate. Male or female rats were exposed to an X-ray dose of 2 Gy. Forty-eight hours after exposure to radiation, erythrocyte count, leukocyte and differential count were performed. Genotoxic effects were assessed in blood leukocytes by the Comet assay. Survival studies were also performed at 60 days post-irradiation. Eritrocyte and leukocyte were reduced in animals exposed to radiation compared to the control, also presenting an altered formula. Treatment with ethyl pyruvate resulted in a protection on erythrocytes of both sexes. Genetic damage was significantly decreased by ethyl pyruvate alone or combined with amifostine, and in females, higher survival was observed only with combined administration. Ethyl pyruvate showed a significant radioprotective action, which could be improved by increasing the dose or time of treatment because it has low toxicity.
Key words: Radioprotection; Ethyl pyruvate; Amifostine; X radiation.
Resumo
Entre os radioprotetores com uso clínico destaca-se a amifostina (WR-2721) eficaz mas com efeitos secundários que impedem seu uso repetitivo. O interesse dos autores é desenvolver radioprotetores menos tóxicos, por si mesmos ou como coadjuvantes de amistofina. Ratos machos ou fêmeas foram expostos a doses de raios X de 2Gy. Ensaiou-se o piruvato de etila, só ou junto com amifostina. Quarenta e oito horas após a exposição à radiação foi realizada a contagem de eritrócitos, de leucócitos e da fórmula leucocitária. Efeitos genotóxicos foram avaliados em leucócitos do sangue pelo Ensaio Cometa. Estudos de sobrevivência foram também realizados a 60 dias pós-irradiação. Nos animais irradiados diminuíram os eritrócitos, e a contagem de leucócitos se reduziu drasticamente em comparação com o controle, apresentando também uma fórmula alterada. O tratamento com piruvato de etila resultou numa proteção dos eritrócitos em ambos os sexos. O dano genético diminuiu significativamente pelo tratamento com piruvato de etila sozinho ou combinado com amifostina, e nas fêmeas se observou maior sobrevivência só com o tratamento combinado. O piruvato de etila mostrou uma ação radioprotetora significativa, que poderia ser melhorada pelo aumento da dose ou do tempo de tratamento, visto que tem baixa toxicidade.
Palavras-chave: Radioproteção; Piruvato de etila; Amifostina; Radiação X.
Introducción
La Agencia Internacional para la Investigación sobre Cáncer (IARC), perteneciente a la Organización Mundial de la Salud, realizó en 2000 una valiosa evaluación sobre los efectos de las radiaciones ionizantes que detalló exhaustivamente eventos de exposiciones y sus efectos dañinos con su grado de intensidad (1). Estos ocurrieron durante usos militares de la energía atómica (por ejemplo, las bombas en Hiroshima y Nagasaki) o los ensayos de otras armas nucleares y las resultantes precipitaciones radiactivas o durante la fabricación de los materiales involucrados. Los usos en medicina de las radiaciones ionizantes son hoy los más relevantes de aquellos que provienen de fuentes que produce la actividad humana e incluyen una cantidad amplia de aplicaciones en diagnóstico y tratamientos (1). También existen experiencias de exposición a radiaciones que derivan del ámbito ocupacional: minería de uranio, exposición a radón, personal de aeronaves y vuelos espaciales, personal médico y técnico vinculado con la medicina nuclear, usos varios en la industria, etc. (1). Los accidentes en plantas de generación de energía, tales como el de Chernobyl, Fukujima o Three Miles Island agregaron una preocupación más, que no ha sido resuelta (1). Otro factor de riesgo por exposiciones masivas a radiaciones ionizantes lo supone la actividad terrorista.
Independientemente de la fuente, la exposición a la radiación ionizante (rayos X o gamma), tendrá consecuencias serias y generalmente irreversibles. Estas se originan en la transferencia de la energía radiante a moléculas celulares, lo que causa su ionización. El agua corporal, por su abundancia, es el blanco principal de la radiación pero también son muy susceptibles el ADN, el ARN, las proteínas y los lípidos celulares. En la fracción de 10-3 segundos todas las reacciones de los radicales libres generados a partir del agua ya están completas. A partir de ese punto y en distintos tiempos, todos los procesos bioquímicos que conducen al daño celular se habrán completado. Durante estos procesos se generan especies reactivas derivadas del oxígeno (ROS) y también nitrogenadas (post inducción de la enzima óxido nítrico sintetasa) (2). Estas moléculas reactivas atacan componentes celulares críticos como el ADN, proteínas, lípidos, etc. En el curso de esas interacciones se producen también radicales libres en las macromoléculas, que conducen a su degradación. Un ejemplo claro es la formación de 4-hidroxinonenal a partir de los lípidos. Este compuesto es considerado como el responsable relevante de los daños ocasionados por la peroxidación de lípidos mediada por ROS (2). La acción sumada de todos estos productos derivados de la acción de las radiaciones conduce a la muerte celular en los distintos tejidos. Si el daño no es lo suficientemente intenso, de todos modos muchas de estas alteraciones moleculares podrán conducir, en tiempos más largos, a otras patologías (por ejemplo, mutaciones en el ADN y cáncer).
Desde hace décadas se han sintetizado algunos compuestos con capacidad radioprotectora o mitigante para los efectos de las radiaciones ionizantes. Fue así que en Estados Unidos se desarrolló un programa de síntesis y ensayos de radioprotección. Se efectuó una cantidad importante de estudios preclínicos y aún clínicos, incluyendo el uso de alguna de estas sustancias en radioterapia de cáncer, intoxicaciones, emergencias militares y exposiciones durante vuelos espaciales (3). De aquellos estudios surgió como un radioprotector de eficacia aceptable la amifostina (WR-2721) (Figura 1). Este compuesto también encontró aplicaciones radioterapéuticas en la clínica del cáncer, por tener selectividad en su efecto respecto del tejido tumoral (4-7). No obstante estas interesantes cualidades, dista de ser un radioprotector ideal debido a su toxicidad (8). Esto hizo que la Administración de Alimentos y Fármacos (FDA) de Estados Unidos aprobara su uso limitado en pacientes contra el daño por radioterapia posterior a cirugías de cánceres de cabeza y cuello y para prevenir la xerostomía (9-10). Se hace muy importante entonces el desarrollo de radioprotectores nuevos o fórmulas de ellos que actúen previniendo las consecuencias de una exposición. Esto incluye todos los ensayos que se requieren para la aprobación de su uso en seres humanos. La amifostina solamente está aprobada para su administración por vía endovenosa aunque algunos la han empleado por vía subcutánea (11). Esta droga tiene muy baja liposolubilidad y en el pH del estómago su carga iónica positiva vuelve muy difícil su absorción por vía oral (11). Por otra parte, un radioprotector ideal debería sostener su efecto por un tiempo razonablemente largo y esto implica que su toxicidad debe ser baja. El uso de WR-2721 en seres humanos tiene algunos efectos adversos de importancia. Puede provocar nausea y vómitos, síntomas que también son propios de la exposición a las radiaciones ionizantes. Además, otros síntomas son la emesis, hipotensión y alergias (12). La existencia de estos efectos adversos impide su administración repetida para lograr un efecto protector sostenido. Lo deseable en un radioprotector es que proteja la mayor parte de los órganos expuestos. La amifostina protege una gran variedad de sitios en el organismo afectado si se la administra un tiempo corto antes de la exposición a la radiación pero mucho menos o nada cuando se la administra después de la exposición (13). Solamente cuando este fármaco está presente en el momento de la irradiación es capaz de reducir la mortalidad de un modo muy significativo. Incluso fue capaz de proteger a las células normales y no a las cancerosas luego de una radioterapia (9). Esta virtud le ha dado aplicaciones extendidas y útiles en la clínica oncológica.
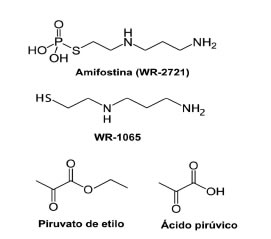
Figura 1. Estructuras de los compuestos radioprotectores o mitigantes ensayados y sus metabolitos relevantes.
El mecanismo de la acción radioprotectora de la amifostina se relaciona básicamente con su capacidad para atrapar radicales libres, para destruir algunos productos muy reactivos que se forman desde moléculas biológicas alteradas, como lípidos y proteínas, a través de la donación de hidrógeno, o bien reaccionando con ellos, como es el caso del 4-hidroxinonenal (14). Esta capacidad depende de su conversión previa por defosforilación enzimática a su metabolito activo, el WR-1065 (Figura 1). Este proceso está mediado por una fosfatasa alcalina presente en las células de distintos órganos y en suero de distintas especies y el humano (9)(15). Este proceso de activación es muy rápido pero aún así debe suceder previamente a la irradiación, de modo de disponer del compuesto sulfidrílico en concentración suficiente cuando se generan los radicales libres de tan corta vida.
La amifostina también presenta efectos protectores cuando se la administra posteriormente a la exposición a las radiaciones ionizantes. Han sido menos estudiados y su relevancia no se ha establecido (13). El hecho de que la acción protectora de la amifostina requiera una activación previa a su metabolito sulfidrílico mediada por una fosfatasa alcalina es crítico y se supone que está vinculado con su utilidad en oncología clínica. La amifostina ha mostrado proteger al tejido normal circundante al canceroso debido a que este último posee un pH más ácido (efecto Warburg).
La idea inicial detrás de los presentes estudios consiste en aprovechar la capacidad de la amifostina cuando se la administra en una sola dosis previa a la radiación pero continuando posteriormente con la administración de otras sustancias de baja toxicidad que permitan reforzar el efecto protector inicial.
El piruvato de etilo también es un atrapador de radicales libres y especies reactivas de oxígeno, que tiene algunas propiedades que pueden compensar problemas y limitaciones del uso de la amifostina como radioprotector (Figura 1). Un único estudio previo en la literatura menciona que el piruvato de etilo protege contra el efecto dañino de las radiaciones ionizantes, comportándose como un agente mitigante del efecto letal de la misma cuando se lo administraba posteriormente a la irradiación (16). Estos estudios estuvieron limitados por su corta duración. El piruvato de etilo puede administrarse por distintas vías, tiene una muy baja toxicidad, permitiendo su administración repetida durante periodos de tiempo más largos en relación con la supervivencia que se busca determinar luego de una exposición a dosis importantes de radiación ionizante.
Por otra parte, el piruvato de etilo mostró ser un protector eficaz para una variedad amplia de patologías y particularmente beneficioso en el manejo de los modelos animales de sepsis y procesos inflamatorios (17-22). Justamente, los procesos inflamatorios severos y daños en las células de las criptas intestinales se observan posteriormente a la exposición a radiaciones ionizantes y son muy relevantes en sus efectos letales (23).
Debido a su liposolubilidad y rápida absorción, el piruvato de etilo puede llegar a todos los tejidos fácilmente y así ejercer su acción protectora. Por ejemplo, en modelos murinos del Mal de Parkinson actuó como neuroprotector (17-19).
En resumen, se consideró relevante extender y profundizar los estudios vinculados con el uso conjunto de amifostina y piruvato de etilo en situaciones de exposición aguda a radiaciones ionizantes. La combinación de ambas sustancias se considera provechosa incluso desconociendo si el piruvato de etilo también protege a las células cancerosas en tanto que la amifostina no lo hace.
Materiales y Métodos
COMPUESTOS QUÍMICOS
El piruvato de etilo (98%) se adquirió en Aldrich Co. (St. Louis, EE.UU.). La amifostina grado USP (como trihidrato, WR-2721) se adquirió en Sigma Co. (St. Louis, EE.UU.). Los otros compuestos usados fueron de grado reactivo analítico.
ANIMALES, TRATAMIENTOS E IRRADIACIÓN
En todos los experimentos se utilizaron ratas macho o hembra de la cepa Sprague-Dawley (10 semanas de vida, 250-290 g de peso) que se mantuvieron en un ambiente controlado con un ciclo de 12 horas de luz-12 horas de oscuridad (de 6 a 18, luz); la temperatura fue controlada en 23±2 ºC y la humedad relativa entre 45 y 65%. El procedimiento utilizado para el manejo y la crianza de los animales siguió lo estipulado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (24). El alimento y el agua estuvieron siempre disponibles ad libitum.
La irradiación de los animales (8 animales por grupo, cuerpo entero) se realizó con una máquina de rayos X (Philips, modelo MG 420, 50/60 ciclos). Los siguientes parámetros se utilizaron para la exposición: Potencia RX 400 Kv, intensidad 8 mA, distancia 30 cm, tiempo de exposición 98 segundos. Los animales se expusieron de a dos por vez, alojados en una caja de policarbonato de 17 cm x 28 cm con cubierta de fibra de papel, centrada bajo la máquina. Con estos valores de operación, la dosis estimada fue de 2 Gy.
La amifostina se administró por la vía intraperitoneal media hora antes de la irradiación, disuelta en solución fisiológica, en una dosis de 50, 100 ó 200 mg/kg. El piruvato de etilo se administró por vía intraperitoneal una hora antes de la irradiación, diluido en solución fisiológica, en una dosis de 50 mg/kg de peso. Para los estudios de supervivencia, los animales recibieron además piruvato de etilo como una solución acuosa 0,3% v/v en el agua de bebida durante un mes a partir del día de la irradiación (22). La solución se renovó diariamente en los bebederos para reducir el riesgo de pérdida por hidrólisis (19). Para cada estudio se realizaron los grupos controles que correspondieran.
ENSAYO COMETA
El ensayo se llevó a cabo en la sangre venosa heparinizada de las ratas. Ratas machos o hembras Sprague Dawley fueron tratadas como se indica en Métodos. El ensayo de cometa alcalino (pH>13) (SCGE) fue realizado siempre 1 hora después de la irradiación, empleándose 5 ratas por grupo, por duplicado para cada muestra en 5 μL de la mezcla de sangre. La determinación de la viabilidad y el ensayo SCGE se llevaron a cabo esencialmente de acuerdo con Tice et al, como se describe a continuación (25): La muestra de sangre se depositó en agarosa de bajo punto de fusión (0,5% en PBS) y 75 μL se depositaron sobre portaobjetos que habían sido cubiertos previamente con agarosa de punto de fusión normal (0,5% en PBS). Después que la agarosa hubo solidificado (4 ºC por 10 min), se aplicó una segunda capa de agarosa de bajo punto de fusión de modo similar a la primera. Los portaobjetos fueron sumergidos luego en una solución lisante (2,5 M NaCl, 100 mM Na2EDTA, 10 mM Tris-HCl, pH 10, que contenían 1% Triton X100 recién preparada y 10% DMSO) por al menos 1 hora a 4 ºC y luego colocado en un aparato de electroforesis horizontal que contenía buffer recién preparado (1 mM Na2EDTA, 300 mM NaOH, pH>13). Después de 20 min de pre-incubación (para desenrollar el ADN), la electroforesis se llevó a cabo por 20 min a un voltaje fijo de 25 V (0,83 V/cm) y 300 mA, ajustado ya sea elevando o bajando el nivel del buffer de electroforesis en la cuba.
Al final de la electroforesis, los portaobjetos se lavaron dos veces con buffer de neutralización (0,4 M Tris-HCl, pH 7,5), se secaron a temperatura ambiente y se fijaron en etanol absoluto por 5 min. Los portaobjetos se tiñeron con 40 μL de bromuro de etidio (20 μg/mL).
Detección de los cometas y análisis estadístico: Las células se analizaron 24 horas después del teñido con un microscopio de fluorescencia Eclipse E 400 (Nikon, Japón) equipado con filtros de epifluorescencia y a una magnificación de 20x. La captación de imágenes se realizó mediante un programa Nikon ACT-2U con una cámara DS 5M digital. Se usó el software CASP adquirido desde http://www.casp.of.pl, para determinar la longitud de la cola, intensidad de la cola y el momento Olive de la cola (TL, TI y TM), todos parámetros relacionados con el grado de daño al ADN en cada célula (26). Para cuantificar el daño al ADN, se analizaron un total de 50 células por portaobjetos. La viabilidad de las suspensiones celulares se evaluó con una tinción dual con diacetato de 5,6-carboxifluoresceína y bromuro de etidio. La viabilidad celular después de los tratamientos fue siempre mayor del 80%.
Los resultados de cada experimento fueron analizados usando el test de Varianza ANOVA de una vía. Para todos los análisis el criterio de significancia fue establecido en p<0,05. Los cálculos se realizaron usando un software GraphPad (GraphPad Instat) (27).
ESTUDIOS SOBRE LOS PARÁMETROS SANGUÍNEOS EN LOS ANIMALES IRRADIADOS Y EL EFECTO DE LOS TRATAMIENTOS RADIOPROTECTORES A 48 HORAS
Luego de 48 horas desde la irradiación, muestras de sangre venosa heparinizada se emplearon para el recuento de leucocitos y eritrocitos, mediante el uso de una cámara de Neubauer. Además, se realizó el extendido para el recuento diferenciado de leucocitos, coloreado con May-Grünwald Giemsa.
ESTUDIOS DE SUPERVIVENCIA A LA IRRADIACIÓN
Con el propósito de evaluar la eficacia radioprotectora general de los tratamientos, se registró la supervivencia y la variación porcentual de peso durante los sesenta días posteriores a la irradiación. Los grupos control, sin irradiar o con los tratamientos solos, se registraron simultáneamente (28). El efecto del piruvato de etilo se ensayó administrándolo solo o en combinación con la amifostina. La evaluación estadística del efecto radioprotector mediante las curvas de supervivencia Kaplan-Meier se realizó con el test Log rank (Mantel-Cox), según el programa estadístico IBM SPSS Statistics versión 19.
Resultados
EFECTO DEL PIRUVATO DE ETILO SOBRE PARÁMETROS DEL ENSAYO COMETA A UNA HORA POST IRRADIACIÓN EN SANGRE DE RATA.
Se midió el efecto del piruvato de etilo, solo o combinado con amifostina sobre la inducción de roturas en las hebras del ADN en células individuales, usando el ensayo Cometa alcalino, en sangre entera.
En las hembras se observó que la irradiación con una dosis de rayos X de 2 Gy condujo a un incremento significativo de la presencia de imágenes de Cometa en la sangre proveniente de las ratas a una hora. La diferencia en todos los parámetros determinados, longitud de la cola, %ADN en la cola y el momento de la cola fue muy significativa (Tabla I). El piruvato de etilo mostró un efecto protector claramente significativo aunque menor que el de la amifostina. El tratamiento combinado de ambas sustancias mantuvo el efecto protector de esta droga. De todos modos, en ningún caso se llegó a recuperar los valores del Control.
Tabla I. Efecto del pre-tratamiento con piruvato de etilo o amifostina sobre el daño inducido por la radiación X (2 Gy, cuerpo entero) en parámetros del ensayo Cometa en sangre de rata hembra a una hora.

En los animales macho se observó un comportamiento similar al de las hembras frente a la dosis de rayos X, así como hacia los tratamientos radioprotectores (Tabla II).
Tabla II. Efecto del pre-tratamiento con piruvato de etilo o amifostina sobre el daño inducido por la radiación X (2 Gy, cuerpo entero) en parámetros del ensayo Cometa en sangre de rata macho a una hora.
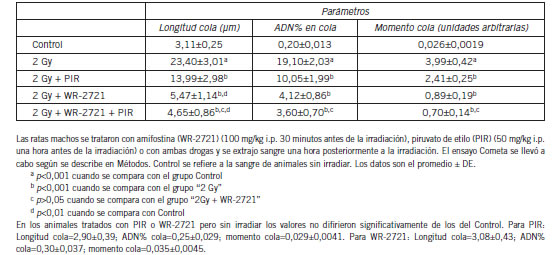
El tratamiento de los animales no irradiados con piruvato de etilo, amifostina o con la combinación de ambos no condujo a incrementos de los parámetros del ensayo Cometa.
EFECTO DE LA IRRADIACIÓN Y DE LOS TRATAMIENTOS RADIOPROTECTORES SOBRE LOS PARÁMETROS HEMATOLÓGICOS A 48 HORAS.
La irradiación de los animales no produjo el mismo efecto en ambos sexos. En los machos, los eritrocitos disminuyeron marcadamente, no así en las ratas hembras, aunque sí significativamente (Tablas III y IV). Los tratamientos ensayados pudieron revertir este efecto con distinta eficacia. En particular, la acción radioprotectora de la amifostina junto con el piruvato de etilo logró restablecer los niveles eritrocitarios normales (29). En las ratas hembras, si bien la radiación X no provocó una disminución de los eritrocitos tan marcada como en los machos, sí pudo observarse un descenso por el tratamiento con amifostina, efecto que no provocó el piruvato de etilo per se y que fue revertido al combinarlo con la amifostina (Tabla III). Por su parte, en los animales no irradiados, se observó que la amifostina provocó una disminución significativa de los eritrocitos en ambos sexos. El piruvato solo tuvo este efecto en las hembras.
Tabla III. Efecto de la irradiación con rayos X y de los tratamientos radioprotectores sobre parámetros hematológicos de ratas hembras a 48 horas.
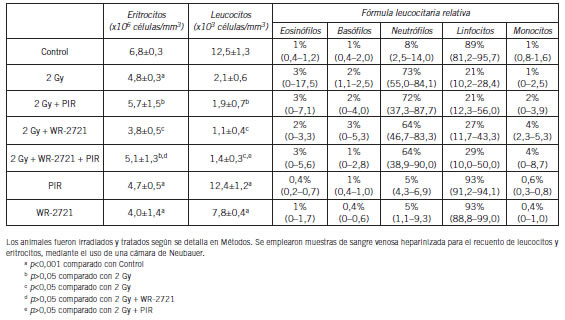
Tabla IV. Efecto de la irradiación con rayos X y de los tratamientos radioprotectores sobre parámetros hematológicos de ratas machos a 48 horas.

En el caso de los leucocitos de las ratas de ambos sexos, la radiación produjo una disminución severa en el número total y una alteración marcada en la fórmula relativa, que ninguno de los tratamientos pudo corregir. En el caso de las hembras no irradiadas, la amifostina provocó una disminución en el número de leucocitos.
EFECTO DE LA IRRADIACIÓN Y DE LOS TRATAMIENTOS RADIOPROTECTORES SOBRE LA SUPERVIVENCIA DE LOS ANIMALES.
Se evaluó la supervivencia de los animales durante un período de 60 días luego de la irradiación y de los tratamientos ensayados por su potencial radioprotector. Los resultados obtenidos muestran que en ambos sexos, una dosis de rayos X de 2 Gy reduce severamente la supervivencia (Figura 2) (Figura 3). La amifostina resultó un radioprotector efectivo, aunque con un efecto que dependió marcadamente de la dosis empleada (Figura 2, A y B). Por su parte, el piruvato de etilo mostró un efecto radioprotector más importante en las hembras, donde la diferencia de supervivencia con el grupo irradiado sin tratamiento fue significativa solamente cuando se lo administró como coadyuvante de la amifostina (Figura 3 A). Esta protección no se observó en los machos (Figura 3 B).
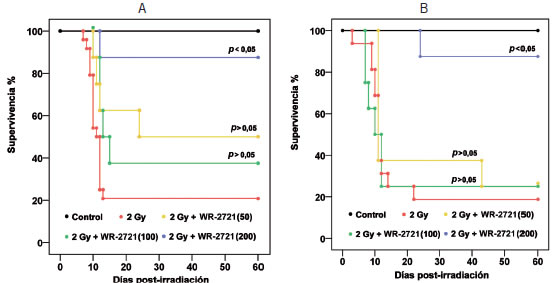
Figura 2. Evaluación de supervivencia a la irradiación con rayos X a una dosis de 2 Gy y el efecto radioprotector de la amifostina (WR-2721). Curvas de supervivencia de Kaplan Meier. A) Hembras. B) Machos. Grupos: Control (no irradiado); 2 Gy (irradiado solamente); 2 Gy + WR-2721 (50) (irradiación y tratamiento con amifostina 50 mg/kg); 2 Gy + WR-2721 (100) (irradiación y tratamiento con amifostina 100 mg/kg); 2 Gy + WR-2721 (200) (irradiación y tratamiento con amifostina 200 mg/kg). La evaluación estadística del efecto radioprotector para cada dosis se realizó mediante el test Log rank (Mantel-Cox). En los animales de ambos sexos no irradiados, los tratamientos per se no produjeron mortalidad en el plazo de 60 días (100% supervivencia).
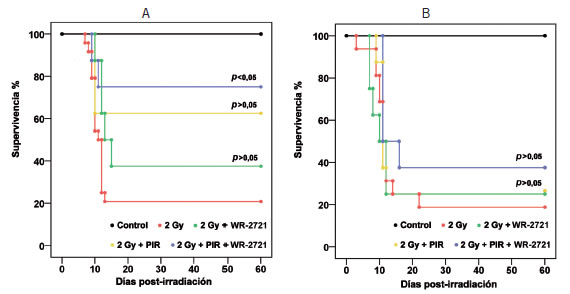
Figura 3. Evaluación de la supervivencia a la irradiación con rayos X a una dosis de 2 Gy y el efecto protector del piruvato de etilo (PIR). Curvas de supervivencia de Kaplan Meier. A) Hembras. B) Machos. Grupos: Control (no irradiado); 2 Gy (irradiado solamente); 2 Gy + WR-2721 (irradiación y tratamiento con amifostina 100 mg/kg); 2 Gy + PIR (irradiación y tratamiento con piruvato de etilo, según se describe en Métodos); 2 Gy + PIR + WR-2721 (irradiación y tratamiento con amifostina y piruvato de etilo, según se describe en Métodos). La evaluación estadística del efecto radioprotector se realizó mediante el test Log rank (Mantel-Cox). En los animales de ambos sexos no irradiados, los tratamientos per se no produjeron mortalidad en el plazo de 60 días (100% supervivencia).
La irradiación con 2 Gy provocó una alteración en la curva de crecimiento de los animales sobrevivientes en ambos sexos, siendo el efecto más marcado en los machos que en las hembras (Figura 4 A y B). Los tratamientos ensayados como radioprotectores no lograron modificar este comportamiento de manera significativa, excepto en el caso de los machos tratados con la mezcla de amifostina y piruvato de etilo, donde se logró una recuperación importante (Figura 4 B). Los tratamientos por sí mismos tuvieron solo un efecto menor sobre la curva de crecimiento en las hembras, no así en los machos (Figura 4 C y D).
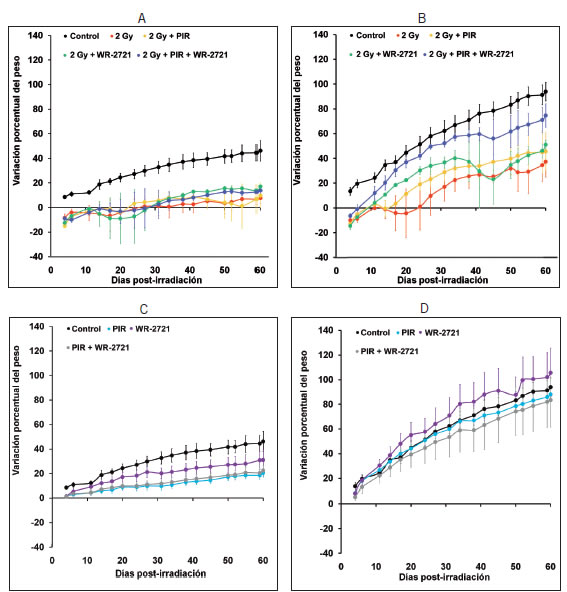
Figura 4. Evolución del peso corporal relativo para los animales irradiados y el efecto radioprotector de los tratamientos con piruvato de etilo o amifostina. A) Hembras: Efecto del tratamiento con PIR, WR-2721 o PIR + WR-2721 en animales irradiados. B) Machos: Efecto del tratamiento con PIR, WR-2721 o PIR + WR-2721 en animales irradiados. C) Hembras: Efecto del tratamiento con PIR, WR-2721 o PIR + WR-2721 en animales no irradiados. D) Machos: Efecto del tratamiento con PIR, WR-2721 o PIR + WR-2721 en animales no irradiados.
Discusión y Conclusiones
Para estudiar los efectos protectores potenciales de ambos compuestos sobre los daños tempranos de las radiaciones ionizantes, se realizaron determinaciones de alteraciones en ADN de leucocitos a una hora de la irradiación de los animales. El ensayo Cometa permite establecer si ha ocurrido un proceso de hidroxilación en las bases del ADN. Ambas sustancias, la amifostina y el piruvato de etilo, mostraron un efecto protector significativo sobre este tipo de daño. No obstante, la acción de la amifostina fue más importante que la del piruvato aunque no lograra revertir completamente el efecto de las radiaciones (Tabla I) (Tabla II) (30). Estos ensayos iniciales sugieren alternativas factibles para mejorar el efecto protector, aumentando las dosis. En el caso de la amifostina, sin embargo, no sería deseable hacerlo ya que podría provocar un incremento en sus efectos adversos. El piruvato de etilo, por su baja toxicidad, no presentaría este riesgo a dosis mayores (18)(19)(22). Incluso, su rápida absorción permitiría la administración oral, que no se ensayó en estos experimentos puesto que el objetivo era probar a ambos compuestos en igualdad de condiciones en cuanto a su administración, frente a un daño tan rápido como el que provoca la radiación ionizante sobre el ADN de los leucocitos (31).
Los resultados de las Tablas III y IV muestran los efectos perjudiciales que tienen las radiaciones ionizantes durante la exposición de cuerpo entero a 2 Gy sobre los componentes centrales de la sangre, los eritrocitos y los leucocitos. No solamente los valores totales de ambos resultaron alterados significativamente, sino que también se observaron alteraciones muy importantes en la fórmula leucocitaria relativa. Se verificaron caídas drásticas en la proporción de linfocitos acompañadas de un aumento significativo de los neutrófilos, eosinófilos, basófilos y monocitos. Estos resultados son los esperables para una exposición humana a dosis entre 1 y 8 Gy, y vinculados con el síndrome hematopoyético (32). Estos estudios iniciales de radioprotección intentan desarrollar tratamientos que disminuyan o impidan los daños observados, a pesar que en la experiencia en seres humanos para dosis entre 1 y 6 Gy el pronóstico de recuperación es bueno (32). La recuperación del número de eritrocitos por el empleo de la amifostina combinada con el piruvato de etilo fue particularmente adecuada y comparable con los valores de los controles. Este tratamiento conjunto sugiere que el piruvato protege contra efectos adversos que tiene la amifostina sobre los eritrocitos. Es interesante mencionar que estudios previos de Giannopoulou y Papadimitriou sugirieron, en estudios empleando WR-2721, que este compuesto aumentaba la proliferación de células endoteliales humanas y que ese efecto era revertido por el piruvato de sodio (33). Más aún, sugirió que ello podría deberse a que el WR- 2721 actuaba sobre esas células produciendo peróxido de hidrógeno o NO, dado que el piruvato de sodio es capaz de reaccionar con ambos (33)(34). Los resultados presentes indicarían que esa hipótesis también puede explicar el efecto beneficioso del tratamiento conjunto de amifostina con piruvato de etilo, comparando con el tratamiento con amifostina sola. La producción de H2O2 y NO dañaría a los eritrocitos por hemólisis, y el piruvato de etilo los protegería al atrapar eficientemente estas moléculas reactivas (ver reacciones en la Figura 5).
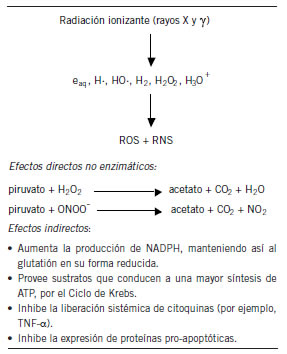
Figura 5. Efectos protectores directos e indirectos del piruvato de etilo. Radioprotección, piruvato de etilo y amifostina
Los tratamientos con amifostina, con piruvato de etilo o con la mezcla de ambos no fueron capaces de impedir la disminución que las radiaciones produjeron sobre el número total de leucocitos (Tabla III) (Tabla IV). En cambio, sí produjeron diferencias importantes en la fórmula leucocitaria relativa. El significado biológico de estos efectos no está claro con los experimentos realizados.
Un aspecto central de este trabajo fue estudiar el impacto de los tratamientos con potencial radioprotector sobre la salud del animal, particularmente la supervivencia y la variación porcentual del peso frente a la irradiación. Se evaluaron los efectos de la radiación X a 2 Gy sobre la supervivencia por 60 días y también los de los tratamientos protectores, en ambos sexos. Puesto que el objetivo general de estos estudios está dirigido a intentar disminuir los riesgos derivados de los efectos adversos de la amifostina, se consideró relevante ensayar el efecto preventivo de una dosis inicial de esta sustancia y continuar el tratamiento con otro compuesto poco tóxico como el piruvato de etilo, con una potencial acción mitigante y que pudiera administrarse por vía oral continuamente durante un tiempo considerable. Fue así que, durante un mes posterior a la irradiación y la aplicación de la dosis de amifostina, se administró piruvato de etilo en el agua de bebida como una solución al 0,3%. En primer lugar, se ensayaron tres dosis distintas de amifostina para evaluar la eficiencia radioprotectora en función de la dosis administrada y elegir entonces una dosis que pudiera combinarse con el piruvato de etilo para evaluar su eficacia. Como se muestra Radiación ionizante (rayos X y ) en la Figura 2, la acción radioprotectora de la amifostina depende marcadamente de la dosis que se emplee. Es así que con la dosis mayor (200 mg/kg) el 90% de los animales de ambos sexos irradiados sobrevivieron hasta los 60 días del ensayo y las muertes sucedieron en el plazo del primer mes. Con las otras dos dosis ensayadas (100 y 50 mg/kg) la mortalidad se incrementó sustancialmente, sobreviviendo solo un 25% de los animales a los 60 días post irradiación. Se anticipó el inicio de las muertes, que ocurrieron desde los 3 días. Los animales restantes sobrevivieron los dos meses del ensayo. Con la dosis más baja de amifostina (50 mg/kg) la mortalidad en los machos tratados aumentó drásticamente y a tiempos más tempranos que los observados para la dosis más alta. Solamente sobrevivió el 35% de los machos a los 10 días (Figura 2 B). Al finalizar el estudio había sobrevivido el 25%. En el caso de las hembras los resultados fueron cualitativa y cuantitativamente diferentes en lo que concierne al inicio y magnitud de la mortalidad. En contraste con lo observado para los machos, el efecto radioprotector de la amifostina fue mayor en las hembras, aunque sin significancia estadística respecto del grupo irradiado sin tratamiento (Figura 2 A).
Como consecuencia de esta evaluación se decidió emplear la dosis intermedia de amifostina de 100 mg/kg para continuar con los estudios sobre el efecto coadyuvante y mitigante del piruvato de etilo por vía oral en ambos sexos.
Si bien los tratamientos con piruvato de etilo o con amifostina (100 mg/kg) no lograron mejorar significativamente la supervivencia en ninguno de los sexos, en el caso de las hembras, el tratamiento combinado de piruvato de etilo con amifostina produjo una recuperación estadísticamente significativa (Figura 3 A).
También se consideró importante estudiar el comportamiento de los tratamientos sobre la variación de peso de los animales de ambos sexos por posibles interacciones adversas o favorables, teniendo en cuenta que las mismas radiaciones ionizantes afectan severamente el crecimiento. Los resultados obtenidos para los animales no irradiados que recibieron los tratamientos se muestran en la Figura 4. En las hembras ninguno de los tratamientos ensayados produjo un cambio significativo en la evolución del peso en el periodo de dos meses. La administración de estos mismos tratamientos en los machos no irradiados tampoco alteró la curva de variación de peso.
La irradiación con 2 Gy afectó severamente el crecimiento, tanto de hembras como de machos, aunque el efecto fue más significativo en los últimos (Figura 4 A y B). En los 20 días posteriores a la irradiación se observó una pérdida de peso en los sobrevivientes de ambos sexos, lo cual es coherente con la mortalidad que se verifica en esos días.
Los tratamientos en los animales irradiados produjeron un comportamiento diferente entre los sexos (Figura 4 A y B). En las hembras, los tratamientos no lograron restituir los valores de crecimiento desde la disminución provocada por la radiación X, aunque sugieren una tendencia a mejorar a partir de los 40 días aproximadamente (Figura 4 A). En los machos, el tratamiento con WR-2721 o con piruvato de etilo no mejoró significativamente la caída en la curva de crecimiento debida a la acción de la radiación ionizante. Sin embargo, el tratamiento combinado de ambas drogas logró incrementar la variación relativa de peso casi hasta los niveles del control.
El análisis conjunto de los resultados de los efectos de los tratamientos ensayados sobre la supervivencia respecto de los efectos sobre la variación relativa de peso, sugiere que ambos se deben a factores no relacionados entre sí o aún inversamente relacionados.
Independientemente de la eficacia de cada compuesto para prevenir o mitigar los efectos dañinos agudos de las radiaciones ionizantes parece claro que difícilmente una sola sustancia pueda lograrlo y sea más conveniente entonces el empleo de fórmulas cuyos componentes aporten propiedades que sean cooperativas o complementarias (35-37). Esto no solamente permite abordar el problema desde distintos aspectos de la patología, sino que en la práctica puede significar una disminución en la dosis de cada uno, si es que poseen alguna toxicidad.
1. IARC-WHO. IARC Monographs on the evaluation of carcinogenic risk to humans. Volume 75. Ionizing radiation. Part 1: X- and gamma-radiation and neutrons. Lyon: IARC Press; 2000. p. 59-101.
2. Riley PA. Free radicals in biology: oxidative stress and the effects of ionizing radiation. Int J Rad Biol 1994; 65: 27-33. [ Links ]
3. Weiss JF, Landauer MR. History and development of radiation-protective agents. Int J Radiat Biol 2009; 85: 539-73. [ Links ]
4. Rose PG. Amifostine cytoprotection with chemotherapy for advanced ovarian carcinoma. Semin Oncol 1996; 23: 83-9. [ Links ]
5. Kligerman MM, Turrisi AT 3rd, Urtasun RC, Norfleet AL, Phillips TL, Barkley T, et al. Final report on phase I trial of WR-2721 before protracted fractionated radiation therapy. Int J Radiat Oncol Biol Phys 1988; 14: 1119-22. [ Links ]
6. Winczura P, Jassem J. Combined treatment with cytoprotective agents and radiotherapy. Cancer Treat Rev 2010; 36: 268-75. [ Links ]
7. van der Vijgh WJ, Peters GJ. Protection of normal tissues from the cytotoxic effects of chemotherapy and radiation by amifostine (Ethyol): preclinical aspects. Semin Oncol 1994; 21(5 Suppl 11): 2-7. [ Links ]
8. Cairnie AB. Adverse effects of radioprotector WR2721. Radiat Res 1983; 94: 221-6. [ Links ]
9. Maier P, Wenz F, Herskind C. Radioprotection of normal tissue cells. Strahlenther Onkol 2014; 190: 745-52. [ Links ]
10. Jensen SB, Pedersen AM, Vissink A, Andersen E, Brown CG, Davies AN, et al. A systematic review of salivary gland hypofunction and xerostomia induced by cancer therapies: prevalence, severity and impact on quality of life. Support Care Cancer 2010; 18: 1039-60. [ Links ]
11. Bardet E, Martin L, Calais G, Alfonsi M, Feham NE, Tuchais C, et al. Subcutaneous compared with intravenous administration of amifostine in patients with head and neck cancer receiving radiotherapy: final results of the GORTEC2000-02 phase III randomized trial. J Clin Oncol 2011; 29: 127-33. [ Links ]
12. Gu J, Zhu S, Li X, Wu H, Li Y, Hua F. Effect of amifostine in head and neck cancer patients treated with radiotherapy: a systematic review and meta-analysis based on randomized controlled trials. PLoS One. 2014;9: e95968. doi: 10.1371/journal.pone.0095968. eCollection 2014. [ Links ]
13. Ormsby RJ, Lawrence MD, Blyth BJ, Bexis K, Bezak E, Murley JS, et al. Protection from radiation-induced apoptosis by the radioprotector amifostine (WR-2721) is radiation dose dependent. Cell Biol Toxicol 2014; 30: 55-66. [ Links ]
14. de Toranzo EGD, Castro JA. Reaction of 4-hydroxynonenal with some thiol containing radio protective agents or their active metabolites. Free Rad Biol Med 1994; 17: 605-7. [ Links ]
15. Valles E, de Castro CR, Castro JA. Radioprotectors as late preventive agents against carbon tetrachloride induced liver necrosis. Protection by 2-(3-amino propylamino) ethyl phosphorothioic acid (WR2721). Exp Mol Pathol 1995; 63: 101-9. [ Links ]
16. Epperly M, Jin S, Nie S, Cao S, Zhang X, Franicola D, et al. Ethyl pyruvate, a potentially effective mitigator of damage after total-body irradiation. Radiat Res 2007; 168: 552-9. [ Links ]
17. Fink MP. Ethyl pyruvate: a novel anti-inflammatory agent. Crit Care Med 2003; 31(1 Suppl): S51-6. [ Links ]
18. Fink MP. Ethyl pyruvate: a novel treatment for sepsis. Curr Drug Targets 2007; 8: 515-8. [ Links ]
19. Fink MP. Ethyl pyruvate. Curr Opin Anaesthesiol 2008; 21: 160-7. [ Links ]
20. Kao KK, Fink MP. The biochemical basis for the anti-inflammatory and cytoprotective actions of ethyl pyruvate and related compounds. Biochem Pharmacol 2010; 80: 151-9. [ Links ]
21. Olek RA, Ziolkowski W, Flis DJ, Fedeli D, Fiorini D, Wierzba TH, et al. The effect of ethyl pyruvate supplementation on rat fatty liver induced by a high-fat diet. J Nutr Sci Vitaminol (Tokyo) 2013; 59: 232-7. [ Links ]
22. Fedeli D, Falcioni G, Olek RA, Massi M, Cifani C, Polidori C, et al. Protective effect of ethyl pyruvate on msP rat leukocytes damaged by alcohol intake. J Appl Toxicol 2007; 27: 561-70. [ Links ]
23. Berger ME, Christensen DM, Lowry PC, Jones OW, Wiley AL. Medical management of radiation injuries: current approaches. Occup Med (Lond) 2006; 56: 162-72. [ Links ]
24. ANMAT. Disposición A.N.M.A.T. N° 6344/96. Reglamentación para Bioterios de Laboratorios Elaboradores de Especialidades Medicinales y/o Análisis para Terceros. [ Links ]
25. Tice RR, Agurell E, Anderson D, Burlinson B, Hartmann A, Kobayashi H, et al. Single cell gel / Comet Assay: Guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen 2000; 35: 206-21. [ Links ]
26. Olive PL, Banath JP, Durand RE. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells using the comet assay. Radiat Res 1990; 122: 86-94. [ Links ]
27. Gad SC. Statistics for toxicologists. En: Hayes AW, editor. Principles and Methods in Toxicology. Philadelphia: Taylor and Francis; 2001. p. 285-364. [ Links ]
28. Crescenti EJ, Medina VA, Croci M, Sambuco LA, Prestifilippo JP, Elverdin JC, et al. Radioprotection of sensitive rat tissues by oligoelements Se, Zn, Mn plus Lachesis muta venom. J Radiat Res 2011; 52: 557-67. [ Links ]
29. Car BD, Eng VM, Everds NE, Bounous DI. Clinical Pathology of the Rat. En: Suckow MA, Weisbroth SH, Franklin CL, editores. The Laboratory Rat. Second edition. Amsterdam: Elsevier-Academic Press; 2006. p. 128-32. [ Links ]
30. Müller AC, Pigorsch S, Beyer C, Lautenschläger C, Dunst J. Radioprotective effects of amifostine in vitro and in vivo measured with the comet assay. Strahlenther Onkol 2004; 180: 517-25. [ Links ]
31. Wang Y, Xu C, Du LQ, Cao J, Liu JX, Su X, et al. Evaluation of the comet assay for assessing the dose-response relationship of DNA damage induced by ionizing radiation. Int J Mol Sci 2013; 14: 22449-61. [ Links ]
32. International Atomic Energy Agency. Effects of ionizing radiation on blood and blood components: A survey. Vienna: IAEA; 1997. IAEA-TECDOC-934, p. 7-22. [ Links ]
33. Giannopoulou E, Papadimitriou E. Amifostine has antiangiogenic properties in vitro by changing the redox status of human endothelial cells. Free Radic Res 2003; 37: 1191-9. [ Links ]
34. Liu J, Litt L, Segal MR, Kelly MJS, Pelton JG, Kim M. Metabolomics of oxidative stress in recent studies of endogenous and exogenously administered intermediate metabolites. Int J Mol Sci 2011; 12: 6469- 501. [ Links ]
35. Stone HB, Moulder JE, Coleman CN, Ang KK, Anscher MS, Barcellos-Hoff MH, et al. Models for evaluating agents intended for the prophylaxis, mitigation and treatment of radiation injuries. Report of an NCI Workshop, December 3-4, 2003. Radiat Res 2004; 162: 711-28. [ Links ]
36. Azzam EI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury. Cancer Lett 2012; 327: 48-60. [ Links ]
37. Bacq ZM. Chemical Protection Against Ionizing Radiation. Springfield: Charles C. Thomas Pub.; 1965. P. 3-74. [ Links ]
Recibido: 27 de mayo de 2016
Aceptado: 22 de julio de 2016














