Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Acta bioquímica clínica latinoamericana
versão impressa ISSN 0325-2957versão On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata mar. 2017
BIOQUÍMICA CLÍNICA
Reactividad cruzada de una prueba de tamizaje para Enfermedad Celíaca con otros autoanticuerpos*
Cross-reactivity of a screening test for celiac disease with other autoantibodies
Reatividade cruzada de um teste de screening para a doença celíaca com outros autoanticorpos
Ana María Aristimuño1, Amelia Noemí de la Colina2, Patricia Rosana Lagoa3, Fernando Daniel Ventimiglia4, María Virginia Minervini2, María Soledad Martínez Methol2, Jorge José Bruno5, Liliana Elena D´Agostino6
2 Bioquímica.
3 Técnica de laboratorio.
4 Doctor en Bioquímica.
5 Licenciado en Bioquímica.
6 Licenciada en Bioquímica. Especialista en Inmunología.
* Laboratorio D’Agostino-Bruno. Calle 14 Nº 280, 1900 La Plata, Argentina.
CORRESPONDENCIA Bioq. ANA MARÍA ARISTIMUÑO Calle 14 Nº 280, 1900 LA PLATA E-mail: aaristimuno@dagostino-bruno.com.ar
Resumen
El objetivo del presente trabajo fue estudiar la presencia de reactividad cruzada de la prueba de tamizaje htTG/DGP para enfermedad celíaca (EC) con otros autoanticuerpos presentes en altos títulos en diferentes enfermedades autoinmunes (EA). Se realizó un estudio de corte transversal donde se seleccionaron 100 pacientes no celíacos, de ambos sexos (15 hombres, 85 mujeres) con edades entre 4 y 86 años que presentaban diversas EA. Para estudiar presencia de EC se realizaron por ELISA los ensayos QUANTALite® (INOVA Diagnostics, EE.UU.): htTG/DGPScreen, htTG IgA e IgG, Gliadina IgAII e IgGII. Los autoanticuerpos de otras EA se determinaron por inmunofluorescencia indirecta y por electroquimioluminiscencia. La reactividad cruzada encontrada con autoanticuerpos no específicos de EC fue de 2,0%. Las dos muestras positivas con la prueba de tamizaje (23,0 U y 24,9 U) presentaron anticuerpos anti-centrómero y anti-nucleares, con títulos 1/1280 y 1/640 respectivamente. Las mismas fueron analizadas para los marcadores de celiaquía y sólo una resultó positiva débil (21,8 U) para anti-Gliadina IgAII. La baja reactividad cruzada hallada con el ensayo de tamizaje htTG/DGP en presencia de otros autoanticuerpos permite concluir que dicha prueba constituye una herramienta de gran utilidad para la pesquisa de EC en pacientes con diferentes enfermedades autoinmunes.
Palabras clave: Autoanticuerpos; Enfermedad celíaca; Prueba de tamizaje.
Abstract
The goal of this study was to show the presence of cross-reactivity screening test htTG/DGP for celiac disease (CD) with other autoantibodies present in high titers in different autoimmune diseases (AD). A cross-sectional study was performed for which 100 patients of both sexes (15 men, 85 women), aged between 4 and 86 years without CD who had different autoimmune pathologies were selected. To study the presence of CD, QUANTALite® (INOVA Diagnostics, USA): htTG/DGP Screen, htTG IgA and IgG, Gliadin IgAII and IgGII tests by ELISA were used. Other autoantibodies from AD were determined by indirect immunofluorescence and by electrochemiluminescence. Cross-reactivity with non-specific autoantibodies found in EC was 2.0%. The two positive samples of screening test (23,0 U and 24,9 U) had anti-centromere antibodies 1/1280 and anti-nuclear antibodies 1/640 respectively. They were analyzed for celiac disease markers and only one was weak positive (21,8 U) for anti-Gliadin IgAII. The low cross reactivity found with screening test htTG/DGP in the presence of other autoantibodies made it possible to conclude that this test is a useful tool for screening of CD in patients with different autoimmune diseases.
Key words: Autoantibodies; Celiac disease; Screening test.
Resumo
O objetivo deste trabalho foi estudar a presença de reatividade cruzada do teste de screening htTG/ DGP para a doença celíaca (DC) com outros autoanticorpos presentes em altos títulos em diferentes doenças autoimunes (DA). Foi realizado um estudo transversal para o qual foram selecionados 100 pacientes não-celíacos, de ambos os sexos (15 homens, 85 mulheres), com idades entre 4 e 86 anos que apresentavam diferentes patologias autoimunes (DA). Para estudar a presença de DC, realizaram-se por ELISA os ensaios QUANTALite® (INOVA Diagnostics, EUA): htTG/DGPScreen, htTG IgA e IgG, Gliadina IgAII e Gliadina IgGII por ELISA. Os autoanticorpos das outras DA foram determinados por imunofluorescência indireta e por eletroquimioluminescência. A reatividade cruzada encontrada com outros autoanticorpos não específicos de DC foi de 2,0%. As duas amostras positivas para o teste de screening (23,0 U e 24,9 U) apresentaram anticorpos anticentrômeros e antinucleares, com títulos 1/1280 e 1/640 respectivamente. Elas foram analisadas para os marcadores de doença celíaca e apenas uma resultou positiva fraca (21,8 U) para anti-Gliadina IgAII. A baixa reatividade cruzada encontrada com o teste de screening htTG/DGP em presença de outros autoanticorpos, permite concluir que este teste constitui um instrumento de grande utilidade para a pesquisa de doença celíaca em pacientes com diferentes doenças autoimunes.
Palavras-chave: Autoanticorpos; Doença celíaca; Teste de screening.
Introducción
La enfermedad celíaca (EC) es un desorden autoinmune inducido por la ingesta de gluten en individuos genéticamente susceptibles. Es una enteropatía que afecta principalmente al intestino delgado proximal y se produce por intolerancia a la gliadina, una proteína presente en cereales, principalmente en el trigo. La aparición de los síntomas es generalmente gradual y caracterizada por un tiempo de latencia de meses o años luego de la introducción del gluten, siendo los más clásicos: diarrea, pérdida de peso y malnutrición. La severidad de los síntomas gastrointestinales y de los signos clínicos, generalmente son un reflejo del grado de malabsorción intestinal (1)(2). Es uno de los desórdenes más comunes en países poblados predominantemente por personas de origen europeo (Europa, Norte y Sur de América y Australia) afectando aproximadamente al 1% de la población general (2).
La EC comparte muchas características con otros desórdenes autoinmunes como el modo poligénico de herencia, una fuerte asociación con antígenos HLA-DQ2 y HLA- DQ8, la producción de una respuesta inflamatoria local (infiltración linfocitaria y producción de citoquinas), la presencia de autoanticuerpos en circulación, la prevalencia en el sexo femenino, la deficiencia de IgA y una asociación con otras enfermedades autoinmunes (1)(2).
La incidencia de EC en varios desórdenes autoinmunes aumenta 10 a 30 veces en comparación con la población general, si bien en muchos casos es clínicamente asintomática o silente (1).
Los anticuerpos anti-péptidos deamidados de gliadina (DGP), anti-transglutaminasa tisular humana (htTG) y anti-endomisio (EMA) son marcadores fuertemente asociados a enfermedad celíaca (EC) (3-11), cuya positividad es criterio de indicación de biopsia de intestino delgado, el gold standard para su diagnóstico (12-14). La prueba de tamizaje htTG/DGP es un enzimoinmunoensayo que permite la detección simultánea de anticuerpos IgA e IgG contra dichos marcadores y puede ser considerado como un ensayo inicial de primera línea en el algoritmo de estudio para EC. Numerosos artículos han demostrado su buen desempeño sólo o en combinación con otras pruebas, en cuanto a sensibilidad, especificidad y valor predictivo positivo (2)(9-11)(15-19). La utilización de un conjugado dual permite detectar EC en inmunodeficientes de IgA (prevalencia 1/400) (13)(20), además es particularmente útil en población pediátrica, donde se conoce que la sensibilidad diagnóstica de los anticuerpos anti-EMA y anti-htTG está reducida en niños pequeños (11). Muchos de esos niños con enfermedad celíaca presentan anticuerpos anti-gliadina. A medida que progresa la enfermedad se producen anticuerpos contra ambos antígenos, gliadina y htTG. La expresión completa de anticuerpos anti-EMA y anti-htTG generalmente ocurre después de los 2 ó 3 años de edad. Por esta razón, se ha recomendado combinar anti-gliadina con anti-EMA o anti-htTG a fin de incrementar la sensibilidad diagnóstica de las pruebas serológicas en edades tempranas (11)(19). El método de tamizaje posee una especificidad de 97,0% y una sensibilidad de 98,6%, según el fabricante (21). En un trabajo publicado por Sugai et al. (12), el ensayo de tamizaje para EC presentó una sensibilidad de 100% tomando en cuenta el valor de corte del fabricante (20,0 U) y 98,4% considerando el valor correspondiente al 100% de Valor Predictivo Positivo, en la detección de EC en pacientes con alto riesgo para la enfermedad (alta probabilidad pretest).
Se define la reactividad cruzada como la reacción de un anticuerpo con un antígeno diferente del que le dio origen, debido a la presencia de determinantes antigénicos compartidos, similares o idénticos (22). Se debe a reacciones no específicas que generan resultados falsos positivos. La reactividad cruzada es el tipo de interferencia más común en inmunoensayos y ocurre cuando sustancias estructuralmente similares al analito o aquellas que poseen epitopes equivalentes al mismo, están presentes en suero y forman complejos que producen señales medibles (23)(24).
El objetivo del presente trabajo fue estudiar la presencia de reactividad cruzada de la prueba de tamizaje htTG/DGP para enfermedad celíaca con otros autoanticuerpos presentes en altos títulos en diferentes enfermedades autoinmunes.
Materiales y Métodos
POBLACIÓN ESTUDIADA
Se realizó un estudio de corte transversal para el cual se seleccionaron 100 pacientes de ambos sexos (15 hombres y 85 mujeres) pertenecientes a la ciudad de La Plata y zona de influencia, con altos títulos de autoanticuerpos. Los pacientes tenían edades comprendidas entre 4 y 86 años (Mediana: 45,5) y presentaban diferentes patologías autoinmunes: Poliartritis, Síndrome de Sjögren (SS), Lupus Eritematoso Sistémico (LES), Esclerodermia, Artritis Reumatoidea (AR), Síndrome Anti-Fosfolipídico (SAF), Colitis Ulcerosa, Granulomatosis de Wegener, Polimiositis, Cirrosis biliar primaria, Espondilitis anquilosante, Neuropatía autoinmune no especificada, Tiroiditis de Hashimoto, Enfermedad de Graves, Diabetes Tipo I (DBT I). Ninguno de los pacientes fue referido con el diagnóstico de EC.
MUESTRAS
Las muestras de sangre fueron obtenidas entre las 7,00 y las 10,00 h, luego de 8 h de ayuno en tubos con gel acelerador de la coagulación. Se dejaron coagular durante 30 minutos a temperatura ambiente y fueron posteriormente centrifugadas durante 15 minutos a 3600 rpm. Los sueros así obtenidos fueron procesados junto con las muestras diarias de rutina y/o guardados a -20 °C hasta su procesamiento semanal, según las determinaciones requeridas en cada caso.
MÉTODOS
Se utilizaron los siguientes ensayos de ELISA, QUANTALite® (INOVA Diagnostics Inc., San Diego, EE.UU.): htTG/DGPScreen, Gliadin IgGII e IgAII, htTG IgA e IgG, CCP3 IgG (anticuerpos anti-péptidos citrulinados cíclicos) y Centromere (anticuerpos anti-centrómero, ACA). El procesamiento fue realizado con un analizador de microplacas automatizado EVOLISTM Twin Plus (Bio-Rad, Marnes-la-Coquette-Francia). El valor de corte para indicar positividad, según el fabricante fue 20,0 U, para los ensayos mencionados.
Los estudios por Inmunofluorescencia Indirecta se realizaron con improntas de ANCA (ethanol fixed human neutrophil) y ANCA (formalin fixed human neutrophil) para la detección de anticuerpos anti-citoplasma de neutrófilos, ANCA C y P, respectivamente (INOVA Diagnostics Inc., San Diego, EE.UU.) y KallestadTMHep-2 Cell Line Substrate (Bio-Rad Laboratories Inc., EE.UU.), para anticuerpos antinucleares (ANA). En la detección de anticuerpos anti-mitocondria (AMA) se utilizaron improntas Mouse Kidney & Stomach Slide (INOVA Diagnostics Inc., San Diego, EE.UU.). Se observaron con Microscopio de fluorescencia Nikon- Eclipse E 400 (Tokio, Japón) con lámpara TK-LED.
Todas las técnicas analíticas se realizaron siguiendo las instrucciones del fabricante y cumplieron los requisitos de calidad establecidos por el laboratorio.
Se estableció como positivo un título de 1/20 para anticuerpos AMA y ANCA, para anticuerpos antinucleares el título de corte fue 1/80 en pacientes adultos y 1/40 en población pediátrica. Los sueros que presentaron positividad se diluyeron hasta la última dilución que presentó máxima fluorescencia.
Los anticuerpos anti-Tiroperoxidasa (aTPO), anti- Tiroglobulina (aTG) y anti-Receptor de TSH (aRTSH), fueron medidos por Electroquimioluminiscencia con un instrumento COBAS e601 ROCHE (Hitachi High- Technologies Corporation, Tokio, Japón).
Los valores de corte para los anticuerpos aTPO fueron ≥34 UI/L, para los anticuerpos aTG ≥115 UI/L y para los anticuerpos aRTSH ≥1,75 UI/L.
ANÁLISIS ESTADÍSTICO
Los cálculos estadísticos se realizaron utilizando el programa IBM® SPSS® Statistics 21, EE.UU. Se consideró nivel de significancia estadística p<0,05.
Resultados
Las especificidades de los autoanticuerpos encontradas en este grupo de pacientes fueron: 7 ACA; 6 anti- CCP3; 52 ANA con títulos ≥1/160 (presentando distintos patrones de fluorescencia); 3 AMA; 1 ANCA C y 1 ANCA P; 16 aTPO y/o aTG, 5 aRTSH. Once pacientes eran diabéticos tipo I (dos de los cuales además fueron hipotiroideos) con diferentes especificidades de autoanticuerpos relacionados con DBT I. En la Figura 1 pueden observarse distintos patrones de fluorescencia.
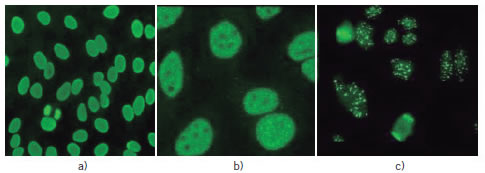
Figura 1. Imágenes de diferentes patrones de inmunofluorescencia en pacientes con enfermedades autoinmunes. Homogéneo. b) Moteado. c) Anti-centrómero.
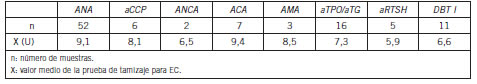
En la Tabla I pueden observarse los valores medios obtenidos con la prueba de tamizaje htTG/DGP para cada especificidad de autoanticuerpos seleccionada.
Tabla I. Frecuencia de autoanticuerpos y media obtenida con la prueba de tamizaje para celiaquía.
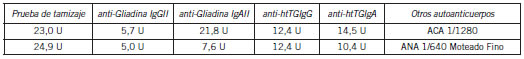
La reactividad cruzada encontrada con otros autoanticuerpos fue de 2,0%, es decir, de las 100 muestras procesadas con la prueba de tamizaje, dos presentaron anticuerpos con valores por encima del valor de corte establecido (23,0 U y 24,9 U). Esas muestras fueron analizadas para los cuatro marcadores de celiaquía, anti-htTG IgA, anti-htTG IgG, anti-Gliadina IgAII y anti-Gliadina IgGII. Sólo una muestra demostró un resultado positivo débil (21,8 U) para anti-Gliadina IgAII, como se indica en la Tabla II. Las dos muestras, extensivamente evaluadas, habían sido caracterizadas como positivas para ACA 1/1280 y ANA 1/640 respectivamente.
Tabla II. Resultados de los marcadores de celiaquía en las 2 muestras positivas para la prueba de tamizaje.
Se realizó el análisis estadístico de los resultados obtenidos con las 100 muestras de suero, los cuales arrojaron un valor medio de 8,3 U y un desvío estándar de 4,1. El 95% de los datos se encontró entre 3,3 U y 21,2 U (Figura 2).
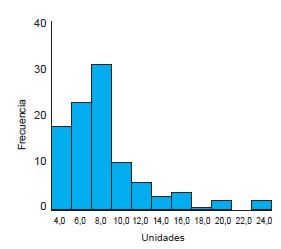
Figura 2. Gráfico de frecuencia de los resultados obtenidos con la prueba de tamizaje.
Discusión y Conclusiones
La EC es una enfermedad autoinmune frecuentemente subdiagnosticada, en particular en sus formas atípicas. Mientras que la biopsia de intestino delgado continúa siendo el gold standard para su diagnóstico, en este grupo de pacientes pauci o asintomáticos, las pruebas serológicas son importantes para determinar aquellos pacientes que deberán ser referidos a biopsia (25). En un trabajo realizado en Argentina, en el área de la ciudad de La Plata se encontró una prevalencia de EC de 1/167 individuos, teniendo en cuenta la población general (26). Este escenario fue el motivo para realizar este estudio, dado que, como se mencionó previamente, la incidencia de EC es mayor en las enfermedades autoinmunes que en la población general. Para ello, se seleccionó un grupo de pacientes con diagnóstico de enfermedades autoinmunes que poseían autoanticuerpos con diferentes especificidades y que, por lo tanto, presentaban mayor riesgo de padecer EC, por lo que los resultados no deben ser interpretados de igual modo en la población general.
En el presente trabajo la reactividad cruzada fue de 2,0%, debido a que dos muestras presentaron resultados de la prueba de tamizaje por encima del valor de corte de 20,0 U. De esos dos sueros sólo uno presentó anticuerpos anti-Gliadina IgA II positivos débiles, ya que los valores comprendidos entre 20,0 y 30,0 U deben ser reportados de este modo.
Los resultados de la población estudiada presentaron un valor medio para la prueba de tamizaje de 8,3 U (IC: 3,2-24,9), el cual se apartó 3 desvíos del valor de corte declarado por el fabricante de 20,0 U, el 75% de los valores del ensayo de tamizaje reportados estuvieron por debajo de 9,5 U.
En numerosas publicaciones se ha estudiado la mayor prevalencia de EC en diferentes patologías autoinmunes respecto de la población general (25)(27-29). Estudios realizados, tanto en niños como en adultos, han demostrado que la EC se presenta en pacientes con DBT I con una prevalencia que varía desde el 4,4 al 11,1%. En una gran proporción de pacientes la EC es asintomática o caracterizada por síntomas modestos/ atípicos. El tamizaje periódico para autoanticuerpos de EC en pacientes con DBT I es mandatorio (27).
Se ha encontrado una prevalencia de EC en pacientes con Enfermedades Tiroideas Autoinmunes (Enfermedad de Graves y Tiroiditis de Hashimoto) entre 2,0 a 7,0%. La coexistencia de EC y Enfermedades Tiroideas Autoinmunes se ha explicado por varios mecanismos entre los cuales se encuentran la predisposición genética y la asociación de ambas enfermedades con el gen que codifica CTLA-4, un gen que confiere susceptibilidad para autoinmunidad tiroidea (28).
En un estudio realizado en Argentina por Rodriguez G et al., el 5,37% de los pacientes con diversas Enfermedades del Tejido Conectivo presentó serología positiva para EC. Se hallaron anticuerpos positivos en pacientes con diagnóstico de SS, AR, Artritis Psoriásica (APs), PM y LES (25).
Iltanen et al. hallaron una frecuencia de 14,7% de EC en 34 pacientes con SS primario, donde se reconocieron como factores de susceptibilidad genética a los haplotipos HLA- DQ2 y DQ8 compartidos por ambas patologías (29).
El desempeño de la prueba de tamizaje utilizada en el presente estudio ha sido ampliamente evaluado por diferentes autores, en diversas poblaciones de pacientes, tanto adultos como niños. Se mencionó previamente el trabajo publicado por Sugai et al. (12), en el cual los autores demostraron que el ensayo de tamizaje fue el único que detectó todos los casos de EC (Sensibilidad 100%) y Especificidad de 92,8%, razón por la cual concluyeron que debería utilizarse como prueba inicial en la investigación de EC.
Resultados similares fueron hallados por Agardh D. (11) quien, utilizando como valor de corte 20,0 U para considerar un resultado positivo, detectó el 100% de los niños con EC no tratados incluyendo menores de 3 años de edad con anticuerpos anti-htTG IgA negativo y aquellos que tenían deficiencia de IgA. La especificidad del ensayo encontrada por este autor fue 89% para pacientes con otros desórdenes como intolerancia a las proteínas de la leche de vaca, alergia a alimentos, deficiencia de IgA, deficiencia de lipasa, gastritis por Helicobacter pylori, diabetes mellitus insulino dependiente, falla de crecimiento o corta estatura o síntomas gastrointestinales momentáneos, todos con biopsia intestinal negativa (controles enfermos); y 97% para los controles sanos.
Según la bibliografía consultada no existe un estudio sistemático que haya evaluado la reactividad cruzada del método de tamizaje para EC con otros autoanticuerpos. El inserto del reactivo htTG/DGPScreen presenta un estudio realizado con 83 muestras controles positivos procedentes de diferentes reactivos de pruebas de autoanticuerpos de INOVA, resultando una reactividad cruzada nula (21). Las muestras control utilizadas en dicho estudio son acuosas, no poseen la misma matriz biológica que las muestras de suero y, por lo tanto, no son conmutables, razón por la cual, el resultado obtenido en el presente estudio refleja lo que ocurre en sueros de pacientes.
La baja reactividad cruzada hallada con la prueba de tamizaje htTG/DGP en presencia de otros autoanticuerpos permite concluir que dicho ensayo constituye una herramienta de gran utilidad para la pesquisa de EC en pacientes con diferentes enfermedades autoinmunes, en quienes existe amplia evidencia científica que poseen mayor probabilidad de desarrollar EC.
AGRADECIMIENTOS
A la Dirección del Laboratorio D’Agostino-Bruno por proporcionar la tecnología y los reactivos para llevar a cabo el estudio, al personal técnico, especialmente a Amalia Soibelzon, quien se desempeña como técnica en el laboratorio.
1. Vijay K, Rajadhyaksha M, Wortsman J. Celiac Disease-Associated Autoimmune Endocrinopathies. Clin Diagn Lab Immunol 2001; 8(4): 678-85. [ Links ]
2. Sapone A, Bai J, Ciacci C, Dolinsek J, Green P, Hadjivassiliou M, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Medicine 2012; 10: 13. [ Links ]
3. Vermeersch P. Diagnostic performance of IgG anti-deamidated gliadin peptide antibody assays is comparable to IgA anti-tTG in celiac disease. Clin Chim Acta 2010; 411: 931–5.
4. Basso D, Guariso G, Fogar P, Navaglia F, Zambon C-F, Plebani M. Insights in the laboratory diagnosis of celiac disease. Lupus 2006; 15: 462-5. [ Links ]
5. Hill PG, McMillan SA. Anti-tissue transglutaminase antibodies and their role in the investigation of celiac disease. Ann Clin Biochem 2006; 43: 105-17. [ Links ]
6. Reeves GEM, Squance ML, Duggan AE, Murugasu RR, Wilson RJ, Wong RC, et al. Diagnostic accuracy of coelic serological tests: a prospective study. Eur J Gastroenterol Hepatol 2006; 18: 493-501. [ Links ]
7. Hooper AD, Cross SS, Hurlstone DP, McAlindon ME, Lobo AJ, Hadjivassiliou M, et al. Pre-endoscopy serological testing for celiac disease: evaluation of a clinical decision tool. BMJ 2007; 334: 729-33. [ Links ]
8. Basso D, Guariso G, Fasolo M, Pittoni M, Schiavon S, Fogar P, et al. A new indirect chemiluminescent immunoassay to measure anti-tissue transglutaminase antibodies. J Pediatr Gastroenterol Nutr 2006; 43: 613-8. [ Links ]
9. Sugai E, Vazquez H, Nachman F, Moreno ML, Mazure R, Smecuol E, et al. Accuracy testing for antibodies to synthetic gliadin-related peptides in celiac disease. Clin Gastroenterol Hepatol 2006; 4: 1112-7. [ Links ]
10. Niveloni S, Sugai E, Cabanne A, Vazquez H, Argonz J, Smecuol E, et al. Antibodies against synthetic deamidated gliadin peptides as predictors of celiac disease: prospective assessment in an adult population with a high pretest probability of disease. Clin Chem 2007; 53: 2186-92. [ Links ]
11. Agardh D. Antibodies against synthetic deamidated gliadin peptides and tissue transglutaminase for the identification of childhood celiac disease. Clin Gastroenterol Hepatol 2007; 5: 1276-81. [ Links ]
12. Sugai E, Moreno M, Hwang H, Cabanne A, Crivelli A, Nachman F, et al. Celiac disease serology in patients with different pretest probabilities: Is biopsy avoidable? World J Gastroenterol 2010; 16(25): 3144-52. [ Links ]
13. Rubio-Tapia A, Hill I, Kelly C, Calderwood A, Murray J. American College of Gastroenterology Clinical Guideline: Diagnosis and Management of Celiac Disease. Am J Gastroenterol 2013; 108(5): 656-77. [ Links ]
14. Hooper AD, Hadjivassiliou M, Hurlstone DP, Lobo AJ, McAlindon ME, Egner W, et al. What is the role of serologic testing in celiac disease? A prospective, biopsy-confirmed study with economic analysis. Clin Gastroenterol Hepatol 2008; 6(3): 314-20. [ Links ]
15. Prince HE: Evaluation of the Inova diagnostics enzyme-linked immunosorbent assay kits for measuring serum immunoglobulin G (IgG) and IgA to deamidated gliadin peptides. Clin Vaccine Immunol 2006; 13(1): 150-1. [ Links ]
16. Liu E, Li M, Emery L, Taki I, Barriga K, Tiberti C, et al. Natural history of antibodies to deamidated gliadin peptides and transglutaminase in early childhood celiac disease. J Pediatr Gastroenterol Nutr 2007; 45: 293-300. [ Links ]
17. Sugai E, Hwang HJ, Vázquez H, Smecuol E, Niveloni S, Mazure R, et al. New serology assays can detect gluten sensitivity among enteropathy patients seronegative for anti-tissue transglutaminase. Clin Chem 2010; 56(4): 661-5. [ Links ]
18. Villanacci V, Corazza GR. Coelic disease. J Clin Pathol 2005; 58: 573-4. [ Links ]
19. Basso D, Guariso G, Fogar P, Meneghel A, Zambon C-F, Navaglia F, et al. Antibodies against synthetic deamidated gliadin peptides for celiac disease diagnosis and follow-up in children. Clin Chem 2009; 55(1): 150-7. [ Links ]
20. Cataldo F, Marino V, Ventura A, Bottaro G, Corazza GR. Prevalence and clinical features of selective immunoglobulin A deficiency in coelic disease: an Italian multicentre study. Gut 1998; 42: 362-5. [ Links ]
21. Inova Diagnostics QUANTA Lite TM h-tTG/DGP Screen. Inova Diagnostics, Inc. San Diego 2007. [ Links ]
22. CLSI. I /LA 18-A2. Specifications for Immunological Testing for Infectious Diseases; Approved Guideline - Second Edition. CLSI, Wayne 2001. [ Links ]
23. Miller JJ, Valdes RJr. Approaches to minimizing interference by cross-reacting molecules in immunoassays. Clin Chem 1991; 37: 144-53. [ Links ]
24. Datta P, Ejilemele A, Petersen J. Quick Guide to Immunoassay Interference. AACC, 2013. AACC Press 1850K Street, NW, Suite 625 Washington DC 20006. [ Links ]
25. Rodriguez G, Zazzetti F, Da Representaçao S, Lencina M, Barreira J, Alvarez K. Frecuencia de anticuerpos para diagnóstico de enfermedad celíaca en pacientes con enfermedades del tejido conectivo y artropatías inflamatorias. Rev Med Chile 2014; 142: 1510-6. [ Links ]
26. Gómez JC, Selvaggio GS, Viola M, Pizarro B, La Motta G, de Barrio S, et al. Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area. Am J Gastroenterol 2001; 96: 2700-4. [ Links ]
27. Camarca M, Mozzillo E, Nugnes R, Zito E, Falco M, Fattorusso V, et al. Celiac disease in type 1 diabetes mellitus. Italian J Pediatrics 2012; 38:10 [ Links ]
28. Lauret E, Rodrigo L. Celiac disease and autoimmune-associated conditions. Biomed Res Int 2013. Disponible en http://dx.doi.org/10.1155/2013/127589. [ Links ]
29. Iltanen S, Collin P, Korpela M, Holm K, Partanen J, Polvi A, et al. Coeliac disease and markers of coeliac disease latency in patients with primary Sjögren’s syndrome. Am J Gastroenterol 1999; 94: 1042-6.
Recibido: 22 de octubre de 2015
Aceptado: 27 de mayo de 2016














