Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata mar. 2017
BIOQUÍMICA CLÍNICA
Comparación del recuento celular entre un método manual y un contador automatizado en líquidos de derrame*
Comparison of manual microscope method and an automated cell count in serous fluids
Comparação da recontagem celular entre um método manual e um contador automatizado em líquidos de derrame
Anabela Angeleri1a, Julia Ariagno1a, Melba Sardi1a, Claudio Carbia2b, Luis Palaoro3a, Adriana Rocher4a
1 Bioquímica, Especialista en Bioquímica Clínica - Área Citología.
2 Bioquímico, Especialista en Bioquímica Clínica - Área Hematología.
3 Dr. de la Universidad de Bs. As., Bioquímico, Especialista en Citología.
4 Dra. de la Universidad de Bs. As., Bioquímica, Especialista en Bioquímica Clínica - Área Citología.
a Laboratorio de Citología.
b Laboratorio de Hematología.
* Departamento de Bioquímica Clínica, Hospital de Clínicas “José de San Martín”; Facultad de Farmacia y Bioquímica-UBA, Argentina.
CORRESPONDENCIA Bioq. ANABELA ANGELERI Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Avenida Córdoba 2351. 1° piso. 1120 CIUDAD AUTÓNOMA DE BUENOS AIRES Tel.: 011-59508658 E-mail: anabela.angeleri@gmail.com
Resumen
El objetivo del trabajo consistió en comparar el recuento celular total en los líquidos de derrame de cavidades serosas entre el método automatizado empleado en hematología y el método manual en hemocitómetro. Se procesaron 107 muestras: 45 líquidos ascíticos (LA) y 62 líquidos pleurales (LP) a los que se les realizó el recuento celular en cámara de Neubauer y en contador hematológico Sysmex XT 1800i. Se obtuvieron los siguientes resultados: 1) Regresión lineal: los coeficientes de correlación indicaron una alta correlación entre ambos métodos (LA r2: 0,999; p<0,0001 y LP r2: 0,997; p<0,0001). 2) Bland-Altman: El análisis de las figuras muestra una excelente concordancia entre ambos métodos. El error sistemático fue 51 para los LA y 97 para los LP, por lo que estos valores son despreciables dado el valor diagnóstico de los datos. Los resultados demuestran que los métodos son comparables entre sí y, por ende, se puede remplazar el recuento manual por el automatizado, de demostrada eficiencia y exactitud. Sin embargo, todos los líquidos requieren una observación al microscopio óptico previa al procesamiento por el contador hematológico, donde se apreciará la presencia de agrupamientos celulares como, por ejemplo, células neoplásicas en disposición glandular que dificultan el análisis por parte del equipo o la interpretación del resultado.
Palabras clave: Derrames serosos; Recuento celular manual; Recuento automatizado; Líquido pleural; Líquido ascítico.
Abstract
The purpose of this work was to compare the total cell count in liquids serous cavities between the automated method used in hematology and the manual method hemocytometer. A total of 107 samples were processed: 45 ascites fluids (LA for its name in Spanish) and 62 pleural fluids (LP for its name in Spanish). The cells were counted in improved Neubauer counting chamber and hematology analyzer Sysmex XT 1800i. The following results were obtained: 1) Linear Regression correlation coefficients indicated a high correlation between the two methods (LA r2: 0.999; p<0.0001 LP r2: 0.997; p<0.0001). 2) Bland-Altman analysis graphics showed excellent agreement between both methods. The systematic error was 51 for LA and 97 for LP; these values are insignificant considering the diagnostic value of the data. he results demonstrate that the methods are comparable and therefore can replace the manual counting by the automated method with proven efficiency and accuracy. However, all fluids require observation by optical microscope before being processed by the hematology analyzer, where the presence of cell clusters such as neoplastic cells in glandular disposition will be appreciated, which hinder the analysis by the equipment or interpretation of results.
Keyword: Serous fluids; Manual microscope cell count method; Automated cell count method; Pleural effusion; Ascitic effusion.
Resumo
O objetivo do trabalho consistiu em comparar a contagem total de células em líquidos de derrame de cavidades serosas entre o método automatizado utilizado em hematologia e o método manual em hemocitômetro. Foram processadas 107 amostras: 45 líquidos ascíticos (LA) e 62 líquidos pleurais (LP) nos quais se realizou a recontagem celular na câmara de Neubauer e no contador hematológico Sysmex XT 1800i. Foram obtidos os seguintes resultados: 1) Regressão linear: os coeficientes de correlação indicaram uma alta correlação entre ambos os métodos (LA r2: 0,999; p<0,0001 e LP r2: 0,997; p<0,0001). 2) Bland-Altman: A análise dos Figuras mostra uma excelente concordância entre ambos os métodos. O erro sistemático foi 51 para os LA e 97 para os LP, resultando estes valores desprezáveis dado o valor diagnóstico dos dados. Os resultados demonstram que os métodos são comparáveis entre si e, portanto, pode ser substituída a contagem manual pela automatizada, de eficiência e exatidão demonstradas. Entretanto, todos os líquidos requerem observação no microscópio óptico prévia ao processamento pelo contador hematológico. Nesse momento se apreciará a presença de agrupamentos celulares como, por exemplo, células neoplásicas em disposição glandular que dificultam a análise por parte da equipe ou a interpretação do resultado.
Palavras-chave: Derrames serosos; Contagem celular manual; Contagem automatizada; Líquido pleural; Líquido ascitico.
Introducción
Los derrames serosos (pleural, ascítico y pericárdico) son el resultado de la formación excesiva de líquido o de la falta de reabsorción y se acumulan en el espacio pleural, peritoneal y pericárdico, respectivamente. Las patologías que causan estos derrames son en su mayoría: insuficiencia cardíaca, cirrosis hepática, síndrome nefrótico, embolia pulmonar, neumonía, tuberculosis, procesos infecciosos, enfermedad maligna, autoinmune y diálisis (1-5).
El estudio citológico de estos fluidos incluye el recuento celular total, diferencial y la probable detección de células malignas. Las células que se encuentran en los líquidos de derrame son: las que revisten las membranas serosas llamadas células mesoteliales, células de origen mesenquimático como leucocitos y macrófagos, y células tumorales provenientes de una metástasis en la serosa o de un tumor primario (6).
El recuento celular de los líquidos es de suma importancia en la categorización del derrame, ayuda a definir el diagnóstico y es crítico en determinadas patologías como por ejemplo la peritonitis bacteriana espontánea; por ello es necesario recurrir a herramientas que aumenten la precisión de los resultados y puedan acercarse al valor verdadero contribuyendo al diagnóstico del derrame.
El método actualmente vigente y recomendado para la evaluación del número total de células presentes en los líquidos es el recuento manual en hemocitómetro (cámara de Neubauer) que es el más empleado de rutina tanto en los laboratorios de citología como en los generales y de guardia (7)(8). En el área hematológica los métodos manuales de contaje celular han sido reemplazados por los contadores automatizados, de superior precisión y exactitud ya que evitan muchas fuentes potenciales de error (dispersión al azar de los elementos en la cámara debido a la distribución de Poisson, error por dilución, error al cargar la cámara, etc.) (9)(10).
El objetivo del trabajo fue comparar el recuento celular total en los líquidos de derrame de cavidades serosas realizado con el método automatizado empleado en hematología y el método manual en hemocitómetro.
Materiales y Métodos
Se procesaron 107 líquidos de derrame provenientes del material de descarte de los líquidos que se reciben en el Área Citología del Dpto. de Bioquímica Clínica del Hospital de Clínicas “José de San Martín” (UBA): 45 ascíticos (LA) y 62 pleurales (LP) a los que se les realizó el recuento celular en cámara de Neubauer por duplicado y por dos operadores diferentes y en contador hematológico Sysmex XT 1800i (Shangai - China). Las muestras fueron obtenidas con heparina a una concentración de 5-10 UI/mL. Las muestras sin etiqueta, con restos de fibrina o coaguladas fueron excluidas.
MÉTODO MANUAL
Para el recuento celular total se utilizó un hemocitómetro (cámara de Neubauer). Se cargaron las 2 cámaras con 10 μL de la muestra. Se realizó el recuento celular por duplicado con 2 diluciones iguales de la muestra o sin diluir de acuerdo con la apreciación en directo. Se contaron alrededor de 100 células en cada cámara o el mayor número posible. La mayor causa de variabilidad o falta de precisión en los resultados es la dispersión al azar de los elementos en la cámara (distribución de Poisson) lo cual es independiente de la homogenización de la muestra. Según esta distribución, la varianza (σ) es igual al número contado (N); el error estándar (ES) es √N y el intervalo de confianza del 95% IC95%=N±1,96 √N. Por lo tanto, el error de recuento puede reducirse aumentando el N. Para validar el recuento se verifica que la diferencia entre ambos recuentos (N1; N2) no supere el IC95% calculando la suma y diferencia entre ambos, se interpola en el figuras: (N1-N2) vs. (N1+N2) y se aceptan los valores si caen por debajo de la curva (Fig. 1). En caso de rechazo se repite el procedimiento desde las diluciones. Se calcula la cantidad de células dividiendo el promedio (N1+N2)/2 y multiplicándolo por el factor de conversión apropiado (11).

Figura 1. Diferencias aceptables para duplicados de recuentos según la suma entre ellos.
La diferencia esperada entre dos recuentos replicados independientes debería ser cero, con un error igual a la raíz cuadrada de la suma de los 2 recuentos. Donde (N1-N2) / (√ (N1 + N2)) debe ser <1,96 con un límite de confianza del 95%. Si la diferencia entre los recuentos es menor o igual a la indicada en el gráfico para la suma de recuentos obtenida, los recuentos son aceptados y la concentración se calcula. Diferencias mayores sugieren errores de conteo, o errores de pipeteado, o que las células no se mezclaron bien, por lo que se obtuvo una distribución no aleatoria en la cámara. Cuando la diferencia entre los recuentos es mayor que la aceptable, se deben desechar los dos valores, y preparar y evaluar dos diluciones nuevas. Ecuación de la curva: y=1,96 x √(N1+N2)
Para el recuento celular diferencial se centrifugó la muestra a 2000 rpm durante 10 minutos; con el sedimento se realizaron 2 extendidos citológicos y fueron coloreados con el método de Giemsa. En caso de observación de células sospechosas de malignidad se confirmó el diagnóstico con la coloración de Papanicolaou.
MÉTODO AUTOMATIZADO
Se utilizó el analizador hematológico Sysmex XT- 1800i (Shangai, China). Este aparato utiliza el poder de las tecnologías de citometría de flujo fluorescente y de enfoque hidrodinámico mediante un exclusivo diodo láser. La citometría de flujo fluorescente proporciona la sensibilidad necesaria para medir y diferenciar tipos celulares en muestras de sangre total y de fluidos corporales. Este método tiene una sensibilidad de 20 células x mm3.
Según las especificaciones del fabricante este aparato está validado para el recuento celular total de leucocitos y el de hematíes.
MÉTODOS ESTADÍSTICOS
Se utilizó el software estadístico SPSS 14,0 para Windows (SPSS, Chicago, IL, EE.UU.). Para evaluar normalidad se aplicó el test de Kolmogorov-Smirnov y para chequear outliers el test de Dixon. Para comparar los dos métodos se emplearon los métodos de regresión lineal y Bland–Altman. La correlación fue considerada significativa con un p<0,05.
Resultados
Se analizaron 107 muestras de líquidos de derrame: 45 ascíticos (LA) y 62 pleurales (LP) a los que se les realizó el recuento celular por método manual y automatizado.
CARACTERÍSTICAS DE LOS LÍQUIDOS ANALIZADOS
Valor menor 40
Valor mayor 9500
Media aritmética 859,4444
95% IC de la media 370,1428 a 1348,7461
Mediana 410
ANÁLISIS ESTADÍSTICO DE LOS RESULTADOS
1) Regresión lineal: los coeficientes de correlación indicaron una alta correlación entre ambos métodos (LA r2: 0,999; p<0,0001 y LP r2: 0,997; p<0,0001).
2) Bland-Altman: El análisis de las figuras muestra una excelente concordancia entre ambos métodos, aunque se aprecia una tendencia a obtener menores valores de recuento con el método manual al ser comparado con el automatizado en ambos líquidos. Según estas figuras el error sistemático fue 51 para los LA y 97 para los LP; estos valores de diferencias de medias (bias = recuento manual–recuento automatizado) resultan despreciables dado el valor diagnóstico de los datos (LA-bias: -51; LP-bias: -97).
Se observó que el recuento celular total fue mayor en los LP (mediana: 630) respecto de los LA (mediana: 390) (Fig. 6).
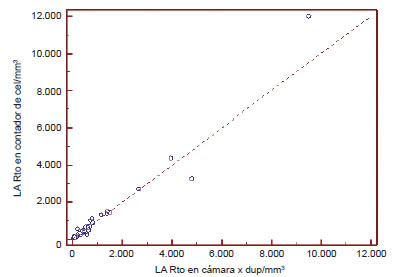
Figura 2. Correlación entre el método manual y automatizado en líquido ascítico.
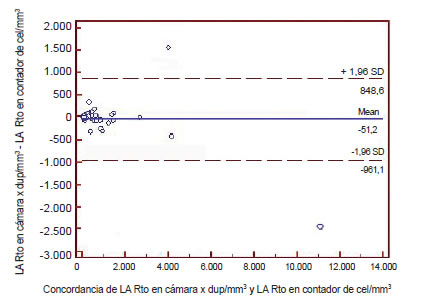
Figura 3. Concordancia entre el método manual y automatizado en el líquido ascítico (Bland Altman).
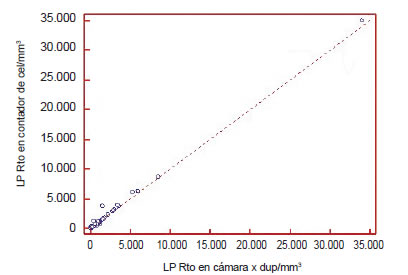
Figura 4. Correlación entre el método manual y automatizado en líquido pleural.
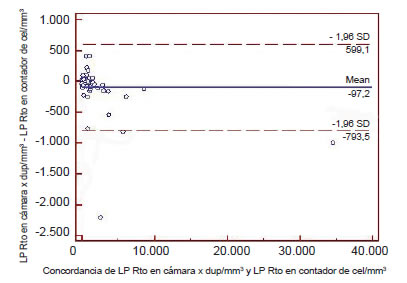
Figura 5. Concordancia entre el método manual y automatizado en el líquido pleural (Bland Altman).
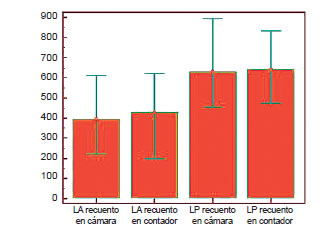
Figura 6. Distribución de los datos de Rto. celular por método manual y automatizado de LA y LP.
Discusión y Conclusiones
La cantidad de células presentes en los líquidos es relevante en la diferenciación del derrame como trasudado o exudado. Utilizando un valor de 300 células x mm3 en líquido ascítico y de 500 células x mm3 en líquido pleural se obtiene una mayor sensibilidad y especificidad en la categorización del derrame (12)(13).
Para que el valor del recuento sea confiable independientemente del método que se utilice la muestra debe reunir ciertas condiciones como por ejemplo, procesarla dentro de las 2 h de obtenida y no presentar coágulo.
Los contadores hematológicos son instrumentos de uso común en todo laboratorio de análisis clínicos. El uso de estos aparatos en fluidos biológicos puede mejorar la calidad y eficiencia en el trabajo, acortar los tiempos de ensayo, reducir el riesgo biológico y beneficiar significativamente al laboratorio. Para la aplicación de esta metodología es necesario que el aparato esté validado previamente (14)(15).
En base a los resultados obtenidos se observa que existe una buena correlación y concordancia entre ambos métodos, por lo tanto el recuento celular puede realizarse por el método automatizado, al igual que lo concluido por otros autores (16-18).
Sin embargo, a pesar de la sofisticación y rapidez de éesta técnica, la observación microscópica es imprescindible para el correcto diagnóstico citológico de estos líquidos, debido a que en estas muestras se encuentran otras células diferentes a los leucocitos, como por ejemplo macrófagos, células mesoteliales y células provenientes de un tumor primario o secundario de la serosa (Fig. 7). La visualización exhaustiva al microscopio de los preparados citológicos pondrá en evidencia la presencia de células tumorales en el caso de encontrarse en estas muestras (19).

Figura 7. Células mesoteliales, macrófagos y leucocitos en líquido pleural. 400x. Coloración de Giemsa.
Las especificaciones de los analizadores XT contemplan la medida de fluidos serosos sin tener en cuenta los otros tipos celulares diferentes a los leucocitos presentes en estas muestras. El tamaño de las células mesoteliales, macrófagos y células tumorales es mayor al de los leucocitos, por lo tanto se desconoce cómo las clasifica el aparato. Por ello, no es adecuado utilizar el autoanalizador para el recuento diferencial.
En los líquidos de punción pueden presentarse muestras con acúmulos celulares. Estos grupos celulares según la morfología pueden ser piocitos, células mesoteliales reactivas o células neoplásicas en disposición glandular (Fig. 8)(Fig. 9).
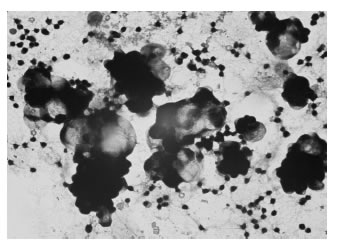
Figura 8. Células sospechosas de malignidad en líquido pleural. 400x. Coloración de Giemsa.
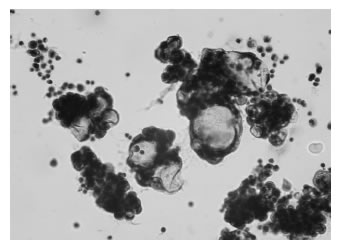
Figura 9. Células neoplásicas en disposición glandular en líquido pleural. 400x. Coloración de PAP.
En estos casos, ninguno de los dos métodos arroja el valor verdadero. El contador hematológico cuenta por defecto ya que los solventes del aparato no llegan a disgregar completamente los acúmulos celulares, sobre todo los de origen neoplásico. En el método manual, a pesar de que el ojo humano no puede discernir la cantidad exacta de células presentes en estos grupos, el recuento celular se aproxima más al valor real.
Se concluye que los resultados demuestran que los métodos son comparables entre sí y, por ende, se puede reemplazar el recuento manual por el automatizado, de demostrada eficiencia y exactitud. Sin embargo, cabe aclarar que todos los líquidos requieren una observación al microscopio óptico previa al procesamiento por el contador hematológico. Allí se apreciará la presencia de agrupamientos celulares como, por ejemplo, células neoplásicas en disposición glandular que dificultarán el análisis por parte del equipo o la interpretación del resultado. Dado que los tipos celulares presentes en los líquidos no son los mismos que los sanguíneos, la discriminación realizada por el equipo no es confiable, por lo que el dato a considerar será sólo el recuento realizado en el canal de células blancas y no su discriminación por tipos celulares.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de interés entre ellos ni entre las entidades a las cuales están vinculados.
Referencias bibliográficas
1. Milevoj Kopcinovic L, Culej J. Pleural, peritoneal and pericardial effusions. Biochemia Medica 2014; 24 (1): 123–37.
2. Burgess L. Biochemical analysis of pleural, peritoneal, pericardial effusions. Review. Clin Chim Acta 2004; 343: 61-84. [ Links ]
3. Ligth RW. Pleural diseases, 4th edition. Philadelphia: Lippincott Williams and Wilkins; 2001. [ Links ]
4. Ligth RW, McGregor MI, Luchsinger PC, Ball WC. Pleural effusions: the diagnostic separation and transudates on exudates. Ann Intern Med 1972; 77: 507-13. [ Links ]
5. Boyer TD, Kahn AM, Reynolds TB. Diagnostic value of ascitic fluid dehydrogenase, protein and white blood count levels. Arch Intern Med 1978; 138: 1103-5. [ Links ]
6. Koss LG. Effusions in the absence of cancer. In: Diagnostic Cytology and Its Histopathologic Bases. 5th ed. Philadelphia: J.B. Lippincott 2005. p. 1082 – 112.
7. Zimmermann M, Ruprecht K, Kainzinger F, Heppner FL, Weimann A. Automated vs. manual cerebrospinal fluid cell counts: a work and cost analysis comparing the Sysmex XE-5000 and the Fuchs-Rosenthal manual counting chamber. Int J Lab Hematol 2011; 33 (6): 629-37. [ Links ]
8. Jonge R, Brouwer R, van Rijn M, van Acker BA, Otten HJ, Lindemans J. Automated analysis of pleural fluid total and differential leukocyte counts with the Sysmex XE- 2100. Clin Chem Lab Med 2006; 44 (11): 1367-71. [ Links ]
9. Hernández-Reyes L. Avances y aplicación clínica de la citometría hemática automatizada. Rev Cubana Hematol Inmunol Hemoter [online] 2013; 29: 24-39. ISSN 0864-0289. [ Links ]
10. Cui W, Wu W, Wang X, Wang G, Hao YY, Chen Y, et al. Development of the personalized criteria for microscopic review following four different series of hematology analyzer in a Chinese large scale hospital. Chin Med J (Engl) 2010 Nov; 123 (22): 3231-7. [ Links ]
11. WHO manual laboratory manual for the examination and processing of human semen. 5ª edición. World Health Organization. Geneve: WHO Press; 2010. [ Links ]
12. Angeleri A, Rocher A, Agman M, Caracciolo B, Negri G, Pandolfo M, et al. Estudio de parámetros bioquímicos en el diagnóstico diferencial del derrame ascítico. Bioquím Patol Clín 2014; 78 (3): 23-9. [ Links ]
13. Angeleri A, Rocher A, Caracciolo B, Pandolfo M, Palaoro L, Perazzi B. Biochemical parameters in pleural fluids: new contributions in the etiologic diagnosis of body fluids. BJMMR 2016; 13 (1): 1-9. [ Links ]
14. Kresie L, Benavides D, Bollinger P, Walters J, Pierson D, Richmond, et al. Performance evaluation of the application of body fluids on the Sysmex XE-2100 series automated hematology analyzer. Lab Hematol 2005; 11: 24–30.
15. Bourner G, De Lasalle B, George T, Tabe Y, Baum H, Culp N. ICSH guidelines for the verification and performance of automated cell counters for body fluids. Int J Lab Hem 2014; 36: 598-612. [ Links ]
16. Chorine Fleming, Henk Russcher, Jan Lindemans and Robert de Jonge. Clinical relevance and contemporary methods for counting blood cells in body fluids suspected of inflammatory disease. Clin Chem Lab Med 2015; 53 (11): 1689–706.
17. de Jonge R, Brouwer R, van Rijn M, van Acker BA, Otten HJ, Lindemans J. Automated analysis of pleural fluid total and differential leukocyte counts with the Sysmex XE-2100. Clin Chem Lab Med 2006; 44 (11): 1367-71. [ Links ]
18. Yang D, Zhou Y, Chen B. Performance evaluation and result comparison of the automated hematology analyzers Abbott CD 3700, Sysmex XE 2100 and Coulter LH 750 for cell counts in serous fluids. Clin Chim Acta 2013; 419: 113–8.
19. Braghirolli D, Pranke P, Calil L. Evaluation of semi-automated cells counting in peritoneal fluid. J Bras Patol Med Lab 2015; 4 (51): 224-8. [ Links ]
20. Rocher A, Guerra F, Rofrano J, Angeleri A, Mendeluk G, Palaoro L. Sensitivity and specificity of cytodiagnosis of body fluids in a laboratory of urgencies. Biotech Histochem 2011; 86 (5): 326-32. [ Links ]
Recibido: 20 de enero de 2016
Aceptado: 26 de agosto de 2016














