Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata Mar. 2017
BIOQUÍMICA CLÍNICA
Determinación de Levetiracetam en suero humano por cromatografía líquida con detección de arreglo de diodos
Levetiracetam determination in human serum by liquid chromatography with diode array detection
Determinação de Levetiracetam em soro humano por cromatografia líquida com detecção de arranjo de diodos
Débora Magalí Assum1a, Maria Belén Orozco2a, Leonela Ana Tantucci1a, Héctor Andrés Suárez3b
1 Bioquímica.
2 Técnica de Laboratorio.
3 Bioquímico. Especialista en Toxicología y Bioquímica Legal.
a Fundación para el Progreso de la Medicina, 9 de Julio 941. Córdoba, Argentina.
b Hospital de Niños de la Santísima Trinidad, Ferroviarios 1250, Córdoba, Argentina.
CORRESPONDENCIA Bioq. DÉBORA MAGALÍ ASSUM Fundación para el Progreso de la Medicina 9 de Julio 941, CÓRDOBA, Argentina.
Resumen
Se desarrolló y validó un nuevo método analítico para determinar Levetiracetam (LEV) en suero humano utilizando cromatografía líquida de alta resolución (HPLC) con detección de arreglo de diodos. El procedimiento es sencillo, puede ser incluido en la rutina del laboratorio y prestar servicio tanto en el monitoreo terapéutico como en la urgencia. El método incluye las siguientes etapas: extracción líquido-líquido con diclorometano y evaporación de la fase orgánica, la droga se reconstituye con fase móvil, se inyecta en el cromatógrafo y se detecta a 205 nm. El tiempo de retención de LEV es de 5 minutos y no presenta interferentes con respecto a otras drogas comúnmente prescriptas con Levetiracetam. La curva de trabajo presentó un rango de linealidad entre 5,2 y 82,9 μg/mL, un límite de detección y cuantificación de 0,8 μg/mL y 2,7 μg/mL, respectivamente. La recuperación fue del 99,8%.
Palabras clave: Levetiracetam; Anticonvulsivante; Cromatografía líquida de alta resolución; Método analítico; Validación.
Abstract
A new analytical method for Levetiracetam (LEV) determination in human serum was developed and validated by high performance liquid chromatography (HPLC) with diode detection. It is a simple methodology that can be included in the laboratory routine and can be useful in both therapeutic drug monitoring and emergencies. The drug extraction is performed through a liquid-liquid extraction with methyl chloride. Subsequently, the organic phase is evaporated, reconstituted with the mobile phase, and injected in the chromatograph to be detected at 205 nm. LEV retention time is 5 min and it does not show interference with respect to other drugs commonly prescribed with Levetiracetam. The work curve showed linearity between 5.2 and 82.9 μg/mL and a detection and quantification limit of 0.8 μg/mL and 2.7 μg/mL, respectively, while the recovery was of 99.8%.
Key words: Levetiracetam; Anticonvulsant; High performance liquid chromatography; Analytical method; Validation.
Resumo
Foi desenvolvido e validado um novo método analítico para determinar Levetiracetam (LEV) em soro humano, utilizando cromatografia líquida de alta eficiência (HPLC) com detecção de arranjo de diodos. O procedimento é simples, pode ser incluído na rotina do laboratório e prestar serviço tanto na monitorização terapêutica quanto na urgência. O método inclui as seguintes etapas: extração líquido-líquido com diclorometano, e evaporação da fase orgânica, o fármaco é reconstituído com fase móvel, é injetado no cromatógrafo e detectado a 205 nm. O tempo de retenção de LEV é de 5 minutos e não apresenta interferentes com relação a outras drogas, comumente prescritas com Levetiracetam. A curva de trabalho apresentou um intervalo de linearidade entre 5.2 a 82.9 μg/mL, um limite de detecção e quantificação de 0.8 μg/mL e 2.7 μg/mL respectivamente. A recuperação foi de 99.8%.
Palavras chave: Levetiracetam; Anticonvulsivante; Cromatografia líquida de alta eficiência; Método analítico; Validação.
Introducción
La epilepsia es un desorden crónico, el cual requiere de largos tratamientos con drogas anticonvulsivantes. Aproximadamente la mitad de los pacientes falla al inicio del tratamiento o presentan interacción farmacológica con otros medicamentos que reciben en su terapia crónica (1). Levetiracetam (LEV) es una nueva droga, derivada de la pirrolidona (S-enantiómero de α-etil-2-oxo-1-pirrolidina acetamida) con diferente actividad anticonvulsivante a la demostrada en las otras drogas antiepilépticas (2). Actualmente su mecanismo de acción no es claro; sin embargo, se ha demostrado que no modula canales de Na+ dependientes de voltaje, ni canales Ca+ activados por bajo voltaje, activa corrientes de Cl¯ dependientes de GABA y de glicina inducidas por moduladores alostéricos (3)(4), y también inhibe corrientes de K+ de rectificación retardada (5-7). Se conoce además que LEV posee un mecanismo de acción por el cual modula la liberación de neurotransmisores mediante la unión a la proteína vesicular SV2A en cerebro (8). Estudios in vivo e in vitro sugieren que LEV no altera la neurotransmisión normal y las características básicas de la célula; se absorbe rápidamente después de su administración oral y la biodisponibilidad oral absoluta es cercana al 100%. Las concentraciones plasmáticas de LEV aumentan proporcionalmente con la dosis del fármaco, lo que se traduce en una cinética lineal, también se une débilmente a proteínas plasmáticas, lo cual reduce el riesgo de interacciones farmacocinéticas (9)(10). LEV es un fármaco anticonvulsivante potente y bien tolerado en monoterapia, en poblaciones adultas, presentando escasa farmacorresistencia principalmente en pacientes de etiología sintomática debido a epilepsia vascular cerebral (11). En politerapia se ha demostrado un amplio espectro terapéutico, especialmente en pacientes mayores de 16 años con crisis parciales, crisis generalizadas como las mioclónicas, ausencias y crisis inducidas por estímulos luminosos. LEV es sugerido para el tratamiento en pacientes con diagnósticos de epilepsia mioclónica juvenil (12)(13). Sin embargo, se ha reportado un paciente epiléptico pediátrico que presentó una elevación de la fosfatasa alcalina (ALP) en sangre después de recibir tratamiento con LEV. Los niveles de ALP retornan a la normalidad después de discontinuar la terapia, confirmando que LEV puede ser la causa “probable” de elevación de ALP en suero (14). Si bien es un fármaco con propiedades farmacocinéticas ideales, se recomienda vigilar su concentración en plasma (rango terapéutico 10 a 40 μg/mL) para optimizar el tratamiento, especialmente en pacientes con insuficiencia renal, ancianos y niños, en los cuales se ve alterada la vida media de la droga (15). Se puede resumir que el papel de LEV en el tratamiento de epilepsia presenta el mejor equilibrio entre seguridad y eficacia (16). Existen reportes que proponen la determinación de LEV por HPLC por ser un método preciso, rápido, simple y confiable tanto para la determinación de LEV en fórmulas farmacéuticas (17)(18), como en suero de pacientes que reciben tratamiento con la droga (19)(23).
La validación de un método analítico es un procedimiento fundamental para asegurar que los resultados obtenidos sean confiables. Para demostrarlo se realizó un plan de validación prospectiva, el que incluyó: alcance de la validación, diseño experimental, materiales e insumos, desarrollo de pruebas de parámetros de validación, evaluación de resultados e informe de validación.
Materiales y Métodos
INSTRUMENTO
Se utilizó un cromatógrafo líquido Agilent Technologies 1260 Infinity (fabricado en Alemania), con bomba cuaternaria, inyector automático, compartimiento de columna controlada y detector con arreglo de diodos. La separación cromatográfica se realizó en columna Eclipse XDB-C18,5 μm y 4,6 x 250 mm (Agilent Technologies). Los datos fueron recolectados mediante el software ChemStation y analizados a 205 nm del espectro.
REACTIVOS Y SOLUCIONES
El estándar de Levetiracetam puro fue donado por Temis Lostaló (UIO-0179, Análisis 7742), como estándar interno (ISTD) Teofilina con una concentración de 18 μg/mL. Diclorometano (Anedra) 84,93 g/mol, Acetonitrilo calidad HPLC (J.T. Baker), agua bidestilada (Regondi) y KH2PO4. Se preparó una solución estándar de trabajo de levetiracetam de 1,450 μg/mL.
PREPARACIÓN DE LAS MUESTRAS
Para el análisis de las muestras se utilizaron sueros de donantes que no estaban bajo tratamiento farmacológico. Estos sueros se estudiaron agregando concentraciones conocidas de la solución estándar de LEV, dependiendo de la etapa a validar. Para la extracción, se partió de 250 μL de suero, a los que se adicionaron 800 μL de diclorometano, ISTD, se agitó durante 5 minutos y se centrifugó 15 minutos a 3.000 rpm. Se extrajo el sobrenadante y se evaporó hasta sequedad, para luego reconstituirlo con 100 μL de fase móvil.
CONDICIONES CROMATOGRÁFICAS
La fase móvil estuvo compuesta por un buffer KH2PO4 (50 mM, pH 6.5) y acetonitrilo (94:6 v/v), con un flujo isocrático de 0,8 mL/min. Se inyectaron 45 μL del extracto, temperatura controlada en la columna a 35 ºC, la señal se obtiene a 205 nm de longitud de onda. El tiempo de retención del Levetiracetam es alrededor de 5 minutos en las condiciones descriptas anteriormente (Fig. 1).
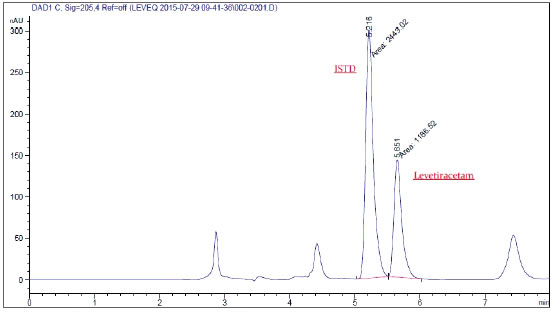
Figura 1. Cromatograma de LEV y su estándar interno.
Se utilizó el software Chem Station para la integración de los cromatogramas (relación entre las áreas de LEV/ ISTD) y mediante la absorción espectral se confirmó la pureza de los picos.
Resultados
PARÁMETROS DE VALIDACIÓN
1. Linealidad
La linealidad es la capacidad de un método de análisis, dentro de un rango determinado, de dar resultados proporcionales a la cantidad de analito presente en una muestra.
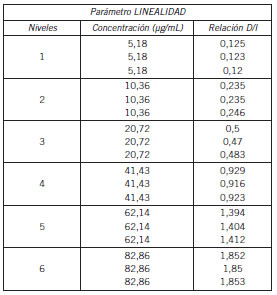
Para determinar el rango de linealidad se procesaron seis niveles por triplicado en matriz proteica, con distinta concentración de la solución estándar de LEV, determinando así el rango de medición del método, el cual fue de 5,2 a 82,9 μg/mL. Del análisis de regresión (Fig. 2, Tabla I) es posible obtener la curva de calibración, graficando concentración del estándar (x) v/s relación droga/ ISTD (y) y determinar así la ecuación de la recta: Y=0,0223 X+0,011, r²: 0,9997. Se evaluó estadísticamente el procedimiento con la prueba t de Student, como un mejor indicador de modelo lineal. Expresando t>t crit (206,5>2,78) lo que permite concluir que existe correlación lineal significativa con un nivel de confianza del 95%.
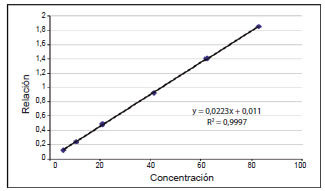
Figura 2. Curva de linealidad LEV (μg/mL).
Tabla I. Niveles de concentración de LEV v/s relación D/I, utilizadas en el rango de linealidad del método.
2. PRECISIÓN
La precisión se estableció en términos de repetibilidad y reproducibilidad, utilizando la guía CLSI EP5-A2 y expresando el grado de imprecisión en valores de desviación estándar (S) y coeficiente de variación (CV%).
Para el ensayo se procesaron 80 muestras a dos concentraciones diferentes según nivel de decisión médica (9,6 y 38,4 μg/mL). Estos se prepararon a partir de la recolección de sueros libres de la presencia de drogas y de la solución estándar de LEV (Tabla II)(Tabla III).
Tabla II. Niveles de concentración de LEV utilizados para determinar precisión.
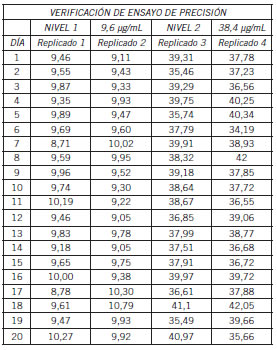
Tabla III. Cálculos de precisión por día de procesamiento de LEV utilizados para determinar precisión.
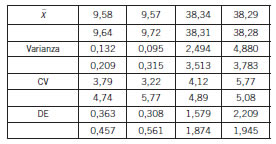
De los valores obtenidos se calcularon los estadísticos para determinar repetibilidad y precisión intermedia, según Tabla III por cada corrida cromatográfica.
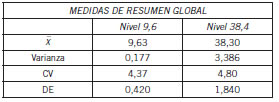
Se obtuvo la precisión intermedia con un CV 4,37 para 9,6 μg/mL y un CV 4,80 para 38,4 μg/mL (Tabla IV).
Tabla IV. Parámetros de precisión por nivel de concentración.
3. LOD – LOQ
Los límites de detección y de cuantificación se obtuvieron a partir de la curva de linealidad. LOD (3Sa/b) 0,797 µg/mL; LOQ (10Sa/b) 2,658 µg/mL, donde Sa es la desviación estándar de la ordenada al origen.
4. VERACIDAD
Para determinar el rendimiento analítico del método en el proceso de extracción y la cantidad de analito existente en la muestra, se realizó un ensayo de recuperación de 5 puntos por triplicado dentro del rango de linealidad del método, mediante el agregado de estándar de levetiracetam de un 30, 50, 100, 130 y 170% del valor esperado. Se analizó estadísticamente a través de un ensayo t de Student para muestras independientes con un nivel de confianza p=0,05. Se obtuvo un porcentaje de recuperación R: 99,8%, (con tob<t exp-0,08<2,145). A través del gráfico % medido vs. % agregado (Fig. 3), y obteniendo mediante el análisis de regresión lineal, se pudo comprobar la pendiente positiva con la inclusión de la ordenada al origen en cero (ecuación de la recta y: 0,9935 y+0,6344, r²: 0,9936-IC: 95%, rango ordenada al origen de -15,24; 16,51 y pendiente de 0,85; 1,14).
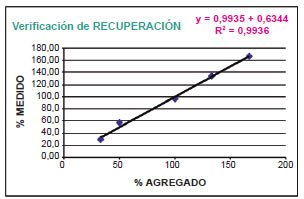
Figura 3. Ensayo de recuperación % medido vs. % agregado de Levetiracetam.
5. ESPECIFICIDAD
Para determinar interferencia interna se utilizaron distintas muestras de suero que presentaban valores patológicos de distintos analitos endógenos por ejemplo sueros hemolizados, con concentraciones de triglicéridos >400 mg/dL, urea >50 mg/dL, bilirrubina total >1,5 mg/dL, albúmina >5,0 mg/dL, y albúmina <3,0 mg/dL. A todos estos sueros se les adicionó la solución estándar de LEV, en concentraciones conocidas y se procesaron por triplicado. Se analizaron en paralelo sueros que presentaban valores normales de dichos analitos con las mismas concentraciones añadidas de solución estándar de LEV. Los datos fueron analizados comparando el porcentaje agregado, con respecto al valor hallado. No se observó diferencia en la recuperación en aquellas muestras que presentaban valores patológicos de triglicéridos, bilirrubina, urea, y albúmina, respecto a los sueros normales. Sí se registró diferencia en las muestras hemolizadas, ya que presentaron una recuperación menor (14,7% -R: 85,3%), considerando de esta manera que las muestras hemolizadas pueden interferir en la medición de este anticonvulsivante.
Para verificar interferencia externa, a una muestra de suero que contenía LEV, se agregaron distintos estándares de otras drogas comúnmente prescriptas como: Fenobarbital, Ethosuximida, Primidona, Fenitoína, Oxcarbamazepina y Carbamazepina. En las condiciones cromatográficas descriptas en este trabajo solo pudieron observarse la presencia de Fenitoina y Fenobarbital, con tiempos de retención diferentes a las drogas analizadas (estándar interno y LEV). No se observaron interferentes en el desarrollo del método cromatográfico en este análisis, con las condiciones descriptas previamente (Fig. 4).
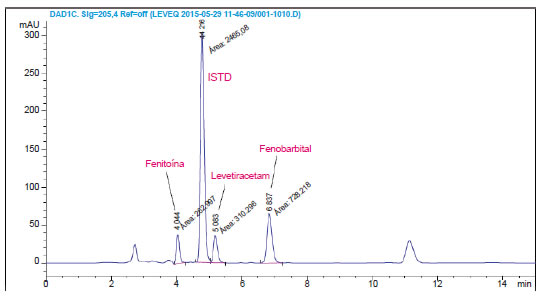
Figura 4. Análisis de interferentes externos.
6. ROBUSTEZ
Se procesaron 2 niveles de levetiracetam (19,2 μg/mL y 38,4 μg/mL) por triplicado. A la mitad de las muestras se las mantuvo en condiciones ideales (sin exposición a luz uv directa, temperatura de 25 °C y sin exponerlas a varios ciclos de descongelado y congelado a -70 ºC). Al resto de las muestras se las expuso a distintas situaciones para comprobar su estabilidad en ciclos de congelamiento y descongelamiento, exposición a temperaturas mayores a 37 ºC y exposición a luz UV, cumpliendo tres periodos de 15 min en condiciones ideales y 15 min aplicando las variantes a analizar.
Para comprobar si alguna de estas condiciones tenía influencia significativa sobre el resultado se utilizó el Test de Youden y Steiner, el cual permite explorar el efecto de cada una de las variables en un solo experimento y así aproximarse a la desviación esperada en la variabilidad de aquellos factores considerados como críticos. De este modo se puede conocer el efecto de cada variable en el método analítico. Como criterio de aceptación para la robustez del método se considera que la diferencia entre los valores obtenidos bajo distintas situaciones sea superior a √2 de la desviación estándar de la precisión del método (S), es decir; < √2. Si se comparan los valores obtenidos en presencia de los distintos parámetros con S √2 para el nivel de 19,2 μg/mL y de 38,4 μg/mL en todos los casos, los resultados fueron < S √2, lo cual refiere que no existe diferencia significativa frente a las distintas variables analizadas.
7. VERIFICACIÓN ANALÍTICA
Después de implementar el nuevo método, se verificó su desempeño utilizando la guía EP15-A2 para verificar precisión y veracidad. Se analizaron dos niveles, 19,2 μg/mL y 38,4 μg/mL. Se consideró un error total aceptable (ETa) del 20%, obteniendo resultados aceptables (Tabla V) (Tabla VI), mediante los cuales se logró obtener el sigma del método, el nivel limitante y el esquema de control de gestión de calidad interno para incorporarlo en la rutina del laboratorio. Utilizando el nivel limitante (19,2 μg/mL) y mediante las OPSpecs chart (Fig. 3) se estableció como procedimiento de control de calidad candidato a la regla 1 3,5S, N2 (dos controles por corrida) (Tabla V) (Tabla VI) (Fig. 5).
Tabla V. Desempeño del método.

Tabla VI. Nivel de Decisión del método, nivel limitante.
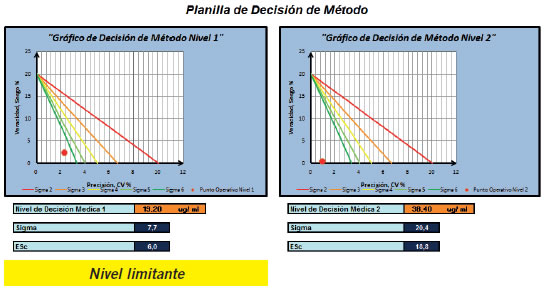
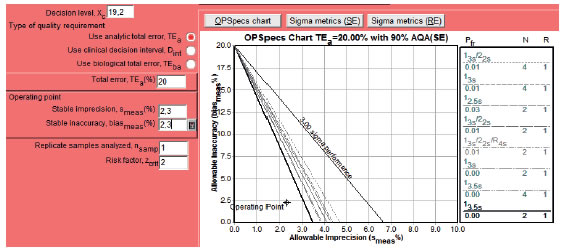
Figura 5. Gráfico de Función de Poder.
Discusión y Conclusiones
LEV es un fármaco con propiedades farmacocinéticas ideales. Se recomienda vigilar su concentración en plasma (rango terapéutico 10 a 40 μg/mL) para optimizar el tratamiento, especialmente en pacientes con insuficiencia renal, ancianos y niños, en los cuales se ve alterada la vida media de la droga. Es importante disponer de un método analítico para su determinación en suero, mediante HPLC con detección de arreglo de diodos, previa extracción líquido – líquido, fase móvil isocrática compuesta por un buffer KH2PO4 (50 mM, pH 6,5) y acetonitrilo (94:6 v/v), con un flujo de 0,8 mL/min. Se inyectan 45 μL del extracto, temperatura controlada en la columna a 35 ºC, la señal se obtiene a 205 nm de longitud de onda. El tiempo de retención del Levetiracetam es alrededor de 5 minutos en las condiciones descriptas anteriormente. Se utilizó teofilina como estándar interno, como control e indicador de posibles errores al extraer la droga de la muestra de suero. No se observó interferencia con las drogas comúnmente prescriptas en la terapia con LEV. En cuanto a la toma de muestras para la determinación de este anticonvulsivante es suficiente con 300 µL de suero, pero se deben evitar las muestras hemolizadas debido a las interferencias observadas en el ensayo de recuperación del mismo.
Se evidenció un buen desempeño metodológico, poniendo a prueba y demostrando los distintos parámetros analíticos. Además se implementó la utilización de la guía EP15-A2, la cual evidencia el comportamiento metodológico en la rutina, aportando el sigma del método, el nivel limitante y el esquema de reglas de control de gestión de calidad interno, para incorporarlo al monitoreo de rutina del laboratorio.
El método desarrollado es un método simple, rápido, preciso, exacto y con sensibilidad aceptable para la determinación de LEV en suero humano, lo cual le permite ser implementado en el laboratorio clínico para el monitoreo terapéutico de pacientes que reciben tratamiento crónico con LEV, también utilizarlo ante la sospecha de toxicidad por dicho fármaco para obtener una respuesta rápida y apropiada para el diagnóstico y seguimiento del paciente.
1. Torres-Ferrús M, Toledo M, González-Cuevas M, Seró- Ballesteros L, Santamarina E, Raspall-Chaure M, et al. Etiología y tratamiento de la epilepsia en una serie de 1.557 pacientes. Rev Neurol 2013; 57 (7): 306-12. [ Links ]
2. Klitgaard H, Matagne A, Gobert J, Wülfert E. Evidence for a unique profile of levetiracetam in rodent models of seizures and epilepsy. Eur J Pharmacol 1998; 353: 191-206. [ Links ]
3. Klitgaard H. Levetiracetam: the preclinical profile of a new class of antiepileptic drugs? Epilepsia 2001; 42 Supl 4: S13-8. [ Links ]
4. Herranz JL, Argumosa A. Características e indicaciones del levetiracetam. Rev Neurol 2002; 35 Supl 1: S110-6. [ Links ]
5. Rigo JM, Nguyen L, Belachew S, Mulgrange B, Leprince P, Moonen G, et al. Levetiracetam: novel modulation of ionotropic inhibitory receptors. Epilepsia 2000; 41 Supl 7: S35. [ Links ]
6. Madeja M, Margineanu DG, Klitgaard H. Effect of levetiracetam on voltage-gated potassium channels: a novel antiepileptic mechanism of action? Epilepsia 2001; 42 Supl 2: S19. [ Links ]
7. Kuzniecky R, Pan J, Burns A, Devinsky O, Hetherington H. Levetiracetam has no acute effects on brain γ-aminobutyric acid levels. Epilepsy Behav 2008; 12 (2): 242-4.
8. Abou-Khalil B. Levetiracetam in the treatment of epilepsy. Neuropsychiatr Dis Treat 2008; 4 (3): 507-23. [ Links ]
9. Radtke RA. Pharmacokinetics of levetiracetam. Epilepsia 2001; 42 Supl 4: S24-7. [ Links ]
10. Martínez-Granero MA, García-Pérez A, Montañes F. Levetiracetam as an alternative therapy for Tourette syndrome. Neuropsychiatr Dis Treat 2010; 6: 309-16. [ Links ]
11. Molins A, Villanueva VE. Levetiracetam en el tratamiento de la epilepsia del adulto. Experiencia en monoterapia. Rev Neurol 2007; 45 (6): 331-3. [ Links ]
12. Verrotti A. Levetiracetam in juvenile myoclonic epilepsy: long-term efficacy in newly diagnosed adolescents. Dev Med Child Neurol 2008; 50: 29-32. [ Links ]
13. Radtke RA. Pharmacokinetics of levetiracetam. Epilepsia 2001; 42 Supl 4: S24-7. [ Links ]
14. Xiong N, Hou L, Lu N, Mohamed A, Wang T, Huang Y. Probable levetiracetam-related serum alkaline phosphatase elevation. BMC Neurology 2012; 97, doi:10.1186/1471-2377-12-97. [ Links ]
15. Pellock JM, Glauser TA, Bebin EM, Fountain NB, Ritter FJ, Coupez RM, et al. Pharmacokinetic study of levetiracetam in children. Epilepsia 2001; 42 (12): 1574. [ Links ]
16. Arroyo S. Eficacia y tolerabilidad de los nuevos antiepilépticos: posición del levetiracetam. Rev Neurol 2002; 35 (3): 227-30. [ Links ]
17. Devanaboyina N, Satyanarayana T, Ganga Rao B. A novel RP-HPLC method for the analysis of levetiracetam in formulations. Der Pharma Chemica 2011; 3 (6): 112-7. [ Links ]
18. Lakshmana Rao A, Naga Yahnavi Y. Validated RP-HPLC method for the estimation of Levetiracetam in bulk and pharmaceutical formulations. E-Journal of Chemistry 2010; 7 (2): 600-4. [ Links ]
19. Olah E, BacsoGy, Fekete J, Sharma VK.Determination of ng/mL levetiracetam using Ultra-High-Performance Liquid Chromatography-Photodiode Absorbance. J Chromatogr Sci 2012; 50: 253-8. [ Links ]
20. Sarmiento LA. Determinación de levetiracetam en suero mediante HPLC-UV. Rev Fac Med 2014; 22 (1): 12-9. [ Links ]
21. Martens-Lobenhoffer A, Bode-Boger MS. Determination of levetiracetam in human plasma with minimal sample pretreatment. J Chromatogr B 2005; 819: 197-200. [ Links ]
22. Contin M, Mohamed S, Albani F, Riva R, Baruzzi A. Simple and validated HPLC–UV analysis of levetiracetam in deproteinized plasma of patients with epilepsy. J Chromatogr B 2008; 873 (1-15): 129-32.
23. Mohammadi B, Majnooni M, Afnanzade N, Jalili R, Bahrami G. Simple and rapid ultra-high performance liquid chromatographic (UHPLC) method for the determination of levetiracetam in human serum: application to a bioequivalence study. Afr J Pharm Pharmacol 2012; 6 (27): 2017-22. [ Links ]
Recibido: 9 de marzo de 2016
Aceptado: 3 de mayo de 2016














