Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Acta bioquímica clínica latinoamericana
versão impressa ISSN 0325-2957versão On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata mar. 2017
BIOQUÍMICA CLÍNICA
Inmunoserología y métodos moleculares para el diagnóstico de Chagas: revisión sistemática rápida
Immunoserology and molecular techniques for diagnosis of Chagas´ disease: rapid systematic review
Imunoserologia e métodos moleculares para o diagnóstico de Chagas: revisão sistemática rápida
Lucas Gonzalez1#, Karenina Scollo2#, Ariel Bardach1,3, Amadeo Sáez-Alquezar4, Carina Ferlín1, Pedro Albajar-Viñas5, Agustín Ciapponi1#, Sergio Sosa-Estani2,3#
1 Instituto de Efectividad Clínica y Sanitaria (IECS). Centro de Investigación de Epidemiología y Salud Pública (CIESP). Dr. Emilio Ravignani 2024. Ciudad Autónoma de Buenos Aires, Argentina. info@iecs.org.ar
2 Instituto Nacional de Parasitología “Dr. Mario Fatala Chabén”, ANLIS, Ministerio de Salud. Av. Paseo Colón 568. Ciudad Autónoma de Buenos Aires, Argentina.
3 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).Godoy Cruz 2290.Ciudad Autónoma de Buenos Aires, Argentina.
4 Programa Nacional de Controle de Qualidade (PNCQ). Sociedade Brasileira de Análises Clínicas (SBAC). Rua Vicente Licínio, 99. Rio de Janeiro, Brazil.
5 Departamento de Control de Enfermedades Desatendidas. Organización Mundial de la Salud. Avenue Appia 20, 1211 Geneva 27, Suiza.
CORRESPONDENCIA Dr. LUCAS GONZÁLEZ Investigador del Instituto de Efectividad Clínica y Sanitaria (IECS) Departamento de Evaluación de Tecnologías Sanitarias y Economía de la Salud Emilio Ravignani 2024 (C1414CPV) CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina Tel/Fax: (+54-11) 4777-8767 www.iecs.org.ar E-mail: lgonzalez@iecs.org.ar
# Autorías compartidas.
Los Dres. Ariel Bardach y Sergio Sosa-Estani pertenecen a la Carrera de Investigador Científico, y el Dr. Agustín Ciapponi a la carrera de Investigador en Salud del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
Financiación: Organización Mundial de la Salud (APW 201106429) e Instituto de Efectividad Clínica y Sanitaria.
Resumen
Con el objetivo de incrementar la precisión diagnóstica, la Organización Mundial de la Salud recomienda la realización de dos o más pruebas inmunoserológicas para el diagnóstico de la enfermedad de Chagas en etapa crónica. El objetivo de este trabajo fue realizar una revisión sistemática rápida acerca del desempeño de las técnicas inmunoserológicas y métodos moleculares en la población general. Se identificaron 178 estudios de los cuales fueron incluidos nueve. Las técnicas de ELISA mostraron la mayor sensibilidad (82-98%) y especificidad (96-100%). Los métodos rápidos mostraron valores de sensibilidad entre 88-93% y especificidad 97- 100%, mientras que los métodos moleculares (PCR) presentaron niveles muy variables de sensibilidad (22-92%) y especificidad (70-100%). Estos resultados muestran que las técnicas de ELISA cuentan con una sensibilidad y especificidad adecuadas. La PCR, al igual que los métodos rápidos, mostró una gran variabilidad en los resultados, debido principalmente a la heterogeneidad de la técnicas y profusión de métodos elaborados de manera in house.
Palabras clave: Chagas; Diagnóstico; Sensibilidad; Especificidad; Reacción en cadena de la polimerasa; Ensayo inmunoenzimático ELISA; Inmunofluorescencia indirecta; Hemaglutinación indirecta.
Abstract
In order to increase diagnostic accuracy, the World Health Organization recommends performing two or more immunoserological tests for the diagnosis of Chagas disease in chronic stage. The aim of this work was to make a rapid systematic review of the performance of immunoserological techniques and molecular methods in the general population. A total of 178 studies were identified, nine ofwhich were included. ELISA techniques showed the highest sensitivity (82-98%) and specificity (96-100%). Rapid methods presented values of sensitivity between 88-93% and 97-100% of specificity, while the molecular methods (PCR) showed highly variable levels of sensitivity (22-92%) and specificity (70-100%). These results indicate that ELISA techniques have adequate sensitivity and specificity. PCR, as well as rapid methods, showed great variability in the results, mainly due to the heterogeneity of the techniques and abundance of “in-house” methods.
Keywords: Chagas, Diagnosis; Sensitivity; Specificity; Polymerase chain reaction; Enzyme-linked immunosorbent assay ELISA; Indirect immunofluorescence; Indirect hemagglutination.
Resumo
Visando a aumentar a precisão do diagnóstico, a Organização Mundial da Saúde recomenda executar dois ou mais testes imunoserológicos para o diagnóstico na fase crônica da doença de Chagas. O objetivo deste trabalho foi fazer uma revisão sistemática rápida sobre o desempenho de técnicas imunoserológicas e métodos moleculares na população em geral. Foram identificados 178 estudos dos quais se incluíram nove. Técnicas de ELISA mostraram a maior sensibilidade (82-98%) e especificidade (96-100%). Métodos rápidos apresentaram valores de sensibilidade e especificidade de 88-93% e 97-100%, respectivamente enquanto que os métodos moleculares (PCR) tinham níveis extremamente variáveis de sensibilidade (22-92%) e especificidade (70-100%). Estes resultados mostram que as técnicas de ELISA possuem sensibilidade e especificidade adequadas. A PCR, bem como os métodos rápidos, mostrou grande variabilidade nos resultados, principalmente devido à heterogeneidade das técnicas e profusão de métodos desenvolvidos de modo in house.
Palavras-chave: Chagas; Diagnóstico; Sensibilidade; Especificidade; Reação em cadeia da polimerase; Ensaio imunoenzimático ELISA; Imunofluorescência indireta; Hemaglutinação indireta.
Introducción
La Enfermedad de Chagas es producida por el parásito Trypanosoma cruzi. La Organización Mundial de la Salud (OMS) estima que en el mundo existen al menos 7 millones de personas infectadas y que cada año se producen 28.000 nuevas infecciones. La mayoría de los afectados habita en América Latina, donde la enfermedad de Chagas se reporta como endémica en 21 países (1). En las últimas décadas se ha observado con mayor frecuencia en los Estados Unidos, Canadá, muchos países europeos y algunos del Pacífico Occidental. En estas regiones la infección se suele adquirir de manera no vectorial, mediante transfusión de sangre y trasplante de órganos donados de individuos infectados que han migrado desde América Latina, o por transmisión vertical (de la madre infectada a su hijo). Por consiguiente, es de vital importancia asegurar la búsqueda de mujeres embarazadas e individuos donantes en regiones fuera de regiones endémicas (2)(3).
Durante la fase aguda, la confirmación de la infección se lleva a cabo al demostrar la presencia del parásito por métodos parasitológicos o por la búsqueda del ADN parasitario a través de métodos moleculares. La reacción en cadena de la polimerasa (PCR, del inglés Polymerase Chain Reaction) es una técnica molecular que permite la amplificación in vivo de fragmentos de ADN. Existen diferentes técnicas de PCR (Hot Start-PCR, Nested-PCR, Real-Time PCR) así como también dos zonas de amplificación o secuencias diana, el ADN de kinetoplasto (PCRk) y el ADN nuclear (PCRn). Los métodos parasitológicos de concentración como el microhematocrito y el Strout, útiles durante la fase aguda pierden sensibilidad en la fase crónica por la disminución de la parasitemia. La PCR, método más sensible, puede ser positiva durante la fase crónica en hasta el 70% de los casos (4).
El diagnóstico de la fase crónica se confirma al detectar inmunoglobulinas G (IgG) dirigidas contra múltiples antígenos parasitarios. Diferentes métodos pueden utilizarse para su detección: ensayo inmuno-enzimático (ELISA), inmunofluorescencia indirecta (IFI), hemoaglutinación indirecta (HAI), aglutinación con partículas de gelatina. Los antígenos del parásito utilizados en estas pruebas varían ampliamente, desde extractos celulares crudos a moléculas definidas o fusión de péptidos. Los antígenos utilizados con la técnica de ELISA se pueden obtener a través del lisado de parásitos (5)(6). Por otro lado, una variación de esta técnica no utiliza antígenos elaborados a partir de lisados sino que los antígenos se construyen con tecnología de ADN recombinante (ELISA recombinante) (5)(6).
Muchos de los reactivos utilizados para las técnicas mencionadas anteriormente son elaborados por los laboratorios de manera local (in-house o home-made), existiendo a su vez una variedad de reactivos disponibles comercialmente (7).
En los últimos años se han diseñado diferentes métodos rápidos, los cuales no requieren de equipamiento especial. Los mismos se basan en diferentes principios: inmunocromatografía, aglutinación de partículas, inmunofiltración o inmunodot. Los resultados obtenidos pueden ser cualitativos o semicuantitativos (8).
Un informe publicado en 1991 que comparó el desempeño de las pruebas serológicas concluyó que la utilización de un método de manera individual tiene baja precisión diagnóstica para enfermedad de Chagas (6). Por este motivo, se recomienda la realización de dos o más pruebas inmunoserológicas que posean principios y utilicen antígenos diferentes para el diagnóstico de la enfermedad en esta etapa (1)(9). Ambas pruebas deben realizarse simultáneamente con la misma muestra de suero. Para considerar el diagnóstico como definitivo (ya sea confirmando o descartando una infección crónica), el resultado de ambas pruebas debe ser coincidente (ambas reactivas o ambas no reactivas). En caso de discordancia se deberá realizar una tercera prueba, o derivarla a un centro de referencia para confirmar o descartar el diagnóstico de la enfermedad (5).
El objetivo del presente trabajo consistió en realizar una revisión sistemática rápida acerca del desempeño de las técnicas de diagnóstico inmunoserológicas y técnicas moleculares (in house o comerciales) para enfermedad de Chagas utilizadas en la población general.
Materiales y Métodos
Se realizó una búsqueda en las principales bases de datos bibliográficas (MEDLINE, LILACS, EMBASE), buscadores genéricos de Internet y agencias de evaluación de tecnologías, de estudios publicados en la última década. La búsqueda se limitó a aquellas publicaciones en idioma inglés, castellano y portugués entre marzo de 2005 y marzo de 2015. Las estrategias de búsqueda empleadas se detallan en el Anexo I.
Se seleccionaron estudios que evaluaron la sensibilidad y especificidad de las diferentes técnicas para el diagnóstico de la enfermedad de Chagas. Se incluyeron revisiones panorámicas (overviews), sistemáticas o narrativas y estudios primarios de precisión diagnóstica realizados sobre pacientes con sospecha clínica de enfermedad de Chagas o en el marco de programas de tamizaje. Fueron excluidos aquellos estudios referidos al tamizaje en bancos de sangre y material de trasplante.
Pares de revisores realizaron de manera independiente el rastreo de las referencias identificadas por título y resumen y posteriormente por texto completo, extractando la información relevante. Las discrepancias fueron resueltas por consenso del equipo completo. Se utilizó el instrumento QUADAS-2 (10)(11) para evaluar el riesgo de sesgo de los estudios incluidos en revisiones sistemáticas de técnicas diagnósticas mediante pares de revisores independientes. Las discrepancias fueron resueltas por consenso del equipo completo. En caso de que las pruebas diagnósticas hubieran sido evaluadas como parte de una intervención, se calificó la evidencia con el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) (12). La revisión fue registrada en PROSPERO [32982].
Resultados
De los 178 artículos identificados y revisados por título y resumen, 39 fueron seleccionados para ser evaluados mediante el texto completo y 30 se excluyeron, como se muestra en el Anexo II (Tabla de estudios excluidos). De los ocho estudios incluidos dos fueron meta-análisis y siete estudios de precisión diagnóstica (Figura 1).
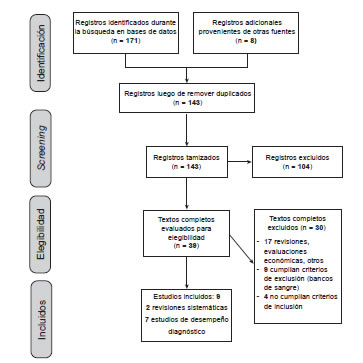
Figura 1. Flujograma de selección de estudios
La información obtenida no permitió la realización de un meta-análisis debido a importante heterogeneidad metodológica y estadística, por lo que se realizó la exposición de los hallazgos de manera descriptiva. Al evaluar mediante la herramienta QUADAS-2 el riesgo de sesgo de los estudios incluidos en la revisión se puntuó a los mismos de manera global como alto, moderado o bajo riesgo de sesgo, según la predominancia de clasificación en cada uno de los dominios de selección y aplicabilidad (Figura 2) en relación al desempeño diagnóstico de las diferentes pruebas para la enfermedad de Chagas a nivel poblacional. Las características de los estudios incluidos se describen en el texto mientras que sus principales resultados e intervalos de confianza del 95% (IC 95%) se presentan en la Tabla I.
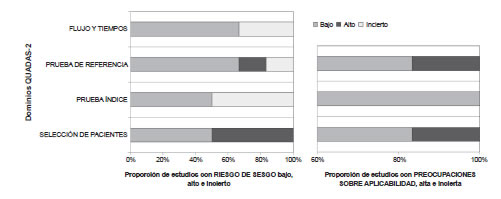
Figura 2. Evaluación del riesgo de sesgo según el instrumento QUADAS-2.
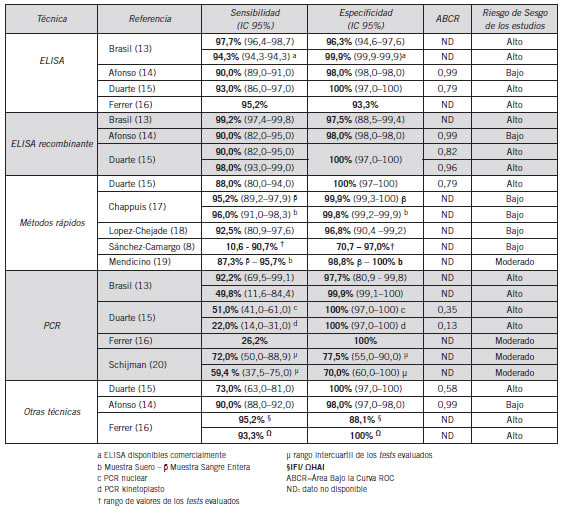
Tabla I. Resumen de la precisión de las pruebas diagnósticas de enfermedad de Chagas
ELISA
Una revisión sistemática publicada por Brasil et al. analizó un total de 164 métodos (n=109.420) basados en la técnica ELISA (13). En su mayoría las técnicas que utilizaron antígenos no recombinante (115 métodos) eran in-house, estando sólo el 30,4% disponibles comercialmente al año 2009. La sensibilidad y especificidad de aquellos estudios con evaluación sesgada de la prueba utilizada como referencia (n=16 estudios) fueron de 97,7% (I2 48%) y 96,3% (I2 58%), respectivamente. El cegamiento parcial de la prueba de referencia explicó en parte la heterogeneidad identificada. Las estimaciones de sensibilidad y especificidad de las técnicas disponibles comercialmente fueron del 94,3% (I2 86%) y 99,9% (I2 96%), respectivamente. El cegamiento parcial de la prueba de referencia explicó en parte la heterogeneidad identificada. En otro meta-análisis llevado a cabo por Afonso et al. fueron evaluadas un total de 45 pruebas basadas en la técnica de ELISA (n=14.882) (14). El 53,3% de ellas estaban disponibles comercialmente al 2012. La sensibilidad global de la técnica fue del 90,0% (I2 96%) con una especificidad del 98,0% (I2 97%). El Área Bajo la Curva ROC (ABCR) reportada fue de 0,99. Duarte et al. publicaron los resultados de un estudio de casos y controles donde se compararon siete pruebas diagnósticas (n=205) (15). Al evaluar las pruebas ELISA una de ellas fue in-house y las otras dos comerciales. La sensibilidad y especificidad del ELISA in-house fue del 93,0% y 100% respectivamente, con un ABCR=0,96. También se encontró que las técnicas comerciales evaluadas en el estudio presentaron resultados similares al anteriormente citado (14). Ferrer et al. realizaron una comparación entre técnicas inmunológicas y moleculares para el diagnóstico de la enfermedad de Chagas tanto en fase aguda como crónica (n=111, 39 de ellos en fase aguda) (16). Durante la fase crónica (n=72) la sensibilidad y especificidad de la prueba ELISA in-house fue de 95,2% y 93,3%, respectivamente.
ELISA RECOMBINANTE
Al evaluar las técnicas basadas en tecnología recombinante comerciales disponibles en el mercado, Brasil reportó una sensibilidad del 99,2% (I2 82%) con una especificidad del 97,5% (I2 84%) (13).
En el meta-análisis de Afonso, la sensibilidad fue 90% (I2 98%), con una especificidad del 98% (I2 95%) y un ABCR=0,99 (14). En el estudio de Duarte la sensibilidad de las técnicas disponibles comercialmente fue del 90,0% y 98,0%, mientras que la especificidad en ambos casos fue del 100%. El ABCR osciló entre 0,95 y 0,99 (15).
MÉTODOS RÁPIDOS DE DIAGNÓSTICO
Sánchez-Camargo et al. evaluaron la precisión diagnóstica y la simpleza del uso de 11 pruebas rápidas comerciales disponibles en el mercado (8). La mayoría de las pruebas estaban basadas en la técnica de inmunocromatografía (siete en formato cassette y dos como tiras reactivas). Si bien al evaluar la facilidad de uso las pruebas en formato cassette recibieron puntuaciones más altas, la sensibilidad y especificidad presentaron una alta variabilidad oscilando entre el 10,6 y el 90,7%, y del 70,7 al 97%, respectivamente. Los valores de sensibilidad y especificidad de las pruebas en formato tira fueron de 92,9% y 94%, respectivamente. En el estudio de Duarte el único test rápido analizado arrojó una sensibilidad de 88,0%, con una especificidad del 100%. El ABCR fue 0,79 (15). Chappuis et al. evaluaron un método rápido de diagnóstico disponible comercialmente basado en la técnica de inmunocromatografía (17). La sensibilidad y especificidad de la prueba al usarse con muestras de suero fue del 96,0% y 99,8%. En otro estudio, Lopez-Chejade et al. evaluaron la utilidad de un test rápido inmunocromatográfico (n=148). Al realizarse la prueba con sangre total, la sensibilidad reportada fue del 92,5% con una especificidad del 96,8% (18). Mendicino et al. evaluaron la precisión diagnóstica de una técnica de inmunocromatografía disponible comercialmente (n=231) (19). La sensibilidad y especificidad reportadas al utilizarse con sangre entera fue 87,3% y 98,8%, encontrando valores más elevados al utilizar suero (95,7% y 100%, respectivamente).
MÉTODOS MOLECULARES
La precisión diagnóstica de la detección de ADNk por PCR fue evaluada en el meta-análisis de Brasil et al. (13). Ninguna de las pruebas estaba disponible comercialmente. La sensibilidad osciló entre el 1,2% y 100%, mientras que la especificidad reportada varió del 50% al 100%, siendo las condiciones asociadas a la gran variabilidad, el almacenamiento con guanidina y el calentamiento de la muestra antes del procesamiento. En aquellas técnicas que cumplían con los dos requisitos, la sensibilidad fue del 92,2% con una especificidad del 97,7% (I2 89) versus 49,81% (I2 94%) y 99,96% (I2 76%) respectivamente, cuando las condiciones mencionadas anteriormente no estaban presentes (13). Los valores de sensibilidad y especificidad de la PCR reportados por Duarte et al. variaron de acuerdo al tipo de ADN detectado del parásito. Los mismos fueron de 51,0% y 100% cuando se trató del ADNk y del 22,0% y 100% cuando fue el nuclear. Los resultados del ABCR fueron 0,35 y 0,13, respectivamente (15). Ferrer et al. evaluaron la precisión diagnóstica de la PCR en pacientes con diagnóstico de Chagas. Se detectó tanto ADNk como ADNn siendo la sensibilidad global de ambas pruebas del 26,2% y la especificidad del 100% en ambos casos (16). Schijman et al. evaluaron el desempeño de diferentes técnicas de PCR (20). Existió una gran variabilidad entre las pruebas evaluadas que incluyó el procedimiento de purificación de ADN utilizado (kits comerciales
Clínicos y de Laboratorio(CLSI, Clinical and Laboratory Standards Institute) (21). Si bien esto permitió acercar su utilización en el algoritmo diagnóstico de Chagas congénito como técnica complementaria esperando en el futuro ser considerada como técnica diagnóstica, como aún no se han validado localmente existe la posibilidad de falsos negativos debido a la circulación de parásitos de otras DTU (22). La PCR también se encuentra en etapa de investigación como un posible método para la detección de falla terapéutica durante el seguimiento de personas que realizaron tratamiento y ante una posible reagudización en personas inmunosuprimidas.
En referencia a los métodos rápidos, la sencillez en su realización y lectura sin la necesidad de disponer de gran aparatología o personal entrenado permite su uso como técnica de rastreo en estudios epidemiológicos, zonas rurales de países endémicos y en países no endémicos. Sin embargo, y a pesar de su buena precisión diagnóstica, se requieren más estudios de validación que incluyen población general (17).
La gran heterogeneidad evidenciada en los resultados, y la abundancia de técnicas in-house y pruebas comerciales dificultan la generalización de los resultados sobre técnicas específicas. En este contexto y con el objetivo de alcanzar y asegurar valores mayores al 98% en la sensibilidad y 95% en la especificidad como criterios sugeridos de calidad que aseguren un buen valor diagnóstico, la implementación de Programas de Evaluación Externa de la Calidad (PEEC) es de fundamental importancia (24).
En Argentina, el PEEC realizado por el INP “Dr. Mario Fatala Chabén” año calendario 2015 a laboratorios que pertenecen a la Red de la Enfermedad de Chagas reportó un índice de eficiencia global del 0,95 (DE: 0,16). Los porcentajes de concordancia para todas las pruebas comerciales e in house oscilaron entre 100% y 91%. Estos valores reportados indican que se obtuvieron valores aceptables por parte de los laboratorios participantes en todo el territorio nacional (24). En Chile, el resultado del PEEC durante el período 2000-2014 informó que la sensibilidad de los métodos ELISAs fue del 96,9 al 100% con una especificidad que osciló entre 76,4 al 100%, mientras que en aquellos que utilizaron reactivos recombinantes, la sensibilidad fue 100% con una especificidad que osciló entre 94% y 98,8% (25).
Ante los resultados observados en estos programas y ante la variabilidad de instrumentos y reactivos de diagnóstico existentes, se destaca la importancia de la implementación de PEEC con el objetivo promover la calidad de los resultados y de obtener información actualizada de los métodos analíticos empleados.
Los resultados encontrados muestran una adecuada sensibilidad y especificidad de las técnicas de diagnóstico actuales. Sin embargo, existe una gran heterogeneidad de las mismas que dificultan la generalización de los resultados sobre métodos específicos. Son necesarios estudios que investiguen de manera comparativa la precisión diagnóstica de las diferentes pruebas disponibles comercialmente antes de su implementación a nivel local. Si bien la PCR no se encuentra validada tiene un futuro promisorio como método para la detección de falla terapéutica y ante una posible reagudización en personas inmunosuprimidas. La sencillez de uso de los métodos rápidos permitiría incorporarlos al rastreo en estudios epidemiológicos, o en zonas rurales.
Anexo I Estrategias de búsqueda utilizadas según la base de datos bibliográficas
Medline PubMed
((“Diagnosis”[Mesh] OR “Mass Screening”[Mesh] OR “diagnosis”[Subheading]) AND ((“Quality Assurance, Health Care”[Mesh] OR (External[All Fields] AND Quality[All Fields] AND (“Assessment”[Journal] OR “assessment”[All Fields])) OR “Clinical Laboratory Services/standards”[Mesh]) OR “Laboratory Proficiency Testing”[Mesh])) AND (“Chagas Disease”[Mesh] OR “Trypanosoma cruzi”[Mesh]) AND (“2005/03/01”[PDat]: “2015/02/26”[PDat] AND “humans”[MeSH Terms])
LILACS
Enfermedad de Chagas OR Doença de Chagas OR Trypanosomiasis, South American OR Tripanosomiasis Sudamericana OR Tripanosomiasis Americana OR Tripanossomíase Sul-Americana OR Tripanossomose Sul-Americana OR Tripanossomíase Americana [Palavras] and quality OR calidad OR qualidade OR PEEC OR EQAS [Palavras] and diagnostico OR diagnosis OR tamizaje OR screening OR Triagem OR screening [Palavras]
EMBASE
‘chagas disease’/exp OR ‘chagas disease’ AND quality AND (diagnosis OR screening).
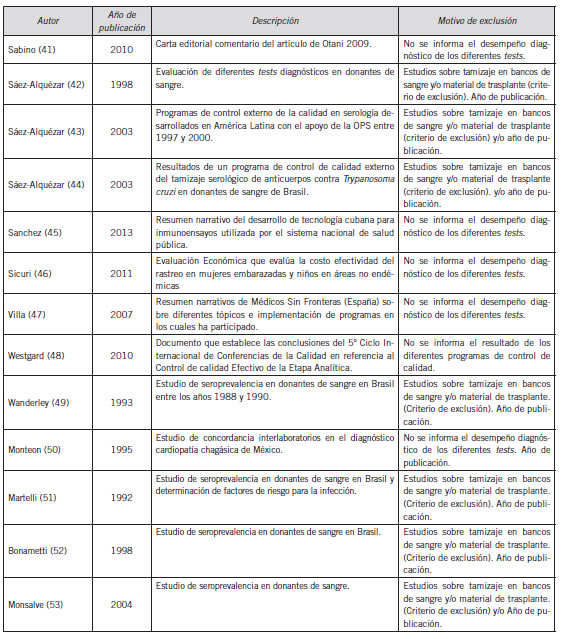
Anexo II Tabla de estudios excluidos

Referencias bibliográficas
1. Organización Mundial de la Salud. La enfermedad de Chagas (Tripanosomiasis americana): Nota descriptiva N°340; 2016. Disponible en: URL: http://www.who.int/mediacentre/factsheets/fs340/es/. (Fecha de acceso: 10 de febrero de 2016). [ Links ]
2. Requena-Mendez A, Angheben A, Munoz J. Screening of Chagas disease in migrants from Latin America in Europe. Trop Med Int Health 2013; 18: 44-5. [ Links ]
3. Basile L, Jansa JM, Carlier Y, Salamanca DD, Angheben A, Bartoloni A, et al. Chagas disease in European countries: the challenge of a surveillance system. Euro Surveill 2011; 16 (37). pii: 19968. [ Links ]
4. Duffy T, Cura CI, Ramirez JC, Abate T, Cayo NM, Parrado R, et al. Analytical performance of a Multiplex Real- Time PCR Assay using TaqMan probes for quantification of Trypanosoma cruzi satellite DNA in blood samples. PLoS Negl Trop Dis 2013; 7 (1). pe: 2000. [ Links ]
5. Ministerio de Salud de la Nación Argentina. Guías para la atención al paciente infectado con Trypanosoma cruzi (Enfermedad de Chagas); 2012. Disponible en URL: http://www.msal.gov.ar/chagas/images/stories/Equipos/Guia_Nacional_Chagas_version_27092012.pdf.(Fecha de acceso: 10 de febrero de 2016). [ Links ]
6. Gomes YM, Lorena VM, Luquetti AO. Diagnosis of Chagas disease: what has been achieved? What remains to be done with regard to diagnosis and follow up studies? Mem Inst Oswaldo Cruz 2009; 104: 115-21. [ Links ]
7. Otani MM, Vinelli E, Kirchhoff LV, del Pozo A, Sands A, Vercauteren G, et al. WHO comparative evaluation of serologic assays for Chagas disease. Transfusion 2009; 49 (6): 1076-82. [ Links ]
8. Sanchez-Camargo CL, Albajar-Vinas P, Wilkins PP, Nieto J, Leiby DA, Paris L, et al. Comparative evaluation of 11 commercialized rapid diagnostic tests for detecting Trypanosoma cruzi antibodies in serum banks in areas of endemicity and nonendemicity. J Clin Microbiol 2014; 52 (7): 2506-12. [ Links ]
9. Organización Panamericana de la Salud. Estimación cuantitativa de la enfermedad de Chagas en las Americas. Quantitative estimate of Chagas disease in the Americas. Report no: OPS/HDM/CD/ 425-06:6). Washington: PAHO; 2006. Spanish. Disponible en URL: http://www.bvsops.org.uy/pdf/chagas19.pdf. (Fecha de acceso: 10 de febrero de 2016). [ Links ]
10. Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med 2011; 155 (8): 529-36. [ Links ]
11. Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol 2003; 3: 25. [ Links ]
12. Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol 2011; 64 (4): 383-94. [ Links ]
13. Brasil PE, De Castro L, Hasslocher-Moreno AM, Sangenis LH, Braga JU. ELISA versus PCR for diagnosis of chronic Chagas disease: systematic review and meta-analysis. BMC Infect Dis 2010; 10: 337. [ Links ]
14. Afonso AM, Ebell MH, Tarleton RL. A Systematic review of high quality diagnostic tests for Chagas Disease. PLoS Negl Trop Dis 2012; 6 (11): e 1881. [ Links ]
15. Duarte LF, Florez O, Rincon G, Gonzalez CI. Comparison of seven diagnostic tests to detect Trypanosoma cruzi infection in patients in chronic phase of Chagas disease. Colomb Med (Cali) 2014; 45 (2): 61-6. [ Links ]
16. Ferrer E, Lares M, Viettri M, Medina M. Comparación entre técnicas inmunológicas y moleculares para el diagnóstico de la enfermedad de Chagas. Enferm Infecc Microbiol Clin 2013; 31 (05): 277-82. [ Links ]
17. Chappuis F, Mauris A, Holst M, Vinasv PA, Jannin J, Luquetti A, et al. Validation of a rapid immunochromatographic assay for the diagnosis of Trypanosoma cruzi infection among Latin American immigrants in Geneva, Switzerland. Trop Med Int Health 2009; 14: 178-9. [ Links ]
18. López-Chejade P, Roca C, Posada E, Pinazo MJ, Gascon J, Portús M. Utilidad de un test inmunocromatográfico para el cribado de la enfermedad de Chagas en asistencia primaria. Enferm Infecc Microbiol Clin 2010; 28 (03): 169-71. [ Links ]
19. Mendicino D, Stafuza M, Colussi C, del Barco M, Streiger M, Moretti E. Diagnostic reliability of an immunochromatographic test for Chagas disease screening at a primary health care centre in a rural endemic area. Mem Inst Oswaldo Cruz 2014; 109 (8): 984-8. [ Links ]
20. Schijman AG, Bisio M, Orellana L, Sued M, Duffy T, Mejia Jaramillo AM, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis 2011; 5 (1): e931. [ Links ]
21. Ramirez JC, Cura CI, Moreira OC, Lages-Silva E, Juiz N, Velazquez E. Analytical validation of quantitative real-time PCR methods for quantification of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. J Mol Diagn 2015; 17 (5): 605-15. [ Links ]
22. Cura CI, Ramírez JC, López Albizu C, Scollo K, Sosa- Estani S. Transferencia de Estrategias Moleculares para el diagnóstico de Chagas Congénito al Sistema Sanitario Público Nacional: Ensayo de Implementación. Actas de la 27º Reunión Anual Sociedad Argentina de Protozoología; 2015, Nov 15-17 Buenos Aires, Argentina. [ Links ]
23. Cura EN, Segura EL. Quality assurance of the serologic diagnosis of Chagas’ disease. Pan Am J Public Health 1998; 3 (4): 242-8.
24. Illa CC, D’Agostino L, Willie JC, Mazziotta D. Evaluación externa de calidad para el diagnóstico serológico de la enfermedad de Chagas: 3 años de evolución. Acta Bioquím Clín Latinoam 2005; 39: 355-7.
25. Laboratorio Nacional de Referencia de Parasitología. Subprograma de serología de Enfermedad de Chagas N°52: Evaluación de Reactivos Comerciales para el diagnóstico serológico de la infección por Trypanosoma cruzi, período 2000 - 2014. Ministerio de Salud de Chile; 2013. Disponible en: URL: http://www.ispch.cl/sites/default/files/u20/info%20Evaluaci%C3%B3n%20de%20reactivos%20Comerciales_2014_0.pdf. (Fecha de acceso: 10 de febrero de 2015). [ Links ]
26. Agapova M, Busch MP, Custer B. Cost-effectiveness of screening the US blood supply for Trypanosoma cruzi. Transfusion 2010; 50 (10): 2220-32. [ Links ]
27. Apt BW, Heitmann GI, Jercic LMI, Jotre ML, Munoz CdVP, Noemi HI, et al. Guidelines for Chagas disease: Part III. Chagas disease in donors to blood banks. Rev Chilena Infectol 2008; 25 (4): 285-8. [ Links ]
28. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al. Congenital Chagas disease: recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis 2011; 5 (10): e1250. [ Links ]
29. Chin-Hong PV, Schwartz BS, Bern C, Montgomery SP, Kontak S, Kubak B, et al. Screening and treatment of chagas disease in organ transplant recipients in the United States: recommendations from the chagas in transplant working group. Am J Transplant 2011; 11 (4): 672-80. [ Links ]
30. Cooley G, Etheridgel RD, Boehlke C, Bundy B, Weatherly DB, Minning T, et al. High throughput selection of effective serodiagnostics for Trypanosoma cruzi infection. PLoS Negl Trop Dis 2008; 2 (10): 1-12. [ Links ]
31. Duffy T, Cura CI, Ramirez JC, Abate T, Cayo NM, Parrado R, et al. Analytical performance of a multiplex real-time PCR assay using taqman probes for quantification of Trypanosoma cruzi Satellite DNA in blood samples. PLoS Negl Trop Dis 2013; 7 (1). [ Links ]
32. Gadelha AA, Vercosa AF, Lorena VM, Nakazawa M, Carvalho AB, Souza WV, et al. Chagas’ disease diagnosis: comparative analysis of recombinant ELISA with conventional ELISA and the haemagglutination test. Vox Sang 2003; 85 (3): 165-70.
33. Kitchen AD, Hewitt PE, Chiodini PL. The early implementation of Trypanosoma cruzi antibody screening of donors and donations within England: preempting a problem. Transfusion 2012; 52 (9): 1931-9. [ Links ]
34. Lima LMD, Alves NP, Barbosa VdF, Pimenta GA, Moraes- Souza H, Martins PRJ. Prevalence of Chagas disease in blood donors at the Uberaba Regional Blood Center, Brazil, from 1995 to 2009. Prevalência da doença de Chagas em doadores de sangue do Hemocentro Regional de Uberaba, Brasil, entre 1995 e 2009. Rev Soc Bras Med Trop 2012; 45 (6): 723-6. [ Links ]
35. Lucey C, Weina PJ. Applying the STARD (Standards for Reporting of Diagnostic Accuracy) checklist to the 2007 Transfusion article ‘Evaluation of a new enzyme-linked immunosorbent assay for detection of Chagas antibody in US blood donors’. Trans R Soc Trop Med Hyg 2008; 102 (2): 155-60.
36. International meeting: new diagnostic tests are urgently needed to treat patients with Chagas disease. Rev Soc Bras Med Trop 2008; 41 (3): 315-9. [ Links ]
37. Menitove JE, Bennett JL, Sher G. Lessons learned from Trypanosoma cruzi test implementation. Transfusion 2012; 52 (9): 1849-51. [ Links ]
38. Minneman RM, Hennink MM, Nicholls A, Salek SS, Palomeque FS, Khawja A, et al. Barriers to testing and treatment for Chagas disease among Latino immigrants in Georgia. J Parasitol Res 2012; 2012, ID 295039; p. 1-11. [ Links ]
39. Ostermayer AL, Passos ADC, Silveira AC, Ferreira AW, Macedo V, Prata AR. O inquérito nacional de soroprevalência de avaliação do controle da doença de Chagas no Brasil (2001-2008). The National Survey of Seroprevalence for Evaluation of the Control of Chagas Disease in Brazil (2001-2008). Rev Soc Bras Med Trop 2011; 44 (supl.2): 108-21. [ Links ]
40. Ramos-Rincon JM, Milla-Jover A, Rodriguez-Diaz JC, Gutierrez-Rodero F. Evaluation of the grade of application of the recommendations of screening for Chagas disease in pregnant women. Rev Clin Esp 2012; 212 (7): 366-8. [ Links ]
41. Sabino EC, Otani MM, Vinelli E, Del Pozo A, Sands A, Vercauteren G, et al. Re: “WHO evaluation of the serologic assays for Chagas disease”. Transfusion 2010; 50 (11): 2507-8.
42. Saez-Alquezar A, Otani MM, Sabino EC, Ribeiro-dos- Santos G, Salles N, Chamone DF. Evaluation of the performance of Brazilian blood banks in testing for Chagas’ disease. Vox Sang 1998; 74 (4): 228-31.
43. Saez-Alquezar A, Otani MM, Sabino EC, Salles NA, Chamone DF. External serology quality control programs developed in Latin America with the support of PAHO from 1997 through 2000. Rev Panam Salud Publica 2003; 13 (2-3): 91-102. [ Links ]
44. Sáez-Alquézar A, Murta M, Marques WP, Silva GRd. Resultados de un programa de control de calidad externo del tamizaje serológico de anticuerpos contra Trypanosoma cruzi en donantes de sangre de Brasil. Rev Panam Salud Pública 2003; 13 (2/3): 129-37. [ Links ]
45. Sánchez A, Gorry C. El diagnóstico inmunológico: convergencia de la biotecnología y la salud pública. MEDICC Rev 2013 Jan; 15 (1) 44-7. [ Links ]
46. Sicuri E, Munoz J, Pinazo MJ, Posada E, Sanchez J, Alonso PL, et al. Economic evaluation of Chagas disease screening of pregnant Latin American women and of their infants in a non endemic area. Acta Trop 2011; 118 (2): 110-7. [ Links ]
47. Villa L, Morote S, Bernal O, Bulla D, Albajar-Vinas P. Access to diagnosis and treatment of Chagas disease/infection in endemic and non-endemic countries in the XXI centuryien. Mem Inst Oswaldo Cruz 2007; 102 (supl.1): 87-94. [ Links ]
48. Westgard J, Mercapide L, Saez-Alquezar A, Porras A, Martínez O, Amaya E, et al. Cómo garantizar la calidad analítica. Rev Latinoam Patol Clin 2010; 57 (4): 179-89. [ Links ]
49. Wanderley DM, Gonzales TT, Pereira MSCA, Nascimento RD, Souza HM. Controle da hemoterapia e da doença de Chagas transfusional: 1988 e 1990. Rev Saúde Pública 1993; 27 (6): 430-5. [ Links ]
50. Monteon VM, Guzman-Bracho C, Floriani-Verdugo J, Ramos-Echevarria A, Velasco-Castrejon O, Reyes PA. Serological diagnosis of Chagas disease: self-sufficiency and interlaboratory concordance. Salud Pública Méx 1995; 37 (3): 232-5. [ Links ]
51. Martelli CM, Andrade AL, Silva SA, Zicker F. Risk factors for Trypanosoma cruzi infection among blood donors in central Brazil. Mem Inst Oswaldo Cruz 1992; 87 (3): 339-43. [ Links ]
52. Bonametti AM, Castelo Filho A, Ramos LR, Baldy JLdS, Matsuo T. Infecçäo por Trypanosoma cruzi em candidatos a doador de sangue. Rev Saúde Pública 1998; 32 (6): 566-71. [ Links ]
53. Monsalve PY, Mujica DM, Silva ER, Mirolo PM, Alvarez C, Rodríguez BC, et al. Importancia del diagnóstico de anticuerpos para Trypanosoma cruzi en donantes voluntarios mediante metodología recomendada por la OMS comparada con la utilizada en el banco de sangre “Dr. José Jesús Boada Boada” y su relación con antecedentes espidemiológicos para enfermedad de Chagas. Bol Méd Postgrado 2004; 20 (2): 107-11.
Recibido: 18 de marzo de 2016
Aceptado: 13 de diciembre de 2016














