Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Acta bioquímica clínica latinoamericana
versão impressa ISSN 0325-2957versão On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata mar. 2017
BIOQUÍMICA CLÍNICA
Complejos inmunes IgM-ApoB100 modificadas
Immune complexes IgM-modified ApoB100
Complexos Imunes IgM-ApoB100 modificadas
Julieta Guillermina Barbero1a, Juan Carlos Nicolás2b
1 Bioquímica.
2 Bioquímico. Esp. en Química Clínica.
a Laboratorio de Análisis Clínicos. Piedras 1904, 5900 Villa María, Córdoba, Argentina.
b Laboratorio de Análisis Clínicos Especializados (LACE S.A.). Av. Vélez Sarsfield 528, 5000 Córdoba, Argentina.
CORRESPONDENCIA
Bioq. JULIETA G. BARBERO Laboratorio de Análisis Clínicos Piedras 1904 5900 VILLA MARÍA, Córdoba; Argentina. E-mail: jgbarberoalvarez@gmail.com
Bioq. JUAN CARLOS NICOLÁS Laboratorio de Análisis Clínicos Especializados (LACE S.A.) Av. Vélez Sarsfield 528 5000 CÓRDOBA, Argentina
E-mail: juancanico@hotmail.com
Resumen
La aterosclerosis es la patología vascular de mayor prevalencia, lo cual motiva numerosas investigaciones sobre su fisiopatogenia. Las lipoproteínas pueden ser modificadas por mecanismos de oxidación y acetilación entre otros, a nivel de sus componentes lipídicos como proteicos, tornándose aterogénicas. Las Apolipoproteínas B100 modificadas (ApoB100m), desempeñan un rol activo en el desarrollo de las lesiones ateroscleróticas conjuntamente con otros factores de riesgo. Éstas tienen la capacidad de producir respuesta inmune llevando a la producción de anticuerpos y la subsecuente formación de complejos inmunes. La importancia de los anticuerpos contra las ApoB100m en la aterogénesis todavía no está clara, existiendo datos contradictorios respecto a si su rol es protectivo o aterogénico. Se establecieron dos objetivos: Determinar los niveles de complejos inmunes circulantes IgM-ApoB100m por enzimoinmunoanálisis, en sujetos normales (sin riesgo aterogénico) y pacientes con alto riesgo y establecer su correlación con los factores de riesgo aterogénico ya establecidos, mediante un estudio observacional transversal. Se obtuvieron valores medios más elevados de IgM-ApoB100m en el grupo de sujetos normales. Los complejos inmunes IgM-ApoB100m correlacionan negativamente con los factores de riesgo aterogénicos clásicos (sexo masculino, avanzada edad, dislipemia, LDL-C aumentado y HDL-C disminuido).
Palabras clave: Complejos inmunes; Inmunoglobulina M; apoB100; Aterosclerosis.
Abstract
Atherosclerosis is the most prevalent vascular disease, which motivates extensive research on its pathogenesis. Lipoproteins can be modified by acetylation and oxidation mechanisms, at the level of lipid components as protein, becoming atherogenic. Modified Apolipoprotein B100 (ApoB100m), play an active role in the development of atherosclerotic lesions in conjunction with other risk factors. These have the ability to produce immune response leading to antibody production and subsequent formation of immune complexes. The importance of antibodies against ApoB100m in atherogenesis is still unclear since, contradictory data exist on whether their role is protective or atherogenic. Two objectives were established: to determine the levels of circulating immune complexes IgM-ApoB100m by enzyme immunoassay, in normal subjects (without atherogenic risk) and high-risk patients and to establish its correlation with atherogenic risk factors established by a cross-sectional study. Higher mean values of IgM-ApoB100m were obtained in the group of normal subjects. Immune complexes IgM-ApoB100 negatively correlated with classic atherogenic risk factors (male, older, dyslipidemia, increased LDL-C and decreased HDL-C).
Keywords: Immune complex; Immunoglobulin M; apoB100; Atherosclerosis.
Resumo
A aterosclerose é a doença vascular mais prevalente, o que motiva numerosas pesquisas sobre sua patogênese. As lipoproteínas podem ser modificadas por meio de mecanismos de oxidação e de acetilação entre outros, em nível de seus componentes lipídicos como proteicos, tornando-se aterogênicas. As apolipoproteínas B100 modificadas (ApoB100m), desempenham um papel ativo no desenvolvimento de lesões ateroscleróticas em conjunto com outros fatores de risco. Elas têm a capacidade de produzir resposta imune que conduz à produção de anticorpos e subsequente formação de complexos imunes. A importância de anticorpos contra a ApoB100m na aterogênese ainda não é clara, existindo dados contraditórios sobre se seu papel é de proteção ou aterogênico. Foram estabelecidos dois objetivos. Determinar os níveis de complexos imunes circulantes IgM-ApoB100m por enzimoimunoanálise em indivíduos normais (sem risco aterogênico) e pacientes de alto risco e, estabelecer sua correlação com os fatores de risco aterogênico já estabelecidos por um estudo Observacional Transversal. Foram obtidos valores médios mais elevados de IgM-ApoB100m no grupo de indivíduos normais. Os complexos imunes IgM-ApoB100 correlacionam negativamente com os fatores de risco aterogênicos clássicos (sexo masculino, idosos, dislipidemia, LDL-C aumentado e HDL-C diminuído).
Palavras-chave: Complexos imunes; Imunoglobulina M; apoB100; Ateroesclerose.
Introducción
Las enfermedades cardiovasculares son consideradas la mayor causa de morbilidad y mortalidad a nivel mundial (1) (2). La aterosclerosis es la patología vascular de mayor prevalencia, lo cual ha motivado innumerables investigaciones destinadas a conocer los mecanismos que la producen a fin de dilucidar estrategias de prevención o tendientes a disminuir su progresión (3) (4). Es un proceso inflamatorio de la pared arterial, en el que se observa una acumulación de macrófagos, linfocitos T activados y neutrófilos, en los sitios de injuria (4) (5). Los factores predisponentes como sexo masculino, edad avanzada, dislipemia, hipertensión arterial, diabetes, obesidad, sedentarismo, tabaquismo, etc., producen alteraciones del endotelio vascular el cual recluta células inflamatorias. Estas células son responsables del engrosamiento de la pared arterial, lo cual reduce su calibre efectivo, y de la formación de trombos, los cuales son responsables de las manifestaciones de morbilidad y mortalidad relacionadas a la patología (6-10).
La fracción lipídica y proteica constituyente de las lipoproteínas, particularmente las de baja, intermedia y muy baja densidad (LDL, IDL y VLDL) pueden ser modificadas. Los principales mecanismos, oxidación (ox) o acetilación (ac) inducen cambios en estas partículas, las cuales, cuando extravasan hacia la capa íntima de la pared arterial de un vaso cuyo endotelio se encuentra alterado, desempeñan un rol activo en el desarrollo de las lesiones ateroscleróticas, conjuntamente con otros factores de riesgo (5) (8) (10-14). Estas partículas lipoproteicas modificadas no pueden ser reconocidas por su receptor natural (LDLR-ApoE), siendo captadas por macrófagos mediante receptores scavengers (CD36, LOX, SR-A y SR-B), dando origen a células espumosas, mecanismos de citotoxicidad celular, expresión de moléculas de adhesión y proliferación celular (3) (5) (15-17). Las lipoproteínas modificadas constituyen un grupo heterogéneo de partículas con características proinflamatorias e inmunogénicas, pudiendo iniciar la respuesta humoral y mediada por células, induciendo la activación de macrófagos, los que producen sobreexpresión de moléculas del complejo mayor de histocompatibilidad, citoquinas y quimiocinas (5-8) (10-12) (14). La capacidad de producir respuesta inmune lleva a la producción de anticuerpos y a la subsecuente formación de complejos inmunes. En trabajos previos se estableció que los anticuerpos de clase IgG (Inmunoglobulina G) contra las lipoproteínas modificadas en suero humano y la formación de complejos inmunes, estimulan la acumulación de ésteres de colesterol en macrófagos del endotelio vascular, lo cual da lugar a la formación de las células espumosas (3) (7) (8) (16) (17). Por el contrario, los complejos formados por anticuerpos de clase IgM demostraron ser protectores (18).
La propia infección por HIV genera dislipemia debido a la acción de citoquinas proinflamatorias como IFN, TNF-α e IL-1. El tratamiento antirretroviral de alta eficacia -HAART- (contra el virus de la inmunodeficiencia humana, HIV), produce alteraciones en la concentración de lípidos plasmáticos (hiperlipemia), caracterizada por la elevación de los niveles de lipoproteína de muy baja densidad (VLDL), lipoproteínas de densidad intermedia (IDL), triglicéridos, colesterol total, lipoproteína de baja densidad (LDL) y la disminución de los niveles de lipoproteínas de alta densidad (HDL) (19) (20-23), por lo cual, el perfil lipídico proaterogénico en personas con HIV/SIDA sumado al tratamiento antirretroviral constituyen un alto riesgo para el desarrollo de enfermedad coronaria.
La importancia de los anticuerpos contra las lipoproteínas modificadas en la aterogénesis todavía no está clara, existiendo datos contradictorios respecto a su rol protectivo o proaterogénico (6-8) (11) (24-29).
Se establecieron dos objetivos: determinar los niveles de complejos inmunes circulantes inmunoglobulina M-Apolipoproteína B100 modificadas (IgM-ApoB100m); y correlacionarla con los factores de riesgo aterogénico ya establecidos mediante un estudio observacional transversal. Los grupos de contraste fueron sujetos sanos, normolipémicos sin riesgo de ateroesclerosis, frente a pacientes dislipémicos HIV-positivos en tratamiento antirretroviral de más de un año de duración.
Materiales y Métodos
TIPO DE ESTUDIO
Se llevó a cabo un estudio de tipo observacional transversal.
POBLACIÓN DE ESTUDIO Y MUESTRAS
Se tomaron muestras de sangre en personas en ayunas, por punción venosa de la región anterocubital (n=110), mediante el sistema Vacutainer® (BD). Las muestras fueron centrifugadas y el suero separado y guardado a -70 °C hasta su análisis. La población consistió en dos grupos previamente seleccionados:
– Pacientes: Sesenta pacientes HIV(+), hombres y mujeres, entre 18 y 79 años de edad, sometidos a tratamiento antirretroviral de alta eficacia (HAART) durante al menos un año, en ausencia de alguna otra patología.
– Controles: Ciento dos sujetos sanos, hombres y mujeres, entre 21 y 60 años de edad, sin tratamiento antirretroviral ni hipolipemiante en el último año, con niveles normales de colesterol total (CT<200 mg/dL), HDL colesterol (HDL-C>40 mg/dL para hombres y HDL-C>50 mg/dL para mujeres), LDL colesterol (LDL-C<130 mg/dL) y triglicéridos (TG<150 mg/dL). Se excluyeron pacientes diabéticos (glucosa>110 mg/dL), con enfermedad hepática (ALT y AST>50 U/L.), enfermedad renal (creatinina sérica>1,3 mg/dL) o cualquier otro tipo de patología conocida.
ASPECTOS ÉTICOS
El estudio fue regido por Normas de Buenas Prácticas Clínicas (GCP-ICH) de acuerdo con lo establecido en la Declaración de Helsinki y sus modificaciones posteriores. El protocolo de investigación fue aprobado por el Comité Institucional de Ética en Investigación de Salud (CIEIS Oulton - Romagosa). Registro Provincial de Investigación en Salud (RePIS) Número 2845 (02/03/2016). Los individuos reclutados firmaron el formulario de Consentimiento Informado (Versión 3.3–Diciembre 2015).
PARÁMETROS ANALÍTICOS
Colesterol total, triglicéridos, colesterol de lipoproteínas de alta densidad (HDL-C), colesterol de lipoproteínas de baja densidad (LDL-C), glucosa, creatinina, AST (aspartatoaminotransferasa), ALT (alaninaaminotransferasa). Se utilizó un analizador c501COBAS6000® (Roche), con reactivos comerciales según indicación del fabricante.
Datos biomédicos relevados: Presión arterial sistólica (PAS), consumo de hipolipemiantes o antihipertensivos y hábito de fumar. Cálculo de Riesgo Cardiovascular (Score Framingham a 10 años - http://www.cvriskcalculator.com)
DETERMINACIÓN DE COMPLEJOS INMUNES IgM-ApoB100m
La determinación de Complejos Inmunes (IgM-ApoB100m) se realizó mediante técnica de enzimoinmunoensayo (ELISA). Brevemente, se utilizaron placas para ELISA alta capacidad de adsorción (Kartell®Labware; Italia), las cuales fueron sensibilizadas a 4 °C toda la noche, con 100 μL/pocillo de anticuerpo anti-apolipoproteína B100 (Roche®), en dilución final 1:10 con solución fisiológica. Después de 5 lavados con 250 μL/pocillo de buffer fosfato salino (PBS), las placas fueron bloqueadas durante 2 horas a temperatura ambiente con 200 μL/pocillo de buffer fosfato salino–albúmina bovina (1%).
Las muestras de suero utilizadas en el estudio fueron diluidas 1:50 con PBS–albúmina bovina (1%). De las respectivas diluciones, 100 μL/pocillo fueron incubados por duplicado (n=2 para cada muestra) durante 3 horas a temperatura ambiente. Después de 5 lavados con 250 μL/pocillo de PBS, 100 μL/pocillo de IgM anti-humana conjugadas con Peroxidasa (Orgentec®) fueron adicionados e incubados durante 30 minutos a temperatura ambiente. Nuevamente se realizaron 5 lavados con 250 μL/pocillo de PBS; se agregaron 100 μL/pocillo de sustrato TMB/H2O2 (Orgentec®). Después de 15 minutos de incubación al abrigo de la luz, la reacción fue detenida por adición de 100 μL/pocillo de solución de HCl 1,0 M. La determinación de las lecturas de absorbancia se realizó antes de los 60 minutos a 450 nm en un lector de placas ELISA (Biotek®Mod. ELX800). Los resultados fueron expresados como la media de las densidades ópticas para cada muestra.
ANÁLISIS ESTADÍSTICO
Para realizar el análisis estadístico se determinaron las variables cuantitativas: media, mediana, desviación estándar, comparación no paramétrica de poblaciones (Mann-Whitney Test) empleando el paquete estadístico InfoStat®. Se consideraron diferencias significativas entre las medias cuando el valor p<0,05.
Resultados
Las variables analizadas para ambos grupos se detallan a continuación (Tabla I).
Tabla I. Descripción poblacional.

Los resultados obtenidos muestran diferencias significativas en las poblaciones (controles y pacientes) respecto a las variables triglicéridos, HDL-C y Score de Framingham. Cuando ambos grupos se subdividieron según sexo (femenino y masculino), se hallaron diferencias significativas respecto a colesterol total (F) y LDL-C (M).
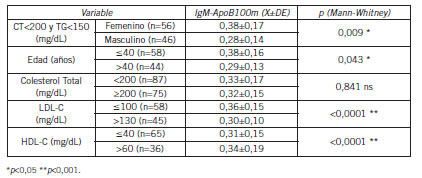
Se establecieron los niveles circulantes de IgM-ApoB100m contrastando factores de riesgo, previamente considerados como proaterogénicos o antiaterogénicos. Los factores considerados fueron: sexo (masculino versus femenino, ambos grupos normolipémicos); edad (£40 años versus >40 años); colesterol total (<200 mg/dL versus ≥200 mg/dL); LDL-C (£100 mg/dL versus >130 mg/dL) y HDL-C (£40 mg/dL versus >60 mg/dL) (Tabla II).
Tabla II. Niveles circulantes de IgM-ApoB100m según factores de riesgo.
La infección por HIV genera dislipemia debido a la acción de citoquinas proinflamatorias; además, el tratamiento antirretroviral de alta eficacia -HAART- produce alteraciones en la concentración de lípidos plasmáticos, lo cual representa un estado proaterogénico ya establecido. Se evaluó si existen diferencias en los niveles de IgM-ApoB100m contrastando controles versus pacientes. Como indicador de riesgo cardiovascular (RCV) se utilizó el Score Framingham a 10 años (Tabla III).
Tabla III. Concentración de IgM-LDLm según el RCV en controles y pacientes.

El grupo de pacientes con mayor riesgo cardiovascular (Score de Framingham más elevado, p<0,0001), presenta valores medios más bajos de IgM-ApoB100m.
Discusión y Conclusiones
Actualmente no se realizan investigaciones sobre complejos inmunes de lipoproteínas o sus fracciones lipídicas o proteicas, modificadas (27), en parte porque se dispone de otros marcadores de riesgo cardiovascular y, además, hasta el momento la significación clínica de los mismos resulta contradictoria (24). Los componentes lipídicos y proteicos pueden ser modificados, mecanismo por el cual las lipoproteínas modificadas ya no pueden ser reconocidas por su receptor natural, escapando a los mecanismos fisiológicos de regulación (7) (8) (11) (14) (15) (27). Las lipoproteínas de baja densidad modificadas (LDLm) constituyen un grupo heterogéneo de partículas con características proinflamatorias e inmunogénicas y la subsiguiente capacidad de inducir respuesta inmune, llevando a la producción de autoanticuerpos (3) (7) (8) (26) (27). Sistemáticamente, todos los trabajos realizados determinan autoanticuerpos o complejos inmunes de LDLm; en este trabajo se determinaron complejos inmunes IgM-ApoB100m, debido a que la participación de apoproteína B100 no se restringe a las LDL, sino que también está presente en lipoproteínas de densidad intermedia (IDL) y lipoproteínas de muy baja densidad (VLDL), las cuales transportan triglicéridos endógenos con características aterogénicas directas e indirectas (25) (30).
Existen datos contradictorios respecto al rol protectivo o proaterogénico de los anticuerpos contra las lipoproteínas modificadas (24) (25) (28) (29).
Las hipótesis planteadas en este trabajo observacional y transversal pretenden dar respuesta al comportamiento de IgM-ApoB100m; para ello se determinaron los niveles en conjunto con variables previamente conocidas como pro o antiaterogénicas (1) (2) (6) (12) (20) (26) (31). Tanto el sexo masculino como el aumento de la edad son factores de riesgo cardiovascular fehacientemente determinados con anterioridad (9). La determinación de IgM-ApoB100m en grupos de pacientes normolipémicos divididos por sexo (femenino versus masculino) y por rango de edad (£40 años versus >40 años), demostró que los valores medios de IgM-ApoB100m son más elevados en los estados de menor riesgo cardiovascular (sexo femenino y edad £40 años), conclusión previamente establecida por otros (29) (31).
La dislipemia constituye uno de los factores con mayor influencia sobre el riesgo cardiovascular (1) (2) (6) (12) (20) (29) (31). Se realizó la determinación de IgM-ApoB100m en diferentes perfiles lipídicos (normolipémicos versus dislipémicos), contrastando grupos de ambos sexos y rango de edades (18–77 años), de las variables colesterol total (CT<200 mg/dL versus ³200 mg/dL); LDL-C (LDL-C£100 mg/dL versus LDL-C>130 mg/dL) y HDL-C (HDL-C£40 mg/dL versus HDL-C>60 mg/dL). Los resultados revelan diferencias significativas en los niveles medios de IgM-ApoB100m, siendo más elevados en los grupos con menor riesgo cardiovascular relacionado a la dislipemia (LDL-C£100 mg/dL y HDL-C>60 mg/dL), no hallándose diferencia relacionada al nivel de colesterol total (CT<200 mg/dL versus CT³200 mg/dL). Este hallazgo concuerda con datos publicados previamente (24)(32)(33) donde los niveles elevados de IgM-ApoB100m correlacionan con menor riesgo cardiovascular (18).
La hipótesis final de estos autores consistió en determinar los niveles de IgM-ApoB100m en grupos diferenciados respecto al riesgo cardiovascular. Para ello se seleccionó un grupo control, ambos sexos, rango de edades 18–77 años, normolipémicos (CT<200 mg/dL y TG<150 mg/dL) y bajo riesgo cardiovascular (Score Framingham 3,4±2,8). El grupo contraste (pacientes) consistió en infectados por HIV de más de un año de evolución y con tratamiento antirretroviral instaurado. Como se demostró anteriormente, la infección por HIV y el propio tratamiento, generan dislipemia conduciendo a un estado de elevado riesgo cardiovascular (21-23). La concentración media de IgM-ApoB100m resultó significativamente más elevada en el grupo control de menor riesgo cardiovascular determinado por Score de Framingham, hallazgo concordante a publicaciones previas (24)( 25)(29)(31-33).
De los hallazgos experimentales se concluye que IgM-ApoB100m presenta correlación inversa con los factores de riesgo cardiovascular. La menor concentración de complejos inmunes, y por lo tanto ApoB100m, probablemente se debe a una rápida depuración del complejo por el sistema retículo endotelial. Al mismo tiempo, la unión de IgM conduciría a la formación de complejos inmunes cuyo tamaño molecular restringe la capacidad de extravasar hacia el espacio subendotelial o podría bloquear estéricamente la interacción de ApoB100m con receptores scavenger, limitando el ingreso celular y formación de la placa de ateroma. IgM-ApoB100m constituye una herramienta adicional útil para la evaluación del riesgo cardiovascular en conjunto con otros marcadores previamente establecidos.
AGRADECIMIENTOS
Los autores agradecen a la Dra. Laura Giordanengo, al Bioq./ Far. Maribel Martinez-Wassaf, a la Bioq. Esp. Silvia Barzón, a la Srta. Florencia Siragura y a la Sra. Soledad Olivetti.
1. Jamison DT, Breman JG, Measham AR, Alleyne G, Claeson M et al. Disease Control Priorities in Developing Countries. 2nd ed. The World Bank, New York: Oxford University Press; 2006 [ Links ]
2. Go AS, Mozaffarian D, Roger VL, Dai S, Ford ES, Fox CS, et al. Heart Disease and Stroke Statistics - 2014 Update: A report from the American Heart Association. Circulation 2013; 129: e28-e292. [ Links ]
3. Wolf D, Stachon P, Bode C, Zirlik A. Inflammatory mechanisms in atherosclerosis. Hamostaseologie 2014; 34 (1): 63–71.
4. Gui T, Shimokado A, Sun Y, Akasaka T, Muragaki Y. Diverse roles of macrophages in atherosclerosis: From inflammatory biology to biomarker discovery. Mediators Inflamm 2012; 2012: 1-14. [ Links ]
5. Libby P, Lichtman A, Hansson G. Immune effector mechanisms implicated in atherosclerosis: From mice to humans. Immunity 2013; 38 (6): 1092–104.
6. Gómez M, Valle V, Arós F, Sanz G, Sala J, Fiol M, et al. Oxidized LDL, Lipoprotein (a), and other emergent risk factors in acute myocardial infarction (FORTIAM Study). Rev Esp Cardiol 2009; 62 (4): 373-82. [ Links ]
7. Li D, Mehta JL. Oxidized LDL, a critical factor in atherogenesis. Cardiovascular Research 2005; 68 (3): 353–4.
8. TomkinGH, Owens D. LDL as a cause of atherosclerosis. Atheroscler Thromb J Atheroscler Thromb 2012; 5 (1): 13–21.
9. Wang JC, Bennett M. Aging and atherosclerosis: Mechanisms, functional consequences, and potential therapeutics for cellular senescence. Circ Res 2012; 111 (2): 245–59.
10. Wang TJ. Assessing the role of circulating, genetic, and imaging biomarkers in cardiovascular risk prediction. Circulation 2011; 123 (5): 551–65.
11. Gleissner CA, Leitinger N, Ley K. Effects of native and modified low-density lipoproteins on monocyte recruitment in atherosclerosis. Hypertension 2007; 50 (2): 276–83.
12. The Emerging Risk Factors Collaboration. Major Lipids, Apolipoproteins, and Risk of Vascular Disease - supplementary online content. JAMA 2009; 302 (18): 1993– 2000.
13. Estronca LMBB, Silva JCP, Sampaio JL, Shevchenko A, Verkade P, Vaz ADN, et al. Molecular etiology of atherogenesis-in vitro induction of lipidosis in macrophages with a new LDL model. PLoS One 2012; 7 (4). [ Links ]
14. Badimon L, Storey RF, Vilahur G. Update on lipids, inflammation and atherothrombosis. Thromb Haemost 2011; 105 (SUPPL. 1): 34–42.
15. Febbraio M, Hajjar DP, Silverstein RL. CD36: a class B scavenger receptor involved in angiogenesis, atherosclerosis, inflammation and lipid metabolism. J Clin Invest 2001; 108(6): 785–91.
16. Rousselle A, Qadri F, Leukel L, Yilmaz R, Fontaine JF, Sihn G, et al. CXCL5 limits macrophage foam cell formation in atherosclerosis. J Clin Invest 2013; 123 (3): 1343–7.
17. Piechota M, Banaszewska A, Dudziak J, Slomczynski M, Plewa R. Highly upregulated expression of CD36 and MSR1 in circulating monocytes of patients with acute coronary syndromes. Protein J 2012; 31(6): 511–8.
18. Fredrikson GN, Björkbacka H, Söderberg I, Ljungcrantz I, Nilsson J. Treatment with apo B peptide vaccines inhibits atherosclerosis in human apo B-100 transgenic mice without inducing an increase in peptide-specific antibodies. J Intern Med 2008; 264 (6): 563–70.
19. Peixoto D. Atherosclerosis in HIV patients : A different disease or more of the same? Atherosclerosis 2015; 240: 333–4.
20. Gopal DM, Larson MG, Januzzi JL, Cheng S, Ghorbani A, Wollert KC, et al. Biomarkers of cardiovascular stress and subclinical atherosclerosis in the community. Clin Chem 2014; 60 (11): 1402–8.
21. Castelo Elías-Calles L, González Calero T. Dislipidemia y virus de inmunodeficiencia adquirida / sida. Rev Cubana Endocrinol 2010; 21 (2): 202-22. [ Links ]
22. Grunfeld C, Delaney JAC, Wanke C, Currier JS, Scherzer R, Biggs ML, et al. Preclinical atherosclerosis due to HIV infection: carotid intima-medial thickness measurements from the FRAM study. AIDS 2009; 23 (14): 1841–9.
23. Lo J, Abbara S, Shturman L, Soni A, Wei J, Rocha-Filho J, et al. Increased prevalence of subclinical coronary atherosclerosis detected by coronary computed tomography agiography in HIV-infected men. AIDS 2010; 24 (2): 243–53.
24. Shoenfeld Y, Hon F, Wu R, Dearing LD, Matsuura E. Are Anti–Oxidized Low-Density Lipoprotein Antibodies Pathogenic or Protective? Circulation 2004; 110: 2552-8.
25. Fredrikson GN, Hedblad B, Berglund G, Alm R, Nilsson JÅ, Schiopu A, et al. Association between IgM against an aldehyde-modified peptide in apolipoprotein B-100 and progression of carotid disease. Stroke 2007; 38 (5): 1495–500.
26. Mironova MA, Klein RL, Virella GT, Lopes-virella MF. Immune complexes, and susceptibility of LDL to in vitro oxidation in patients with type 2 diabetes. Diabetes 49: 1033–41.
27. Gruzdeva O, Uchasova E, Dyleva Y, Belik E, Karetnikova V, Shilov A, et al. Multivessel coronary artery disease, free fatty acids, oxidized LDL and its antibody in myocardial infarction. Lipids Health Dis 2014; 13 (1): 111. [ Links ]
28. Ravandi A, Boekholdt SM, Mallat Z, Talmud PJ, Kastelein JJP, Wareham NJ, et al. Relationship of IgG and IgM autoantibodies and immune complexes to oxidized LDL with markers of oxidation and inflammation and cardiovascular events: results from the EPIC-Norfolk Study. J Lipid Res 2011; 52: 1829–36.
29. Fukumoto M, Shoji T, Emoto M, Kawagishi T, Okuno Y, Nishizawa Y. Antibodies against oxidized LDL and carotid artery intima-media thickness in a healthy population. Arter Thromb Vasc Biol 2000; 20 (3): 703–7.
30. Nordestgaard BG. Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: New insights from epidemiology, genetics, and biology. Circ Res 2016; 118 (4): 547–63.
31. Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE : A systematic review. Semin Arthritis Rheum 2013; 43 (1): 77–95.
32. Hulthe J, Wiklund O, Hurt-Camejo E, Bondjers G. Antibodies to oxidized LDL in relation to carotid atherosclerosis, cell adhesion molecules, and phospholipase A(2). Arterioscler Thromb Vasc Biol 2001; 21 (2): 269–74.
33. Fagerberg B, Gullberg UP, Alm R, Nilsson J, Fredrikson GN. Circulating autoantibodies against the apolipoprotein B-100 peptides p45 and p210 in relation to the occurrence of carotid plaques in 64-year-old women. PLoSOne 2015; 10 (3): 1–12.
Recibido: 17 de mayo de 2016.
Aceptado: 21 de octubre de 2016.














