Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.1 La Plata mar. 2017
BROMATOLOGÍA
Beneficios de la fibra dietética y poder antioxidante del salvado de arroz en ratas deficientes en Vitamina E
Benefits of fiber and antioxidant power of rice bran in Vitamin E deficient rats
Beneficios da fibra alimentar e poder antioxidante do farelo de arroz em ratos deficientes em Vitamina E
Carlos Aguilar-García1, Anna María Cioccia2, Victor Gavino3, Marlén Gutiérrez2, Patricio Hevia4
1 Doctor en Ciencia de los Alimentos, Universidad de Oriente, Núcleo de Nueva Esparta - Venezuela. Departamento de Tecnología de Alimentos.
2 Magister en Nutrición, Universidad Simón Bolívar. Caracas - Venezuela. Departamento de Procesos Biológicos y Bioquímicos.
3 PhD en Physiological Chemistry, Université de Montréal - Canada. Department of Nutrition.
4 PhD en Nutrición, Universidad Simón Bolívar. Caracas - Venezuela. Departamento de Procesos Biológicos y Bioquímicos.
CORRESPONDENCIA PATRICIO HEVIA Ph.D. Prof. Nutrición Bioquímica Departamento de Tecnología de Procesos Biológicos y Bioquímicos Universidad Simón Bolívar CARACAS, Venezuela E-mail: phevia@usb.ve
Resumen
Las recomendaciones de consumo de fibra no se cumplen y hay una necesidad por alimentos con fibra. El salvado de arroz (SA) tiene fibra y propiedades antioxidantes. Aquí se evaluaron estas propiedades en ratas suficientes (+) y deficientes (-) en Vitamina E (VitE) con o sin SA. Las ratas fueron divididas en cuatro grupos. Dos consumieron dietas +VitE y uno tenía SA. Los restantes consumieron dietas -VitE y uno tenía SA. El consumo de alimento, su eficiencia y el crecimiento, fueron similares entre los 4 grupos pero la masa fecal húmeda o seca fue 3 veces superior en los SA+. La hemoglobina en sangre y el hierro hepático fueron similares entre grupos, pero en los grupos (SA-) la VitE hepática fue 10 veces menor en las ratas -VitE que en las +VitE. Sin embargo, en las ratas -VitE/SA+, la VitE hepática fue sólo 2,6 veces menor. Este efecto del SA también se detectó en los eritrocitos, ya que la catalasa y la glutatión reductasa aumentaron en el grupo -VitE/SA-pero no en el grupo -VitE/SA+. El estudio muestra que SA no interfirió con el crecimiento y el metabolismo del hierro, sino que tuvo un efecto laxante y previno parcialmente la deficiencia de VitE.
Palabras clave: Salvado de arroz; Efecto laxante; Antioxidante; Vitamina E hepática en ratas; Catalasa y glutatión reductasa en eritrocitos; Deficiencia dietética de fibra.
Abstracts
Dietary fiber requirements are met by only a small fraction of the population. There is need for supplemented foods to fill this gap. Rice bran (RB) is high in fiber and has antioxidant properties. The effects of rice bran fiber on several metabolic indicators and the antioxidant capacity of rice bran in rats was reported. Rats were divided into 4 dietary groups: Vitamin E-sufficient with (+VitE/RB+) or without (+VitE/RB-) rice bran; Vitamin E-deficient with (-VitE/RB+) or without (-VitE/RB-) rice bran. Food intake, growth and feed efficiency were similar in all groups but wet and dry fecal mass of the RB+ groups were 3 times higher than the RB- groups. Blood hemoglobin and liver iron were also similar among all groups. However, the liver VitE concentration of the rats of (-VitE/RB-) group was 10x lower than the (+VitE/RB-) group. In contrast, liver VitE of the rats (-VitE/RB+) was only 2.6x lower. This effect of RB was also seen in erythrocytes since, catalase and glutathione reductase increased in the VitE deficient rats but RB prevented this increase. This study shows that dietary RB did not interfere with growth, feed efficiency and iron metabolism, it provided dietary fiber and laxation and partially prevented VitE deficiency.
Key words: Rice bran; Laxation; Antioxidant; Rat liver Vitamin E; Erythrocyte catalase and glutathione reductase; Dietary fiber gap.
Resumo
As recomendações de ingestão de fibras não são cumpridos e existe uma necessidade de alimentos ricos em fibras. Farelo de arroz (FA) tem fibra e propriedades antioxidantes. Aqui, estas propriedades foram avaliadas em ratos suficientes (+) e pobres (-) em Vitamina E (VitE) com ou sem FA. Os ratos foram divididos em 4 grupos. Dois consumiram dietas +VitE e um tinha FA. Os restantes consumiram dietas -ViteE e um tinha FA. O consumo de alimento, sua eficiência e crescimento foram semelhantes entre os 4 grupos, mas nos grupos (FA-) a VitE hepática foi 10 vezes menor nos ratos -VitE que nos +VitE. Entretanto, nos ratos -VitE/FA+, a VitE hepática foi apenas 2,6 vezes menor. Este efeito do FA também foi detectado nos eritrócitos, visto que catalase e glutationa redutase aumentaram no grupo -VitE/FA-, mas não no grupo -VitE/FA+. O estudo mostra que FA não interferiu no crescimento ou no metabolismo do ferro, porém teve um efeito laxante e impediu parcialmente a deficiência de VitE.
Palavras-chave: Farelo de arroz; Efeito laxante; Antioxidante; Vitamina E hepática em ratos; Catalase e glutationa redutase em eritrócitos; Deficiência de fibra alimentar.
Introducción
En la primera mitad del siglo XIX la dieta del humano cambió (1). Debido a nuevos descubrimientos en la industria molinera, la capacidad para remover el germen y el salvado del endospermo de los granos de cereales mejoró significativamente. Con esto, la población humana dejó de consumir granos de cereales enteros y los reemplazó por granos de cereales refinados (1). Esto tuvo consecuencias negativas, tanto desde el punto de vista nutricional como en la salud de la humanidad. Los efectos nutricionales más importantes se observaron en los países consumidores de arroz donde se reportó un significativo aumento en la incidencia de beriberi. Así, en Japón, K. Takaki observó este incremento y lo solucionó, reemplazando parte del arroz blanco presente en las raciones ofrecidas a marineros japoneses con otros alimentos (2). Asimismo, en Java, C. Eijkman demostró que en aves y humanos el reemplazo del arroz blanco por arroz integral prevenía el beriberi (3). Christian Eijkman ganó el premio Nobel en 1929 por el descubrimiento de un factor antineurítico presente en el salvado de arroz (3). Ahora se sabe que este factor es la Vitamina B1 (tiamina), cuya concentración en el arroz entero y en el salvado de arroz es aproximadamente 17 y 77 veces más alta que en el arroz pulido, respectivamente (4). La asociación entre el consumo de granos refinados y la salud la estableció Dennis Burkitt, quien en la mitad de los años 70 propuso su teoría sobre la fibra dietética (5). Esta teoría, que se basó en comparar la incidencia de las “Enfermedades Occidentales” entre África y los Estados Unidos, propone que la alta prevalencia de enfermedades cardíacas, apendicitis, enfermedad diverticular, hemorroides, cálculos biliares, la hernia al hiato, el cáncer de colon y la obesidad observada en los Estados Unidos se debía al bajo consumo de fibra.
Desde los años finales del siglo XX y comienzos del siglo XXI el conocimiento en relación con la importancia del consumo de granos de cereales enteros ha progresado mucho. Actualmente, los granos de cereales enteros, no sólo se consideran buenas fuentes de nutrientes esenciales y fibra sino que aportan, además, almidones resistentes, oligosacáridos, antioxidantes y muchos otros compuestos que puede proteger contra las enfermedades crónicas (6). Algunos de estos componentes, actuando como prebióticos, pueden cambiar la flora intestinal estimulando la proliferación de bacterias beneficiosas en el aparato gastrointestinal e incluso, actuando sobre el sistema inmune a nivel sistémico, pueden favorecer una condición general menos inflamatoria (6). Estos componentes están localizados principalmente en el salvado y el germen de los granos de cereales enteros (7). Los beneficios de los granos de cereales enteros en relación con la salud incluyen una serie de enfermedades entre las que se encuentran las enfermedades cardiovasculares, la diabetes y la respuesta a la insulina, las enfermedades digestivas, el cáncer y la obesidad (8) (9). Por esta razón, desde el punto de vista de la salud pública, la fibra y los granos de cereales enteros se consideran como alimentos prioritarios, y en consecuencia, en muchos países se han establecido niveles de consumo apropiados para asegurar que la población obtenga estos beneficios (8). Sin embargo, a nivel mundial estas recomendaciones no se cumplen, por lo que se ha considerado como una necesidad urgente, minimizar la brecha entre lo que se recomienda y lo que se consume (fiber gap) (10). Se han propuesto varias formas de hacerlo; una de ellas es agregarle a los cereales refinados la fibra perdida durante el procesamiento (10), así como agregar fibra a alimentos de consumo masivo como son el pan de sandwich o la masa de la pizza (11). Para este propósito, los salvados de cereales aparecen como una buena opción, ya que son ricos en fibra y nutrientes esenciales y además contienen una gran variedad de hidratos de carbono indigeribles, fitoquímicos y antioxidantes (12) (13). En relación con esto, el salvado de arroz es un producto interesante, ya que es muy rico en antioxidantes como tocoferoles, tocotrienoles, orizanol y otros fitoesteroles (12) (13). Además, el salvado de arroz tiene una alta concentración de fibra y se comercializa como un producto con propiedades hipolipemiantes, anticancerígenas, antioxidantes y laxantes (12) (13).
Venezuela es un país productor de arroz y prácticamente todo el salvado se utiliza para alimentación animal. Sin embargo, estudios previos (14-16) han demostrado que el salvado obtenido de una variedad de arroz venezolano conocido como Z-15 tiene un alto contenido de fibra, y una buena capacidad antioxidante determinada in vitro. Además, el estudio previo de Aguilar- García et al. (14) demostró que comparado con el arroz integral, en el salvado se concentran la mayoría de los antioxidantes (tocoferoles, tocotrienoles, ϒ-orizanol y polifenoles totales) y en consecuencia, tiene una mayor capacidad antioxidante medida in vitro determinada por varios métodos como son la capacidad para reducir el hierro (FRAP), el ácido 2,2´-azinobis-3-etilbenzotiasolin-6-sulfónico (ABTS) y la capacidad para neutralizar el radical oxígeno (ORAC). Los resultados de estos estudios mostraron además, que el FRAP fue más sensible a los polifenoles totales y a los tocotrienoles, mientras que el ORAC respondió mejor a los tocoferoles y el ABTS fue el menos sensible de todos los métodos utilizados. Estas observaciones señalan que los resultados de medir la capacidad antioxidante in vitro deben ser interpretados con cautela, especialmente cuando se mide en sistemas complejos que contienen varios tipos de antioxidantes como es el salvado de arroz. Estos resultados, en conjunto con nuevas observaciones en el área de la fibra y los granos de cereales enteros que sugieren que su asociación con un mejor estado de salud podría estar relacionada con sus efectos sobre la microbiota intestinal (6) (7) y/o el efecto de algunos antioxidantes sobre la expresión genética (17), motivaron el presente estudio. En él se reporta el efecto del salvado de arroz sobre varios aspectos del sistema antioxidante en ratas alimentadas con dietas suficientes (+VitE) y deficientes (-VitE) en vitamina E, como son: la VitE hepática, sustancias reactivas al ácido tiobarbitúrico (TBARS) en suero e hígado y la actividad de enzimas antioxidantes en eritrocitos. Además, se estudió el efecto del consumo de salvado de arroz sobre la ingesta de alimento y el crecimiento, la masa fecal y el metabolismo del hierro.
Materiales y Métodos
PREPARACIÓN DEL SALVADO DE ARROZ
La muestra de salvado de arroz usada en este estudio se preparó a partir de arroz con cáscara de la cepa Zeta-15 (Z-15) obtenida de la “Asociación Venezolana de Productores de Arroz”, con sede en Acarigua, Estado Portuguesa, Venezuela. Del arroz con cáscara Z-15 (humedad 12±1%) se produjo arroz integral en un “Mini Tester Husker (Rimac MTH-35A)” de Rice Machinery Supply Corp., Hialeah Gardens. Fl. EE.UU). El salvado se obtuvo después de pulir el arroz integral en un pulidor (Grainman 60-115-60-2H5), de la “Douglas International Corp”. Coral Gables Fl. EE.UU). El arroz pulido sirvió para otros estudios, mientras que el salvado de arroz recuperado se cernió usando un cedazo ASTM de 60 mallas con el fin de obtener un tamaño de partículas uniforme. Las lipasas se inactivaron en un secador de bandejas (30 min a 100 °C), tal como recomienda Champagne (18). Este salvado de arroz se usó para preparar las dietas mostradas en la Tabla I. La dieta fue esencialmente la dieta AIN-93-G (19), pero los hidratos de carbono fueron almidón de maíz y no se agregó fibra ni el antioxidante Ter-butilhidroquinona. Estos ingredientes se excluyeron debido a que podían interferir con el objetivo de este estudio, que era evaluar los efectos de la fibra y la capacidad antioxidante del salvado de arroz Z-15. Por esta misma razón, la VitE presente en el aceite de soya utilizado se eliminó con carbón activado. Para ello, 50 g de aceite, 50 g de hexano, 4 g de carbón activado y una barra magnética se dispusieron en un Erlenmeyer de 250 mL. La mezcla se mantuvo con agitación durante 5 h a temperatura ambiente. Luego, la muestra se filtró al vacío para eliminar el carbón y la solución se mantuvo en vacío toda la noche para eliminar el hexano (20).
Tabla I. Composición de las dietas1 que consumieron los cuatro grupos de ratas estudiadas.
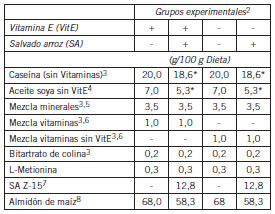
1. Las dietas se formularon de acuerdo al American Institute of Nutrition (AIN-93-G) (19). 2. Los grupos fueron: I) Dieta control: Con VitE, sin SA (+VitE/SA-). II) Con VitE, con SA (+VitE/SA+). III) Sin VitE, sin SA (-VitE/ SA-). IV) Sin VitE, con SA (-VitE/SA+). 3. Adquirido de Harlan-Teklad. Madison, Wi USA. 4. De origen local y tratado con hexano y carbón activado para eliminar VitE (20). 5. La mezcla mineral fue la AIN-93G-MX. (19). 6. Las mezclas vitamínicas se prepararon con vitaminas individuales usando la formulación (AIN-93-VX) (19), la VitE acetato se omitió en la mezcla vitamínica sin VitE. 7. Preparado como se describe en el texto e incorporado en la dieta a expensas del almidón. 8. Adquirido localmente de Pandock C.A. Caracas-Venezuela. *12,8 g de SA aportaron 1,39 g proteína de arroz y 1,67 g aceite de arroz (21).
DISEÑO EXPERIMENTAL
Veintiocho ratas de la cepa Sprague Dawley, obtenidas del Bioterio de la Universidad Simón Bolívar, con un peso de 78,5±9 g se colocaron en jaulas individuales de acero inoxidable y se acondicionaron durante 7 días con la dieta control mostrada en la Tabla I. Al final del período de acondicionamiento, las ratas se distribuyeron al azar en 4 grupos con 7 ratas por grupo. Los grupos experimentales y sus correspondientes dietas se muestran en la Tabla I. Las ratas consumieron estas dietas durante 15 días con agua y alimento ad libitum.
El consumo de alimento y el peso corporal se midió día por medio. Para esto, se utilizó una balanza Ohaus 1600 tipo Dial-O-Gram provista con un contenedor para animales.
Durante los últimos 4 días del experimento se recolectaron y pesaron las heces que luego se secaron en una estufa a 80 °C hasta peso constante. Al final del experimento, las ratas, anestesiadas con éter, se sacrificaron por decapitación. La sangre se dispuso en tubos heparinizados, se determinó la concentración de hemoglobina y luego se separaron los glóbulos rojos del plasma por centrifugación (2500 rpm, 10 min, 4 °C). El plasma se dispuso en tubos plásticos y se guardó congelado a -80 °C. Se eliminó la capa de glóbulos blancos por aspiración y los eritrocitos se lavaron tres veces con solución fisiológica. Luego, los eritrocitos lavados y centrifugados se hemolizaron usando 2 volúmenes de H2O y se centrifugaron para eliminar residuos. Los eritrocitos hemolizados se guardaron a -80 °C hasta que se usaron para determinar actividad enzimática. Los hígados se removieron, se pesaron y se guardaron congelados a -80 °C hasta ser usados. El cuidado y manejo experimental de las ratas se realizó utilizando los lineamientos establecidos por el National Research Council (22).
DETERMINACIONES ANALÍTICAS
Todos los reactivos químicos utilizados fueron de grado analítico y las determinaciones se realizaron por duplicado.
ENZIMAS ANTIOXIDANTES EN ERITROCITOS
Actividad de la Catalasa
La actividad se determinó en una muestra diluida (1:10 en H2O) de eritrocitos hemolizados. La mezcla de reacción fue la descrita para células cultivadas de tejido neuronal y homogenatos de hígado de ratas descrito por Cohen et al. (23). Este método se basa en la capacidad del H2O2 que queda después de inactivar la enzima para oxidar el hierro reducido, permitiendo que el hierro férrico reaccione con tiocianato de potasio (KSCN), formando ferritiocianato (FeSCN) que es un complejo de color rojo. La actividad de la catalasa de las muestras hemolizadas de cada una de las 28 ratas incluidas en el estudio se determinó en base a la absorbancia del complejo a 492 nm, medido después de 1 y 9 min de reacción. La actividad se calculó y expresó como unidades de catalasa, tal como describe Cohen et al. (23) y representa la velocidad con que disminuye el color rojo por minuto y por gramo de hemoglobina presente en el hemolizado.
Actividad de la Glutation Reductasa
La actividad de esta enzima se determinó en una muestra diluida (1:2 en H2O) del hemolizado de eritrocitos tal como recomiendan Bayuomi y Rosalki (24) y Sauberlich (25). Este método mide la capacidad del NADPH de reducir al glutatión oxidado. La reducción del glutatión genera NADP. La velocidad de oxidación del NADPH a NADP se mide con un espectrofotómetro a una longitud de onda de 340 nm, después de 5 y 10 minutos de reacción. La mezcla de reacción fue la descrita en (24) (25) y se expresó como unidades de Glutation Reductasa tal como describe Bayuomi y Rosalki (24), que representa la disminución en la concentración de NADPH por minuto y por gramo de hemoglobina en el hemolizado.
INDICADORES DEL ESTADO NUTRICIONAL DEL HIERRO
La hemoglobina sanguínea en los eritrocitos hemolizados se determinó con el método espectrofotométrico de Drabkin (26) utilizando el equipo Mak 115 de Sigma. El hematocrito se determinó en tubos capilares (Thomas Scientific) que se centrifugaron en una centrífuga clínica (2500 rpm, 10 min, 4 °C) y el hematocrito (%) se calculó usando un lector de Thomas Scientific.
El hierro hepático se determinó en 0,1 g de hígado cortado en trozos pequeños. El hierro se extrajo del tejido con 1 mL de una solución que contenía 50 g de ácido tricloroacético, 124,2 mL HCl 12 M en 500 mL de H2O. El hierro se determinó por el método espectrofotométrico de la ferrozina propuesto por Bothwell y Torrance (27).
VITAMINA E HEPÁTICA
La VitE hepática se determinó en 500 μL de un homogenato de hígado (0,5 g hígado en 2 mL H2O) utilizando el método de Ueda e Igarashi (28). Este método mide la VitE después de saponificarla y extraerla en la muestra de hígado, usando cromatografía líquida de alta presión (HPLC). Las condiciones cromatográficas fueron las mismas descritas previamente (29). Se utilizó acetato de retinilo como patrón interno durante todo el procedimiento. Este método no discrimina entre los diferentes isómeros de la VitE.
SUSTANCIAS REACTIVAS AL ACIDO TIOBARBITÚRICO (TBARS)
Las TBARS se determinaron en 100 μL de suero o en 100 μL de un homogenato de hígado (1 g hígado en 10 mL KCl 1,5%), utilizando la técnica propuesta por Ohkawa et al. (30), con 1,1,3,3- tetrahidroxipropano como patrón.
Resultados
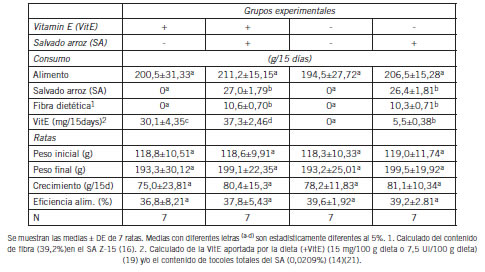
En este estudio, en los grupos que contenían salvado de arroz, el contenido de salvado de arroz Z-15 fue de 12,8% del peso total de la dieta y de acuerdo con la composición de este salvado (16) (21), aportó 1,39 g de proteína y 1,67 g de grasa por 100 g de dieta. Esto representa 7% y 24% de la proteína y de la grasa contenidas en la dieta, respectivamente. La Tabla I muestra que en las dietas con salvado de arroz, esta proteína y grasa se restaron de la caseína y del aceite de soya utilizados en su preparación. En esta forma, las dietas con salvado resultaron isonitrogenadas e isocalóricas con respecto a las dietas que no contenían salvado de arroz. De los datos presentados en la Tabla II, se puede calcular que las ratas asignadas a las dietas con salvado de trigo consumieron aproximadamente 3,5 g de fibra por kg de peso corporal por día. Esto corresponde a un consumo de fibra que es 6,4 veces mayor que el consumo recomendado para los humanos (8) y el 70% del consumo recomendado para roedores (19).
Tabla II. Consumo de alimento y crecimiento de ratas alimentadas con dietas suficientes o deficientes en Vitamina E (VitE), con o sin salvado de arroz (SA) durante 15 días.
En general, en este estudio la cantidad de salvado incorporado a las dietas se planificó de manera de incorporar la mayor cantidad de fibra posible, pero manteniendo su concentración dentro de límites similares a los recomendados para humanos. Al mismo tiempo, el reemplazo de la caseína y el aceite de soya por la proteína y la grasa del salvado se mantuvo lo más bajo posible, con el fin de evitar posibles efectos negativos en relación con el consumo de alimento y el crecimiento.
La Tabla II muestra que ni la inclusión de salvado de arroz o la deficiencia de VitE tuvieron efectos significativos en el consumo de alimento de las ratas estudiadas y esto se mantuvo a lo largo de todo el período experimental. De acuerdo con estos resultados, la Tabla II muestra que los cuatro grupos de ratas mostraron ganancias de peso similares. Esto lo confirma la Figura 1 que muestra las variaciones del peso de las ratas durante el experimento.
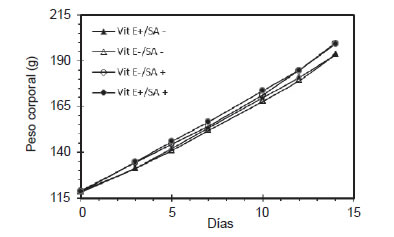
Figura 1. Variaciones en el peso corporal de ratas (7 por grupo) que consumieron dietas suficientes o deficientes en VitE (VitE+ o VitE-) con o sin salvado de arroz Z-15 (SA+ o SA-) durante 15 días.
La Figura 1 señala que el incremento de peso medido a lo largo del experimento, siguió un patrón similar en los cuatro grupos que consumieron las diferentes dietas que se superponen unos a otros, especialmente hasta el día 10. De acuerdo con estos resultados de consumo y crecimiento, la Tabla II también muestra que la eficiencia del alimento (crecimiento x 100/consumo) fue similar en los cuatro grupos de ratas estudiados.
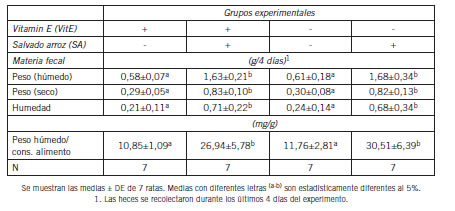
La Tabla III muestra la masa fecal excretada durante los últimos 4 días del experimento. En la tabla se observa que las ratas que consumieron las dietas con salvado de arroz excretaron aproximadamente 2,8 veces más heces húmedas y secas que las que no consumieron salvado. Asimismo, la humedad fecal y la razón entre el peso fecal y el alimento consumido fueron 3,1 y 2,54 veces más altas en las ratas que consumieron salvado.
Tabla III. Masa fecal de ratas que consumieron dietas suficientes o deficientes en Vitamina E (VitE), con o sin salvado de arroz (SA) durante 15 días.
La Tabla IV muestra que el hematocrito, la hemoglobina y el hierro hepático fueron similares en los cuatro grupos de ratas, indicando que el salvado de arroz no tuvo efectos negativos sobre el estado nutricional del hierro. En contraste, la VitE hepática fue diferente en todos los grupos dietarios. Así, la concentración de VitE en el hígado de las ratas que consumieron la dieta -VitE/SA-fue 10 veces menor que la de las ratas asignadas al grupo +VitE/SA-. Sin embargo, la concentración hepática de VitE de las ratas alimentadas con la dieta -VitE/SA+ fue sólo 2,6 veces menor que la de las ratas del grupo +VitE/SA-. Adicionalmente, se observa que el salvado de arroz causó un aumento (x 1,43 veces) en la VitE hepática del grupo +VitE/SA+con respecto a las ratas que consumieron la dieta suficiente en VitE pero sin salvado (+VitE/SA-).
Tabla IV. Estado del hierro, TBARS en plasma e hígado, Catalasa y Glutation Reductasa eritrocitarias y VitE hepática de ratas que consumieron dietas suficientes o deficientes en Vitamina E (VitE), con o sin salvado de arroz (SA) durante 15 días.

La Tabla IV muestra además, que las TBARS medidas tanto en el suero como en el hígado fueron similares en los 4 grupos. Sin embargo, la tabla señala que la capacidad de los eritrocitos para detoxificar H2O2 por la vía de la catalasa o de utilizar NADPH para reducir al glutatión por la vía de la glutatión reductasa fueron 35% y 39%, respectivamente, mayores en el grupo deficiente en VitE sin salvado de arroz (-VitE/SA-). Este incremento lo previno tanto la VitE como el salvado de arroz.
Discusión y Conclusiones
Aun cuando los beneficios del consumo de fibra se han reconocido hace décadas (31) y las ventajas del consumo de granos de cereales enteros se ha establecido más recientemente (1), la ingesta de estos ingredientes alimenticios en el mundo occidental es muy baja (8-11) y mantiene una brecha muy importante con respecto a los consumos recomendados por los expertos (9). Así, en EE.UU. el consumo de fibra diario recomendado en adultos varía entre 25 y 38 g/día (11), pero esto lo cumple menos del 5% de la población (11) y los registros de consumo señalan que la mayoría de los americanos deberían casi doblar su consumo de fibra para cumplir las recomendaciones (11). El hecho que los alimentos más frecuentemente consumidos sean bajos en fibra (30), justifica la inclusión de fibra en estos alimentos como una solución práctica para reducir lo que se conoce como la brecha de la fibra (11). De acuerdo con esto, aquí se describen los efectos de agregar salvado de arroz, un subproducto de la producción de arroz blanco que es rico en fibra y que tiene propiedades antioxidantes, en la dieta de ratas.
A pesar que la relación entre el consumo de fibra y la saciedad es un hecho relativamente bien aceptado, la literatura señala que depende de muchos factores (8) y en consecuencia no se puede generalizar. Los resultados de este experimento muestran que las dietas utilizadas fueron bien aceptadas y resultaron en consumos, crecimientos y eficiencias alimenticias similares, tanto en las dietas que tenían como en las que no tenían salvado de arroz. Esto está de acuerdo con reportes (12) (13) que señalan que como el salvado de arroz es una buena fuente de nutrientes, no afectó negativamente el estado nutricional de las ratas que lo consumieron. Resultados similares se han reportado con salvado de trigo (32). Los resultados de este estudio también son consistentes con estudios de corto plazo (33), realizados en humanos que recibieron dietas con diferentes concentraciones de fibra de frijoles (3 g y 12 g) y que no afectaron ni la saciedad ni el consumo calórico. En contraste, en estudios con humanos obesos, pero de largo plazo (9 semanas), tanto la saciedad como el consumo calórico, disminuyeron proporcionalmente con el tiempo y la concentración de fibra (dextrina de maíz) (33). Por último, este trabajo mostró que una deficiencia de VitE mantenida durante 2 semanas no afectó ni el consumo de alimento ni el crecimiento de las ratas.
Uno de los efectos más notables de consumir fibra es un aumento en la masa fecal, que ocurre en asociación con sus propiedades laxantes (8). Este efecto constituye la base de la “teoría de la fibra dietaria” (5) y de los beneficios de la fibra sobre la salud gastrointestinal. En este estudio, el salvado de arroz incorporado en un 12,8% en la dieta, aportó 5,02 g de fibra por 100 g de dieta y su consumo aumentó el peso fecal húmedo y seco casi 3 veces. El incremento en el peso fecal asociado con el consumo de fibra puede resultar de: a) agua retenida por la fibra en el intestino; b) componentes indigeribles de la fibra que permanecen en el intestino y que se excretan con la heces y c) una porción no fermentable de la fibra que actuando como un prebiótico, aumenta la masa bacteriana y el peso fecal (8). En este estudio, las heces de las ratas que consumieron salvado de arroz tenían más agua y más sólidos secos, señalando que se cumplieron los primeros dos factores. Debido a que en estas ratas no se estudió la microflora intestinal no es posible saber si esto contribuyó a aumentar el volumen fecal en las ratas que consumieron salvado de arroz. Sin embargo, es probable que esto haya ocurrido, ya que sin la fermentación bacteriana de parte del salvado de arroz, hubiera sido imposible que las ratas que lo consumieron mostraran crecimientos y eficiencias de utilización del alimento consumido, similares a las que no lo consumieron. La fibra del salvado de arroz contiene principalmente celulosa y hemicelulosa con una cantidad muy reducida (1%) de β-glucanos solubles (34). Los animales de estómago simple como la rata, carecen de las enzimas necesarias para digerir estos hidratos de carbono. Sin embargo, la microflora intestinal (microbiota) puede metabolizarlos y utilizarlos para su propia proliferación y crecimiento en el intestino. Adicionalmente, estas bacterias liberan productos como los ácidos grasos de cadena corta que pueden ser utilizados por el hospedador como una fuente energética, convirtiendo así, la fibra indigerible en energía digerible (31). Además de estas consideraciones energéticas, la microbiota intestinal tiene muchas otras funciones en la fisiología y metabolismo del hospedador. Una de ellas es que puede modular al sistema inmune tanto en el intestino como en tejidos distales (35). Así, cambios en la composición y densidad de la microbiota intestinal pueden alterar la respuesta inmune y en consecuencia el nivel inflamatorio incluso en órganos distales al intestino (36). Estudios recientes sugieren una asociación entre la microbiota intestinal y la obesidad, el síndrome metabólico, la diabetes, las alergias y las enfermedades autoinmunes (36-38). Los hidratos de carbono indigeribles en la fibra tienen un efecto trófico sobre las bacterias sacarolíticas (lactobacilos y las bifidobacterias) en la microbiota intestinal. Este efecto se considera deseable ya que se asocia con un sistema inmune más tolerante hacia antígenos inocuos, produciendo un ambiente menos inflamatorio, tanto en el intestino como en otras regiones del organismo (6) (7) (31).
En este estudio se evaluaron algunos aspectos del estado del hierro, esencialmente por dos razones: la primera se refiere a la preocupación de que la fibra así como compuestos asociados con la fibra como son los polifenoles y el ácido fítico reducen la absorción del hierro (8); y la segunda es que los eritrocitos son muy susceptibles a la deficiencia de VitE y que esta deficiencia produce anemia hemolítica en humanos susceptibles, como ocurre en el caso de los niños prematuros (39). Sin embargo, en este experimento ni el salvado de arroz ni la deficiencia de VitE alteraron significativamente el estado del hierro. El salvado de arroz Z-15 tiene un alto contenido de fibra, polifenoles y ácido fítico (16), pero al mismo tiempo tiene alto contenido en hierro (15). Por su alto contenido de polifenoles y ácido fítico, se suponía que debería haber reducido los niveles de la reserva hepática de hierro. El hecho de que esto no fuera así, sugiere que el alto contenido de hierro del salvado arroz Z-15 pudo ser suficiente para compensar los posibles efectos negativos de sus polifenoles o ácido fítico. También vale la pena señalar que la homeostasis del hierro es controlada por el eje hepcidina-ferroportina (40). En este sistema, el hígado detecta cambios en el hierro sistémico y responde aumentando (alto hierro o inflamación) o disminuyendo (bajo hierro o anoxia) la producción de hepcidina. Esta hormona hepática, actuando sobre el único sistema de exportación de hierro de la célula que es la ferroportina, reduce o aumenta la absorción de hierro y el transporte entre tejidos (40). Este eje probablemente explica que en este estudio el salvado de arroz no afectó el estado de hierro y también la idea (8) de que mientras haya suficiente hierro en la dieta, la fibra no afecta negativamente al estado nutricional del hierro.
Las anemias hemolíticas se caracterizan por presentarse con bajo hematocrito y hemoglobina y reservas de hierro normales o elevadas (40). En este estudio, las ratas asignadas al grupo deficiente en VitE sin salvado (-VitE/SA-) tuvieron el más bajo hematocrito (29,5%). Sin embargo, esto no fue significativo desde el punto de vista estadístico. Esto señala que 15 días con una dieta deficiente en VitE es insuficiente para producir un caso claro de anemia hemolítica. Debido a que estas ratas también crecieron igual a las asignadas a las dietas suficientes en VitE, la única evidencia de que estas ratas estaban deficientes, fue que su contenido de VitE en el hígado fue 10 veces menor que el de las asignadas a las dietas suficientes en esta vitamina.
Un hallazgo importante en este estudio fue que la severa reducción en la concentración hepática de VitE asociada con el consumo de la dieta deficiente en esta vitamina durante 15 días, fue prevenida parcialmente por el consumo de salvado de arroz. Así, las ratas que consumieron la dieta deficiente en VitE con salvado de arroz (-VitE/SA+) tenían 4 veces más VitE hepática que las que consumieron la deficiente en VitE sin salvado de arroz (-VitE/SA-). La contribución del salvado de arroz en aumentar la VitE hepática también se vio en las ratas que consumieron la dieta suficiente en VitE y salvado (+VitE/SA+), ya que estas ratas tuvieron una concentración de esta vitamina en el hígado que fue un 43% más elevada que las que consumieron la misma dieta pero sin salvado de arroz.
La concentración de VitE en el hígado es importante en relación con los mecanismos de defensa antioxidante del organismo, ya que el hígado participa en la distribución de la VitE a los diferentes tejidos por la acción de la proteína transportadora del α-Tocoferol (α-TTP) (41) y como se demostró aquí, responde rápidamente a la deficiencia de VitE.
Los resultados mostraron que las ratas alimentadas con la dieta sin VitE y sin salvado de arroz tenían 2,51 μg de VitE/g hígado y esta vitamina no se originó de la dieta consumida durante los 15 días que duró el experimento. Así, la VitE hepática proveniente de la dieta en las ratas que consumieron la dieta control (+VitE/SA-) fue 25,07-2,51 μg, mientras que en las ratas que recibieron la dieta deficiente en VitE pero con salvado (-VitE/SA+) fue 9,57-2,51 μg, o sea 22,56 y 7,06 μg de VitE/g hígado, respectivamente. Como 7,06 es el 31% de 22,56, esto indica que en este estudio el salvado de arroz fue 31% tan efectivo como la VitE añadida en la dieta en aumentar la concentración hepática de VitE. Ya que de acuerdo con la composición de la dieta (19), las ratas alimentadas con la ración +VitE/SA- consumieron 15 UI α-tocoferol (Tabla II), se desprende que el salvado de arroz Z-15, ofrecido en las concentraciones utilizadas en este experimento, fue equivalente al 31% de esta cantidad o 4,65 UI de α-tocoferol. Esta reserva de VitE asociada con el consumo de salvado de arroz probablemente resulta de una reducción en las necesidades diarias de VitE y también al contenido de VitE del salvado de arroz. El salvado de arroz puede reducir las necesidades de VitE debido a que contiene una variedad de antioxidantes tales como polifenoles, ϒ-oryzanol y una compleja variedad de tocoles (15) (16), los cuales reemplazando a la VitE en su función antioxidante ya sea en el intestino y/o a nivel sistémico, podrían disminuir las necesidades de utilizar esta vitamina, señalando que el salvado de arroz podría tener el efecto de ahorrar VitE. También el contenido de fibra en el salvado de arroz puede proveer un ambiente menos inflamatorio y así reducir el estrés oxidativo y el requerimiento de VitE. En relación con la posible contribución de la VitE presente en el salvado de arroz a la concentración de esta vitamina en las ratas asignadas a los grupos que lo consumieron, es importante señalar que el contenido de tocoles totales en el salvado de arroz fue de 20,9 mg/100 g, pero de esto, solo 23% fueron tocoferoles, 77% fueron tocotrienoles y su concentración de α-tocoferol alcanzó a sólo 12,6% (14) (21). Con respecto a esto, hay que señalar que a pesar de que a los tocotrienoles se le atribuyen una serie de beneficios a la salud bien establecidos (42), su disponibilidad (43) y su retención (17) en los tejidos es baja comparada con el α-tocoferol (all-rac-α-tocoferol), que es la única forma de VitE capaz de satisfacer las necesidades diarias de esta vitamina (41). Esto indica que la contribución del salvado de arroz a la VitE hepática, debe ser pequeña.
Debido a su contenido de hemoglobina y oxígeno, los glóbulos rojos son muy sensibles a la oxidación. En estas células la hemoglobina representa un 95% de sus proteínas totales y 3% de esto se oxida diariamente a metahemoglobina con liberación de superóxido. Luego, por la acción de la enzima superóxidodismutasa, el ion superoxido es transformado a H2O2. El peróxido de hidrógeno no es el único compuesto que causa estrés oxidativo en los glóbulos rojos, pero es uno de los más importantes causantes de daños (44), tales como fragilidad de la membrana celular y anemia hemolítica, especialmente en casos de deficiencia de VitE (40). Una evidencia de esto es que la fragilidad de la membrana celular de los glóbulos rojos ante un desafío con H2O2 se usa para establecer el estado nutricional de la VitE (39). Los glóbulos rojos utilizan principalmente dos sistemas enzimáticos para neutralizar H2O2 que son la catalasa y glutatión peroxidasa. La catalasa descompone H2O2 a agua, mientras que la glutatión peroxidasa, una enzima que contiene selenio, neutraliza tanto peróxidos orgánicos como H2O2, usando al glutatión reducido como un co-sustrato (44). En este estudio, la descomposición del H2O2 en eritrocitos se expresó como actividad de la catalasa, mientras que la capacidad para reducir el glutatión usando NADPH se expresó como actividad de glutatión reductasa. La importancia de tener suficiente glutatión reducido y NADPH en los glóbulos rojos lo demuestra la propensión de los pacientes con una deficiencia de la enzima glucosa-6-fosfato deshidrogenasa, los cuales desarrollan una anemia hemolítica porque no producen suficiente NADPH en el ciclo de las pentosas y en consecuencia no pueden reducir el glutatión (40).
De acuerdo con la discusión anterior, este estudio mostró que los eritrocitos de las ratas que consumieron la dieta deficiente en VitE y sin salvado (-VitE/SA-), necesitaron tener actividades más elevadas de la y la Glutation Reductasa para neutralizar H2O2 y utilizar NADPH para reducir al glutatión, respectivamente. Esto no se vio en los dos grupos que consumieron las dietas con VitE, ni en el grupo que consumió la dieta sin VitE pero con salvado de arroz. Esto señala que el salvado de arroz compensó la deficiencia de VitE, ya que en las ratas en este grupo (-VitE/SA+), tal como ocurrió en los grupos con VitE no hubo necesidad de aumentar estas actividades enzimáticas. Fue probablemente el aumento en la actividad de estas enzimas, que ocurrió durante la producción de nuevos eritrocitos en ratas que estaban creciendo y expandiendo su volumen sanguíneo lo que las protegió de desarrollar la anemia hemolítica típica de la deficiencia de VitE. El hecho que el salvado de arroz evitó que se produjera este aumento de la actividad de estas enzimas antioxidantes en los eritrocitos, es una señal de que el efecto del salvado de arroz no se limitó al hígado sino que también tuvo un efecto antioxidante más allá de este órgano. La capacidad del salvado de arroz de ahorrar VitE es importante, ya que la mayoría de la población (>92% de la población americana) no satisface sus requerimientos de esta vitamina (45). Esto es una preocupación especialmente importante entre los obesos con síndrome metabólico, ya que estos pacientes tienen un requerimiento mayor de VitE y reducen su consumo graso con el fin de bajar de peso (45). En estas condiciones, el uso de alimentos que tengan un alto contenido de fibra junto con una capacidad antioxidante que ahorre VitE, tal como ocurrió aquí con el salvado de arroz, pudiera ser conveniente.
En este estudio, las TBARS medidas en plasma e hígado no fueron diferentes en ninguno de los grupos estudiados. Esto indica que 15 días en una dieta deficiente en VitE no es suficiente para producir un incremento importante del estrés oxidativo en ratas, probablemente debido a un contenido residual de VitE todavía presente en el sistema y también a la activación de otros mecanismos antioxidantes que compensaron esta deficiencia.
En conclusión, este estudio muestra que en ratas en crecimiento, el salvado de arroz venezolano Z-15 fue bien aceptado y resultó en crecimientos y eficiencias del alimento similares a los exhibidos por las ratas que no lo consumieron. En estas ratas, el salvado de arroz aumentó la masa fecal y no interfirió con el metabolismo del hierro. Adicionalmente, este salvado tiene una clara actividad antioxidante, ya que su consumo estuvo asociado con mayores niveles de VitE en el hígado y evitó la estimulación de enzimas antioxidantes en ratas deficientes en esta vitamina.
Los resultados de este experimento in vivo muestran que el salvado de arroz, un subproducto del procesamiento del arroz, es un ingrediente alimenticio con un alto contenido de fibra y una capacidad antioxidante que podría ser útil para reducir las brechas de consumo tanto de la fibra como de la VitE.
CONFLICTOS DE INTERÉS
Los autores declaran no tener conflictos de interés.
AGRADECIMIENTOS
Los autores están agradecidos de la Prof. Mercedes Mosqueda del “Instituto de Tecnología de Alimentos de la Universidad Central de Venezuela”, ya fallecida, por su inspiración y por suministrar tanto la muestra de arroz entero Z-15 como la experiencia y el equipo necesario para preparar el salvado de arroz. Los autores también agradecen a los Decanatos de Investigación y de Postgrado de la Universidad “Simón Bolívar” (Caracas-Venezuela) por financiar este estudio.
1. Slavin J. Whole grains and human health. Nutr Res Rev 2004; 17: 99 -110. [ Links ]
2. Itokawa Y. Kanehiro Takaki (1849-1920) a biographical sketch. In: Darby WJ, Jukes TH, Editors. Founders of Nutrition Science. Biographical Articles from The Journal of Nutrition. Bethesda Maryland, USA: The American Institute of Nutrition 1992; 2: 1041-6. [ Links ]
3. Jansen BCP. Eijkman C. (1858-1930). In: Darby WJ, Jukes TH, Editors. Founders of Nutrition Science. Biographical Articles from The Journal of Nutrition. Bethesda Maryland, USA: The American Institute of Nutrition; 1992; 1: 289-94. [ Links ]
4. Bemeur Ch, Butterworth RF. Thiamin. En: Ross CA, Caballero B, Cousins RJ, Tucker KL, Xiegler TR, Editors. Modern Nutrition in Health and Disease. Eleventh ed. Philadelphia USA: Walters Kluver/Lippincott Williams & Wilkins; 2012. p. 317-24. [ Links ]
5. Story JA, Kritchevsky D. Denis Parson Burkitt (1911- 1993). J Nutr 1994; 124: 1551-4. [ Links ]
6. Binns N. Probiotics, prebiotics and the gut microbiota. ILSI Europe. Concise Monograph Series. Brussels Belgium; 2013.
7. Slavin J. Why whole grains are protective: Biological mechanisms. Proc Nutr Soc 2003; 62: 129-34. [ Links ]
8. Willis HJ, Slavin JL. Dietary fiber. In: Ross CA, Caballero B, Cousins RJ, Tucker KL, Xiegler TR, Editors. Modern Nutrition in Health and Disease. Eleventh ed. Philadelphia USA: Walters Kluver/Lippincott Williams & Wilkins; 2012. p. 58-64. [ Links ]
9. Ruxton C, Derbyshire E. The health benefits of whole grains and fibre. Nutr Food Sci 2014; 44: 492-519. [ Links ]
10. Mobley AR, Slavin JL, Hornick B. The future of recommendations on grain foods in dietary guidance. J Nutr 2013; 143: 1527S-32S. [ Links ]
11. Mobley AR, Miller Jones J, Rodríguez J, Slavin J, Zelman KM. Identifying practical solutions to meet America´s fiber needs: Proceedings from the food & fiber summit. Nutrients 2014; 6: 2540-51. [ Links ]
12. Nagendra Prasad NM, Sanjay KR, Shravya Khatokar M, Vismaya MN, Nanjunda Swamy S. Health benefits of rice bran- A review. J Nutr Food Sci 2011; 1:108. Disponible en: URL: http://www.omicsonline.org/health-benefits-of-rice-bran-a-review-2155-9600.1000108.php?aid=1923 (Fecha de acceso 14 de junio de 2015) [ Links ]
13. Kaklon TS. Rice bran: Production, composition, functionality, food applications and physiological benefits. In: Cho SS, Samuel P, Editors. Fiber Ingredients. Food Applications and Health Benefits. New York: CRC Press. Taylor & Francis Group; 2009. p. 305-21. [ Links ]
14. Aguilar-Garcia C, Gavino G, Baragaño-Mosqueda M, Hevia P, Gavino VC. Correlation of tocopherol, tocotrienol, γ-oryzanol and total polyphenol content in rice bran with different antioxidant capacity assays. Food Chem 2007; 102 (4): 1228-32.
15. Aguilar-García C, Hevia P, Nuñez M. Minerales, ácido fítico, y γ-oryzanol en harinas integrales y salvados de arroz de tres variedades de arroz (Oriza sativa) cultivados en Venezuela. Anales Venezolanos de Nutrición 2014; 27 (2): 252-7.
16. Aguilar-García C, Hevia P, Ortiz M, Nuñez M, Nuñez M. Compuestos bioactivos en harinas integrales y salvados de arroz (Oryza sativa L). SABER 2017; 29 (1): enero-marzo (en prensa). [ Links ]
17. Lirange M, Meydani M, Zingg JM, Azzi A. α-Tocopheryl-phosphate regulation of gen expression in preadipocytes and adypocites. Biofactors 2012; 38: 450-7.
18. Champagne ET. Brown rice stabilization. In: Marshall WE and Wadworth JI, Editors. Rice Science and Technology. New York: Marcell Dekker; 1994. p. 381-6. [ Links ]
19. Reeves PG, Nielsen FH, Fahey Jr GC. AIN-93 Purified diets for laboratory rodents: Final Report of the American Institute of Nutrition Ad Hoc Writing Committee on the Reformulation of the AIN-76A Rodent Diet. J Nutr 1993; 123: 1939-51. [ Links ]
20. Mohri K, Dohmoto C, Ikesu H, Igarashi O. A simple elimination method of vitaminE from vegetable and fish oil for the preparation of vitamin E deficient diets. J Jpn Soc Nutr Food Sci 1983; 36: 122-4. [ Links ]
21. Aguilar-Garcia C. Macro y micromponentes de tres variedades de arroz cargo (Oryza sativa) respuesta fisiológica en ratas, inducida por el salvado de arroz [Dissertation]. Caracas Venezuela: Universidad Central de Venezuela; 2008. [ Links ]
22. Institute of Laboratory Animal Resources. Comission on Life Sciences. National Research Council. Guide for the care and use of laboratory animals. Washington DC: National Academy Press; 1996. [ Links ]
23. Cohen G, Kim M, Ogwu V. A modified catalase assay suitable for a plate reader and for the analysis of brain cell cultures. J Neurosc Methods 1996; 67: 53-6. [ Links ]
24. Bayoumi RA, Rosalki SB. Evaluation of methods of coenzyme activation of erythrocyte enzymes for detection of vitamin B1, B2 and B6. Clin Chem 1976; 22: 327-35. [ Links ]
25. Sauberlich HG. Erythrocyte Glutathione Reductase Assays. In: Sauberlich HG, Editor. Laboratory Tests for the Assesment of Nutritional Status. Second Ed. Washington DC: CRC Press; 1999. p. 60-4. [ Links ]
26. Drabkin DL, Austin JH. Spectrophotometric studies II. Preparations from washed blood cells, nitric oxide hemoglobin and sulfhemoglobin. J Biol Chem 1935; 112: 51-65. [ Links ]
27. Bothwell TH, Torrance JD. A simple technique for measuring iron concentration in formalinised liver samples. South African Medical Science 1968; 33 (1): 9-11. [ Links ]
28. Ueda T, Igarashi O. Determination of Vitamin E in biological specimens and foods by HPLC. Pretreatment of samples and extraction tocopherols. J Micronutr Anal 1990; 7: 79-96. [ Links ]
29. Liuzzi JP, Cioccia AM, Hevia P. In well-fed young rats, Lactose-induced diarrhea reduces the apparent absorption of Vitamins A and E and affects preferentially Vitamin E status. J Nutr 1998; 128: 2467-72. [ Links ]
30. Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxide in animal tissue by thiobarbituric acid reaction. Anal Biochem 1979; 95: 351-8. [ Links ]
31. Slavin J. Fiber and prebiotics: Mechanisms and health benefits. Nutrients 2013; 22: 1417-35. [ Links ]
32. Cilli V, Hevia P. Wheat bran and whole wheat flours as sources of fiber and calories to the rat. Nutrition Reports International 1989; 39: 917-30. [ Links ]
33. Bonnema AL, Altschwager D, Thomas W, Slavin JL. The effect of a beef-based meal compared to a calorie matched bean-based meal on appetite and food intake. J Food Sci; 2015. Disponible en: URL: http://onlinelibrary.wiley.com/doi/10.1111/1750-3841.12991/abstract (Fecha de acceso 30 de setiembre de 2015). [ Links ]
34. Hardgrave KL. Processing and utilization of rice bran in the United States. In: Marshall WE and Wadworth JI, Editors. Rice Science and Technology. New York: Marcell Dekker; 1994. p. 381-6. [ Links ]
35. Valentine M, Piermattei A, Di Sante G, Migliara G, Delogu G, Ria F. Immunomodulation by gut microbiota: Role of Toll-like receptors expressed by T cells. J Immunology Research 2014; 8 pages. Disponible en: URL: http://dx.doi.org/10.1155/2014/586939 (Fecha de acceso 16 de febrero de 2015). [ Links ]
36. Bellkaid Y, Hand TW. The role of the microbiota in immunity and inflammation. Cell 2014; 157: 121-41. [ Links ]
37. Alcock J, Maley CC, Aktipis CA. Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms. Bioessays 2014; 36: 940-9. [ Links ]
38. Devaraj S, Hemarajata P, Versalovic J. La microbiota intestinal humana y el metabolismo corporal. Implicaciones con la obesidad y la diabetes. Acta Bioquím Clín Latinoam 2013; 47: 421-34. [ Links ]
39. Sauberlich HG. Vitamin E (Tocopherols). In: Sauberlich HG, Editor. Laboratory Tests for the Assesment of Nutritional Status. Second Ed. Washington DC: CRC Press; 1999. P. 249-66. [ Links ]
40. Páez MC, Cioccia AM, Hevia P. Papel de la hepcidina y la ferroportina en la regulación hormonal de la homeostasis del hierro. VITAE Academia Biomédica Digital 2014; No. 59. Disponible en: URL: http://vitae.ucv.ve/index_pdf.php?modules/articulo=pdf.phpmodule=articulo=pdf&n=5008&rv=114 (Fecha de acceso: 9 de setiembre de 2015). [ Links ]
41. Traber MG. Vitamin E. In: Ross CA, Caballero B, Cousins RJ, Tucker KL, Xiegler TR, Editors. Modern Nutrition in Health and Disease. Eleventh ed. Philadelphia USA: Walters Kluver/Lippincott Williams & Wilkins; 2012. p. 293-304. [ Links ]
42. Chandra KS, Khanna S, Rink C, Sashwata R. Vitamin E: Tocotrienols. In: Vitamins and hormones. Advance in Research and Applications. Academic Press 2007; 76: 203-68. [ Links ]
43. Fu YF, Che HL, Mean Yi-Tan D, Teng KT. Bioavailability of tocotrienols: Evidence in human studies. Nutr&Metab 2014; 11: 5. Disponible en: URL: http://www.nutritionandmetabolism.com/content/11/1/5 (Fecha de acceso 4 de marzo de 2014). [ Links ]
44. Rocha S, Gómez D, Lina M, Bronze-da-Rocha E, Santos-Silva A. Peroxiredoxin-2, Glutathione Peroxidase and Catalase in cytosol and membrane of erytrocytes under H2O2 induced oxidative stress. Free Radical Research 2015; 48 (8): 990-1003. [ Links ]
45. Mah E, Sapper TN, Chitchumroonchokchai Ch, Failla ML, Schill KE, Clinton SK, et al. α-Tocopherol bioavailabity is lower in adults with metabolic syndrome regardless of dairy fat co-ingestion: a randomized, doble-blind, crossover trial. Amer J Clin Nutr 2015; 102(5):1070-80. Disponible en: URL: http://ajcn.nutrition.org/content/early/2015/10/07/ajcn.115.118570 (Fecha de acceso: 11 de junio de 2015).
Recibido: 10 de abril de 2016
Aceptado: 26 de agosto de 2016














