Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.2 La Plata jun. 2017
BIOQUÍMICA CLÍNICA
Determinación colorimétrica de glucosa y consumo de glucosa en cultivos de células adiposas 3T3-L1
Colorimetric determination of glucose and glucose consumption in cultured 3T3-L1 adipose cells
Determinação colorimétrica de glicose e consumo de glicose em cultura de células adiposas 3T3-L1
Ana Delia Pinzón García1a, Adrián Gabriel Sandoval Hernández2b, Paola Andrea Rivera Diaz3a, Doris Esther Gómez Camargo4c, Claudio Jaime Gómez Alegría5a
1 Doctor en Ciencias: Química.
2 Doctor en Ciencias Biomédicas.
3 Magister en Ciencias Farmacéuticas.
4 Doctor en Bioquímica y Biología Molecular.
5 Doctor en Ciencias (Biología).
a Universidad Nacional de Colombia, Sede Bogotá, Facultad de Ciencias, Departamento de Farmacia. Grupo UNIMOL.
b Área de Bioquímica, Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá.
c Universidad de Cartagena, Facultad de Medicina, Doctorado en Medicina Tropical del SUE Caribe. Grupo UNIMOL.
Lugar de realización del trabajo: Universidad Nacional de Colombia, Sede Bogotá, Facultad de Ciencias, Departamento de Farmacia, Avda. Carrera 30 #45-03, Bogotá. Código Postal 111321 - Colombia.
CORRESPONDENCIA CLAUDIO J. GÓMEZ ALEGRÍA Universidad Nacional de Colombia, Sede Bogotá Facultad de Ciencias, Departamento de Farmacia Avda. Carrera 30 #45-03, BOGOTÁ. Código Postal 111321 - Colombia Teléfono: 3165000 ext.14622 E-mail: cjgomeza@unal.edu.co
Resumen
El objetivo de este trabajo fue evaluar la potencial aplicación de un método colorimétrico para cuantificar glucosa y consumo de glucosa en cultivos de células adiposas, el cual se lleva a cabo, principalmente, por métodos radioactivos. Las células 3T3-L1 fueron inicialmente diferenciadas a adipocitos mediante tratamiento hormonal. La glucosa y su consumo en respuesta a la insulina se cuantificó con un ensayo enzimático-colorimétrico usando un reactivo comercial. A partir de una condición basal de glucosa de 200 mg/dL, el tratamiento con insulina 100 nM o 1000 nM provocó una respuesta bifásica en la glucosa extracelular: una primera reducción del 20-30% a 0,5-8 h (p<0,001), y una segunda reducción del 54-66% a 12-16 h (p<0,001). Dicho efecto mostró una CE50 de 960 nM. El pretratamiento de los adipocitos con dexametasona 10, 100 o 1000 nM inhibió por completo el efecto de la insulina. Todas las mediciones se realizaron en el rango de respuesta lineal del ensayo. El método colorimétrico resultó ser útil para cuantificar glucosa y consumo de glucosa en adipocitos 3T3-L1. Este método, con apropiados ajustes, podría ser la base de nuevos bioensayos destinados a evaluar la actividad biológica y/o farmacológica de potenciales fármacos.
Palabras clave: Consumo de glucosa; Bioensayo; Insulina; Dexametasona; Adipocitos 3T3-L1.
Abstract
The aim of this work was to evaluate the potential application of a colorimetric assay to quantify glucose and glucose consumption in adipose cells which is, mainly, quantified by radioactive methods. 3T3-L1 cells were first differentiated into adipocytes by hormonal treatment. Glucose and insulin-induced glucose consumption were quantified by an enzyme-colorimetric assay using a commercial reagent. From a basal condition of 200 mg/dL glucose, treatment with 100 nM or 1000 nM insulin caused a biphasic response in extracellular glucose: an initial 20-30% reduction at 0.5-8 hours (p<0.001), and a second 54-66% reduction at 12-16 h (p<0.001). This effect showed an EC50 of 960 nM. Pretreatment of adipocytes with 10, 100 or 1000 nM dexamethasone completely inhibited the insulin effect. All these measurements were performed in the linear response range of the assay. The colorimetric method proved to be useful to quantify glucose and glucose consumption in 3T3-L1 adipose cells. This method, with appropriate adjustments, could lead to the development of new bioassays with the purpose of evaluating the biological and/or pharmacological activity of potential drugs.
Keywords: Glucose uptake; Biological assay; Insulin; Dexamethasone; Adipocytes 3T3-L1.
Resumo
O objetivo deste estudo foi avaliar a aplicação de um método colorimétrico para quantificar glicose e captação de glicose em culturas de células adiposas, o qual é levado a cabo, principalmente, por métodos radiativos. As células 3T3-L1 foram diferenciadas inicialmente em adipócitos mediante tratamento hormonal. A glicose e seu consumo em resposta à insulina foi quantificada com um ensaio enzimático-colorimétrico usando um reagente comercial. A partir de uma condição basal de glicose 200 mg/dL, o tratamento com insulina 100 nM ou 1000 nM causou uma resposta bifásica na glicose extracelular: uma primeira redução de 20-30% a 0,5-8 horas (p<0,001), e uma segunda redução de 54-66% a 12 -16 h (p<0,001). Tal efeito mostrou uma CE50 de 960 nM. O pré-tratamento dos adipócitos com dexametasona em concetrações 10, 100 ou 1000 nM reverteu completamente o efeito da insulina. Todas as medições foram realizadas na faixa de resposta linear do ensaio. O método colorimétrico provou ser útil para a quantificação de glicose e consumo de glicose em adipócitos 3T3-L1. Este método, com ajustes apropriados, poderia ser a base de novos bioensaios destinados a avaliar a atividade biológica e/ou farmacológica de potenciais fármacos.
Palavras-chave: Consumo de glicose; Bioensaio; Insulina; Dexametasona; Adipócitos 3T3-L1.
Introducción
Los ensayos clásicos para valorar el consumo de glucosa en modelos de células animales se fundamentan, principalmente, en el empleo de métodos radiactivos para cuantificar el ingreso de análogos de glucosa marcados radiactivamente, tales como [14C]-Glucosa o [3H]-Glucosa a las células (1)(2). Aunque este tipo de ensayos tiene como ventaja su alta sensibilidad, es relevante mencionar que el uso de isótopos radiactivos representa varios riesgos: para la salud del operador, contaminación del medio ambiente, requerimiento de equipos costosos, espacios físicos y realización de protocolos exclusivos para la manipulación y desecho de radioisótopos (3), lo cual estimula la búsqueda de procedimientos alternativos que simplifiquen y economicen el trabajo.
Más recientemente, se han venido implementando métodos no radioactivos, principalmente los que están basados en el uso de derivados de glucosa fluorescentes como por ejemplo el 2-(N-(7-nitrobenzo-2-oxa-1,3-diazol-4-il)amino)-2-deoxiglucosa) (2-NBDG). Estos métodos, representarían una alternativa válida y más segura al uso de radioisótopos en los estudios de valoración del consumo de glucosa, y comienzan a ser aplicados tanto en células animales como en células procariotas (4–7).
Por otro lado, a nivel del laboratorio clínico, la cuantificación de glucosa en muestras biológicas se ha basado en múltiples métodos sencillos y más económicos que se subdividen en químicos (Benedict, Ferrocianuro, o-toluidina, etc.) y enzimáticos (glucosa oxidasa, hexoquinasa y glucosa deshidrogenasa), los cuales utilizan colorimetría para valorar el producto de la reacción (8). Sin embargo, ninguno de estos ensayos ha sido utilizado para evaluar glucosa y consumo de glucosa en cultivos celulares.
El presente estudio, por consiguiente, tuvo como objetivo evaluar la posible aplicación de un ensayo enzimático-colorimétrico para cuantificar glucosa en el sobrenadante de células adiposas 3T3-L1 y observar, de manera indirecta, el consumo celular de glucosa. Esta evaluación es de vital importancia porque permitiría ampliar la oferta de bioensayos para evaluar in vitro la actividad biológica y farmacológica de moléculas o sustancias.
Materiales y Métodos
REACTIVOS
La línea de fibroblastos 3T3-L1 derivada de células embrionarias de ratón (9)(10) fue adquirida de la colección americana de cultivos (ATCC por sus siglas en inglés). Insulina (INS), Dexametasona (Dex) y 1-metil 3-isobutilxantina (IBMX) fueron de Sigma-Aldrich (St. Louis, EE.UU.). Los medios de cultivo Dulbecco´s
Modified Eagle´s Medium (DMEM) de alto contenido en glucosa (4,5 g/L) y OptiMEM, así como el suero fetal bovino (FBS), piruvato de sodio, bicarbonato de sodio, la solución de Tripsina-EDTA (0,25%) y los antibióticos penicilina y estreptomicina (10000 U/mL y 10000 mg/mL, respectivamente), fueron todos adquiridos de GIBCO Thermo Fisher Scientific (MA, EE.UU.).
ENSAYO DE CUANTIFICACIÓN DE GLUCOSA
La cuantificación de glucosa se realizó con el método enzimático-colorimétrico de la glucosa oxidasa/ peroxidasa, empleando el reactivo comercial Glucosa (BioSystems; Barcelona, España). La técnica se fundamenta en el uso de dos reacciones acopladas catalizadas por las enzimas glucosa oxidasa y peroxidasa que convierten la glucosa en quinoneimina (11), compuesto que absorbe a 500 nm. El ensayo se adaptó a un formato de microplacas de 96 pozos que empleó 2 μL de muestra (o patrón) y 200 μL del reactivo, y la reacción se llevó a cabo a temperatura ambiente (16-25 ºC) por 10 min. A continuación, se leyó inmediatamente la absorbancia a 490 nm en un lector de microplacas Biorad, Modelo SSO. Para el cálculo de la concentración de glucosa, la absorbancia de la muestra se comparó con la del patrón de glucosa (100 mg/dL o 5,55 mmol/L) proporcionado por el proveedor del reactivo, de acuerdo con las instrucciones del fabricante. El rango de linealidad del ensayo se determinó a partir de las lecturas de la absorbancia a 490 nm obtenidas con soluciones de glucosa de diferente concentración (200, 100, 50, 25, 12,5, 6,25, 3,125, 1,562, 0,781, 0,391, 0,195 y 0,098 mg/dL) preparadas por dilución seriada a partir de una concentración de 200 mg/dL. Los datos fueron ajustados a una regresión lineal.
CULTIVO DE CÉLULAS 3T3-L1
Las células fueron mantenidas sobre frascos T25 con 7 mL de medio completo (DMEM alto en glucosa (4,5 g/L) suplementado con suero fetal bovino (FBS) (10% v/v), piruvato de sodio (110 mg/L), bicarbonato de sodio (3,7 g/L) y los antibióticos penicilina (100 U/mL) y estreptomicina (100 μg/mL). El cultivo se mantuvo a 37 ºC en atmósfera húmeda con 5% CO2 y con renovación del medio cada dos días hasta lograr un 60-80% de confluencia, momento en el cual las células se levantaron con solución de tripsina-EDTA 0,25%, se diluyeron y se sembraron a una densidad inicial de 2500 células/ cm2 en un frasco nuevo.
DIFERENCIACIÓN DE CÉLULAS 3T3-L1 EN ADIPOCITOS.
Las células 3T3-L1 fueron sembradas en medio completo, sobre placas de 96 ó de 24 pozos a una densidad inicial de 3000 y 5000 células/cm2, respectivamente, y se incubaron a 37 ºC hasta llegar a confluencia. A los dos días post-confluencia (tiempo cero de diferenciación), el medio de cultivo se cambió por medio de diferenciación (medio completo suplementado con IBMX 0,5 mM, Dex 0,1 µM e INS 10 µg/mL) por 48 h, después de lo cual volvieron a medio completo hasta el día 8 de diferenciación, con cambios de medio cada dos días (12)(13).
Los cambios morfológicos de las células diferenciadas fueron visualizados y documentados en un microscopio óptico de contraste de fases (ECLIPSE E600, Nikon, EE.UU.), disponible a través del sistema de Laboratorios inter-facultades de la Universidad Nacional de Colombia, Sede Bogotá.
EFECTO DE INSULINA SOBRE LA GLUCOSA EXTRACELULAR
El efecto de insulina se estudió sobre adipocitos diferenciados por 7-8 días. Las células primero se colocaron durante 1 h en medio OptiMEM sin glucosa, y luego se estimularon con concentraciones variables de insulina (0 a 1000 nM) en OptiMEM suplementado con glucosa 200 mg/dL. El estímulo se mantuvo por un tiempo variable (0-16 h), después de lo cual se cuantificó la glucosa extracelular según lo indicado previamente.
Algunos resultados se presentan como las medidas directas de la glucosa extracelular (glucosa en el medio de cultivo). Otros, como la medida indirecta del consumo de glucosa, que se calculó a partir de la diferencia entre la glucosa extracelular basal (GB) y la glucosa extracelular después del estímulo con insulina (GI) según la ecuación:
Consumo = GB – GI
EFECTO DE DEXAMETASONA SOBRE LA GLUCOSA EXTRACELULAR
Para evaluar el efecto de dexametasona sobre la respuesta a la insulina, los adipocitos de 8 días de diferenciación fueron primero pretratados con este corticoide. Para ello, las células fueron colocadas 48 h en medio completo que contenía dexametasona (1-1000 nM) según lo reportan otros autores (14–18), después de lo cual el cultivo fue colocado en ayuno de glucosa durante 1 h en OptiMEM, y luego estimulado con insulina 1000 nM por 16 h, para posteriormente cuantificar la glucosa extracelular mediante el ensayo previamente descrito.
ANÁLISIS ESTADÍSTICO
Inicialmente, se determinó la parametricidad de los datos, por medio del test de normalidad de D’Agostino- Pearson (19), y las pruebas de homocedasticidad de Cochran (20) y prueba F-max de Hartley (21). La comparación entre los distintos tratamientos experimentales y sus controles se realizó mediante análisis de varianza simple (ANOVA) (22) utilizando el programa GraphPadPrism versión 6.07 (Demo) para Mac. En aquellos casos en los cuales se encontraron diferencias significativas se procedió a realizar un test de comparaciones múltiples de Dunnett (23).
Los datos experimentales fueron graficados con el mismo programa GraphPadPrism versión 6.07.
Para la curva concentración-respuesta frente a insulina, los puntos experimentales se ajustaron a un modelo de regresión no lineal logístico de cuatro parámetros mediante la aplicación Solver de Excel 2011, según la fórmula:
![]()
donde F(x) es el consumo fraccional de glucosa (y/ymáximo); a, mínimo asintótico; b, coeficiente de Hill; c, concentración efectiva 50 (CE50); d, máximo asintótico.
Resultados
CÉLULAS ADIPOSAS
En este estudio se trabajó con cultivos de células 3T3- L1, una línea celular comprometida a diferenciarse en adipocitos bajo estímulo hormonal apropiado. La Figura 1 muestra imágenes representativas del cultivo en estado basal no diferenciado (Fig. 1A) y después de 8 días de diferenciación, según las condiciones descritas (Fig. 1B). Se aprecian cambios característicos del proceso de adipogénesis, incluyendo un notable aumento del tamaño celular y la adquisición de una morfología redondeada o esférica. Tales cambios, más los ensayos funcionales que se muestran más adelante, y las observaciones de que las células diferenciadas se tiñen con aceite rojo O (resultados no mostrados), esto último indicativo de la acumulación citoplasmática de lípidos neutros, sugieren que el protocolo aplicado fue efectivo en inducir el proceso de diferenciación a adipocitos maduros en las células 3T3-L1.

Figura 1. Diferenciación de células 3T3-L1 en adipocitos. Las células fueron cultivadas y diferenciadas según lo descripto en Materiales y Métodos. (A) Células control sin diferenciar; (B) Células diferenciadas por 8 días (400x).
ENSAYO DE GLUCOSA
Se adaptó un ensayo comercial de glucosa a un formato de microplacas de 96 pozos, lo que implicó reducir, en un factor de 5, los volúmenes de muestra y reactivo sugeridos por el fabricante. En este nuevo formato el ensayo mostró linealidad en todo el rango de concentraciones en una evaluación desde 0,098 a 200 mg/dL; coeficiente de correlación r2=0,9909) (Fig. 2). Todos los resultados presentados en este trabajo estuvieron dentro de este rango de linealidad.
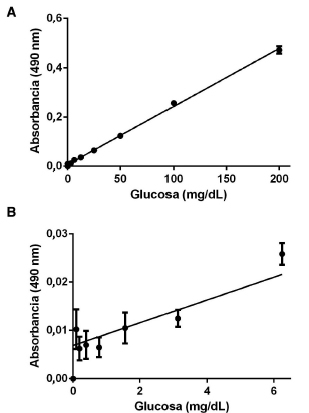
Figura 2. Linealidad del ensayo de glucosa. Se prepararon diluciones seriadas de glucosa y se realizó el ensayo según lo indicado en Materiales y Métodos. (A) Curva de todo el rango de concentraciones evaluado (0-200 mg/dL). (B) Curva de la zona de baja concentración (0 a 6,25 mg/dL de glucosa). Los puntos representan los datos experimentales. La línea sólida representa el ajuste de regresión a la ecuación de la recta (y=mx+b), donde m=0,002357 y b=0,006879 (r2=0,9909). Se representa el promedio y el error estándar de la media de cuatro réplicas (n=4).
EFECTO DE LA INSULINA
A continuación se aplicó el ensayo de glucosa para evaluar el efecto de la insulina en el modelo de células adiposas. En la Figura 3 se observa que, bajo condiciones basales (sin estímulo de insulina), la glucosa extracelular experimentó cambios mínimos durante un período de 16 h. Al estimular con insulina 10 nM se observó un comportamiento similar al basal, con una disminución de menos del 10% tras 16 horas de tratamiento (p<0,05). Sin embargo, los cambios mayores en los niveles de glucosa extracelular se evidenciaron al tratar los adipocitos con insulina en concentraciones de 100 y 1000 nM, observándose una respuesta bifásica, donde se aprecia una primera fase de reducción de la glucosa extracelular entre 20 y 30% a 0,5 horas de tratamiento (p<0,001) que se mantiene hasta las 8 h, y una segunda fase donde se alcanzó un efecto máximo del 54 y 66% de reducción a 12-16 h de tratamiento (p<0,001) (Fig. 3).

Figura 3. Efecto de la insulina sobre los niveles de glucosa extracelular en células adiposas 3T3-L1. Adipocitos diferenciados en placas de 96 pozos fueron estimulados con insulina (a la concentración indicada) por 0-16 horas, y la glucosa extracelular cuantificada de acuerdo a lo descrito en materiales y métodos. Se representa el promedio y la desviación estándar (n=5). *p≤0,05; **p≤0,01; ***p≤0,001).
A partir de los valores de concentración de glucosa extracelular es posible calcular el consumo de glucosa según se indica en Materiales y Métodos, lo que permitió estudiar la respuesta en términos del consumo de glucosa en función de la concentración de insulina administrada durante 16 h. La Figura 4 muestra tales resultados, donde se observa la dependencia entre el consumo de glucosa y la concentración de insulina. El mejor ajuste de los datos a un modelo de regresión logística permitió estimar la concentración efectiva 50 (EC50) para insulina en 960 nM.

Figura 4. Curva concentración-respuesta para el consumo de glucosa estimulado por insulina en células adiposas 3T3-L1. Las células fueron estimuladas con diferentes concentraciones de insulina por 16 horas y el consumo de glucosa fue calculado a partir de la glucosa extracelular. Los puntos representan los datos experimentales y la línea sólida representa el mejor ajuste de los datos al modelo de regresión logístico de cuatro parámetros, cuya ecuación se proporcionó en Materiales y Métodos y cuyos parámetros ajustados fueron a=0,286, b=1,052, c=961,8, y d=1,0).
Los resultados anteriores claramente establecen que el ensayo enzimático-colorimétrico es útil para medir cambios en la glucosa extracelular y también en el consumo de glucosa estimulado por insulina en las células adiposas 3T3-L1. Adicionalmente, estos resultados soportan la conclusión de que el protocolo de diferenciación implementado generó adipocitos funcionales y que el ensayo de glucosa colorimétrico aplicado representaría una prueba de tipo funcional en estas células.
EFECTO DE LA DEXAMETASONA
Con el fin de confirmar la potencialidad del ensayo como una prueba funcional, se decidió estudiar, a continuación, el efecto de dexametasona, un reconocido inductor de resistencia a la insulina (24)(25), sobre la respuesta celular inducida por la insulina. Para esto, los adipocitos 3T3-L1 fueron primero pre-tratados con dexametasona (0-1000 nM) durante 48 horas, después de lo cual se midió la respuesta observada frente a un estímulo con insulina 1000 nM por 16 horas.
En la Figura 5 se observa que los adipocitos control (sin dexametasona) respondieron al estímulo con insulina disminuyendo un 21% la glucosa extracelular (p<0,001), respuesta asociada al consumo de glucosa estimulado por insulina. El pre-tratamiento con dexametasona 0,1 nM no afectó la respuesta frente a la insulina (25% de reducción; p<0,001). Sin embargo, a concentraciones de dexametasona de 1 nM, o superior, el glucocorticoide comenzó a inhibir el efecto de la insulina, y lo hizo en una manera dependiente de la concentración utilizada (Fig. 5). El máximo efecto inhibitorio se observó en concentraciones de dexametasona de 10, 100 y 1000 nM, donde el nivel de glucosa extracelular fue estadísticamente similar al control basal sin insulina (Fig. 5).

Figura 5. Inhibición mediada por dexametasona del efecto de insulina sobre los niveles de glucosa extracelular en células adiposas 3T3-L1. Adipocitos diferenciados en placas de 24 pozos fueron pre-tratados por 48 h con dexametasona (Dex) a las concentraciones indicadas y luego tratados con medio control sin (-) o con (+) insulina 1 mM para estimular el consumo celular de glucosa. Se representa el promedio y la desviación estándar (n=5). **p≤0,01; ***p≤0,001.
Discusión y Conclusiones
El presente trabajo se enfocó en evaluar la aplicación de un método colorimétrico para la cuantificación y consumo de glucosa en cultivos de células adiposas. Como modelo celular se utilizó la línea de 3T3-L1, que se caracteriza por la capacidad de diferenciarse a células adiposas maduras bajo estimulación hormonal apropiada. Aplicando el protocolo de diferenciación descrito en la metodología, el cultivo de células 3T3-L1 adquirió un fenotipo característico de las células adiposas maduras. A continuación, se utilizó un reactivo que se comercializa para cuantificar glucosa en muestras de suero o plasma a nivel del laboratorio clínico y cuyo fundamento es el uso de dos reacciones enzimáticas acopladas para convertir la glucosa en un producto colorimétrico que absorbe entre 490 y 500 nm.
Los resultados mostraron que el método colorimétrico aplicado es útil para cuantificar glucosa y consumo de glucosa en muestras de células adiposas 3T3-L1 y, además, permite detectar cambios en los niveles de glucosa en respuesta al tratamiento con insulina. En efecto, el tratamiento de las células adiposas 3T3-L1 con insulina 100 o 1000 nM llevó a una disminución significativa de la glucosa extracelular, manifestada en un comportamiento bifásico en el período de tiempo estudiado (0-16 horas). Esta respuesta es un reflejo del efecto de la hormona a nivel celular, donde la interacción con el receptor de insulina gatilla la activación de una vía de señalización que conduce al ingreso de glucosa a la célula, mediado por el transportador de glucosa Glut4 (primera fase en minutos), y luego una segunda fase lenta (en horas) donde existen ajustes metabólicos dados por el efecto de la hormona sobre la expresión génica (26)(27). Este resultado no sólo evidenció la utilidad del ensayo para cuantificar glucosa en el cultivo celular, sino que, además, indica que el método puede ser utilizado como un ensayo funcional en esta línea celular. Lo anteriormente expuesto se confirmó al estudiar el efecto de dexametasona, un fármaco que induce resistencia a la insulina en las células. En este caso, el pre-tratamiento de las células adiposas 3T3-L1 con dexametasona 10, 100 o 1000 nM durante 48 horas resultó en la pérdida de la respuesta a la insulina, lo que concuerda con lo reportado por otros autores (24)(25). Todos los cambios reportados en el presente estudio fueron obtenidos dentro del rango de linealidad del ensayo.
Un hecho que vale la pena destacar es que, con el método colorimétrico aplicado, los efectos se observaron al estimular con concentraciones de insulina 100-1000 nM, superiores a las reportadas con los ensayos basados en el uso de radioisótopos, donde usualmente se observan efectos con insulina 5-100 nM (15)(16)(28)(29). Esta diferencia podría deberse a las diferencias de sensibilidad que existen entre ambos tipos de métodos y/o a diferencias en las condiciones experimentales utilizadas; por ejemplo, la concentración inicial de glucosa que en nuestro caso fue alta (200 mg/dL) y que será un punto a considerar en futuros ajustes del protocolo para otras aplicaciones.
Otro aspecto importante de este trabajo es el relacionado con el concepto de consumo de glucosa. Mientras los ensayos de glucosa radiactivos se enfocan, principalmente en el proceso de transporte de glucosa al interior celular, el método enzimático-colorimétrico aplicado en este estudio involucra no sólo el transporte de este azúcar sino también su utilización metabólica, la que, por la escala de tiempo estudiada (0-16 h), debe ser el principal proceso reflejado. Este hecho se considera una ventaja de este ensayo ya que es más acorde con el contexto fisiológico que experimentan las células de nuestro organismo, donde existen picos breves de insulina post-prandial que estimulan el rápido ingreso de glucosa a las células y que se suman a los efectos de niveles de la insulina basal que mantienen un estímulo permanente sobre el metabolismo de las células y tejidos (30).
En conjunto, estos resultados avalan la capacidad del método colorimétrico para cuantificar, de manera directa, glucosa extracelular y al mismo tiempo, el consumo de glucosa estimulado por insulina (de manera indirecta) en las células adiposas 3T3-L1. En las búsquedas bibliográficas realizadas no se han encontrado reportes de la aplicación de un ensayo colorimétrico para la cuantificación de glucosa o del consumo de glucosa en cultivos de células adiposas ni de otros tipos de células animales. En consecuencia, los datos presentados en este trabajo se constituyen en resultados novedosos y pioneros en el campo, y representan una nueva aplicación del método colorimétrico comercial de glucosa. Aunque en este estudio sólo se evaluó una marca comercial de reactivo de glucosa, los autores consideran que los mismos resultados deberían ser observados con reactivos de otras marcas basados en los mismos principios de medición.
El empleo exitoso del método enzimático-colorimétrico basado en reactivos seguros y económicos permiten proponerlo como una alternativa experimental segura, sencilla y de menor costo al de los métodos existentes, para este tipo de análisis. Especialmente, en el caso de laboratorios con un presupuesto reducido o que no cuenten con instalaciones o protocolos para el manejo de isótopos radioactivos.
También vale la pena señalar que el procedimiento descrito en este artículo, con sus respectivos y apropiados ajustes, podría servir de base para el desarrollo de nuevos bioensayos como aquellos enfocados, por ejemplo, en el tamizaje preliminar de moléculas con potencial farmacológico de origen natural o sintético (hipoglicemiantes, sensibilizadores a la insulina y antibióticos, entre otros). Otras potenciales aplicaciones podrían darse en el campo de la investigación clínica mediante el desarrollo de ensayos funcionales que permitan identificar marcadores serológicos asociados con sensibilidad o resistencia a la insulina, lo que representa un tema de gran relevancia clínica debido a la asociación que existe entre la resistencia a la insulina y ciertas patologías (31)(32), así como entre ésta y ciertas complicaciones peri- y post-operatorias durante el manejo anestésico de cirugías programadas (33)(34).
En conclusión, en este trabajo se presenta la primera evidencia experimental de la aplicación exitosa de un método enzimático-colorimétrico para cuantificar glucosa y consumo de glucosa en células adiposas 3T3-L1. El método debería ser aplicable a otros tipos de células animales y también procariotas, y servir de base para el diseño de nuevos bioensayos funcionales con aplicación en distintos campos de las biociencias.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, Vicerrectoría de Investigación, Dirección de investigación de Sede Bogotá (DIB) por la financiación del presente trabajo a través del Proyecto Hermes Código 9014 (Código QUIPU Nº 201010012698).
A la Vicerrectoría de Investigación de la Universidad de Cartagena, por el apoyo al Fortalecimiento de grupos año 2013.
Al Departamento de Farmacia de la Universidad Nacional de Colombia, Laboratorio de ensayos Farmacológicos, por el acceso a la unidad de cultivos celulares.
DECLARACIÓN DE CONFLICTO DE INTERÉS
Los autores declaran no tener conflictos de interés de ningún tipo en la realización del presente trabajo.
Referencias bibliográficas
1. Brown PD, Badal S, Morrison S, Ragoobirsingh D. Acute impairment of insulin signalling by dexamethasone in primary cultured rat skeletal myocytes. Mol Cell Biochem 2007; 297 (1-2): 171-7. [ Links ]
2. Sokoloff L, Reivich M, Kennedy C, Des Rosiers MH, Patlak CS, Pettigrew KD, et al. The [14C] deoxyglucose method for the measurement of local cerebral glucose utilization: theory, procedure, and normal values in the conscious and anesthetized albino rat. J Neurochem 1977; 28 (5): 897-916. [ Links ]
3. Vogel HG. Drug discovery and evaluation: Pharmacological assays. 3a edición. Vogel HG, Maas J, Gebauer A, editores. Germany: Springer; 2008. p. 1398-400. [ Links ]
4. Leira F, Louzao MC, Vieites JM, Botana LM, Vieytes MR. Fluorescent microplate cell assay to measure uptake and metabolism of glucose in normal human lung fibroblasts. Toxicol In vitro 2002; 16 (3): 267-73. [ Links ]
5. O’Neil RG, Wu L, Mullani N. Uptake of a fluorescent deoxyglucose analog (2-NBDG) in tumor cells. Mol Imaging Biol 2005; 7 (6): 388-92.
6. Yamada K, Saito M, Matsuoka H, Inagaki N. A real-time method of imaging glucose uptake in single, living mammalian cells. Nat Protoc 2007; 2 (3): 753-62. [ Links ]
7. Yoshioka K, Takahashi H, Homma T, Saito M, Oh KB, Nemoto Y, et al. A novel fluorescent derivative of glucose applicable to the assessment of glucose uptake activity of Escherichia coli. Biochim Biophys Acta 1996; 1289 (1): 5-9. [ Links ]
8. Passey RB, Gillum RL, Fuller JB, Urry FM, Giles ML. Evaluation and comparison of 10 glucose methods and the reference method recommended in the proposed product class standard (1974). Clin Chem 1977; 23 (1): 131-9. [ Links ]
9. Green H, Meuth M. An established pre-adipose cell line and it’s differentation in culture. Cell 1974; 3 (2): 127-33.
10. Green H, Kehinde O. An established preadipose cell line and its differentiation in culture. II. Factors affecting the adipose conversion. Cell 1975; 5 (1): 19-27. [ Links ]
11. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969; 6: 24-7. [ Links ]
12. Ntambi JM, Young-Cheul K. Adipocyte differentiation and gene expression. J Nutr 2000; 130 (12): 3122S - 6S. [ Links ]
13. Russell TR, Ho R. Conversion of 3T3 fibroblasts into adipose cells: Triggering of differentiation by prostaglandin F2alpha and 1-methyl-3-isobutyl xanthine. Proc Natl Acad Sci USA 1976; 73 (12): 4516-20. [ Links ]
14. Sakoda H, Ogihara T, Anai M, Funaki M, Inukai K, Katagiri H, et al. Dexamethasone-induced insulin resistance in 3T3-L1 adipocytes is due to inhibition of glucose transport rather than insulin signal transduction. Diabetes 2000; 49 (10): 1700-8. [ Links ]
15. Shizuka T, Nagashima T, Kajita K, Miura A, Yamamoto M, Itaya S, et al. Effect of glucocorticoid receptor antagonist RU 38486 on acute glucocorticoid-induced insulin resistance in rat adipocytes. Metabolism 1997; 46 (9): 997-1002. [ Links ]
16. Kajita K, Ishizuka T, Miura A, Kanoh Y, Ishizawa M, Kimura M, et al. Glucocorticoid-Induced insulin resistance associates with activation of protein kinase C isoforms. Cell Signal 2001; 13 (3): 169-75. [ Links ]
17. Gathercole LL, Bujalska IJ, Stewart PM, Tomlinson JW. Glucocorticoid modulation of insulin signaling in human subcutaneous adipose tissue. J Clin Endocrinol Metab 2007; 92 (11): 4332-9. [ Links ]
18. Buren J, Liu HX, Jensen J, Eriksson JW. Dexamethasone impairs insulin signalling and glucose transport by depletion of insulin receptor substrate-1, phosphatidylinositol 3-kinase and protein kinase B in primary cultured rat adipocytes. Eur J Endocrinol 2002; 146: 419-29. [ Links ]
19. D’Agostino R, Pearson ES. Tests for departure from normality. Empirical results for the distributions of b2 and √ b1. Biometrika 1973; 60 (3): 613-22.
20. Cochran WG. The distribution of the largest of a set of estimated variances as a fraction of their total. Ann Hum Genet 1941; 11 (1): 47-52. [ Links ]
21. Hartley HO. The use of range in analysis of variance. Biometrika 1950; 37 (3-4): 271-80. [ Links ]
22. Fisher RA. The correlation between relatives on the supposition of mendelian inheritance. Philos Trans R Soc Edinburgh 1918; 52: 399-433. [ Links ]
23. Dunnett CW. A multiple comparison procedure for comparing several treatments with a control. J Am Stat Assoc 1955; 50 (272): 1096-121. [ Links ]
24. Andrews RC, Walker BR. Glucocorticoids and insulin resistance: old hormones, new targets. Clin Sci (Lond) 1999; 96 (5): 513-23. [ Links ]
25. Ruzzin J, Wagman AS, Jensen J. Glucocorticoid-induced insulin resistance in skeletal muscles: defects in insulin signalling and the effects of a selective glycogen synthase kinase-3 inhibitor. Diabetologia 2005; 48 (10): 2119-30. [ Links ]
26. Saltiel A, Kahn C. Insulin signalling and the regulation of glucose and lipid metabolism. Nature 2001; 414 (6865): 799-806. [ Links ]
27. Shi J, Kandror K. Study of glucose uptake in adipose cells. Methods Mol Biol 2008; 456: 307-15. [ Links ]
28. Ross SA, Chen X, Hope HR, Sun S, McMahon EG, Broschat K, et al. Development and Comparison of two 3T3- L1 adipocyte models of insulin resistance: increased glucose flux vs. glucosamine treatment. Biochem Biophys Res Commun 2000; 273 (3): 1033-41. [ Links ]
29. Li J, Houseknecht K, Stenbit A, Katz E, Charron M. Reduced glucose uptake precedes insulin signaling defects in adipocytes from heterozygous GLUT4 knockout mice. FASEB J 2000; 14 (9): 1117-25. [ Links ]
30. Bhatnagar S, Srivastava D, Jayadev M, Dubey A. Molecular variants and derivatives of insulin for improved glycemic control in diabetes. Prog Biophys Mol Biol 2006; 91: 199-228. [ Links ]
31. Alam S, Mustafa G, Alam M, Ahmad N. Insulin resistance in development and progression of nonalcoholic fatty liver disease. World J Gastrointest Pathophysiol 2016; 7 (2): 211-7. [ Links ]
32. El Hayek S, Bitar L, Hamdar LH, Mirza FG, Daoud G. Poly Cystic Ovarian Syndrome: an updated overview. Front Physiol 2016; 7: 124. [ Links ]
33. Pomares J, Palomino RR, Gómez CJ, Gómez Camargo D. Metabolic syndrome and perioperative complications during elective surgery using general anesthesia. Rev Colomb Anestesiol 2012; 40 (2): 106-12. [ Links ]
34. Pomares J, Mora-García G, Palomino R, De León YD, Gómez-Alegría C, Gómez-Camargo D. Metabolic syndrome and perioperative complications during scheduled surgeries with spinal anesthesia. Open J Anesth 2014; 4: 167-76. [ Links ]
Recibido: 14 de junio de 2016
Aceptado: 11 de agosto de 2016














