Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.51 no.2 La Plata jun. 2017
BIOQUÍMICA CLÍNICA
Evaluación de la zona gamma del proteinograma por electroforesis: correspondencia clínico-patológica*
Evaluation of protein electrophoresis in the gamma zone: clinicopathological correspondence
Avaliação da área gamma do proteinograma por eletroforese: correspondência clínico-patológica
María José Boban1, Rafael de Elías2, Oscar Kiener2, Gisel Kiener1, Valeria Jarmi3, Silvia Barzón3
1 Bioquímica.
2 Bioquímico Especialista en Química Clínica.
3 Bioquímica Especialista en Inmunología.
* Laboratorio Central del Sanatorio Allende. Av. Pedro Laplace (5009), Bº Cerro de las Rosas, Córdoba. República Argentina.
CORRESPONDENCIA MARÍA JOSÉ BOBAN Laboratorio Central del Sanatorio Allende Av. Pedro Laplace 5749, Bº Villa Belgrano 5009 CÓRDOBA, República Argentina. E-mail: majoboban@hotmail.com
Resumen
El proteinograma por electroforesis (PxE) sérico es solicitado para detectar modificaciones del perfil proteico. El objetivo del trabajo fue evaluar las alteraciones de la zona gammaglobulina y su correspondencia con distintos estados clínico-patológicos. Se incluyeron 7.259 pacientes (1-89 años) a los que en 2013 se les solicitó PxE. Según el trazado densitométrico, en la zona gammaglobulina se reconocieron diferentes grupos: hipogammaglobulinemia (<0,60 g/dL), hipergammaglobulinemia policlonal (≥1,80 g/dL), banda monoclonal (BM) y bandas oligoclonales. Prevaleció la hipergammaglobulinemia policlonal (4,2%), seguida por BM (1,4%) e hipogammaglobulinemia (0,8%). Hipergammaglobulinemia policlonal (>3 g/dL) se observó en: hepatitis autoinmune, cirrosis, síndrome de Sjögren, enfermedad mixta del tejido conectivo, HIV, hepatitis C y enfermedad de Castleman. El hallazgo de BM correspondió a 47% de pacientes con gammapatía monoclonal de significado incierto y 40% con mieloma múltiple; el 0,5% fueron casos nuevos. Con hipogammaglobulinemias, en adultos prevaleció la inmunosupresión terapéutica (55%), seguida por diabetes/síndrome metabólico/hipotiroidismo (23%); en niños, 22% por inmunosupresión y 78% con hipogammaglobulinemia no clasificada como inmunodeficiencia primaria. Se concluye que en 6,4% de los PxE se observó alteración de la zona gammaglobulina; prevaleció la hipergammaglobulinemia policlonal. En 1 de cada 200 PxE se pesquisó un paciente con BM. El hallazgo de hipergammaglobulinemia policlonal o BM se correspondió con distintos estados clínico-patológicos.
Palabras clave: Proteinograma por electroforesis; Hipogammaglobulinemia; Hipergammaglobulinemia; Zona gammaglobulinas; Banda monoclonal.
Abstract
Serum protein electrophoresis (PEP) is requested to screen changes in the protein profile. The aim of this study was to evaluate alterations in the gamma globulin zone and correspondence with various clinical and pathological states. 7259 patients were included (1-89 years of age) who had been requested a PEP in 2013. According to the densitometric tracing, in the gamma globulin zone different groups were recognized: hypogammaglobulinemia (<0.60 g/dL), polyclonal hypergammaglobulinemia (≥1,80 g/dL), monoclonal band (MB) and oligoclonal band. The polyclonal hypergammaglobulinemia prevailed (4.2%), followed by MB (1.4%) and hypogammaglobulinemia (0.8%). Polyclonal hypergammaglobulinemia (>3 g/dL) was observed in autoimmune hepatitis, alcoholic cirrhosis, Sjögren’s syndrome, mixed connective tissue disease, HIV, hepatitis C and Castleman’s disease. The MB finding corresponded to a 47% of patients with monoclonal gammopathy of undetermined significance and 40% with multiple myeloma; 0.5% were new cases. In adults, hipogammaglobulinemias prevailed in therapeutic immunosuppression cases (55%), followed by patients with diabetes/ metabolic syndrome/ hypothyroidism (23%); in children, 22% with immunosuppression and 78% corresponded to hipogammaglobulinemias not classified as primary immunodeficiency. To conclude, an alteration in the gamma globulin zone was observed in 6.4% of PEP. In 1 out of 200 PEP MB was found. The finding of polyclonal hypergammaglobulinemia or MB corresponded to different clinicopathological states.
Key words: Protein electrophoresis; Hypogammaglobulinemia; Hypergammaglobulinemia; Gammaglobulin zone; Monoclonal band.
Resumo
O proteinograma por eletroforese (PXE) sérico é solicitado para detectar modificações no perfil proteíco. O objetivo do trabalho foi avaliar as alterações da área gammaglobulina e sua correspondência com diversos estados clínico-patológicos. Incluíram-se 7259 pacientes (1-89 anos) aos quais, em 2013, foi solicitado um PxE. De acordo com o traçado densitométrico, na área gammaglobulina, diferente grupos foram reconhecidos: hipogammaglobulinemia (<0,60 g/dL), hipergammaglobulinemia policlonal (≥1,80 g/dL), banda monoclonal (BM) e bandas oligoclonais. Prevaleceu a hipergammaglobulinemia policlonal (4,2%), seguida por BM (1,4%) e hipogammaglobulinemia (0,8%). Hipergammaglobulinemia policlonal (>3 g/dL) foi observada em: Hepatite autoimune, cirrose, síndrome de Sjögren, doença mista do tecido conjuntivo, HIV, hepatite C e doença de Castleman. O achado de BM correspondeu a 47% de pacientes com gammapatia monoclonal de significado indeterminado e 40% com mieloma múltiplo; 0,5% eram casos novos. Com hipogammaglobulinemias em adultos prevaleceu a imunossupressão terapêutica (55%), seguida por diabete/síndrome metabólica/hipotireoidismo (23%); em crianças, 22% por imunossupressão e 78% com hipogammaglobulinemia não classificados como imunodeficiência primária. Conclui-se que em 6,4% dos PxE foi observada alteração da área gammaglobulina; prevaleceu a hipergammaglobulinemia policlonal. Em 1 de cada 200 PxE foi encontrado um paciente com BM. O achado de hipergammaglobulinemia policlonal ou BM se correspondeu com diferentes estados clínico-patológicos.
Palavras-chave: Proteinograma por eletroforese; Hipogammaglobulinemia; Area gammaglobulinas; Hipergammaglobulinemia; Banda monoclonal.
Introducción
El método de elección para realizar una evaluación visual y semicuantitativa de las proteínas séricas es el proteinograma por electroforesis (PxE). La migración de proteínas séricas en un campo electroforético depende de varios factores que incluyen: el soporte empleado, el pH del buffer, la concentración de electrolitos, la temperatura, la cantidad de corriente aplicada y el punto isoeléctrico de las moléculas a separar (1) (2). En la actualidad se recomienda la utilización de técnicas de alta resolución, como la electroforesis en gel de agarosa, la cual resuelve al menos 6 bandas: albúmina, alfa 1 (a1), alfa 2 (a2), beta 1 (b1), beta 2 (b2) y gammaglobulinas (g); la fracción beta globulinas se desdobla en transferrina (b1) y complemento C3 (b2). La alta resolución resulta de una combinación de factores: control de temperatura, uso de lactato de calcio en el buffer, espesor del gel y aplicación de la muestra; todos estos parámetros están estandarizados en los sistemas automatizados de electroforesis. La automatización mejora la resolución de la corrida electroforética, permitiendo no sólo la mejor detección de una banda monoclonal (BM) beta-migrante, sino también la pesquisa de una pequeña BM (1-4).
En un trazado densitométrico normal se visualiza la albúmina como un pico homogéneo, seguido de las 5 fracciones globulinas con aspecto heterogéneo. La inspección visual de la corrida electroforética es de gran utilidad para evaluar alteraciones en la zona g; la ubicación de las inmunoglobulinas en el PxE comprende la zona b-g, siendo característica la migración en b de IgA y en g de IgG e IgM (1) (2) (5). El aumento o disminución de las inmunoglobulinas se evidencia por modificaciones en el trazado densitométrico. La presencia de una banda heterogénea
ancha, generalmente de movilidad g o b-g, sugiere un incremento policlonal de las inmunoglobulinas denominada hipergammaglobulinemia policlonal, la presencia de una banda homogénea que puede migrar desde las g hasta las a2 globulinas se denomina BM y una disminución de la región g se interpreta como hipogammaglobulinemia (3) (5-7). La presencia de dos o más bandas escalonadas en la zona g se define como bandas oligoclonales (6).
Las alteraciones observadas pueden ser el signo o manifestación de una enfermedad subyacente o ser atribuidas a alguna causa en particular, como a un determinado tratamiento. Una hipogammaglobulinemia debe ser documentada por la cuantificación en suero de IgG, IgA e IgM (3) (7) (8). En la hipergammaglobulinemia policlonal, la inspección visual y porcentual del trazado densitométrico del PxE sérico es suficiente para establecer esta condición (9). A diferencia de las anteriores, el hallazgo de una BM orienta a la sospecha clínica de un desorden proliferativo clonal de células plasmáticas o células B, lo cual es mandatorio para realizar estudios complementarios de cuantificación y caracterización de la proteína monoclonal, tales como inmunofijación y cuantificación de cadenas livianas libres. Además, se debe solicitar un perfil bioquímico y radiológico junto a la punción de médula ósea para poder establecer la condición clínica del paciente (2-4) (10).
Cabe resaltar que las hipergammaglobulinemias pueden ser policlonales o monoclonales; el informe de un PxE debe ir acompañado del trazado densitométrico lo cual evitaría una confusión en la interpretación y estudios innecesarios al paciente (3).
El objetivo del presente trabajo es revalorizar la información obtenida por el PxE sérico de la zona g y a partir de la observación visual y trazado densitométrico establecer correspondencia con distintos estados clínico-patológicos.
Materiales y Métodos
DISEÑO DEL TRABAJO
Estudio observacional, retrospectivo y transversal.
PACIENTES
Se evaluaron todos los pacientes consecutivos (n=8.907) que en 2013 fueron atendidos en el Laboratorio Central del Sanatorio Allende de la Ciudad de Córdoba (sucursal Villa Belgrano o Nueva Córdoba), con solicitud de PxE. Las muestras se obtuvieron por punción venosa; los pacientes concurrieron por consultorio externo con un ayuno mínimo de 8 horas o se encontraban internados en la institución. La sangre fue recolectada en tubos Vacutainer® con gel separador; se siguieron las instrucciones del fabricante para la obtención del suero. Las muestras fueron procesadas el mismo día que se obtuvieron; en caso de haber sido necesario se conservaron, hasta su procesamiento a 4 ºC por un tiempo máximo de 48 h y por períodos más prolongados a -20 ºC. Los datos clínicos, diagnóstico y resultados de estudios complementarios fueron obtenidos de las historias clínicas informatizadas de la institución. El protocolo de trabajo se rigió por la declaración de Helsinki.
MUESTRA ESTUDIADA
La muestra estuvo constituida por los resultados de PxE del primer ingreso del paciente al sistema informático del laboratorio; se excluyeron resultados repetidos en el período evaluado y pacientes menores de 1 año de edad. En todos los pacientes estudiados el PxE correspondió a una única determinación, reflejando diferentes situaciones clínicas o distintos estadios de la enfermedad y/o tratamientos.
DETERMINACIÓN DE PROTEÍNAS TOTALES
La determinación de proteínas totales se realizó en un autoanalizador Hitachi Modular P (Roche Diagnostics, Rotkreuz, Suiza) por el método colorimétrico de Biuret. Las proteínas totales fueron utilizadas para calcular los g/dL de las fracciones proteicas a partir del trazado densitométrico.
PROTEINOGRAMA SÉRICO POR ELECTROFORESIS
La electroforesis fue realizada en el autoanalizador Interlab G26 (Interlab, Roma, Italia) sobre geles de agarosa de alta resolución. A partir de la carga manual de las muestras el procedimiento se efectuó en forma totalmente automatizada hasta la visualización del trazado densitométrico en el soft provisto por el fabricante del equipo. La técnica electroforética resolvió 6 fracciones: albúmina, a1, a2, b1, b2 y g. Los PxE fueron evaluados por un profesional bioquímico entrenado en electroforesis; para cada muestra la interpretación de la región g fue consignada en el sistema informático del laboratorio como: normal, hipogammaglobulinemia (<0,60 g/dL), hipergammaglobulinemia policlonal (≥1,80 g/dL), BM (acompañado de la región en la cual se observó dicha banda) o bandas oligoclonales. La técnica empleada requirió una concentración mínima de aproximadamente 0,05 g/dL de proteína para ser visualizada como BM.
Resultados
Los pacientes incluidos en el estudio fueron divididos de acuerdo con la concentración y característica de la región g del PxE según se detalla en la Figura 1. Las corridas electroforéticas fueron interpretadas en forma visual y por el trazado densitométrico (Figura 2). El 6,4% (462/7259) de los PxE tuvieron alguna alteración en la región g. En la Tabla I se detallan las características demográficas de cada grupo de pacientes.

Figura 1. Pacientes evaluados e incluidos en el estudio.

Figura 2. Corrida electroforética y trazado densitométrico.
A. Normal. B. Hipogammaglobulinemia. C. Banda monoclonal en zona gammaglobulinas. D. Hipergammaglobulinemia policlonal a expensas de IgG y/o IgM con herradura b-γconservada. E. Hipergammaglobulinemia policlonal a expensas de IgG y/o IgM con desaparición de la herradura b-γpor incremento de IgA. F. Desaparición de la herradura b-γa expensas de IgA.
Tabla I. Características demográficas de los pacientes con alteración en zona g

La hipergammaglobulinemia policlonal fue el hallazgo más frecuente, seguido por los pacientes con BM y en menor proporción con hipogammaglobulinemia. La mayor prevalencia de niños con alteración en la región g se observó en este último grupo (Tabla II); el 78%, entre 19 meses y 4 años de edad, tuvieron manifestaciones clínicas tales como: enfermedades alérgicas, diarrea e infecciones de vías aéreas superiores que requirieron sólo tratamiento sintomático. El resto de los niños, y la mayor proporción de adultos con esta condición, correspondieron a pacientes que recibieron terapia inmunosupresora o quimioterapia por su enfermedad de base. El 11% de los pacientes adultos con linfoma o leucemia linfática crónica no estaba recibiendo terapia farmacológica al momento del PxE. El 23% de los pacientes con hipogammaglobulinemia tuvieron como único hallazgo clínico diabetes o insulino resistencia, junto a otras patologías como síndrome metabólico, hipertensión arterial o hipotiroidismo.
Tabla II. Pacientes con hipogammaglobulinemia (g<0,60 g/dL)

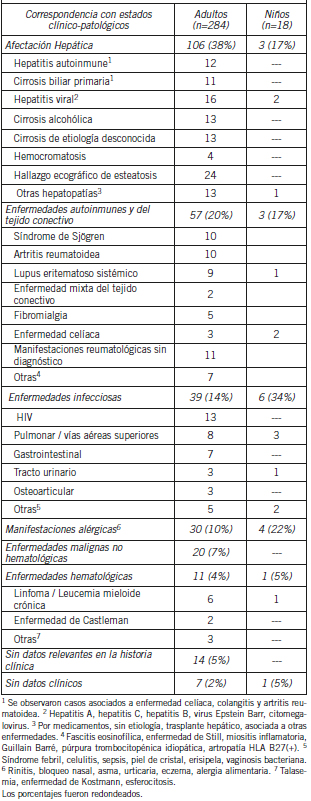
En el grupo de pacientes con hipergammaglobulinemia policlonal la proporción de niños fue menor que en aquellos con hipogammaglobulinemia; en esta población etaria, las patologías más frecuentes fueron las infecciosas seguidas por las alérgicas. Con respecto a los adultos, las enfermedades hepáticas fueron las más prevalentes. Se reconoció un 23% de pacientes con hipergammaglobulinemia (entre 1,8 y 2,5 g/dL), sin un diagnóstico establecido; en las historias clínicas se constató uno o más de los siguientes signos: movilización de enzimas hepáticas, sobrepeso y/o dislipemia, pero todos tuvieron en común una ecografía con distintos grados de esteatosis hepática. El segundo grupo de patologías más prevalentes fueron las enfermedades autoinmunes y del tejido conectivo, seguidas por las enfermedades infecciosas. En la Tabla III se detallan las condiciones clínico-patológicas observadas en este grupo de pacientes. Hipergammaglobulinemias policlonales con g >3,0 g/dL fueron observadas en pacientes con enfermedad hepática, enfermedades del tejido conectivo y HIV; en un paciente con enfermedad de Castleman se observó una g >5 g/dL a expensas de todas las inmunoglobulinas. Un 5% de los pacientes tuvieron una hipergammaglobulinemia policlonal entre 1,8 y 2,7 g/dL sin datos clínicos relevantes que pudieran estar asociados a esta condición.
Tabla III. Pacientes con hipergammaglobulinemia policlonal (g≥1,80 g/dL)
En la Tabla IV se detallan los pacientes con BM; la patología más prevalente fue la gammapatía monoclonal de significado incierto (GMSI) seguida por mieloma múltiple (MM). El rango etario de estos pacientes fue de 34 a 89 años; el paciente de menor edad con MM tuvo 34 años, con GMSI 42 años y con macroglobulinemia de Waldeström 49 años. En 4 individuos con GMSI (3 femenino; 1 masculino) la patología de base fue el síndrome de Sjögren. De los 101 pacientes, el 39% fueron identificados como casos nuevos; del total de PxE realizados en el año, el 0,5% (39/7259) correspondió a un nuevo sujeto con BM.
Tabla IV. Pacientes con banda monoclonal

En tres pacientes se observaron bandas oligoclonales en la zona g; en uno de ellos, de 62 años, dos meses pos autotrasplante de médula ósea, debido a un MM, otra paciente de 48 años con HIV y la restante de 17 años, que al momento del PxE cursaba una infección por citomegalovirus.
Discusión y Conclusiones
En la serie de casos estudiada se observó que el 6,4% de los pacientes tuvieron alguna alteración de la zona g del PxE sérico. El hallazgo más prevalente fue una hipergammaglobulinemia policlonal, seguido por la observación de BM e hipogammaglobulinemia. Se pudo establecer que 1 de cada 200 PxE realizados correspondió a un nuevo paciente con BM.
Al igual que lo observado por Dispenzieri et al. (9) y otros autores (6)(7), en pacientes adultos, las afectaciones hepáticas fueron las que más se correspondieron con una hipergammaglobulinemia policlonal, seguidas por las enfermedades autoinmunes y del tejido conectivo, enfermedades infecciosas, manifestaciones alérgicas, neoplasias no hematológicas y enfermedades hematológicas; en el 5% de los casos no se pudo establecer una asociación clínico-patológica que justificara dicho hallazgo. El aumento policlonal de inmunoglobulinas es frecuente en pacientes con enfermedad hepática crónica, aunque el mecanismo que explique dicho incremento no ha sido aun descripto, se ha postulado que como consecuencia de la disfunción hepática existiría un reducido clearence hepático de antígenos y endotoxinas, lo que produciría un significativo incremento en la activación de linfocitos; también se postula un deterioro de la remoción de anticuerpos circulantes. El incremento policlonal de inmunoglobulinas tendría un importante rol en la patogénesis de la fibrosis y en la progresión de la enfermedad hepática (11-13).
El mayor incremento policlonal se observó en pacientes con hepatitis autoinmune, cirrosis hepática, síndrome de Sjögren, enfermedad mixta del tejido conectivo, HIV, hepatitis C y enfermedad de Castleman. Al igual que lo observado por otros autores, se reconocieron en el trazado densitométrico patrones característicos de elevación de inmunoglobulinas en: hepatitis autoinmune (IgG elevada, representada por el incremento de g conservando la herradura b-g), cirrosis biliar primaria (IgM elevada, incremento de g conservando la herradura b-g), en enfermedad hepática alcohólica (IgA elevada, con desaparición de la herradura b-g) y en HIV el perfil densitométrico evidenció desaparición de la herradura b-g (por incremento de IgA) y aumento de g (a expensas de IgG y/o IgM) (6) (9) (11) (14) (15). Tan relevante es identificar el incremento policlonal, que en hepatitis autoinmune un aumento de IgG sérica de 1,1 veces el límite superior normal es el “sello” de esta enfermedad y forma parte de los criterios diagnósticos simplificados (13)(16).
Es bien documentada la hipergammaglobulinemia policlonal observada en los procesos autoinmunes e infecciosos (15) (17-20), al igual que en enfermedad hepática crónica, sin embargo, hay poca evidencia de lo que ocurre en estadios tempranos de acumulación grasa (21). En los casos estudiados, el 23% de los pacientes con aumento de g policlonal tuvieron por examen ecográfico, distintos grados de esteatosis hepática, sin un diagnóstico que justifique dicho incremento; esta observación fue considerada un hallazgo.
En pacientes con BM, la mitad de los casos nuevos requirió tratamiento debido a que fueron diagnosticados con MM, macroglobulinemia de Waldeström, amiloidosis o linfoma; los restantes correspondieron a pacientes con GMSI. La GMSI es una condición asintomática y uno de los más prevalentes desórdenes premalignos en personas mayores de 50 años, con un riesgo del 1% por año de progresión a MM, de ahí la importancia de la pesquisa y seguimiento de estos pacientes (10) (22-24). Se pesquisó un nuevo caso con BM en el 0,5% de todos los PxE realizados en un año; se estableció para GMSI una prevalencia del 1% en adultos mayores a 30 años, este valor es concordante con lo observado por Wadhera y Rajkumar (25). En todos los casos con BM se pudo establecer una correspondencia clínico-patológica.
La hipogammaglobulinemia puede ser una condición fisiológica, congénita o adquirida (2) (6-8); en este estudio prevaleció la presentación adquirida, secundaria a un tratamiento inmunosupresor o quimioterapia. El 78% de los niños manifestó una hipogammaglobulinemia sintomática pero no clasificada dentro de las inmunodeficiencias primarias. La hipogammaglobulinemia fue el signo que motivó estudios complementarios, que confirmaron el diagnóstico, en un paciente con enfermedad de cadenas livianas. Es reconocido que el 10% de los pacientes con MM y el 20% de los sujetos con amiloidosis primaria se manifiestan con una hipogammaglobulinemia en el PxE sérico; en estos pacientes también es probable observar un patrón electroforético compatible con síndrome nefrótico (2) (6) (7). Es mandatorio solicitar estudios para gammapatía monoclonal en sujetos adultos en los cuales se evidencia una hipogammaglobulinemia no terapéutica. Un 23% de pacientes con esta condición tuvieron en común, diabetes tipo 2 o insulino resistencia y otras patologías asociadas; aunque en sujetos diabéticos han sido descriptas alteraciones en la inmunidad celular, hay pocas evidencias sobre defectos en la inmunidad humoral (26); un estudio prospectivo podría dilucidar el significado de este hallazgo.
La observación de bandas oligoclonales en el PxE en pacientes pos autotrasplante de médula ósea está asociada a un buen pronóstico, actualmente también se observa en sujetos con gammapatía monoclonal en tratamiento con los nuevos esquemas terapéuticos (27). En enfermedades infecciosas causadas principalmente por citomegalovirus y virus de Epstein Barr, se ha reportado el hallazgo tanto de una pequeña BM como de bandas oligoclonales, las cuales desaparecen ante la resolución de la enfermedad (28) (29).
Distintas patologías, como por ejemplo linfoma, estuvieron presentes en más de una de las condiciones estudiadas, lo cual refleja las diversas formas de manifestación de la enfermedad, distintos estadios clínicos, tratamientos, etc., por lo cual es de suma importancia la correlación clínico-patológica del hallazgo en el PxE.
En conclusión, tanto las hipergammaglobulinemias policlonales como el hallazgo de una BM se correspondieron con distintos estados clínicos patológicos. En el informe de resultados del PxE emitido por el laboratorio se debe hacer referencia a la interpretación de la región g ya que para el profesional médico es orientativo en cuanto a la sospecha clínica y al tipo de estudios complementarios que deba solicitarle al paciente.
CONFLICTOS DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
AGRADECIMIENTOS
Los autores agradecen a la Bioquímica Gisela D’Astolfo y a la Sra. Angélica Ferreira Aguiar por la traducción al portugués.
1. Karcher RE, Landers JP. Electrophoresis. En: Burtis CA, Ashwood ER, Border B, Tietz NW, editors. Tietz fundamentals of clinical chemistry 6th ed. Philadelphia: W.B. Saunders Elseiver; 2001, p.: 102-11. [ Links ]
2. Keren DF. Procedures for the evaluation of monoclonal immunoglobulins. Arch Pathol Lab Med 1999; 123 (2): 126-32. [ Links ]
3. Kyle RA. Sequence of testing for monoclonal gammopathies. Archiv Pathol Lab Med 1999; 123 (2): 114-8. [ Links ]
4. Keren DF, Alexanian R, Goeken JA, Gorevic PD, Kyle RK, Tomar RH. Guidelines for clinical and laboratory evaluation of patients with monoclonal gammopathies. Arch Pathol Lab Med 1999; 123 (2): 106-7. [ Links ]
5. Jenkins MA. Serum and urine electrophoresis for detection and identification of monoclonal proteins. Clin Biochem Rev 2009; 30: 119-22. [ Links ]
6. Brousse C. Anomalías de la electroforesis de las proteínas sanguíneas. EMC-Tratado de Medicina. Cedex: EMC, 2008; 12 (3): 1-6. [ Links ]
7. Rajkumar SV. Recognition of monoclonal proteins. Kyle RA, Connor RF, editors. Waltham, MA: 2011. Disponible en: http//www.uptodate.com/contents/recognition-of-monoclonal-proteins. Fecha de acceso: 1 de junio de 2016. [ Links ]
8. Bezrodnik L, Gómez Raccio AC, Canil LM, Rey MA, Carabajal PC, Fossati CA, et al. Hypogammaglobulinaemia secondary to cow-milk allergy in children under 2 years of age. Immunology 2007; 122 (1): 140-6. [ Links ]
9. Dispenzieri A, Gertz MA, Therneau TM, Kyle RA. Retrospective cohort study of 148 patients with polyclonal gammopathy. Mayo Clin Proc 2001; 76: 476-87. [ Links ]
10. Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15 (12): e538-48. [ Links ]
11. Liu WT, Jing YY, Han ZP, Li XN, Liu Y, Lai FB, et al. The injured liver induces hyperimmunoglobulinemia by failing to dispose of antigens and endotoxins in the portal system. PLoS ONE 2015; 10 (3): e0122739. [ Links ]
12. Lebherz-Eichinger D, Schwarzer R, Motal MC, Klaus DA, Mangold A, Ankersmit HJ. Liver transplantation reverses hypergammaglobulinemia in patients with chronic hepatic failure. Biochem Med (Zagreb) 2015; 25 (2): 252-61. [ Links ]
13. Fallatah HI, Akbar HO. Elevated serum immunoglobulin G levels in patients with chronic liver disease in comparison to patients with autoimmune hepatitis. Libyan J Med 2010; 5: 4857. [ Links ]
14. Bruha R, Dvorak K, Petrtyl J. Alcoholic liver disease. World J Hepatol 2012; 4 (3): 8-90. [ Links ]
15. Ehrenstein MR, Isenberg DA. Hypergammaglobulinaemia and autoimmune rheumatic diseases. Ann Rheum Dis 1992; 51 (11): 1185-7. [ Links ]
16. Hennes EM, Zeniya M, Czaja AJ, Parés A, Dalekos GN, Krawitt EL, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology 2008; 48: 169-76. [ Links ]
17. Lo MS, Zurakowski D, Son MBF, Sundel RP. Hypergammaglobulinemia in the pediatric population as a marker for underlying autoimmune disease: a retrospective cohort study. Pediatric Rheumatol Online J 2013; 11: 42. [ Links ]
18. De Milito A, Nilsson A, Titanji K, Thorstensson R, Reizenstein E, Narita M, et al. Mechanisms of hypergammaglobulinemia and impaired antigen-specific humoral immunity in HIV-1 infection. Blood 2004; 103 (6): 2180-6. [ Links ]
19. Hunziker L, Recher M, Macpherson AJ, Ciurea A, Freigang S, Hengartner H, et al. Hypergammaglobulinemia and autoantibody induction mechanisms in viral infections. Nat Immunol 2003; 4 (4): 343-9. [ Links ]
20. Bournia VK, Vlachoyiannopoulos PG. Subgroups of Sjögren syndrome patients according to serological profiles. J Autoimmun 2012; 39: 15-26. [ Links ]
21. McPherson S, Henderson E, Burt AD, Day CP, Anstee QM. Serum immunoglobulin levels predict fibrosis in patients with non-alcoholic fatty liver disease. J Hepatol 2014; 60 (5): 1055-62. [ Links ]
22. Weiss BM, Kuehl WM. Advances in understanding monoclonal gammopathy of undetermined significance as a precursor of multiple myeloma. Expert Rev Hematol 2010; 3 (2): 165-74. [ Links ]
23. Bianchi G, Ghobrial IM. Does my patient with a serum monoclonal spike have multiple myeloma? Hematol Oncol Clin North Am 2012; 26 (2): 383-93. [ Links ]
24. Therneau TM, Kyle RA, Melton LJ, Larson DR, Benson JT, Colby CL, et al. Incidence of monoclonal gammopathy of undetermined significance and estimation of duration before first clinical recognition. Mayo Clin Proc 2012; 87 (11): 1071-9. [ Links ]
25. Wadhera RK, Rajkumar SV. Prevalence of monoclonal gammopathy of undetermined significance: a systematic review. Mayo Clin Proc 2010; 85 (10): 933-42. [ Links ]
26. Koh GC, Peacock SJ, van der Poll T, Wiersinga WJ. The impact of diabetes on the pathogenesis of sepsis. Eur J Clin Microbiol Infect Dis 2012; 31 (4): 379-88. [ Links ]
27. Fernández de Larrea C, Tovar N, Cibeira MT, Aróstegui JI, Rosiñol L, Elena M, et al. Emergence of oligoclonal bands in patients with multiple myeloma in complete remission after induction chemotherapy: association with the use of novel agents. Haematologica 2011; 96 (1): 171-3. [ Links ]
28. Bühler S, Laitinen K, Holthöfer H, Järvinen A, Schauman KO, Hedman K. High rate of monoclonal gammopathy among immunocompetent subjects with primary cytomegalovirus infection. Clin Infect Dis 2002; 35 (11): 1430-3. [ Links ]
29. Drouet E, Chapuis-Cellier C, Bosshard S, Verniol C, Niveleau A, Touraine, et al. Oligo-monoclonal immunoglobulins frequently develop during concurrent cytomegalovirus (CMV) and Epstein–Barr virus (EBV) infections in patients after renal transplantation. Clin Exp Immunol 1999; 118 (3): 465-72.
Recibido: 6 de julio de 2016
Aceptado: 14 de noviembre de 2016














