Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.52 no.3 La Plata set. 2018
BIOQUÍMICA CLÍNICA
Valor diagnóstico de variables lipídicas y antropométricas en las disfunciones metabólicas
Diagnostic value of lipid and anthropometric variables in metabolic dysfunctions
Valor diagnóstico de variáveis lipídicas e antropométricas nas disfunções metabólicas
Jesús Velásquez1a, Héctor Herrera2a, Lorena Encalada-Torres3, Sara Wong4a, Erika Severeyn5a
1 Ing., MSc, PhD. Departamento de Termodinámica y Fenómenos de Transferencia. Universidad Simón Bolívar.
2 Antropólogo, MSc, PhD. Departamento de Tecnología de Procesos Biológicos y Bioquímicos. Universidad Simón Bolívar.
3 Médico Internista. Magister en Investigación de la Salud. Facultad de Ciencias Médicas, Universidad de Cuenca.
4 Ing., MSc, PhD. Departamento de Ingeniería Eléctrica, Electrónica y Telecomunicaciones. Universidad de Cuenca.
5 Ing., MSc, PhD. Departamento de Tecnología de Procesos Biológicos y Bioquímicos. Universidad Simón Bolívar.
a Grupo de Bioingeniería y Biofísica Aplicada. Universidad Simón Bolívar. Valle de Sartenejas, Baruta, Caracas, Venezuela.
CORRESPONDENCIA Ing. JESÚS VELÁSQUEZ E-mail: jmvelasquezf@usb.ve
Resumen
El objetivo del estudio fue evaluar el desempeño de detección del índice de disfunción metabólica (IDM) construido a partir de los valores de circunferencia abdominal, triglicéridos e índice de masa corporal. Se estudiaron 829 sujetos (327 de sexo masculino, 60,4±19,8 años). Se establecieron los diagnósticos de resistencia a la insulina (RI), y síndrome metabólico según los criterios del HOMA-IR, NCEP-ATP III (SM) y NCEP-ATP III revisado (SM-R). Se usó el área bajo las curvas ROC (ABC), los puntos de corte óptimo (PCO), sensibilidad (SEN), especificidad (ESP), valor predictivo positivo y valor predictivo negativo (VPN) para la evaluación del desempeño del IDM. Se pudo constatar que el IDM tiene una capacidad de detección aceptable puesto que se observó un ABC>0,75 en todos los casos. Además, se encontraron valores mayores (p<0,01) de IDM en los grupos con SM, SM-R y RI en comparación con los grupos que no padecían las patologías. Adicionalmente, los PCO para la RI (IDM>21,01), SM (IDM>16,01) y el SM-R (IDM>19,51) reportaron valores de ESP, SEN, VPN mayores que 0,70. Por tanto, a partir de un índice compuesto por tres variables tomadas de un estudio médico de rutina, se pueden diagnosticar dos patologías que conllevan al desarrollo de la diabetes y enfermedades cardiovasculares.
Palabras clave: Resistencia a la insulina; Índice de masa corporal; Síndrome metabólico; HOMA-IR; Curvas ROC.
Abstract
The objective of the study was to evaluate the performance of metabolic dysfunction index (MDI) detection constructed from the values of abdominal circumference, triglycerides and body mass index. A total of 829 subjects (327 males, 60.4±19.8 years), diagnosed with insulin resistance (IR) and metabolic syndrome according to the HOMA-IR, NCEP-ATP III (SM) and NCEP -ATP III revised (SM-R) criteria were studied. The area under the ROC curves (AUC), the optimal cut-off points (OCP), sensitivity (SEN), specificity (SPE), positive predictive value and negative predictive value (NPV) were used to evaluate the performance of the MDI. It was found that the MDI has an acceptable detection capacity since an AUC>0.75 was observed in all cases, and higher values (p<0.01) of MDI were found in the groups with SM, SM-R and IR compared to groups that do not suffer from the pathologies. Additionally, the OCPs for IR (MDI>21.01), SM (MDI>16.01) and SM-R (MDI>19.51) reported values of SPE, SEN, NPV greater than 0.70. Therefore, from an index composed of three variables taken from a routine medical study, two pathologies can be diagnosed that lead to the development of diabetes and cardiovascular diseases.
Keywords: Insulin resistance; Body mass index; Metabolic syndrome; HOMA-IR; ROC curves.
Resumo
O objetivo do estudo foi avaliar o desempenho de detecção do índice de disfunção metabólica (IDM) construído a partir dos valores de circunferência abdominal, triglicerídeos e índice de massa corporal. Foram estudados 829 indivíduos (327 homens, 60,4±19,8 anos), estableceram-se os diagnósticos de resistência à insulina (RI) e síndrome metabólica de acordo com os critérios de HOMA-RI, NCEP-ATP III (SM) e NCEP-ATP III revisado (SM-R). A área sob as curvas ROC (ABC), os pontos de corte ótimo (PCO), sensibilidade (SEN), especificidade (ESP), valor preditivo positivo e valor preditivo negativo (VPN) foram utilizados para avaliar o desempenho do IDM. Verificou-se que o IDM possui uma capacidade de detecção aceitável, visto que uma ABC>0,75 foi observada em todos os casos. Valores maiores (p<0,01) de IDM foram encontrados nos grupos com SM, SM- R e RI em comparação com grupos que não sofrem com as patologias. Além disso, os PCOs para a RI (IDM>21.01), SM (IDM>16.01) e SM-R (IDM>19.51), relataram valores de ESP, SEN, VPN maiores que 0,70. Portanto, a partir de um índice composto por três variáveis de um estudo médico de rotina, duas patologias podem ser diagnosticadas que levam ao desenvolvimento de diabetes e doenças cardiovasculares.
Palavras-chave: Resistência à insulina; Índice de massa corporal; Síndrome metabólica; HOMA-IR; Curvas ROC.
Introducción
El síndrome metabólico (SM) es una condición relacionada con el estilo de vida, y se ha convertido en un problema social y de salud pública (1), que afecta a más del 20% de la población adulta de los Estados Unidos (2), China (3), Europa (4) y los países en desarrollo (5). El SM constituye un agrupamiento de criterios antropométricos y fisiológicos definidos a partir de valores establecidos de presión arterial, índices de distribución adiposa abdominal (circunferencia abdominal-CAB) y parámetros bioquímicos definidos y estandarizados por diversas organizaciones. El SM es una disfunción del metabolismo que con frecuencia conlleva un aumento del riesgo de aparición de enfermedades cardiovasculares, obesidad, resistencia a la insulina (6) y diabetes tipo II (7).
Se considera resistencia a la insulina (RI) o baja sensibilidad a la insulina (SI), cuando en presencia de insulina plasmática la célula muestra una incapacidad para captar glucosa (8). Este desorden metabólico trae como consecuencia el desarrollo de disfunciones como la obesidad y problemas cardiovasculares (9). El método más usado para el diagnóstico de la RI es el HOMA-IR (10). Se considera el diagnóstico de RI cuando se presenta un HOMA-IR >2,5 (11). Cabe destacar que el HOMA-IR es útil solamente en estudios poblacionales y de investigación, pero no está validado su uso a nivel individual debido a que no existe un método estandarizado de medición de insulina que sea preciso a concentraciones bajas (<12 pmol/L) (12)(13).
Actualmente el diagnóstico de sobrepeso y obesidad se basa en el índice de masa corporal (IMC), debido a la buena correlación existente entre éste y el grado de adiposidad, y su estrecha asociación epidemiológica con mortalidad y morbilidad ligada a la obesidad. El término de índice de masa corporal, introducido en 1972 por Ancel Keys (14), consiste en dividir el peso (en kg) por la altura al cuadrado (en metros). La clasificación empleada en el presente, según el IMC para definir peso bajo, peso normal, sobrepeso y obesidad en sus diferentes grados, se basa en los puntos de corte propuestos por la OMS (WHO por sus siglas en inglés) en 1998 (15). No obstante, este índice tiene la desventaja de no discriminar entre tejido graso y magro (16).
Existen numerosos criterios diagnósticos del SM. El que más se usa es el criterio de diagnóstico según el National Cholesterol Education Program-Adult Treatment Panel III (7), y su versión revisada que cambia los valores de circunferencia abdominal (CAB) para hombres (CAB>90 cm) y mujeres (CAB>80 cm) en caso de tratarse de una población asiática o latina (17) y los valores de glucosa con un corte de glucosa>100 mg/dL. En esta versión revisada los valores de CAB son establecidos por la International Diabetes Federation (IDF). Un estudio posterior estableció una versión armonizada del diagnóstico del SM que establecía los cortes de CAB y glucosa mencionados anteriormente (18). Por otro lado, se ha empleado el HOMA-IR para establecer el diagnóstico del SM (19). Igualmente otros trabajos han determinado puntos de corte de la CAB y del IMC para el diagnóstico del SM (20)(21).
Algunos estudios han diseñado índices que identifican sujetos con RI (22)(23); estos índices usan como variables de entrada la circunferencia abdominal, el índice de masa corporal y los triglicéridos. En uno de ellos se usó una base de datos de 40 sujetos con edades entre 18 y 40 años. En este estudio, el índice propuesto fue capaz de detectar sujetos con alteraciones en la insulina y la glucosa postprandial, indicando que se encontraban en etapas tempranas de la RI (22). En otro estudio se usó una base de datos más extensa, compuesta por 120 sujetos con edades entre 65 y 98 años (23). En este estudio el índice propuesto fue capaz de identificar los sujetos con RI incluso en una base de datos compuesta por adultos en edad avanzada. En estos trabajos no se establecen puntos de corte para el diagnóstico de la RI; sólo se hallan las diferencias significativas de los índices propuestos entre el grupo con RI y el grupo control. Igualmente, en el caso del SM no existe un índice general que establezca un punto de corte para el diagnóstico de esta patología; sólo existen los criterios de diagnóstico desarrollados por la NCEP-ATPIII.
El objetivo de este estudio fue encontrar un punto de corte para el índice de disfunción metabólica (IDM) diseñado en los trabajos de Velásquez et al (22)(23) que pueda discriminar sujetos con SM y con RI, utilizando variables bioquímicas y antropométricas. Para esto, se integró una base de datos compuesta por tres bases de datos, una recolectada en la Universidad de Cuenca en Ecuador (24) y dos recolectadas en la Universidad Simón Bolívar en Venezuela (25)(26). A partir de estas bases de datos, y del IDM (22)(23) se realizó una evaluación del desempeño del IDM en la predicción del SM y la RI, y con la construcción de las curvas de característica operativa del receptor (ROC por sus siglas en inglés - receiver operating characteristic) se hallaron los puntos de corte óptimo. Finalmente, se calcularon las medidas de desempeño (sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo) para los puntos de corte óptimo propuestos.
Materiales y Métodos
BASE DE DATOS
La base de datos utilizada es una compilación de tres bases de datos:
1. Base de datos 1 (BD1; n=120, edad=71,8±6,8 años, masculino=42): En 2015, adultos mayores de más de 65 años sin diabetes fueron reclutados en el proyecto DIUC-PROMETEO denominado: Variabilidad de la frecuencia cardíaca y la sensibilidad a la insulina en la población de edad avanzada de Cuenca, Ecuador (24).
2. Base de Datos 2 (BD2; n=25, edad=29,6±6,3 años, masculino=25): En 2009 se reclutaron a hombres entre 18 y 45 años sin diabetes en el proyecto del Decanato de Investigación y Desarrollo de la Universidad Simón Bolívar denominado: Estudio Electrocardiográfico de Neuropatía Cardíaca en el Síndrome Metabólico (25).
3. Base de datos 3 (BD3; n=684, edad=59,6±20,1 años, masculino=260). Entre 2004 y 2012, hombres y mujeres adultos del distrito capital de Venezuela fueron reclutados en el laboratorio de Evaluación Nutricional de la Universidad Simón Bolívar (26).
En cada una de las bases de datos a cada sujeto se le realizó medición de triglicéridos, colesterol transportado por HDL, medidas antropométricas (IMC y CAB), presión arterial (diastólica y sistólica), glucosa e insulina en ayunas.
Para la determinación del IMC se midieron el peso corporal (kg) y la altura (cm) utilizando una balanza y tallímetro de pared marca Health O'Meter® 402LB para la BD1, y una balanza y tallímetro doble romana marca DETECTO® para BD1 y BD2. En las tres bases de datos, los sujetos estaban descalzos y vestían ropa liviana. El IMC se calculó como el peso (kg) dividido la altura al cuadrado (m2). La CAB fue medida con una cinta métrica al final de una espiración normal; la cinta métrica se situó en la línea media entre el margen costal inferior y la espina ilíaca anterosuperior en bipedestación.
La presión arterial fue medida según las normas del Séptimo informe del Joint National Committee (JNC7) para la prevención, detección, evaluación y tratamiento de la hipertensión arterial (27). Se utilizaron estetoscopio y esfigmomanómetro adecuadamente calibrado marca RIESTER® (BD1), y marca MICROLIFE® (BD2 y BD3). Los participantes estuvieron en reposo 5 minutos antes de la medición, y se tomó en posición supina y en decúbito dorsal obteniendo la media para el valor de la toma. Se tomaron las fases I y V de Korotkoff para el valor de la presión arterial sistólica y diastólica, respectivamente.
Se recogieron muestras de sangre para análisis bioquímicos después de un ayuno de doce horas y las concentraciones séricas de glucosa, triglicéridos y colesterol de lipoproteínas de alta densidad fueron medidas usando un sistema ADVIA 1650 Chemistry de Siemens® (BD1), y el equipo automatizado de HITACHI® (BD2 y BD3). La insulina se determinó mediante el método ECLIA electroquimioluminicencia en el equipo Cobas e 411 de ROCHE® (BD1); y el método de inmunoensayo IMMULITE 1000 de Siemens® (BD2 y BD3).
Los tres protocolos clínicos de las tres bases de datos se adhirieron a los principios de la Declaración de Helsinki y fueron aprobados por el Comité de Bioética de la Facultad de Ciencias Médicas de la Universidad de Cuenca en Ecuador (BD1) y Universidad Simón Bolívar (BD2 y BD3) en Venezuela. Todos los sujetos dieron un consentimiento informado por escrito.
La base de datos usada, conformada por la BD1, BD2 y BD3, consta de 829 sujetos en total, los cuales fueron diagnosticados de resistencia a la insulina y síndrome metabólico. Para el diagnostico de la RI se usó un HOMA-IR>2,5 (10) (11), para el diagnóstico del SM se usó la versión de la National Cholesterol Education Program- Adult Treatment Panel III de 2002 (7), y la versión revisada (SM-R) del National Cholesterol Education Program- Adult Treatment Panel III (18). De esta manera se construyeron los vectores de diagnóstico de resistencia a la insulina (VRI), de síndrome metabólico (VSM) y de síndrome metabólico revisado (VSM-R).
ÍNDICE USADO
Se utilizó el índice de disfunción metabólica (IDM) diseñado en los trabajos de Velásquez et al (22)(23), sin tomar en cuenta la optimización particular realizada en cada uno de esos trabajos. Este índice usa como variables de entrada los valores de circunferencia abdominal, índice de masa corporal y triglicéridos. En las bases de datos donde este índice ha sido validado, se pudo constatar que es capaz de discriminar sujetos con RI en sus estadios iniciales, tanto en una base de datos de adultos jóvenes como en adultos mayores (22)(23). El IDM obedece a la siguiente ecuación:
IDM=IMC×CAB2×TG⁄TGN (1)
donde el IMC es el índice de masa corporal definido como la relación del peso entre la altura al cuadrado (kg/m2), CAB es la circunferencia abdominal (m), TG son los valores de triglicéridos, TGN (150 mg/dL) es el borde superior considerado como valor normal de triglicéridos en la literatura (17).
MEDIDAS DE DESEMPEÑO
Para hallar la capacidad de detección del índice se graficaron las curvas ROC para cada patología. Las curvas ROC son un método estadístico usado para determinar la exactitud diagnóstica de un test que utiliza escalas continuas. Las curvas ROC se emplean con tres propósitos: determinar el punto de corte en el que se alcanza la sensibilidad y especificidad más alta, evaluar la capacidad del test de diferenciar sujetos sanos versus enfermos, y comparar la capacidad discriminativa de dos o más pruebas diagnósticas que expresan sus resultados como escalas continuas (28)(29).
En este estudio, para construir las curvas ROC, se halló el índice para cada uno de los sujetos, construyéndose así el vector resultado del índice (VR). Con el VR se halló el mínimo y el máximo de dicho vector y se construyó un vector diagnóstico (VD) con números equitativamente espaciados entre el valor mínimo y el máximo del VR.
Cada valor del VD se tomó como punto de corte, y se evaluó comparando con los VRI, VSM y VSM-R. Para la evaluación de cada punto de corte del vector VD se obtuvieron los verdaderos positivos (VP), falsos positivos (FP), verdaderos negativos (VN) y los falsos negativos (FN). Luego se hallaron la sensibilidad (SEN), especificidad (ESP), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para cada valor del vector VD. Las ecuaciones (2-5) describen los parámetros de predicción.

Con la sensibilidad y la especificidad de cada punto de VD, se construyeron las curvas ROC para cada patología. Así como también el Área Bajo la Curva (ABC), considerándose un valor predictivo aceptable aquel índice con un ABC mayor a 0,75 (30).
Se consideró el punto de corte óptimo aquel que presentaba la menor distancia entre la curva ROC y el punto [0,1] de la gráfica de la curva ROC.
ANÁLISIS ESTADÍSTICO
Todos los datos fueron procesados usando el programa MATLAB® versión R2015a. Se manejaron muestras no pareadas con distribución distinta a la normal, por tanto para determinar las diferencias entre grupos de dos se usó la prueba estadística no paramétrica Mann- Whitney U y entre grupos de tres o más se usó la prueba estadística no paramétrica de Kruskal Wallis (31). Los datos en el texto y en las tablas se presentan como valores de media y desviación estándar, valores mínimos y máximos e intervalo de confianza del 95%.
Resultados
En la Tabla I se pueden observar las características de la base de datos usada para cada patología estudiada. En la Tabla II se presentan las medidas de desempeño halladas para evaluar el punto de corte óptimo. Para cada punto de corte óptimo se muestran la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo; así como también el ABC de cada curva ROC. Se puede observar que el índice tiene un valor predictivo aceptable para las dos patologías en estudio puesto que presenta un ABC por encima de 0,75 en todas las curvas ROC.
Tabla I. Características de la base de datos.

Tabla II. Área bajo la curva, sensibilidad, especificidad, valor predictivo negativo y valor predictivo positivo para el punto de corte óptimo del IDM para cada una de las patologías.

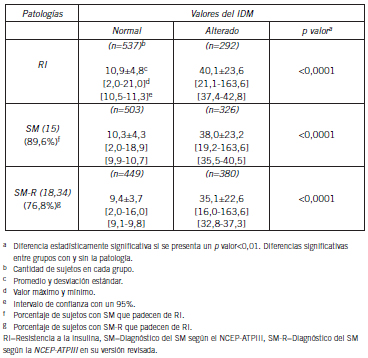
En la Tabla III se muestran los valores del índice de disfunción metabólica para cada población usando los valores de corte óptimos para el diagnóstico de cada patología.
Tabla III. Valores del índice de disfunción metabólica en cada una de las poblaciones usando los puntos de corte óptimo para el diagnóstico de cada patología.
Discusión y Conclusiones
En la base de datos recolectada (Tabla I), se hallaron diferencias significativas entre grupos en el peso, la CAB, C-HDL, triglicéridos, IMC y HOMA-IR, en la altura no se encontraron diferencias significativas. Igualmente, se pudo constatar que la base de datos no es homogénea en cuanto a los grupos de sexo, de un total de 829 sujetos, 327 eran hombres; el sexo femenino fue más frecuente, sin embargo la cantidad de hombres por mujer tiende a aumentar en el grupo con RI en relación con el grupo control, y tiende a disminuir en los grupos de SM y SM-R; esto podría indicar que los hombres podrían ser un grupo susceptible a desarrollar la RI (32); en cambio, las mujeres son más vulnerables a desarrollar el SM. En cuanto a la edad, se puede observar que los sujetos con mayor edad se encuentran en los grupos de RI y SM, indicando que los adultos mayores son un grupo de mayor propensión a desarrollar estas enfermedades (33).
En cuanto al grupo con RI, se puede comprobar en la Tabla I, que son el grupo con mayor CAB, mayor IMC y menor C-HDL. Esto corrobora algunos estudios que indican una relación directa entre el aumento de la CAB, IMC, disminución del C-HDL y el desarrollo de la RI (22)(34)(35). En cuanto al grupo con SM, se observa que es el grupo con valores más altos de triglicéridos, lo cual es de esperar puesto que los triglicéridos forman parte del criterio diagnóstico del SM de la NCEP-ATPIII.
En la Tabla II se puede observar que la curva con mejor capacidad predictiva fue la del diagnóstico del SM y SM-R, puesto que presentan un ABC de 0,8221 y 0,8170 respectivamente, y un valor predictivo negativo de 0,87 y 0,83, respectivamente.
Por otro lado, la curva de diagnóstico de RI presenta el más bajo valor predictivo positivo (0,26), mientras que la curva de diagnóstico del SM-R, presenta el mejor valor predictivo positivo (0,65), indicando que el índice predice mejor la probabilidad de tener SM-R en caso de dar positivo. Igualmente, la curva ROC de diagnóstico para la RI, con un ABC de 0,7937, presenta el mejor valor predictivo negativo (0,96) en relación con las demás curvas, lo cual indica que es capaz de predecir la probabilidad de no tener la enfermedad en caso de dar negativo.
En líneas generales, el IDM muestra un ABC por encima de 0,75; una sensibilidad y especificidad superior a 0,70, para ambas patologías, un valor predictivo negativo mayor a 0,80 para ambas patologías y un valor predictivo positivo mayor a 0,60 para el SM, lo cual indica que su desempeño es aceptable para el SM y para la RI, a pesar que para esta última tiene un valor predictivo positivo menor que 0,30.
En la Tabla II se muestran los puntos de corte óptimo del IDM para cada patología. En el caso del diagnóstico del SM-R se puede observar que tiene un punto de corte menor comparado con el punto de corte de la RI y el SM, es decir que todos los individuos con un IDM>16,01 que son diagnosticados con SM-R, también serán diagnosticados con SM según la versión de la NCEP-ATPIII y con RI. Esto corrobora algunos estudios que han relacionado la RI y el SM (36), indicando incluso que el SM puede desembocar en el desarrollo de la RI (37). En otras palabras, se podría decir que el SM podría suponer, por lo menos en el caso de esta base de datos, el punto de inicio de la RI (38).
De la tabla III se puede observar que de los 380 sujetos diagnosticados con SM-R hay un 77% que padecen de RI; lo que sugiere que al ser diagnosticado de SM-R hay una alta probabilidad de padecer de RI. Lo mismo se puede constatar para el caso del diagnóstico de SM según el criterio de la NCEP-ATPIII, que de 326 sujetos con SM existe un 89,5% de sujetos con RI. Adicionalmente, se encontraron diferencias estadísticamente significativas entre grupos, lo que sugiere que el IDM es capaz de diferenciar entre sujetos normales y aquellos con las patologías estudiadas (Tabla III).
En este trabajo se planteó hallar los valores de corte para el síndrome metabólico y resistencia a la insulina usando el IDM. Para esto se hallaron medidas de desempeño (sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo) así como el ABC de las curvas ROC.
Se observó que el IDM puede discriminar entre sujetos con SM y RI y los sujetos sin las patologías. Igualmente, el IDM tiene una capacidad de detección aceptable y establece como punto de corte para la RI de IDM>21,01 y para el SM de IDM>19,51 para el criterio de NCEP-ATPIII y IDM>16,01 para el criterio de NCEP-ATPIII revisado. Igualmente, se confirma la relación existente entre la RI y SM, y el IDM establece que hay altas probabilidades de ser diagnosticado de RI si se padece de SM.
Por tanto, a partir del IDM, construido sobre la base de dos medidas antropométricas y una medida bioquímica, determinables fácilmente con un examen médico estándar, se podría establecer un diagnóstico para dos patologías altamente relacionadas y que conllevan al desarrollo de la diabetes y enfermedades cardiovasculares.
AGRADECIMIENTOS
Este trabajo fue realizado gracias al financiamiento de la Dirección de Investigación de la Universidad de Cuenca (DIUC) y al Decanato de Investigación y Desarrollo de la Universidad Simón Bolívar.
1. Zimmet P, Alberti G. Una nueva definición mundial del síndrome metabólico por la Federación Internacional de Diabetes: fundamento y resultados. Rev Esp Cardiol 2005; 58 (12): 1371-6. [ Links ]
2. Beltrán-Sánchez H, Harhay MO, Harhay MM, McElligott S. Prevalence and trends of metabolic syndrome in the adult U.S. population, 1999-2010. J Am Coll Cardiol 2013; 62 (8): 697-703. [ Links ]
3. Xi B, He D, Hu Y, Zhou D. Prevalence of metabolic syndrome and its influencing factors among the Chinese adults: the China Health and Nutrition Survey in 2009. Prev Med 2013; 57 (6): 867-71. [ Links ]
4. Vishram JK, Borglykke A, Andreasen AH, Jeppesen J, Ibsen H, Jorgensen T, et al. MORGAM Project. Impact of age and gender on the prevalence and prognostic importance of the metabolic syndrome and its components in Europeans. The MORGAM Prospective Cohort Project. PLoS One 2014; 9 (9): e107294. [ Links ]
5. Prasad DS, Kabir Z, Dash AK, Das BC. Prevalence and risk factors for metabolic syndrome in Asian Indians: A community study from urban Eastern India. J Cardiovasc Dis Res 2012; 3 (3): 204-11. [ Links ]
6. Roberts CK, Hevener AL, Barnard RJ. Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training. Comprehensive Physiol 2013; 3 (1): 1-58. [ Links ]
7. National Cholesterol Education Program. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final report. Circulation 2002; 106: 3143- 421. [ Links ]
8. Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance. Annual Rev Physiol 2010; 72: 219-46. [ Links ]
9. Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature 2006; 444 (7121): 840-6. [ Links ]
10. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetología 1985; 28 (7): 412-9. [ Links ]
11. Friedrich N, Thuesen B, Jorgensen T, Juul A, Spielhagen C, Wallaschofksi H, et al. The Association Between IGF-I and Insulin Resistance. A general population study in Danish adults. Diabetes Care 2012; 35 (4): 768-73. [ Links ]
12. Carrasco NF, Galgani FJ, Reyes JM. Síndrome de resistencia a la insulina. Estudio y manejo. Rev Méd Clínica Las Condes 2013; 24 (5): 827-37. [ Links ]
13. Staten MA, Stern MP, Miller WG, Steffes MW, Campbell SE. Insulin Standardization Workgroup. Insulin assay standardization. Diabetes Care 2010; 33 (1): 205-6. [ Links ]
14. Keys A, Fidanza F, Karvonen M. Indices of relative weight and adiposity. J Chronic Dis 1972; 25 (6): 329-43. [ Links ]
15. WHO, Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet 2004; 363 (9403):157. [ Links ]
16. Kok P, Seidell JC, Meinders ME. The value and limitations of the body mass index (BMI) in the assessment of the health risks of overweight and obesity. Ned Tijdschr Geneeskd 2004; 148 (48): 2379-82. [ Links ]
17. Grundy S, Cleeman J, Stephen D, Donato K, Eckel R, Barry F, et al. Diagnosis and management of the metabolic syndrome An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. AHA/NHLBI Scientific Statement. Circulation 2005; 112 (17): 2735-52. [ Links ]
18. Alberti KGMM, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120 (16): 1640-5. [ Links ]
19. Motamed N, Miresmail SJH, Rabiee B, Keyvani H, Farahani B, Maadi M, et al. Optimal cutoff points for HOMA-IR and QUICKI in the diagnosis of metabolic syndrome and non-alcoholic fatty liver disease: A population based study. J Diabetes Complications 2016; 30 (2): 269-74. [ Links ]
20. Gozashti M, Najmeasadat F, Mohadeseh S, Najafipour H. Determination of most suitable cut off point of waist circumference for diagnosis of metabolic syndrome in Kerman. Diabetes & Metabolic Syndrome: Clin Res Rev 2014; 8 (1): 8-12. [ Links ]
21. Worachartcheewan A, Dansethakul P, Nantasenamat C, Pidetcha P, Prachayasittikul V. Determining the optimal cutoff points for waist circumference and body mass index for identification of metabolic abnormalities and metabolic syndrome in urban Thai population. Diabetes Res Clin Pract 2012; 98 (2): e16-21. [ Links ]
22. Velásquez J, Wong S, Encalada L, Herrera H, Severeyn E. Lipid-anthropometric index optimization for insulin sensitivity estimation. Proceedings of the 11th International Symposium on Medical Information Processing and Analysis; 2015 Nov 17-19; Cuenca, Ecuador. United States: International Society for Optics and Photonics Digital Library; 2015. [ Links ]
23. Velásquez J, Severeyn E, Herrera H, Encalada L, Wong S. Anthropometric index for insulin sensitivity assessment in older adults from Ecuadorian highlands. Proceedings of the 12th International Symposium on Medical Information Processing and Analysis; 2016 Dic 5-7; Tandil, Argentina. United States: International Society for Optics and Photonics Digital Library; 2017. [ Links ]
24. Parra F, Andrade Solano-Quinde L, Palacio-Baus K, Encalada L, Wong S, et al. Plataforma basada en ecgML para el estudio de las complicaciones cardiovasculares en el adulto mayor con síndrome metabólico. Maskana 2015; 6 (Supl.): 157-64. [ Links ]
25. Severeyn E, Wong S, Herrera H, Altuve M. Anthropometric measurements for assessing insulin sensitivity on patients with metabolic syndrome, sedentaries and marathoners. Proceedings of 37th Annual International Conference of the IEEE; 2015 Ago 25-29; Milan, Italia. United States: Engineering in Medicine and Biology Society; 2015. [ Links ]
26. Herrera H, Rebato E, Arechabaleta G, Lagrange H, Salces I, Susanne C. Body Mass Index and Energy Intake in Venezuelan University Students. Nutrition Research 2003; 23 (3): 389-90. [ Links ]
27. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289 (19): 2560-72. [ Links ]
28. Akobeng A. Understanding diagnostic tests 3: receiver characteristic curves. Acta Paediatr 2007; 96 (5): 644-7. [ Links ]
29. Altman DG, Bland JM. Diagnostic tests 3: receiver operating characteristic plots. Br Med J 1994; 309 (6948): 188. [ Links ]
30. Reitsma J, Glasa A, Rutjesa A, Scholten R, Bossuyta P, Zwindermana A. Bivariate analysis of sensitivity and specificity produces informative summary measures in diagnostic reviews. J Clin Epidemiol 2005; 58 (10): 982-90. [ Links ]
31. Marusteri M, Bacarea V. Comparing groups for statistical differences: how to choose the right statistical test? Biochem Med 2010; 20 (1): 15-32. [ Links ]
32. Bonneau G, Pedrozo W, Berg G. Adiponectin and waist circumference as predictors of insulin-resistance in women. Diabetes & Metabolic Syndrome: Clin Res Rev 2014; 8 (1): 3-7. [ Links ]
33. Bang E, Tanabe K, Yokoyama N, Chijiki S, Kuno S. Relationship between thigh intermuscular adipose tissue accumulation and number of metabolic syndrome risk factors inmiddle-aged and older Japanese adults. Exp Gerontol 2016; 79: 26-30. [ Links ]
34. Despre´s JP, Couillard C, Gagnon J, Bergeron J, Leon A, Rao DC, et al. Race, visceral adipose tissue, plasma lipids, and lipoprotein lipase activity in men and women: The health, risk factors, exercise training, and genetics (HERITAGE) family study. Arterioscler Thromb Vasc Biol 2000; 20 (8): 1932-8. [ Links ]
35. Kang HT, Yoon JH, Kim JY, Ahn SK, Linton JA, Koh SB, et al. The association between the ratio of triglyceride to HDL-C and insulin resistance according to waist circumference in a rural Korean population. Nutr Metab Cardiovasc Dis 2012; 22 (12): 1054-60. [ Links ]
36. Taverne F, Richard C, Couture P, Lamarche B. Abdominal obesity, insulin resistance, metabolic syndrome and cholesterol homeostasis. Pharma Nutrition 2013; 1 (4): 130-6. [ Links ]
37. Sharma M, McClung J, Nader A. Adiponectin: A mediator of obesity, insulin resistance, diabetes, and the metabolic syndrome. Translational Research Coronary Artery Dis 2016; 33-42. [ Links ]
38. Gallagher E, LeRoith D, Karnieli E. The metabolic syndrome from insulin resistance to obesity and diabetes. Med Clin N Am 2011; 95 (5): 855-73. [ Links ]
Recibido: 23 de junio de 2017
Aceptado: 28 de junio de 2018














