Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.52 no.3 La Plata set. 2018
CONTROL DE CALIDAD
Influencia de los anticoagulantes EDTAK2 y EDTAK3 en los resultados del hemograma*
Influence of the EDTAK2 and EDTAK3 anticoagulants on hematology testing results
Influência dos anticoagulantes EDTAK2 e EDTAK3 nos resultados do hemograma
Carolina Juliana Goedelmann1, Cintia Benavídez2, María Cristina Durando2, Romina Vanesa Garcia1, María Paula González Cid2, María Cecilia Sala1, Liliana Paz2c
1 Bioquímico especialista en hematología (UBA).
2 Bioquímico.
* Laboratorio Central, Área Hematología y Hemostasia, Hospital de Pediatría Garrahan, Combate de los Pozos 1881. (C 1245 AAM) C.A.B.A. República Argentina.
CORRESPONDENCIA Bioq. CAROLINA GOEDELMANN Valle 1225, piso 2, dpto. A CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina E-mail: carogoedel@gmail.com
Resumen
El International Council for Standardization in Haematology (ICSH) recomienda el uso de ácido etilendiaminotretaacético dipotásico (EDTAK2) como anticoagulante para el hemograma, mientras que el Clinical and Laboratory Standards Institute (CLSI) EDTAK2 o ácido etilendiaminotetraacético tripotásico (EDTAK3). El objetivo de este trabajo fue evaluar la influencia del tipo de sal de EDTA utilizado en la variación de los resultados de los parámetros hematológicos. Se recolectaron 24 muestras por venopunción, de cada una se cargó una alícuota en EDTAK3 y otra en EDTAK2. De los 23 parámetros evaluados en el autoanalizador Sysmex XN1000 (Roche Diagnostics), sólo los de la serie roja presentaron diferencias estadísticamente significativas en las muestras pareadas (p<0,05). El sesgo superó las especificaciones de calidad de Variabilidad Biológica Mínima para hematocrito (2,9%) y concentración de hemoglobina corpuscular media (1,7%), de Variabilidad Biológica Deseable para el volumen corpuscular medio (1,7%) y Variabilidad Biológica Óptima para hemoglobina (1,2%) y recuento de eritrocitos (1,2%). No se hallaron diferencias significativas en los parámetros de la serie blanca, ni en los plaquetarios y tampoco en los reticulocitarios. Para disminuir el error preanalítico, cada laboratorio debe estandarizar la extracción de los hemogramas empleando un único tipo de anticoagulante.
Palabras clave: Anticoagulante EDTA; Hemograma; Fase preanalítica.
Abstract
The International Council for Standardization in Haematology (ICSH) currently supports de use of ethylenediaminetetraacetic acid dipotassium (EDTAK2) anticoagulant for hematology testing, while the Clinical and Laboratory Standards Institute (CLSI) recommends EDTAK2 or ethylenediaminetetraacetic acid tripotassium (EDTAK3). The objective of this study was to evaluate the influence of the EDTA formulations in the results of hematologic parameters. A total of 24 samples were collected by venous puncture and two aliquots were loaded: one in EDTAK3 and another in EDTAK2. Of the 23 hematologic parameters tested with the use of Sysmex XN1000 (Roche diagnostics) hematologic analyser, only those in the red series showed statistically significant differences in the paired samples (p < 0.05). The bias exceeded the quality specifications of Minimum Biological Variability for hematocrit (2.9%) and mean corpuscular hemoglobin concentration (1.7%), Desirable Biological Variability for the mean corpuscular volume (1.7%) and Biological Variability Optimal for hemoglobin (1.2%) and erythrocyte count (1.2%). No significant differences were found in the parameters of white series, neither platelets, nor reticulocytes. To reduce the preanalytical error, each laboratory should standardize the extraction for complete blood cell count using a single type of anticoagulant.
Key words: EDTA anticoagulant; Complete blood cell count; Pre-analytic phase.
Resumo
A International Council for Standardization in Haematology (ICSH) recomenda a utilização do ácido etileno diamino treta-acético dipotássico (EDTAK2) como anticoagulante para hemograma, enquanto que a Clinical and Laboratory Standards Institute (CLSI) EDTAK2 ou ácido etileno diamino treta-acético tripotássico (EDTAK3). O objetivo deste trabalho foi avaliar a influência do tipo de sal de EDTA utilizado na variação dos resultados dos parâmetros hematológicos. Foram recolhidas 24 amostras por venopunção, de cada uma se carregou uma alíquota de EDTAK3 e outra de EDTAK2. Dos 23 parâmetros avaliados no autoanalisador Sysmex XN1000 (Roche Diagnostics), apenas aqueles da série vermelha apresentaram diferenças estatisticamente significativas nas amostras emparelhadas (p<0,05). O viés superou as especificações de qualidade da Variabilidade Biológica Mínima para o hematócrito (2,9%) e concentração de hemoglobina corpuscular média (1,7%), de Variabilidade Biológica Desejável para o volume corpuscular médio (1,7%) e Variabilidade Biológica Ótima para a hemoglobina (1,2%) e contagem de eritrócitos (1,2%). Não foram encontradas diferenças significativas nos parâmetros da série branca, nem nos plaquetários, nem nos reticulocitários. Para reduzir o erro pré-analítico, cada laboratório deve padronizar a extração dos hemogramas usando um único tipo de anticoagulante.
Palavras-chave: Anticoagulante EDTA; Hemograma; Fase pré-analítica.
Introducción
En la literatura científica están ampliamente descriptos los errores de laboratorio generados por problemas preanalíticos, así como la importancia de estandarizar y establecer procedimientos apropiados para la extracción de muestras de sangre por punción venosa (1-3).
El anticoagulante de elección para el hemograma es el ácido etilendiaminotetraacético (EDTA C10H16N2O8) debido a que permite una mejor preservación de los componentes celulares (1). Existen tres formas salinas de este agente quelante: EDTA disódico (EDTANa2), dipotásico (EDTAK2) y tripotásico (EDTAK3). Las sales de EDTA causan pérdida de agua de las células afectando el tamaño de los glóbulos rojos porque son hiperosmolares. De las tres sales, el EDTAK3 es la que genera la mayor deshidratación del eritrocito y por lo tanto, el menor volumen corpuscular medio. Por otro lado, la formulación líquida del EDTAK3 produce, por efecto dilucional, que los resultados de los parámetros medidos en forma directa, como la hemoglobina, el recuento de leucocitos, eritrocitos y plaquetas, sean 1-2% menores a los de la sangre circulante (4).
A pesar de que el EDTANa2 y el EDTAK2 se comportan de forma similar, tanto en la contracción de los eritrocitos por deshidratación como en el aumento de volumen celular durante el almacenamiento prolongado de la muestra, la solubilidad del EDTAK2 en sangre entera es mayor. Además, su formulación en spray seco no produce efectos dilucionales en muestras de volúmenes pequeños. Por estos motivos, el International Council for Standardization in Haematology (ISCH) recomienda el uso de EDTAK2. La cantidad de EDTAK2 agregada debe ser 1,5 - 2,2 mg por mL de sangre. Esta relación resulta suficiente para anticoagular con mínimos cambios celulares (4). En cambio, el Clinical and Laboratory Standards Institute (CLSI) recomienda utilizar cualquiera de las dos sales potásicas en concentraciones de 1,5 - 2,2 mg por mL de sangre (5).
En nuestro laboratorio se utilizan indistintamente 2 tipos de tubos para el hemograma, uno con EDTAK2 y otro con EDTAK3. El objetivo de este trabajo fue evaluar la equivalencia estadística y clínica entre los parámetros del hemograma medidos en sangre anticoagulada con EDTAK2 y EDTAK3.
Materiales y Métodos
RECOLECCIÓN DE MUESTRAS
Se recolectaron 24 muestras de pacientes ambulatorios que tenían una solicitud de hemograma programada. Se cargaron dos alícuotas de sangre por paciente en tubos de polipropileno de igual lote, una en tubos DVS con EDTAK3 10 g% para 1,3 mL de sangre y otra en tubos BD Microtainer con EDTAK2 1 mg para 500 μL de sangre. La toma de muestra fue realizada por un único extraccionista experto de acuerdo con el manual de toma de muestras del laboratorio.
PROCESAMIENTO DE LAS MUESTRAS EN EL LABORATORIO
Las muestras fueron procesadas dentro de la hora de extraídas, en el mismo autoanalizador Sysmex XN1000 (Roche Diagnostics), por el mismo operador y con los mismos lotes de reactivo. El instrumento fue calibrado por el fabricante con material de referencia apropiado (XN CALTM, Sysmex), verificado por el laboratorio, controlado diariamente con material provisto por el fabricante (XN CHECKTM, Sysmex) y quincenalmente con material de un programa de evaluación externa de la calidad (RIQAS, Randox).
Los parámetros evaluados incluyeron: recuento de leucocitos (LEU), recuento de eritrocitos (ERIT), hemoglobina (HGB), hematocrito (HTO), volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM), concentración de hemoglobina corpuscular media (CHCM), ancho de distribución eritrocitaria (ADE), recuento de plaquetas por impedancia (PLT-I), recuento de plaquetas fluorescentes (PLT-F), volumen plaquetario medio (VPM), diferencial leucocitario (recuento absoluto de neutrófilos (NEU), linfocitos (LINF), monocitos (MONO), eosinófilos (EOS), basófilos (BASO)), recuento de reticulocitos (RETI), equivalente de hemoglobina reticulocitaria (Ret-He), fracción de plaquetas inmaduras (IPF) y fracción de reticulocitos inmaduros (IRF).
ANÁLISIS ESTADÍSTICO
Se evaluaron las diferencias estadística y clínicamente significativas entre ambos tubos para cada parámetro.
Antes del análisis estadístico se testeó la normalidad de la distribución de los datos con el test de D´Agostino Pearson. Para evaluar la significancia estadística de las diferencias, se utilizó la prueba t de Student para muestras pareadas en los parámetros que presentaron distribución normal. Los parámetros sin distribución normal fueron evaluados con el test de Wilcoxon. Valores de p<0,05 fueron considerados estadísticamente significativos.
Para aquellos parámetros con diferencias estadísticamente significativas, se evaluó la significancia clínica de las mismas. Para ello se calculó el sesgo con el método de Bland-Altman (6). Este sesgo se comparó con las especificaciones de calidad permitidas para Variabilidad Biológica (VB). Existen tres niveles de especificaciones de calidad para VB, de más a menos exigente: óptimo (VBo), deseable (VBd) y mínimo (VBm). Se calculó para cada parámetro el Error Index (EI), utilizando la siguiente fórmula: EI= (EDTAK2 – EDTAK3) * 100/ EDTAK2 * ETa, siendo ETa el error total aceptable de acuerdo con las especificaciones de calidad para VB. El EI resulta aceptable si se encuentra entre (-1) y 1; valores por fuera de estos límites indican que la diferencia entre ambos anticoagulantes excede las especificaciones de calidad para VB. Se consideró tolerable un 5% de las muestras con EI fuera de rango.
Las especificaciones de VBd fueron originalmente publicadas por Ricos et al. en 1999 (7) y los datos han sido actualizados en 2014 en el sitio web de Westgard (8). Las especificaciones de VBm y VBo se calcularon a partir de los datos tabulados en el citado sitio web aplicando las siguientes fórmulas:
Sesgo mínimo aceptable = 0,375 * √ (CVG2 + CVI2)
Sesgo óptimo aceptable = 0,125 * √ (CVG2 + CVI2)
ETa mínimo = 1,65 * (0,75 * CVI) + 0,375 * √ (CVG2 + CVI2)
ETa óptimo=1,65 * (0,375 * CVI) + 0,125 * √ (CVG2 + CVI2).
Siendo CVG el coeficiente de variación interindividual y CVI el coeficiente de variación intraindividual (7) (9).
Resultados
Para ERIT, HTO, HGB, CHCM, ADE-DE se observaron diferencias estadísticamente significativas (p<0,05) según las muestras fueran recolectadas en EDTAK2 o EDTAK3. Las diferencias de los valores medios de los parámetros distribuidos normalmente se muestran en la Tabla I y de los parámetros no distribuidos normalmente en la Tabla II.
Tabla I. Equivalencia estadística: comportamiento de parámetros que presentaron distribución normal de muestras recolectadas en EDTK2 vs EDTAK3.
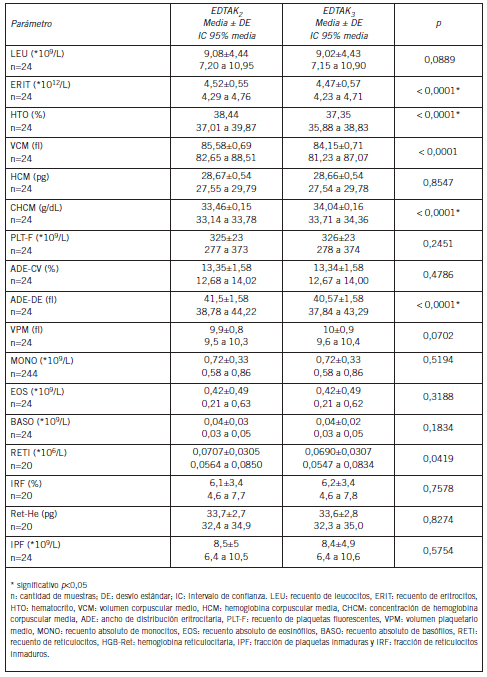
Tabla II. Equivalencia estadística: comportamiento de los parámetros que no presentaron distribución normal de muestras recolectadas en EDTK2 vs EDTAK3

El HTO y la CHCM presentaron un sesgo mayor al permitido, independientemente del criterio utilizado para evaluarlo (VBo, VBd o VBm). El VCM presentó un sesgo no aceptable para VBd y VBo. El RBC y la HGB sólo fueron rechazados por VBo. El ADE-DE carece de especificaciones de calidad establecidas por VB. Los valores fueron en promedio 2,3% mayores en las muestras con EDTAK2 que en las con EDTAK3. Estas comparaciones se muestran en la Tabla III y en la Figura 1.
Tabla III. Equivalencia clínica de muestras recolectadas en EDTK2 vs EDTAK3

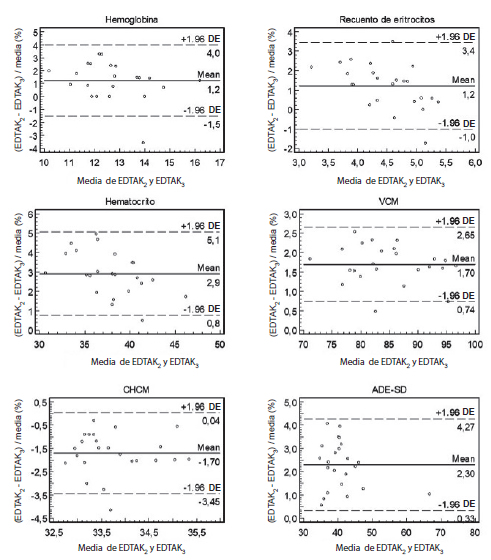
Figura 1. Gráficos de Bland y Altman para HGB, HTO, ERIT, VCM, CHCM y ADE-DE de muestras sanguíneas recolectada en EDTK2 vs EDTAK3. Las diferencias están expresadas en porcentaje. Anticoagulantes y EDTAK3. Las diferencias están expresadas en porcentaje.
El comportamiento del EI acompañó la tendencia del sesgo en todos los parámetros, pero con una sensibilidad menor. Es decir, salvo para la CHCM en que el rechazo por EI también ocurrió por los tres criterios de VB, el resto de los parámetros fueron rechazados por un criterio más exigente al ser evaluados por EI: HTO por VBd, VCM por VBo, HGB por VBo y RBC no son rechazados por EI (Tabla III).
Discusión y Conclusiones
La calidad total en las pruebas de hematología es esencial para garantizar resultados confiables para la toma de decisiones clínicas apropiadas. Aunque los autoanalizadores actuales proporcionan resultados rápidos, con alto rendimiento y gran exactitud, las pruebas pueden ser afectadas por problemas extra analíticos considerados triviales (10).
El HTO, HGB y VCM son parámetros importantes, tanto para el enfoque diagnóstico en pacientes con sospecha de anemia, como para su seguimiento, y pueden verse comprometidos por el tipo de anticoagulante empleado.
En este trabajo los valores de HGB y ERIT resultaron en promedio 1,2% más bajos en las muestras recolectadas con EDTAK3, probablemente debido al efecto dilucional del anticoagulante. Sin embargo, esta tendencia no se observó en LEU, NEU, LINF, MONO, EOS, BASO, PLT-I y PLT-F. Tampoco hubo diferencias en los parámetros reticulocitarios.
El VCM fue significativamente menor en los tubos con EDTAK3 porque el grado de deshidratación de las células en este anticoagulante es mayor. Los autoanalizadores Sysmex calculan el HTO sumando los pulsos de eritrocitos detectados por impedancia eletrónica. Dado que cada pulso es proporcional al tamaño celular y que el VCM fue menor en las muestras con EDTAK3 los hematocritos también resultaron más bajos.
La CHCM es un parámetro calculado por los contadores hematológicos utilizando la fórmula CHCM = HGB * 100/HTO. Como en las muestras recolectadas en EDTAK3 la HGB resultó solo ligeramente inferior comparada con las extraídas en EDTAK2, pero el HTO fue francamente más bajo, los valores obtenidos de CHCM con EDTAK3 resultaron, en promedio, 1,7% más altos. Cabe destacar que el sesgo de la CHCM, al igual que el del HTO, fue clínicamente significativo independientemente del nivel de tolerancia de VB utilizado para evaluarlo.
El ADE-CV y el ADE-DE son formas de estimar la distribución de tamaños de los eritrocitos. El ADE-DE se mide en fL y es la medida que corresponde al ancho del histograma de eritrocitos a la altura del 20% por encima de la línea de base. Mientras, que el ADE-CV se obtiene del histograma de eritrocitos como ADE-CV = DE * 100 / VCM (11) (12). El ADE-CV depende del DE del histograma de eritrocitos y también del VCM. Como ambos fueron más bajos en las muestras con EDTAK3 es probable que la relación se haya mantenido constante y debido a esto el ADE-CV no varió significativamente entre los anticoagulantes. Por el contrario, el ADE-DE fue significativamente menor en las muestras con EDTAK3 debido a que solo depende del ancho del histograma y éste resultó más bajo en estas muestras. En la práctica clínica no está difundido el uso del ADE-DE y no hay forma de evaluar la significancia clínica de este sesgo por falta de especificaciones de calidad.
La diferencia en la HGB sólo fue clínicamente significativa cuando se la evaluó con el criterio más exigente (VBo). Además, para los parámetros de la serie roja los criterios de VB, aún los de VBm, son bastante estrictos y cercanos al desempeño analítico (estado del arte) de los métodos actuales (13-15). Podría entonces pensarse que es exagerado considerar clínicamente significativos a estos sesgos. Pero es muy importante recordar que se están evaluando condiciones preanalíticas: si el sesgo de base para el HTO fue de 2,9%, dependiendo del anticoagulante que se utilizó en la extracción, no resta margen para el error analítico en el resultado.
Con los avances en la automatización los errores analíticos ya no son el principal factor que influye en la calidad de los resultados de las pruebas de laboratorio. Esta mayor seguridad en la fase analítica ha permitido centrar la atención en fuentes alternativas de errores, como factores preanalíticos y postanalíticos. Se ha demostrado que la mayoría de los errores de laboratorio ocurren en la fase preanalítica, principalmente debido a la falta de protocolos estandarizados (3). La ISCH recomienda el uso de EDTAK2 para el hemograma mientras que la CLSI no hace distinciones entre EDTAK2 y EDTAK3, pero no explicita que se puedan utilizar indistintamente ambos anticoagulantes en el mismo laboratorio (4)(5). En este trabajo se demostró que pueden producirse diferencias apreciables en los parámetros de la serie roja dependiendo de la sal de EDTA utilizada como anticoagulante. Por lo tanto, para disminuir el error preanalítico, cada laboratorio debe estandarizar la extracción de los hemogramas con un único tipo de anticoagulante. Es esencial un control riguroso de las condiciones preanalíticas para mantener las buenas prácticas de laboratorio, puesto que cada resultado está condicionado por la muestra de la cual deriva el valor.
1. Banfi G, Salvagno GL, Lippi G.The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med 2007; 45 (5): 565–76.
2. Lippi G, Guidi GC, Mattiuzzi C, Plebani M. Preanalytical variability: the dark side of the moon in laboratory testing. Clin Chem Lab Med 2006; 44 (4): 358–65.
3. Carraro P, Plebani M. Errors in a Stat Laboratory: types and frequencies 10 years later. Clin Chem 2007; 53 (7): 1338-42. [ Links ]
4. ICSH expert panel on Cytometry. Recommendations of the ISCH in Haematology for EDTA anticoagulation of blood for blood cell counting and sizing. Am J Clin Pathol 1993; 100 (4): 371-2. [ Links ]
5. Clinical and Laboratory Standards Institute. Tubes and additives for venous blood specimen collection. NCCLS H1-A5:2003. 5th edn. [ Links ]
6. Altman DG, Bland JM. Measurement in medicine: the analisys of method comparison studies. Statistician 1983; Vol. 32: 307-17. [ Links ]
7. Ricos C, Alvarez V, Cava F, Garcia Lavio JV, Hernandez A, Jimenez CV, et al. Current databases on biological variation: Pros, cons and progress. Scand J Clin Lab Investig 1999; 59 (7): 491-500. [ Links ]
8. Westgard QC. Desirable Biological Variation Database Specifications, [serial on line] 2014 Update. Disponible en https://www.westgard.com/biodatabase1.htm. Fecha de acceso: 13 de mayo de 2018. [ Links ]
9. Fraser CG, Petersen PH, Libeer JC, Ricos C. Proposals for setting generally applicable quality goals solely based on biology. Ann Clin Biochem 1997; 34: 8-12. [ Links ]
10. Lima-Oliveira G, Lippi G, Salvagno GL, Montagnana M, Poli G, Solero GP, et al. Brand of dipotassium EDTA vacuum tube as a new source of pre-analytical variability in routine haematology testing. Br J Biomed Sci 2013; 70 (1): 7-9. [ Links ]
11. Walters JG, Garrity PF. RDW-SD and RDW-CV: Their relationship to RBC distribution curves and anisocytosis, Sysmex International J 1993; 3 (1): 40-5. [ Links ]
12. Caporal FA, Comar SR. Evaluation of RDW-CV, RDW-SD, and MATH-1SD for the detection of erythrocyte anisocytosis observed by optical microscopy. J Bras Patol Med Lab 2013; 49 (5): 324-31. [ Links ]
13. Vis JY, Huisman A. Verification and quality control of routine hematology analyzers. Int J Lab Hem 2016; 38 (1): 100–9.
14. Topic E, Nikolac N, Panteghini M, Theodorsson E, Salvagno GL, Miler M, et al. Med How to assess the quality of your analytical method? Clin Chem Lab Med 2015; 53 (11): 1707–18.
15. Molina A, Guiñon L, Perez A, Segurana A, Bedini JL, Reverter JC, et al. State of the art vs biological variability: Comparison on hematology parameters using Spanish EQAS data. Int J Lab Hem 2018; 40 (3): 284-91. [ Links ]
Recibido: 22 de mayo de 2018
Aceptado: 12 de junio de 2018














