Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.1 La Plata mar. 2019
TOXICOLOGÍA
Micetismos. Parte 2: Síndromes con sintomatología demorada y latencia muy larga
Alicia Beatriz Pomilio1a*, Stella Maris Battista2b, Ángel Alonso3c
1 Doctora de la Universidad de Buenos Aires (Ph.D.), Investigadora Superior de CONICET. Profesora de la Universidad de Buenos Aires.
2 Médica. Doctorando en la Facultad de Medicina, Universidad de Buenos Aires. Docente en Facultad de Medicina (UBA).
3 Doctor en Medicina (Ph.D.), Médico, Facultad de Medicina, Universidad de Buenos Aires (UBA). Profesor Emérito UBA. Investigador en Histología, Microbiología e Inmunología.
a Departamento de Bioquímica Clínica, Área Hematología, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires, Av. Córdoba 2351, C1120AAF Buenos Aires, Argentina. Tel: (+54) (11) 4814 3952.
b Microbiología I, Cátedra 2 (Inmunología), Facultad de Medicina, Universidad de Buenos Aires. Correo electrónico: battistasm@yahoo.com.ar
c División Alergia e Inmunología, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires. Correo electrónico: administracion@cientifica.org.ar
* Autor para correspondencia.
Correspondencia Prof. Dra. ALICIA B. POMILIO Departamento de Bioquímica Clínica, Área: Hematología Hospital de Clínicas “José de San Martín” Universidad de Buenos Aires Av. Córdoba 2351 C1120AAF CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina. Correo electrónico: pomilio@ffyb.uba.ar
Resumen
En este trabajo se analizan los micetismos menos comunes, caracterizados por la aparición demorada de síntomas y por tiempos de latencia muy largos. Estas intoxicaciones son provocadas por especies de hongos ectomicorrícicos poco comunes. Se analizan: a) Toxíndrome nefrotóxico demorado o retrasado. Micetismo orellánico o por orellanina. b) Toxíndrome con rabdomiólisis. Micetismos por Tricholoma equestre y Tricholoma terreum. c) Toxíndrome encefalopático o neurotóxico retrasado. Micetismo por Pleurocybella porrigens. d) Toxíndrome cardiovascular. Micetismo por Trogia venenata. Se discuten el tiempo de incubación, las características sintomatológicas, el curso clínico, las toxinas responsables de cada micetismo y su mecanismo de acción, y el tratamiento que ha resultado efectivo para la recuperación de los pacientes.
Palabras clave: Micetismos; Síndromes demorados; Toxíndromes; Cortinarius; Tricholoma; Pleurocybella; Trogia; Toxinas; Tratamiento.
Abstract
Mushroom poisonings. Part 2: Delayed-onset syndromes with very long latency time
Less common mycetisms, characterized by delayed-onset and very long latency times are analyzed. These intoxications are caused by rare ectomycorrhizal fungal species. The following syndromes have been taken into account: (a) Delayed nephrotoxic syndrome. Orellanic mycetism or mycetism due to orellanin. (b) Syndrome with rhabdomyolysis. Mycetisms by Tricholoma equestre, and Tricholoma terreum. (c) Delayed encephalopathic or neurotoxic syndrome. Mycetism by Pleurocybella porrigens. (d) Cardiovascular syndrome. Mycetism by Trogia venenata. The incubation time, symptom characteristics, clinical course, toxins responsible for each mycetism and their mechanism of action, and treatment that has shown to be effective for patient recovery are discussed.
Keywords: Mycetisms; Delayed-onset syndromes; Toxidromes; Cortinarius; Tricholoma; Pleurocybella; Trogia; Toxins; Treatment.
Resumo
Intoxicações por cogumelos. Parte 2: Síndromes com sintomas retardados e latência muito longa
Neste trabalho, analisam-se micetismos menos comuns, caracterizados pelo aparecimento retardado de sintomas e tempos de latência muito longos. Essas intoxicações são causadas por espécies raras de fungos ectomicorrízicos. São analisados os seguintes: (a) síndrome de toxicidade nefrotóxica retardada ou atrasada. Micetismo orelânico ou micetismo por orelanina. (b) Toxíndrome com rabdomiólise. Micetismo por Tricholoma equestre e Tricholoma terreum. (c) Toxicidade tardia encefalopática ou neurotóxica. Micetismo por Pleurocybella porrigens. (d) Síndrome cardiovascular. Miceticismo por Trogia venenata. O tempo de incubação, as características sintomatológicas, o curso clínico, as toxinas responsáveis por cada micetismo e seu mecanismo de ação e o tratamento efetivo para a recuperação dos pacientes são discutidos.
Palavras-chave: Miscetismos; Síndromes retardadas; Toxidromes; Cortinarius; Tricholoma; Pleurocybella; Trogia; Toxinas; Tratamento.
1. Introducción
El presente trabajo corresponde a la segunda parte de cuatro artículos referidos a micetismos. La primera parte (1) se refirió a la clasificación de las intoxicaciones debidas a la ingestión de carpóforos de hongos Basidiomicetos ectomicorrícicos en base al tiempo de incubación o al período de latencia en: 1) Toxíndromes con un período de latencia mayor de 6 horas (entre 6 y 24 horas), denominados micetismos tardíos. 2) Toxíndromes con un período de latencia superior o igual a un día, denominados micetismos demorados o retrasados. 3) Toxíndromes con un período de latencia inferior a 6 horas, denominados micetismos tempranos. En ese trabajo se analizaron seis micetismos tardíos provocados por amatoxinas de Amanita phalloides, especies nefrotóxicas de Amanita, especies de Clitocybe, giromitrina, especies de Morchella y por Hapalopilus rutilans respectivamente.
En el presente trabajo (parte 2) se discutirán los micetismos demorados del grupo 2, que corresponden a:
a) Toxíndrome nefrotóxico demorado o retrasado. Micetismo orellánico o por orellanina.
b) Toxíndrome con rabdomiólisis. Micetismos por Tricholoma equestre y T. terreum.
c) Toxíndrome encefalopático o neurotóxico retrasado. Micetismo por Pleurocybella porrigens.
d) Toxíndrome cardiovascular. Micetismo por Trogia venenata.
Estos son síndromes menos comunes, varios de los cuales han ocurrido inicialmente en determinadas áreas geográficas, extendiéndose después a otras zonas quizás por tratarse de Basidiomicetos ectomicorrícicos con árboles caducifolios y también perennes (coníferas) que al ser introducidos en otros continentes contribuyeron a la dispersión de los hongos, algunos comestibles y otros de alta toxicidad. Esto ha pasado por ejemplo con gran parte del continente americano, y un especial ejemplo es la Argentina, por la introducción de árboles de Europa, Estados Unidos, Australia y Japón.
En el presente artículo es necesario también acotar que en los hongos superiores, Macromicetos, lo que se recolecta para el consumo, corresponde a sus cuerpos fructíferos (carpóforos), que en castellano se denominan “setas” (en inglés: “mushrooms”) y el organismo completo “hongo” (en inglés: “fungus”), pero que en la Argentina llamamos indistintamente “hongo”.
La parte 3 que corresponde a micetismos tempranos gastrointestinales, será tema del tercer artículo. En la parte 4 se analizarán micetismos tempranos con síntomas complejos.
2. Análisis de cada síndrome principal del micetismo considerado (en el presente trabajo se tratarán sólo los micetismos demorados)
GRUPO 2: Micetismos demorados
2.1. Toxíndrome nefrotóxico demorado o retrasado. Micetismo orellánico o por orellanina
Este micetismo se debe a hongos del género Cortinarius, que crecen en bosques de árboles de hoja caduca o de pinos según la especie y se encuentran muy distribuidos en Europa y América del Norte, donde han causado un gran número de intoxicaciones y a veces muertes. Estos hongos suelen confundirse con hongos comestibles como Cantharellus cibarius, Cantharellus tubaeformis y Armillaria mellea (sinónimo: Armillariella mellea), como también con los hongos psicoactivos Psilocybe spp. y es probable que este micetismo ocurra más a menudo de lo informado (2)(3). Cortinarius es uno de los géneros más grandes en la subdivisión Basidiomycotina que comprende de 2.000 a 3.000 especies diferentes, ampliamente distribuidas en el mundo; sólo en la Península Ibérica crecen unas 500 especies de este género (4).
La mayoría de las especies del género Cortinarius son tóxicas, especialmente las que se encuentran en el subgénero Cortinarius, sección Orellani (5) (anteriormente subgénero Leprocybe, sección Orellani (6), pero existen dudas con muchas otras: Cortinarius caperatus y Cortinarius praestans son las especies reconocidas como comestibles (4)(5)(7)(8).
Período de latencia. Esta intoxicación, también llamada “síndrome de Orellanus”, tiene un larguísimo período de latencia, de 2 a 15 días, a veces de 3 días a 3 semanas después de la ingestión (9). Esta incubación sin síntomas hace que algunas personas confiadas consuman repetidas veces el mismo tipo de carpóforo (10)(11).
Síntomatología. Algunos pacientes sufren molestias gastrointestinales leves en el período de latencia. Luego aparecen náuseas, vómitos, letargo, anorexia, micción frecuente, sed intensa, boca y labios secos, sensación de ardor en la lengua, pérdida de apetito, poliuria, diarrea, estreñimiento y vómitos, seguidos por dolor de cabeza, escalofríos y gran cansancio general. También, tras una cierta mejoría, aparece la fase renal, ya que hay una recaída por afección renal grave (11); el dolor lumbar y la oliguria (más raramente poliuria) pueden coincidir con la fase gastrointestinal, junto con polidipsia en el 50% de los casos. Aparecen también vómitos, oliguria, edemas e incluso trastornos neurológicos (somnolencia, insomnio, parestesia, trastornos cognitivos) y reacciones parasimpaticomiméticas (por ejemplo: miosis ocular) (12). Después de 1 a 9 semanas del inicio de la insuficiencia renal, al realizar la biopsia renal se pudo apreciar, en la mayoría de los casos, nefritis tubulointersticial con daño del epitelio tubular. También pudo observarse edema intersticial, infiltrados inflamatorios y el inicio de fibrosis intersticial. Tras un período de 35 a 180 días, en una segunda biopsia renal se evidenció disminución del edema, fibrosis intersticial y lesión tubular de diferente intensidad (4).
Es decir que la intoxicación por Cortinarius spp. se caracteriza por una tubulopatía aguda diferida, que puede progresar hacia la insuficiencia renal crónica en la mitad de los casos (13). En casos más graves, sin embargo, se trata de una insuficiencia renal creciente, que ocurre después de aproximadamente 5-15 días, caracterizada por oligoanuria y síntomas de uremia. Muchos casos agudos se resuelven por trasplante renal. Sin embargo, teniendo en cuenta la posible cinética del compuesto tóxico debería tomarse una distancia mínima de 6 meses entre la intoxicación y el trasplante (14)(15).
En caso de intoxicación leve, los síntomas pueden desaparecer de manera espontánea, con una evolución favorable en el curso de unos días (16). Si bien, en algunos casos, se han descripto alteraciones hepáticas (aumento de transaminasas y de bilirrubina), puede descartarse que exista lesión hepática grave. En casos bien documentados de intoxicación en Francia no se detectó ninguna anomalía clínica ni biológica que sugiriera afectación hepática y la biopsia hepática fue normal (16). En estudios de experimentación animal, tampoco se ha detectado toxicidad hepática (17). Si existe toxicidad hepática por Cortinarius spp., probablemente sea precoz, limitada y transitoria.
Historia de la intoxicación. Primeros casos clínicos. Todas las especies del género Cortinarius eran consideradas comestibles hasta que en 1952 se produjeron en Polonia 102 casos de intoxicación con Cortinarius orellanus, por lo que fallecieron 19 personas. Los primeros registros de intoxicación se publicaron en 1957 en Polonia (18). Grzymala publicó 135 casos de intoxicación atribuida a C. orellanus observados en Polonia desde 1953 hasta 1962 (19). Desde entonces, otras especies del género Cortinarius, subgénero Leprocybe, sección Orellani (6), actualmente subgénero Cortinarius, sección Orellani (5), han sido incriminadas y se ha confirmado la responsabilidad de la toxina orellanina (19)(20). La insuficiencia renal grave causada por Cortinarius speciosissimus se reconoció por primera vez en 1972 y se registró sólo en Escandinavia, hasta que en el verano de 1979 se registraron los primeros casos debidos a esta especie en Escocia (21). Posteriormente, en 1987 se produjo en Francia la intoxicación de 26 cadetes militares por consumo de sopa de hongos, elaborada exclusivamente con C. orellanus, durante unas maniobras de supervivencia; si bien no hubo desenlaces fatales, 12 pacientes presentaron nefritis tubulointersticial aguda con insuficiencia renal aguda; de los cuales, 8 se recuperaron rápidamente y los otros 4 sufrieron insuficiencia renal crónica durante varios meses (16). En el otro grupo de 14 pacientes, se observó leucocituria inicial en 12 casos, si bien la función renal se mantuvo normal durante un año de seguimiento. Las pruebas de hidroxilación y de acetilación hepáticas realizadas después de 6 meses en 22 pacientes no proporcionaron ninguna explicación de la fuerte sensibilidad individual a la toxicidad renal debida a este hongo (16).
En 1994 y 1995 se investigaron seis brotes de envenenamiento que involucraron a diez individuos en el norte de Italia y en Austria (22). En una extensa revisión de la literatura publicada en 2001, se registraron 245 casos de intoxicación por diferentes especies de Cortinarius (13). En Baviera, Alemania, se deben principalmente al consumo de C. rubellus (anteriormente C. speciosissimus) que crecen en los bosques de abetos y se confunden con Armillaria mellea (sinónimo: Armillariella mellea) (15)(23).
En América del Norte se informó recientemente que la intoxicación con Cortinarius orellanosus causó insuficiencia renal irreversible en un paciente dentro del período de 1-2 semanas luego de la ingestión (5).
Se ha propuesto que tiene valor pronóstico la cantidad de carpóforos ingeridos, la aparición precoz del cuadro gastrointestinal y de la insuficiencia renal, y los antecedentes de patología renal (4), si bien, hay controversias al respecto.
Toxinas. El compuesto nefrotóxico potente de varias de las especies nefrotóxicas del género Cortinarius es la orellanina (3,3’,4,4’-tetrahidroxi-2,2’-bipiridina-1,1’- dióxido), que es el derivado hidroxilado dimérico de piridina N-óxido (2, 24, 25). La orellanina es resistente al calor, al frío y al secado, por lo que el almacenamiento, el desecado y la cocción no la desactivan (26).
La orellanina fue aislada en 1962 de C. orellanus, cuando se estudiaron además sus efectos anátomo-patológicos (19); en 1965 se realizó un estudio clínico de las intoxicaciones debidas a la ingestión de este hongo (20). La estructura de la orellanina fue descripta en 1979 (24) y fue confirmada en 1987 por rayos X (27).
La orellanina experimenta reducción química y descomposición por calor o luz (degradación fotoquímica) al compuesto tóxico orellinina y finalmente a un compuesto no tóxico orellina (Fig. 1) (24)(28). La orellanina se encuentra in vivo como el correspondiente 4,4’-diglucósido (Fig. 2), que la genera por hidrólisis (29).

Figura 1. Estructuras químicas de orellanina, orellinina y orellina.

Figura 2. Estructura química del compuesto natural 4,4’- diglucopiranósido de orellanina.
De los cuerpos fructíferos de especies del género Cortinarius también se han aislado e identificado varios otros compuestos como: polipéptidos cíclicos (30), compuestos de bipiridilo (24), varios tipos de derivados de antraquinona y triterpenoides cromogénicos (31). También se aislaron tres disulfuros de los cuerpos fructíferos de un Basidiomiceto Cortinarius sp. de Nueva Zelanda que se identificaron como: óxido disulfuro asimétrico de cortamidina, 2,2’-ditiobis(piridina N-óxido) y como el correspondiente disulfuro simétrico (Fig. 3); los dos primeros mostraron actividad antimicrobiana significativa y citotoxicidad (32).

Figura 3. Estructuras químicas del óxido disulfuro asimétrico de cortamidina, 2,2’-ditiobis(piridina N-óxido) y del disulfuro simétrico.
La investigación temprana de los componentes tóxicos de C. speciosissimus condujo al aislamiento de cortinarinas A-C (Fig. 4), péptidos cíclicos con una fluorescencia característica y estructuralmente parecidos a las falotoxinas (30). La cortinarina A se convierte en el hígado en cortinarina B, la más tóxica, mientras que la cortinarina C sería inocua. Sin embargo, varios grupos de investigación no pudieron aislar de esa especie ningún ciclopéptido similar a las cortinarinas (25)(33). Se requiere más investigación para aclarar la existencia de estos ciclopéptidos.

Figura 4. Estructuras químicas de las cortinarinas A-C.
Se conocen unos pocos compuestos nitroaromáticos de Basidiomicetos, entre ellos, el ácido 6-nitro-iso-vainillínico (Fig. 5) de los cuerpos fructíferos de Cortinarius anomalus (34). También se producen aminoaldehídos aromáticos, como 2-amino-4-metoxi-benzaldehído (Fig. 5) obtenido de los carpóforos de Cortinarius umidicola (35).

Figura 5. Estructuras químicas de ácido 6-nitro-iso-vainillínico y 2-amino-4-metoxibenzaldehído.
Además, los cuerpos fructíferos de color oliva del hongo no comestible Cortinarius infractus producen los derivados de β-carbolina, muy fluorescentes, infractinas A y B (Fig. 6) (36). Otros derivados de β-carbolina 7-hidroxilados son bruneínas A-C y el ácido 3-(7-hidroxi- 9H-β-carbolin-1-íl)-propanoico (Fig. 6) de Cortinarius brunneus (37). Las pruebas biológicas de bruneína A mostraron una inhibición muy baja de la enzima acetilcolinesterasa (menos del 50% de inhibición a una concentración de 10-4 M contra acetilcolinesterasa y la enzima relacionada butirilcolinesterasa), sin citotoxicidad asociada (37)(38).

Figura 6. Estructuras químicas de los derivados de β-carbolina: infractinas A y B, bruneínas A-C y ácido 3-(7-hidroxi-9H-β- carbolin-1-íl)-propanoico.
Se determinaron también cinco cerebrósidos de los cuerpos fructíferos del Basidiomiceto Cortinarius tenuipes de China, que fueron identificados mediante métodos químicos y datos espectroscópicos como: (4E,8E)-N-D-2’-hidroxitetracosanoíl- 1-O-β-D-glicopiranosil-9-metil-4,8-esfingadienina (cortenuamida A), (4E,8E)-N-D-2’-hidroxitricosanoíl- 1-O-β-D-glicopiranosil-9-metil-4,8-esfingadienina (cortenuamida B), (4E, 8E)-N-D-2’-hidroxidocosanoíl-1- O-β-D-glicopiranosil-9-metil-4,8-esfingadienina (cortenuamida C), (4E, 8E)-N-D-2’-hidroxioctadecanoíl-1- O-β-D-glicopiranosil- 9-metil-4,8-esfingadienina y (4E, 8E)-N-D-2’ hidroxipalmitoíl-1-O-β-D-glicopiranosil-9- metil-4,8-esfingadienina (Fig. 7) (39).
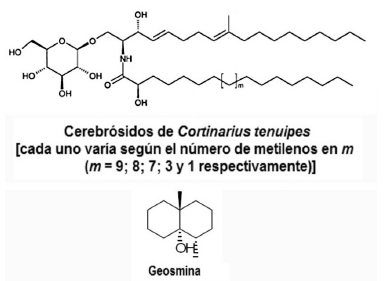
Figura 7. Estructuras químicas de cerebrósidos y del compuesto volátil geosmina presentes en especies del género Cortinarius.
También se estudiaron los compuestos químicos volátiles, algunos responsables de los olores pungentes, como el olor a naftaleno de Cortinarius lebre, hongo comestible de Chile, que es causado por indol (40), el olor anisado de C. odorifer debido a p-anisato de metilo (41) y el desagradable olor terroso del basidioma de Cortinarius hinnuleus de Europa Central, mediante microextracción en fase sólida con cromatografía gaseosa de headspace acoplada a espectrometría de masa, identificando así: geosmina (Fig. 7) (responsable del olor desagradable), β-cariofileno y β-barbateno, además de los compuestos volátiles de C8: 1-octen-3-ol, 1-octen-3-ona, octan-3-ol, octan-3-ona y 2-octen-1-ol (42). En general, los compuestos orgánicos volátiles desempeñan un papel importante para los hongos en su entorno natural, actuando como señales entre hongos y plantas, y también con insectos.
Cortinarius cinnamomeoluteus P. D. Orton [sinónimo= C. salignus (M. M. Moser & Gerw. Keller) G. Garnier] es un hongo no comestible, cuyos carpóforos aparecen de julio a octubre en Alemania. Los principales pigmentos de C. cinnamomeoluteus son: flavomanina-6,6’-dimetiléter (color amarillo verdoso) y un producto de su oxidación (color amarillo), anhidroflavomanina-9,10-quinon-6,6’- dimetiléter, y los dos ácidos carboxílicos de antraquinonas: dermoluteína (color amarillo) y dermorrubina (color rosa púrpura). También se detectaron en pequeña cantidad: 5-clorodermorrubina (color rosa púrpura), endocrocina (color amarillo) (Fig. 8) y los correspondientes glicósidos de los ácidos carboxílicos de antraquinonas. Además, probablemente se producen más productos de oxidación de flavomanina-6,6’-dimetiléter o de anhidroflavomanina-9,10-quinon-6,6’-dimetiléter, que presentan color amarillo a amarillo-marrón. C. cinnamoneus, C. croceus (C. cinnamomeolutescens, C. cinnamomeobadius, Dermocybe cocea) y C. uliginosus (Dermocybe uliginosa) son tres especies estrechamente relacionadas, sospechosas de ser tóxicas, que tienen una composición de pigmentos prácticamente idéntica (43-45).

Figura 8. Pigmentos antraquinónicos del género Cortinarius.
Cortinarius cinnabarinus Fr. y C. semisanguineus (Fr.) Gillet, ambas especies de Méjico, también contienen pigmentos antraquinónicos: emodina, dermorrubina, dermocibina y flavomanina (Fig. 8) (46).
Varios carpóforos del género Cortinarius, como: C. arcuatorum R. Henry, C. cf. calochrous Fr., C. fulvoincarnatus Joach. y C. sodagnitus R. Henry dan una llamativa reacción de color rojo-tinta cuando se tratan con un álcali acuoso (47), debido a la presencia de cromógenos; más adelante se propone un mecanismo para esta reacción. De los carpóforos de Cortinarius fulvoincarnatus se aislaron e identificaron seis cromógenos, denominados sodagnitinas A-F (Fig. 9), que son triterpenoides del tipo malabaricano (Fig. 10) con una cadena lateral altamente modificada (31).

Figura 9. Estructuras químicas de sodagnitinas A-F.

Figura 10. Esqueleto triterpenoide de tipo malabaricano.
Las sodagnitinas A y C presentan actividad biológica contra Bacillus subtilis, Bacillus brevis y Nematospora coryli a concentraciones ≥ 5 μg/disco. Ambas sodagnitinas son citotóxicas contra células tumorales L1210 a concentraciones superiores a 1 y 5 μg/mL, respectivamente.
Las sodagnitinas son polvos amorfos e incoloros que se pueden conservar durante varios meses a temperatura ambiente. La adición de álcali a sus soluciones alcohólicas causa inmediatamente el desarrollo de color rojo característico, que persiste durante varias horas. El máximo UV/Vis (lmáx) se desplaza de 292 nm (log ε=3,78) a 520 nm (log ε=4,01).
El cambio de color puede explicarse debido a la formación de un anión oxonol muy deslocalizado según el mecanismo propuesto en la Fig. 11. La reacción ocurre por la adición de un anión hidroxilo al grupo metileno exo de la cadena lateral de la sodagnitina, seguido por una fragmentación con la apertura concomitante del anillo tetrahidropirano. La subestructura 1,9-dioxononatrieno resultante da lugar al anión oxonol de color rojo que presenta lmáx = 320 nm. Los valores lmáx de aniones oxonoles similares, así como el de un anión oxonol calculado con sustituyente oxigenado en C-3 (lmáx calc. = 526 nm) (Fig. 11), concuerdan bien con los de las soluciones alcalinas de sodagnitinas (31).

Figura 11. Mecanismo propuesto para la reacción de color rojo de las sodagnitinas con álcali.
Mecanismo de acción de la orellanina. El micetismo por especies del género Cortinarius se caracteriza por insuficiencia renal aguda retrasada, y en algunos casos progresa a enfermedad renal en etapa terminal. El compuesto responsable es la toxina orellanina, que es una bipiridina estructuralmente similar a los herbicidas Diquat (1,1’-etilen-2,2’-bipiridinio) y Paraquat (1,1’-dimetil-4,4’-bipiridinio) y a la neurotoxina dopaminérgica 1-metil-4-fenil-1,2,3,6-tetrahidro-piridina (MPTP) por lo que se ha sugerido que su mecanismo de acción puede estar relacionado con el de estos compuestos. Se ha demostrado que la orellanina inhibe la síntesis de proteínas in vitro y que tiene que ser activada antes de producir su efecto (48). La orellanina genera radicales libres de oxígeno a partir de un complejo que forma con hierro, el cual puede jugar un rol importante en algunos de los efectos tóxicos conocidos de la orellanina; el mecanismo de toxicidad se correlacionó con una depleción de glutatión y ascorbato, que están implicados en la defensa contra el daño oxidativo (49).
La orellanina presenta afinidad por las células epiteliales tubulares y se acumula en el riñón, donde despliega su efecto tóxico llevando a una nefritis intersticial severa. El mecanismo de acción tubulotóxica ha sido en parte aclarado, pues Richard et al (50) demostraron mediante resonancia de espín electrónico que la orellanina produce el radical anión orto-semiquinona aparentemente estable (Fig. 12) y especies radicales reactivas de oxígeno, al comparar las propiedades de la orellanina con las de otros compuestos de bipiridina. Experimentalmente, después de una oxidación fotoquímica con luz visible, se observó una forma radical de la orellanina a pH fisiológico bajo condiciones aeróbicas o anaeróbicas. Este radical, identificado como radical anión orto-semiquinona, también se generó por oxidación con agentes oxidantes biológicos o sistemas enzimáticos. La producción de radicales superóxido e hidroxilo se mostró mediante el método de trampa de espín utilizando 5,5-dimetil-l-pirrolin-N-óxido (DMPO) como trampa de espín. Los agentes biorreductores como glutatión y cisteína involucran in vitro al radical semiquinona y orellanina en un proceso de ciclado redox resultando en la producción de radicales libres glutationilo y oxígeno. Este proceso condujo in vitro a un gran consumo de oxígeno y a una marcada depleción del nivel de glutatión (50).

Figura 12. Formación de un radical anión orto-semiquinona, mediante una oxidación de un electrón, a partir de orellanina a pH 5,8 a 11. Valores de pK aparentes de la toxina: pK1 = 1,5, pK2 = 5,8 y pK3 = 11,0.
La nefritis intersticial aguda es una causa frecuente de lesión renal aguda, que representa el 15-27% de las biopsias renales realizadas debido a esta condición. En general, la nefritis intersticial aguda es inducida por medicamentos, como: fármacos antimicrobianos y antiinflamatorios no esteroideos (51). La patogenia se basa en una reacción inmunológica contra antígenos nefritogénicos endógenos por las células tubulares, con inmunidad mediada por células que les da un rol patogénico principal. Los infiltrados intersticiales característicos, compuestos principalmente de linfocitos, macrófagos, eosinófilos y células plasmáticas, experimentan una rápida transformación en las áreas de fibrosis intersticial. Una proporción significativa de nefritis intersticial aguda tiene actualmente una presentación oligosintomática, si bien la presencia de síntomas extrarrenales específicos, como fiebre, erupción cutánea, artralgias y eosinofilia periférica, tienen un papel importante para orientar el diagnóstico clínico (51).
Los estudios biológicos realizados con orellanina revelaron una actividad nefrotóxica significativa, con un valor de DL50 oral promedio en ratones de 39 mg/kg de peso corporal y DL50 intraperitoneal en ratones de 5 mg/kg de peso corporal, si bien los datos clínicos sugieren una mayor sensibilidad a la toxina en humanos que en ratones (2). En los animales, la administración de orellanina purificada provoca los mismos efectos que la intoxicación en humanos (4).
Además, una fuerte fluorescencia está asociada con orellinina y orellina que son los productos de descomposición de orellanina (25).
Faltaría investigar la contribución al cuadro sintomatológico de los restantes compuestos activos descriptos en la sección Toxinas, que se han encontrado en especies del género Cortinarius.
Técnicas de detección de orellanina en carpóforos, fluidos corporales y biopsias renales. El diagnóstico de este síndrome se basa en la identificación microscópica de las esporas de hongos del género Cortinarius y en la detección de la toxina orellanina en los hongos sobrantes.
Se conoce un método sencillo para determinar la presencia de orellanina en los carpóforos, en las sobras de la comida tóxica o en los restos de la limpieza de los hongos, descripto por Pöder y Moser (52) y por Bresinsky y Besl (6) que consiste en agregar una gota de cloruro férrico al 2% en HCl 0,5N al líquido obtenido por presión de carpóforos enteros o fragmentos de los mismos, frescos o rehidratados; en presencia de orellanina, el líquido amarillento inmediatamente se tiñe de rojo púrpura-azul oscuro a violeta (52-54).
Se han desarrollado diferentes métodos de análisis para detectar orellanina, como: cromatografía en capa delgada, electroforesis y resonancia electrónica paramagnética (4). Es posible una detección de orellanina por cromatografía de fluorescencia en fluidos corporales y en biopsia renal, la sensibilidad se considera muy alta con 10 ng. Supuestamente, el compuesto tóxico puede determinarse en las primeras 24 horas en orina y hasta dos semanas en suero (55). Sin embargo, la mayoría de estos métodos dan falsos positivos y su límite de sensibilidad es alto.
En el tejido de biopsia renal, la orellanina es detectable mediante la técnica de cromatografía en capa delgada (22)(23) hasta 6 meses después de la intoxicación (9). Sin embargo, muchas veces no ha sido posible la detección de orellanina en tejidos, orina y suero tanto tiempo después de la intoxicación, aún con un diagnóstico confiable (15)(22).
Dado que la orellanina es sensible a la luz, para un análisis confiable, todos los pasos posteriores a la biopsia renal deben realizarse en oscuridad. Para el análisis mediante cromatografía en capa delgada, es recomendable que el material de la biopsia sea transferido a aproximadamente 1 mL de solución de metanol acuoso al 50% en un vial de vidrio (el metanol puede disolver los plastificantes de los viales de plástico) envuelto con papel de aluminio para proteger de la luz (54).
Se examinaron un total de 87 muestras clínicas (muestras de orina y sangre que incluían material de biopsia renal de tres pacientes) para detectar la presencia de orellanina tiempo después de la intoxicación mediante cromatografía en capa delgada utilizando pequeñas cantidades de material de biopsia renal (22). Sin embargo, no se encontró toxina en muestras de orina o sangre, lo cual se debe a que la orellanina se concentra rápidamente en los riñones en una forma relativamente soluble y no se puede detectar en orina, sangre y líquidos de diálisis en el momento en que aparecen los primeros síntomas (22).
Por lo tanto, las muestras biológicas a analizar se deben obtener lo más pronto posible, congelarlas, evitar la luz porque la orellanina se degrada y realizar su análisis lo antes posible.
También se desarrollaron métodos de ensayo de diagnóstico basados en cromatografía líquida de alta resolución (sigla HPLC, del inglés: high-performance liquid chromatography) y cromatografía líquida-espectrometría de masa tándem (CL-EM/EM), especialmente con ionización por electrospray (ESI: electrospray ionization), para la identificación y cuantificación de orellanina en hongos. Así se usó CL-ESI-EM/EM para determinar orellanina total en Cortinarius rubellus, en plasma sanguíneo enriquecido y un guiso de hongos preparado a partir del hongo comestible Cantharellus tubaeformis con la adición de un solo espécimen de C. rubellus (2). La existencia de orellanina mono- y diglicosilada en C. rubellus también se demostró, aunque no se pudo obtener un análisis cuantitativo de los glucósidos debido a la rápida hidrólisis en el extracto. La extracción con HCl 3M o agua produjo principalmente orellanina, mientras que el metanol o metanol acidificado extrajeron principalmente orellanina mono y diglicosilada. La mayor recuperación de orellanina total se obtuvo con HCl 3 M, que posteriormente se utilizó para el análisis cuantitativo. Una columna de HPLC C18 y un pH bajo en los eluyentes retuvieron todas estas toxinas. La orellanina pudo detectarse a un nivel de 4,9 ng/mL en todos los extractos, el cual está muy por debajo del umbral de los efectos tóxicos agudos. Además, se probó el patrón de fragmentación de orellanina en EM/EM por electrospray. El método descripto es útil para dos aplicaciones importantes: 1) Análisis cuantitativo de productos alimentarios procesados que pueden estar contaminados con orellanina de carpóforos de Cortinarius. 2) Método para monitorear orellanina a bajas concentraciones dentro del intervalo terapéutico en el suero sanguíneo, ya que actualmente se está evaluando orellanina para el tratamiento del cáncer renal metastásico (2).
Recientemente se identificó orellanina mediante CL-EM/EM en Cortinarius armillatus. La concentración media de toxina de 145 μg/g fue <1% de la de C. rubellus, que es más tóxico. El método por HPLC puede detectar orellanina hasta 17 μg/g, mientras que el método CL-EM/EM es casi 2.000 veces más sensible y puede detectar orellanina hasta 30 ng/g. Ambos análisis son cuantitativos, selectivos y ahora están disponibles para aplicaciones de diagnóstico (5).
También se desarrollaron métodos analíticos de HPLC y CL-EM/EM en tejidos para detectar orellanina e investigar sus efectos toxicológicos en ratones (56). El límite de cuantificación por HPLC fue de 10 μg/g y el límite de detección fue de 20 ng/g para CL-EM/EM. En ratones inyectados con orellanina, las concentraciones de orellanina en riñón fueron 97±51 μg/g en el día 0 y 17±1 μg/g al terminar el día 3. Se registraron lesiones esplénicas y hepáticas en este modelo de ratón (56).
Análisis histopatológico. La histología de tejidos de la biopsia renal muestra un pronunciado daño tubulointersticial con necrosis focal, infiltrados inflamatorios y edema intersticial en glomérulos intactos. Luego se desarrolla una fibrosis intersticial en aumento (15)(57).
Un estudio inmunohistológico de IgG, IgM, IgA y C3d no mostró ningún hallazgo conspicuo (15).
En una paciente de 62 años se realizó una biopsia renal 2 días después del ingreso. El examen histológico mediante microscopía óptica mostró nefritis intersticial aguda de tipo linfomononuclear y glomérulos preservados globalmente. Un aumento mayor del intersticio tubular reveló distrofia tubular con vacuolización anisométrica, pérdida de membranas del borde en cepillo y detritus celulares en la luz tubular. Se pudo observar un daño tubular agudo moderado y nefritis tubulointersticial aguda no destructiva mínima, probablemente debida a este micetismo. La cromatografía en capa delgada de una muestra de biopsia procesada adecuadamente como se describió antes no detectó la toxina orellanina (3).
Análisis clínicos. Las pruebas de laboratorio generalmente revelan alto nitrógeno ureico (N-ureico) en sangre (cantidad de nitrógeno circulando en forma de urea en el torrente sanguíneo). El hígado produce urea en el ciclo de la urea como producto del metabolismo proteico, que a su vez es eliminada a través de los riñones. Un aumento de los valores de N-ureico en sangre indica disminución en la función renal, si bien los niveles elevados de creatinina son más específicos para evaluarla. Una de las causas del aumento de N-ureico es la disminución en la tasa de filtración glomerular, lo cual sugiere insuficiencia renal. Valores normales (v.n.) en adultos: N-ureico=6-20 mg/100 mL de sangre (6-20 mg/dL o 1,8-7,1 mmol/L); creatinina=0,5-1,3 mg/dL.
Un valor de N-ureico muy elevado (>80 mg/dL) generalmente indica un daño moderado-severo en la función renal.
Cuando la relación N-ureico/creatinina es mayor de 20, se debe sospechar que el paciente tiene una insuficiencia renal de origen pre-renal, llevando el análisis a las posibles causas de la disminución del flujo hacia los riñones, comúnmente por shock hipovolémico o por deshidratación asociada al uso de diuréticos, baja ingesta de agua o pérdida de líquidos al tercer espacio.
Los pacientes intoxicados con especies del género Cortinarius desarrollan insuficiencia renal anúrica, o bien, oliguria después de varios días de vómitos y diarreas, por lo que presentan los parámetros de retención N-ureico y creatinina muy aumentados. A modo de ejemplo, se registraron valores de N-ureico de 110 mg/ dL a 240 mg/dL y valores de creatinina de 4,6 mg/dL a 18,4 mg/dL en pacientes de ambos géneros, y edades de 26 a 85 años, incluyendo un niño de 11 años, en el momento de ser internados. Esos valores se incrementaron al aumentar la gravedad de la lesión renal en ese momento (3)(10)(12)(15)(54)(58)(59). En pacientes con lesión renal menos grave los valores de creatinina sérica (1,7 mg/dL) son levemente mayores a los normales al momento de la internación.
La evolución del paciente internado se puede observar mediante los valores de creatinina que van aumentando, hasta mantenerse estables cuando el tratamiento es efectivo, y en algunos casos con resultados favorables, disminuyen hasta llegar a valores normales.
Considerando que la creatinina sérica generalmente no sube más de 2 mg/dL por día en el caso de una insuficiencia renal aguda, se puede determinar retrospectivamente la fecha en que los pacientes podrían haber tenido una función renal normal (15).
Varios pacientes estaban anémicos cuando se internaron, con valores de hemoglobina de 11,5 g/dL (3)(15). En la mayoría de ellos se observó aumento en los niveles de potasio y fosfato (ejemplo: K+: 5,1-9,1 mEq/L; v.n.: 3,5-4,5 mEq/L), mientras que sodio y calcio estaban disminuidos (ejemplo: Na+: 123-134 mEq/L; v.n.: 135-145 mEq/L; Ca++: 1,10-1,15 mEq/L; v.n.: 2,13-2,55 mEq/L) (3)(10)(15)(58)(59).
En pacientes con marcado aumento de potasio, el electrocardiograma mostró signos de hiperpotasemia, por lo que fueron transferidos a la unidad de cuidados intensivos (58)(59).
En la gasometría se observaron valores anormales de pH de 7,32-7,39 (v.n.: 7,35-7,45), HCO -3 de 13- 16 mEq/L (v.n.: 22-26 mEq/L), presión parcial de oxígeno PO2: 268 mmHg (v.n.: 80-100 mmHg), presión parcial de dióxido de carbono PCO2: 31 mmHg, (v.n.: 35- 45 mmHg) (10)(12)(58)(59).
En el hemograma se destaca una plaquetopenia, por ejemplo: 69 x 103/μL de plaquetas; el resto del hemograma y de los parámetros de coagulación son normales (10).
Cuando se pudo obtener algo de orina, el análisis mostró microhematuria en varios pacientes (3)(58)(59).
Los parámetros de la función hepática estaban en el rango normal en la mayoría de los pacientes; sólo en algunos se observaron valores aumentados. Los valores corresponden a las enzimas: aspartato aminotransferasa (AST), también conocida como transaminasa glutámico oxalacética sérica (GOT o SGOT: del inglés serum glutamic oxaloacetic transaminase); alanina aminotransferasa (ALT) o transaminasa glutámico-pirúvica sérica (SGPT: del inglés serum glutamic pyruvic transaminase) y gamma-glutamil transferasa (GGT)] (3).
Los parámetros inmunológicos y las pruebas virológicas fueron todos negativos (3)(10)(15). Así, estaban en el rango normal: anticuerpos antinucleares (ANA), anticuerpos anticitoplasma de neutrófilo (ANCA), anti- ADN y anticuerpos antimembrana basal glomerular, factores del complemento y haptoglobina. Las serologías para los virus de la hepatitis B (VHB), de la hepatitis C (VHC) y de la inmunodeficiencia humana (HIV) fueron negativas. El proteinograma C3, C4 y la cuantificación de inmunoglobulina estaban en límites normales.
En las ecografías renales generalmente ambos riñones, o sólo uno de ellos, estaban ligeramente agrandados con parénquima ensanchado, mientras que en otros pacientes los riñones eran de tamaño normal (3)(15).
Cuando se pudo realizar una biopsia renal, se realizó más de una en distintos días y el análisis histológico mostró infiltrado linfocítico intersticial focal marcado, compatible con nefritis intersticial (12). Varios pacientes presentaron nefritis tubulointersticial aguda, como el hallazgo predominante en la biopsia renal (60); las lesiones atróficas y necróticas del epitelio tubular estuvieron presentes en diversos grados en cada paciente. Los glomérulos y los vasos estaban normales. El análisis de inmunofluorescencia demostró la ausencia de depósitos de inmunoglobulina o de complemento (54)(58)(59).
Se observan amplias variaciones en la sensibilidad individual y no hay correlación entre la cantidad ingerida y la intensidad de los signos (61), si bien hay controversias en este último aspecto. La alta sensibilidad individual puede sugerir que la toxicidad renal se debe al metabolismo hepático de la toxina y a la capacidad de hidroxilación de los citocromos P450 hepáticos (16).
Especies causantes del micetismo. Reino: Fungi; División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Cortinariaceae: Cortinarius armillatus (5); Cortinarius cinnamomeus (L.) Fr. (Basónimo: Agaricus cinnamomeus L.) (crece en la Argentina: Tierra del Fuego) (62); Cortinarius cotoneus, Cortinarius gentilis (Fr.) Fr., Cortinarius henricii, Cortinarius hinnuleus, Cortinarius limonius; Cortinarius limonioides M.M. Moser (crece en la Argentina: Neuquén, Río Negro, Tierra del Fuego) (62); C. orellanoides, C. orellanosus (crece bajo robles en el oeste de Michigan, EE.UU.) (63), C. orellanus Fries (en bosques de coníferas del Norte de Europa), Cortinarius phoenicus, Cortinarius pseudosulphureus, Cortinarius rubellus Cooke (en bosques de coníferas del Norte de Europa) (2), C. speciosissimus, Cortinarius splendens Rob. Henry, Cortinarius trivialis, Cortinarius venetus.
Cortinarius cinnabarinus Fr. y C. semisanguineus (Fr.) Gillet, ambas especies de Méjico, provocan micetismo gastrointestinal (64).
Se confirmó la nueva especie tóxica norteamericana C. orellanosus en Michigan, EE.UU., estrechamente relacionada con C. orellanus, mediante el análisis filogenético de las regiones del espaciador interno transcripto (ITS: internal transcribed spacer) del gen de ARN ribosomal nuclear de una muestra de hongos tóxicos de Michigan ingeridos por una paciente que contrajo insuficiencia renal crónica, una muestra control de C. orellanus (JFA9859) de Europa y otras secuencias ITS estrechamente relacionadas de Cortinarius (63). Los resultados revelaron que el material de Michigan está muy relacionado con otras secuencias ITS del clado Orellani en Cortinarius, pero es distinto de ellas, por ser una nueva especie de este género (63).
Una fuente de diagnóstico erróneo es la nomenclatura de los hongos, la cual está establecida por el Código Internacional de Nomenclatura Botánica, que en inglés corresponde a: International Code of Botanical Nomenclature. Vale la pena acotar que, según el “Index fungorum” (65)(66), C. orellanoides Rob. Henry, C. orellanoides Rob. Henry, var. orellanoides, C. orellanoides var. speciosissimus Consiglio, D. Antonini & M. Antonini, C. speciosissimus Kühner & Romagn, C. speciosissimus var. julii Moënne- Locc. & Reumaux, C. speciosissimus var. ochraceovelatus Moënne-Locc. & Reumaux, C. speciosissimus Kühner & Romagn. var. speciosissimus, C. speciosus J. Favre, Dermocybe orellanoides (Rob. Henry) M.M. Moser son sinónimos de Cortinarius rubellus Cooke. Queda aparte C. orellanus (Fr.) Fr.; esta última especie es claramente distinguible de la anterior (54).
En la opinión de Robertson et al. (67), Cortinarius rainierensis es también un sinónimo de C. rubellus.
Las principales especies nefrotóxicas mortales son entonces C. orellanus, C. rubellus, C. splendens y C. henricii y sus variedades, las cuales contienen orellanina.
Hasta hace pocos años se consideraban igualmente tóxicas un buen número de especies de Cortinarius con carpóforos de tonos canela, amarillos y rojizos, como: Cortinarius bolaris, Cortinarius rubicundulus, Dermocybe cinnamomea y Dermocybe semisanguinea. La presencia de orellanina no se ha demostrado en todas ellas y no se poseen datos precisos sobre su toxicidad, por lo que son catalogadas como especies sospechosas.
2.2.Toxíndrome con rabdomiólisis. Micetismo por Tricholoma equestre
Tricholoma equestre es una especie considerada hasta hace poco comestible de gran calidad y ampliamente comercializada y consumida en todo el mundo. La intoxicación por T. equestre se produce por consumo de grandes cantidades de esta especie en varias comidas en días sucesivos, o bien requiere haberlos consumido con anterioridad. Parece que existe un componente de susceptibilidad o predisposición individual asociado. Es decir que el consumo aislado de T. equestre podría no causar efectos en el individuo, salvo que éste fuese especialmente sensible (68-70).
En todo caso, hasta que no se conozca completamente la parte intrínseca de esta intoxicación (predisposición, intolerancia, dosis, etc.), la mejor recomendación es no consumir los carpóforos o, de hacerlo, consumir únicamente pequeñas cantidades y espaciar mucho su consumo.
También resultó tóxica la especie Tricholoma terreum.
Período de latencia. Es largo; los síntomas aparecen de 24 a 72 horas después de la última ingestión de los hongos.
Síntomatología. Este micetismo puede dar lugar a complicaciones cardíacas y respiratorias y al cuadro clínico denominado rabdomiólisis, que se caracteriza por la aparición de lesiones en la musculatura estriada o esquelética (71). La rabdomiólisis consiste en la desestructuración y posterior necrosis de las fibras musculares y por esta lesión del músculo esquelético se produce la liberación de mioglobina, fósforo, potasio, etc. en el torrente sanguíneo. La mioglobina liberada puede provocar daño renal, necrosis tubular aguda y conducir a insuficiencia renal aguda (72). Si afecta al músculo cardíaco puede provocar miocarditis aguda.
Los síntomas son en general fatiga y debilidad muscular, acompañados de mialgia, centrada en la parte superior de las piernas. Estos signos se acompañan de eritema facial, náuseas con vómitos, confusión y sudor abundante; su gravedad depende del grado de daño muscular y si se desarrolla insuficiencia renal.
La debilidad muscular suele empeorar a los tres o cuatro días después de la ingestión de los carpóforos, produciendo rigidez en las piernas y producción de orina muy oscura. Los síntomas son acompañados generalmente de eritema facial, náuseas ligeras sin vómitos y transpiración profusa.
Algunos de estos casos con rabdomiólisis están asociados no sólo con disfunción renal y alteración electrolítica (hipercalemia, hipocalcemia), sino también con complicaciones respiratorias y cardíacas (arritmia, colapso cardiovascular) que conducen a la muerte.
Historia de la intoxicación. Primeros casos clínicos. Las primeras intoxicaciones con T. equestre se registraron en Francia en 1992 con doce casos, algunos fatales, y todos con rabdomiólisis (73). Posteriormente, hubo intoxicaciones con desenlace fatal en otros países como Polonia (68)(74) y Lituania (75), determinando inequívocamente que ocurrían después del consumo repetido de grandes porciones de carpóforos de T. equestre durante comidas consecutivas, a pesar de que esta especie fuera reconocida como un sabroso hongo comestible.
Se han citado casos de intoxicaciones similares en países como Taiwan, Estados Unidos y Japón, causadas por Russula subnigricans, cuya ingestión puede ocasionar rabdomiólisis, lesión renal aguda, shock cardiogénico y muerte (76-80), pero que a diferencia de T. equestre presenta un tiempo de latencia muy corto, ya que los síntomas aparecen unas pocas horas después de la ingestión de esta especie de Russula. Por lo tanto, se tratará en la Parte 3 de esta serie de artículos referida a micetismos tempranos.
La distribución, comercialización y consumo de T. equestre fueron prohibidos en 2001 en Alemania (73) y en los años subsiguientes en Italia (81) y Francia (82). En España desde el 29 de octubre de 2006 (83), se prohíbe cautelarmente la comercialización de cualquier presentación de T. equestre en todo el territorio español, así como su importación (en este Orden las especies T. equestre, Tricholoma auratum y Tricholoma flavovirens son la misma especie). Esta prohibición ha sido refrendada en el Real Decreto 30/2009 (84).
Toxinas. Se han aislado e identificado distinto tipo de metabolitos de especies del género Tricholoma, entre ellos: triterpenoides, esteroles, indoles y compuestos acetilénicos. El agente causante de su toxicidad a nivel muscular es desconocido en el momento actual. Se determinó que la familia Tricholomataceae de Basidiomicetos contiene lectinas, hemaglutininas y hemolisinas (85)(86).
Indol y escatol (Fig. 13) se han identificado en los extractos pungentes de numerosos miembros del género Tricholoma (87). También indol-3-carboxaldehído (Fig. 13), que se encuentra en el extracto volátil de Tricholoma sulphureum, presenta un desagradable olor a carbón o alquitrán (88).

Figura 13. Estructuras químicas de indol, escatol e indol-3-carboxaldehído.
Se estudiaron química y toxicológicamente las toxinas presentes en los carpóforos de otra especie europea tóxica, T. terreum (79). Se identificaron quince nuevos triterpenoides terreólidos A-F y saponaceólidos H-P (Fig. 14). Los terreólidos A-C poseen un sistema único 5/6/7 trioxaespirocetal, mientras que los terreólidos D-F poseen un novedoso esqueleto carbonado. Las configuraciones absolutas de las estructuras de estos triterpenoides se confirmaron mediante cristalografía de rayos X de cristal único. Dos compuestos abundantes en el hongo, saponaceólido B y saponaceólido M (Fig. 14), mostraron toxicidad aguda, con valores DL50 de 88,3 y 63,7 mg/kg cuando se administraron por vía oral en ratones (79).

Figura 14. Estructuras químicas de terreólidos A-F y de saponaceólidos B, H-P. Micetismos.
Se encontró que ambos compuestos aumentan los niveles séricos de creatín-quinasa en ratones, lo que indica que T. terreum puede ser la causa de la intoxicación y conducir, en última instancia, a la rabdomiólisis (79). Se cuestionaron estos hallazgos en base a consideraciones micológicas y micotoxicológicas debido a que T. terreum es un hongo comestible (89); sin embargo, los saponaceólidos B y M al calentarlos directamente y al hervirlos con agua, mostraron estabilidad y que, por lo tanto, son capaces de resistir el calentamiento prolongado durante la cocción (90).
Recientemente se han efectuado varias reacciones sobre el meroterpenoide (-)-terreumol C del hongo T. terreum con el objeto de obtener nuevos meroterpenoides citotóxicos (91).
Se han aislado e identificado tres triterpenoides raros, saponaceólidos Q-S (Fig. 15), de los cuerpos fructíferos del hongo T. terreum obtenido del suroeste de Francia. El saponaceólido Q mostró cierta citotoxicidad contra cuatro líneas de células tumorales humanas (92).

Figura 15. Estructuras químicas de saponaceólidos Q-S.
En la especie Russula subnigricans (Familia: Russulaceae) del Este Asiático, el compuesto responsable de la aparición de rabdomiólisis resultó ser el ácido cicloprop-2-en-carboxílico (Fig. 16) que posee un ciclo muy pequeño y muy tensionado (76). Este compuesto es muy inestable y al concentrar soluciones de esta toxina se produce su polimerización, causando la pérdida de su toxicidad. Sin embargo, no está claro que este compuesto se encuentre en T. equestre, por lo que queda por estudiar en profundidad la toxicidad de esta especie y la estructura de sus posibles componentes tóxicos.

Figura 16. Estructura química del ácido cicloprop-2-en-carboxílico.
Mecanismo de acción. El daño del músculo esquelético puede adoptar diversas formas. Cuando el tejido muscular se lesiona se llena rápidamente del líquido procedente de la circulación, que incluye iones sodio. La inflamación en sí puede producir la destrucción de las células musculares, pero las que sobrevivan estarán sujetas a diversas perturbaciones que causarán un aumento de los iones calcio en el compartimento intracelular; la acumulación de calcio fuera del retículo sarcoplasmático produce una contracción muscular continua y el agotamiento del trifosfato de adenosina o ATP, el principal transportador de energía de la célula (93)(94). La misma depleción de ATP puede provocar una afluencia descontrolada de calcio. La contracción persistente de la célula muscular conduce a la descomposición de las proteínas intracelulares y a la desintegración de la célula (95).
Toxicidad de T. equestre y T. terreum en ratones y ensayo de creatin-quinasa sérica. Al ensayar la toxicidad de los extractos crudos en cloroformo/metanol (1:1) de las dos especies, T. equestre y T. terreum, ambos extractos resultaron tóxicos en ratones por vía oral. Por partición de los extractos entre agua y acetato de etilo, se encontró que la fracción no polar (fase de acetato de etilo) de T. terreum y la fracción polar (fase acuosa) de T. equestre eran tóxicas, lo que indica que estos hongos pueden contener diferentes toxinas (79).
La toxicidad del extracto crudo de T. terreum correspondió a un valor de DL50 de 1,51 g/kg y la fracción no polar tóxica a DL50 de 1,18 g/kg, mientras que la fracción polar no mostró toxicidad, y la dosis máxima de tolerancia fue de 10,0 g/kg. Se observaron signos de intoxicación dependientes de la dosis, como ataxia, movimiento reducido y convulsiones, y convulsiones recurrentes seguidas de muerte después de 45-60 minutos (79).
Los valores DL50 de saponaceólido B y saponaceólido M fueron de 88,3 y 63,7 mg/kg respectivamente, tras la administración oral. Los ratones que fueron alimentados forzadamente por vía oral con estos dos compuestos lipofílicos presentaron signos de intoxicación, dependientes de la dosis, como los mencionados anteriormente.
Los ratones tratados con los compuestos saponaceólido B y saponaceólido M mostraron un aumento de 1,52 a 1,65 veces en los niveles séricos de creatín-quinasa en relación con los ratones que recibieron agua o 1% de Tween-80 (79).
Como se mencionó anteriormente, la fracción polar de T. equestre resultó tóxica. No se detectaron en la especie T. equestre los saponaceólidos B y M ni los terreólidos presentes en T. terreum. Es probable que T. equestre contenga otras toxinas aún no identificadas.
T. equestre puede haber sido confundido con T. terreum dado que los dos hongos crecen en ambientes similares y pertenecen al mismo género.
Ensayos clínicos en pacientes. La rabdomiólisis tiene como marcador un aumento en la actividad de la enzima creatín-fosfoquinasa sérica, tanto en ratones como en humanos (76). En los pacientes se registraron aumentos de creatín-fosfoquinasa sérica y de transaminasas de origen no hepático y en algunos casos signos de afectación renal. En los casos graves los niveles de creatín-fosfoquinasa son muy elevados, la fiebre es alta y persistente, hay disnea y signos de insuficiencia cardíaca, que pueden culminar con la muerte. Los pacientes suelen sufrir hiperpnea (70)(96).
Un grupo de investigadores franceses (71) estudió a doce pacientes que tenían como síntomas unas lesiones de la musculatura estriada que llevó a la muerte a tres de ellos: síntomas de fatiga y debilidad muscular acompañados de mialgia, principalmente en la parte superior de las piernas, 24 a 72 horas después de su última comida que contenía hongos. La debilidad empeoró en tres o cuatro días, conduciendo a rigidez de las piernas y a la producción de orina oscura. Estos síntomas fueron acompañados de eritema facial, náusea ligera sin vómito, y transpiración profusa en ocho de los pacientes. No hubo fiebre, y cinco pacientes tuvieron hiperpnea. Los hallazgos del examen físico, que incluyó auscultación pulmonar y examen neurológico, no fueron significativos.
El aumento de creatín-fosfoquinasa fue determinante para el diagnóstico de rabdomiólisis severa después de una semana de haber comido T. equestre. Los ensayos iniciales en los pacientes mostraron evidencias de rabdomiólisis, con una actividad sérica de creatín-fosfoquinasa media de 226.067 U/L en mujeres y 34.786 U/L en hombres, no evidenciándose daño hepático. Los valores de g-glutamiltransferasa fueron normales (5 a 24 U/L) y los niveles máximos promedio de aspartato-aminotransferasa y alanina-aminotransferasa en mujeres fueron de 8.104 y 1.392 U/L respectivamente, mientras que en hombres 1.173 y 325 U/L (71).
En los 15 días subsiguientes, en todos los pacientes excepto tres, se normalizaron los valores de las enzimas séricas gradualmente y la mayoría de los síntomas desaparecieron, si bien la debilidad muscular persistió durante varias semanas (71)(74).
Los tres pacientes que fallecieron experimentaron un aumento de la disnea en reposo, aumentos de estertores en ambas bases pulmonares, y fueron llevados a la unidad de cuidados intensivos. Los tres presentaron hipertermia (una temperatura por encima de los 42 °C); signos de miocarditis aguda, que incluía arritmia cardíaca, colapso cardiovascular, y aumento del complejo QRS en el electrocardiograma sin acidosis severa (pH 7,37, con un nivel de bicarbonato sérico de 16-20 mmol/L); y evidencia de disfunción renal, con niveles elevados de urea en sangre (N-ureico: 30-52 mg/dL), creatinina sérica (1,4-2,5 mg/dL), hiperpotasemia (potasio: 6,0 a 7,2 mEq/L), hipocalcemia (calcio: 5,6-8,3 mg/dL) y un nivel normal de proteínas totales. Los tres pacientes tuvieron creatín-fosfoquinasa con valores de 632.000, 138.900 y 295.700 U/L, con isoenzima MB (o CPK2, exclusiva del tejido cardíaco) acercándose de 0,5 a 0,7% del total. A pesar del cuidado fisiológico intensivo, que incluyó, en un caso, hemofiltración endovenosa continua, los tres pacientes murieron. La autopsia reveló lesiones miocárdicas idénticas a las lesiones musculares en un paciente, lesiones renales en otro, y ninguna lesión hepática en el último (71)(74).
Se describieron cuatro casos (tres adultos y un niño), que padecieron intoxicación aguda con T. equestre (97), después de haber comido de 100 a 400 gramos del hongo en unas pocas comidas consecutivas. Después de consumir aproximadamente 1.000 gramos de T. equestre durante 3-4 días, los sujetos desarrollaron fatiga, debilidad muscular, mialgia y, en dos casos, insuficiencia respiratoria aguda con la necesidad de terapia respiratoria. La creatín-quinasa sérica máxima fue 48.136 U/L en los adultos y 306 U/L en el niño. Los niveles séricos máximos de las enzimas aspartato transaminasa (AST) y alanina transaminasa (ALT) fueron 802 U/L y 446 U/L en los adultos y 39 U/L y 56 U/L en el niño. Todas las pruebas bioquímicas de rutina estuvieron dentro del rango normal. No se encontraron otras causas de rabdomiólisis como infecciones parasitarias o virales, enfermedades inmunes, traumas o exposición a medicamentos. El paciente, de 72 años, que desarrolló insuficiencia respiratoria aguda, murió en el segundo día de la hospitalización. En los otros pacientes, todos los síntomas y anomalías bioquímicas mencionados anteriormente desaparecieron después de 2 a 3 semanas de hospitalización (97).
Se observaron a todos los pacientes ingresados en los centros de toxicología para niños y adultos en Gdańsk y Biała Podlaska, Polonia, entre 2001 y 2010, intoxicados con Tricholoma equestre (98). Como ya se ha descripto, los principales síntomas clínicos incluyeron debilidad muscular, náuseas sin vómitos, diaforesis sin fiebre y, en los casos más graves, insuficiencia respiratoria aguda. En los resultados bioquímicos se observó un marcado aumento en los niveles de creatín-quinasa, AST y ALT. La tasa de mortalidad fue del 20%, observando que la gravedad de la intoxicación se correlacionó con la cantidad de hongos ingeridos.
De acuerdo con los resultados, el cuadro clínico de intoxicaciones con este hongo silvestre podría ser diferente en niños y adultos y dependería de la cantidad ingerida de estos hongos. El efecto adverso más grave es la insuficiencia respiratoria aguda y la miocarditis con arritmia cardíaca y colapso cardiovascular (98).
Análisis histológico muscular. En seis pacientes se obtuvieron muestras del músculo cuadriceps para análisis histológico. La observación al microscopio óptico mostró que la arquitectura fascicular de los músculos estaba bien preservada, las miofibrillas tenían una apariencia como “mordisqueadas”, y en algunos casos estaban separadas unas de otras por edema con ausencia de vacuolas o por la acumulación de glucógeno o grasa, signos de un daño muscular directo (71)(74).
Experimentos en ratones. Para establecer con certeza la implicancia de esta especie en los cuadros de lesión muscular se llevaron a cabo experimentos con ratones, con el hongo deshidratado o con sus extractos, con p-fenilendiamina que es una sustancia que produce rabdomiólisis, y un grupo control, durante tres días seguidos y en forma repetida. Se midieron varias enzimas musculares en sangre, y se detectó un aumento significativo sólo en los casos de administración de T. equestre y de la sustancia miotóxica. Se observó una amplia variación en la respuesta, algunos ratones murieron y otros no se vieron afectados con la misma gravedad, lo que reprodujo, en cierta medida, lo ocurrido en humanos (71). Es decir que, el consumo de cantidades grandes y en días repetidos de T. equestre podría producir la muerte en algunos casos por implicancia de la musculatura cardíaca.
Estudio molecular del complejo de especies T. equestre. El complejo de especies T. equestre incluye tres especies de ectomicorrizas: Tricholoma flavovirens (Pers.) S. Lundell, T. auratum (Paulet) Gillet y T. equestre (L.) P. Kumm, que producen esporóforos con láminas de color amarillo intenso, pero son difíciles de distinguir mediante análisis morfológicos, tanto a nivel macroscópico como microscópico. En T. equestre, se reconocen dos variedades adicionales: T. equestre var. populinum (a veces reconocida como T. frondosae) y T. equestre var. pallidifolia (reconocida como T. joachimii) caracterizada por láminas pálidas a blancas. Para explorar la extensión taxonómica, ecológica y geográfica y los límites del complejo de especies T. equestre, se realizó una comparación molecular de las cepas mundiales de este complejo, mediante el uso de secuencias de dos marcadores moleculares: región de ITS1/5.8S/ITS2 de la unidad ribosomal nuclear y la parte 5’ del gen mitocondrial cox1. Los análisis filogenéticos confirmaron a las cepas europeas de T. equestre, T. flavovirens y T. auratum como representativas de una sola especie, que aparece asociada a varias coníferas según su origen geográfico (99).
En el contexto de una sola especie de T. equestre, la ubicación geográfica podría conducir a la caracterización de subespecies o variedades, como sugiere la reunión de las cuatro cepas asiáticas (japonesas) de T. auratum en un clado filogenético distinto. Más aún, en este análisis T. joachimii y T. equestre var. pallidifolia son dos representantes de una especie diferente al grupo T. equestre, que estaría relacionada filogenéticamente con Tricholoma columbetta que también posee láminas blancas. En forma similar, el análisis filogenético de los datos moleculares y la falta de flujo de genes entre las cepas asociadas con árboles de hoja ancha y las del complejo T. equestre, más bien argumentan dos especies distintas en función del nicho ecológico: T. frondosae bajo árboles de amplias hojas y T. equestre debajo de coníferas (99).
Especies causantes del micetismo. Reino: Fungi; División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Tricholomataceae: Tricholoma equestre (L.) P. Kumm [= T. flavovirens (Pers.) Lundell.] forma ectomicorrizas con los pinos y es de distribución mundial, especialmente en Europa, y en cada país se conoce con un nombre característico (en España: “seta de los caballeros”; en francés: “Chevalier”, “tricholome des chevaliers”, “bidaou”; en inglés: “yellow knight”; en alemán: “Grünling”). En la Argentina esta especie se encuentra en Sierra de los Padres, Partido de General Pueyrredón, Provincia de Buenos Aires (100), y es fácilmente reconocible por su color amarillento como el del azufre y su porte de gran tamaño con sombrero de 5-10 cm y altura similar.
Otra especie que produce rabdomiólisis es T. terreum (Schaeff.) P. Kumm, que crece en Francia.
2.3. Toxíndrome encefalopático o neurotóxico demorado. Micetismo por Pleurocybella porrigens
Si bien los carpóforos de la especie Pleurocybella porrigens (conocida en Japón como “Sugihiratake” y en América del Norte como “Alas de Ángel”, en inglés: Angel Wings) generalmente se consideran comestibles, han sido implicados en dos brotes, documentados, con encefalopatía fatal. Ambos incidentes se produjeron en Japón y la mayoría de las víctimas tenían trastornos renales preexistentes (101)(102).
Período de latencia. La latencia es larga, en unas 2-3 semanas tras la ingestión de P. porrigens, comienzan los síntomas neurológicos.
Síntomatología. El inicio de los síntomas es subagudo y se demora después de comer los hongos. Los intoxicados no presentan síntomas gastrointestinales como en otros micetismos, sino que los síntomas iniciales son temblor, disartria y/o debilidad de las extremidades inferiores (hipotonía), que duran un promedio de 4,5 días (en un rango de 2 a 11 días), seguidos por trastornos graves de la conciencia y convulsiones intratables, acompañadas con fiebre alta. El resultado ha sido un estado epiléptico (status epilecticus) en cinco pacientes (103); también se observó mioclono en cuatro pacientes y reflejo de Babinski en tres.
El pronóstico fue diferente de un caso a otro. Tres pacientes murieron a los 13, 14 y 29 días después del inicio de los síntomas. Dos pacientes mostraron un trastorno persistente de la conciencia un mes después del inicio de los síntomas. Un paciente presentó parkinsonismo después de recuperarse de la perturbación de la conciencia. Cuatro pacientes se recuperaron casi por completo alrededor de un mes después del inicio del cuadro de encefalitis. En tres pacientes de los cuatro recuperados, la insuficiencia renal no fue grave y no necesitaron someterse a hemodiálisis. Esto sugiere que el grado de insuficiencia renal es clave para el pronóstico de este tipo de encefalopatía (103).
Historia de la intoxicación. Primeros casos clínicos. El primer incidente de encefalopatía aguda relacionada con la ingestión del hongo P. porrigens fue endémico en Japón y ocurrió en septiembre y octubre de 2004 en nueve prefecturas, donde se enfermaron 59 personas y murieron 17 (103), todas con la edad promedio de 70 años. La muerte ocurrió entre 13 y 29 días después de la aparición de los síntomas, como máximo tres semanas después del consumo de P. porrigens (103). En ese otoño de 2004, aparentemente debido a las fuertes lluvias tempranas en Japón, los carpóforos de P. porrigens fueron de proporciones inusuales, abundantes y se consumieron en cantidad, dando lugar al episodio endémico.
El segundo incidente ocurrió en 2009, cuando un paciente de 65 años murió de encefalopatía aguda después de ingerir P. porrigens. Este hombre se había sometido a hemodiálisis durante 3 meses debido a insuficiencia renal crónica. La ingestión de los carpóforos le produjo convulsión generalizada, coma y muerte; se realizó la autopsia (104).
Toxina. El compuesto tóxico es un aminoácido aziridina inusual e inestable denominado pleurocibelaziridina (Fig. 17).

Figura 17. Estructura química de pleurocibelaziridina.
Del carpóforo de P. porrigens se obtuvieron también una lectina y varios aminoácidos citotóxicos, entre ellos seis nuevos aminoácidos con un esqueleto común de β-hidroxixalina (105), por lo que se sospechó que podrían haber surgido de un precursor muy reactivo, un aminoácido aziridina como pleurocibelaziridina.
Pleurocibelaziridina contiene un anillo de tres miembros con un grupo NH en uno de los vértices, con dos grupos metilo como sustituyentes de uno de los carbonos del ciclo y el otro carbono con un hidrógeno y un grupo carboxilo (-CO2H). El ataque nucleofílico de dicho compuesto por moléculas endógenas, como alcoholes, glicerol, azúcares, etc., podría causar la apertura del anillo de aziridina y dar lugar a la formación de los seis aminoácidos obtenidos (106).
Para confirmar la existencia de pleurocibelaziridina, se esterificaron extractos del hongo para crear los ésteres metílico y de difenilmetilo del compuesto, los cuales al bajar la reactividad del grupo carboxilo libre permitieron demostrar la presencia de pleurocibelaziridina en los carpóforos en un muy alto nivel de 5,75 mg/g (106)(107).
Mecanismo de acción de pleurocibelaziridina. El mecanismo de acción para la toxicidad de P. porrigens no se ha establecido definitivamente. Se ha demostrado que el carpóforo de P. porrigens contiene el compuesto inestable pleurocibelazidirina.
Dado que el tejido cerebral de las víctimas del micetismo presentó síntomas característicos de la mielina erosionada, es decir que se encontraba destruida la barrera protectora que rodeaba a las células cerebrales críticas, se examinó si la pleurocibelaziridina podría causar los síntomas desmielinizantes observados.
Al ensayar la pleurocibelaziridina y su éster metílico en células CG4-16 de oligodendrocitos de rata, la pleurocibelaziridina resultó ciertamente tóxica para las células. En cambio, no se observó tal toxicidad en las células tratadas con el correspondiente éster metílico o con las unidades de beta-hidroxivalina previamente identificadas. Por lo tanto, se llegó a la conclusión que tanto el grupo carboxilo como la aziridina son cruciales para la citotoxicidad. En cuanto a la concentración, frente a oligodendrocitos de rata la pleurocibelaziridina tuvo poco efecto a 3 μg/mL, pero a 10 μg/mL causó una reducción del 60% en la viabilidad celular y a 30 g/mL la redujo en más del 95% (107).
También surgió como alternativa que el hongo P. porrigens pudiese contener niveles tóxicos de sales de cianuro. Por ello, se determinaron los niveles de los iones cianuro y tiocianato en quince muestras por cromatografía líquida de alta resolución con detección fluorimétrica, detectándose rangos de ND-114,0 y ND-17,0 μg/g de peso seco respectivamente, que en el hongo estarían como sales de sodio o de potasio (108). Estos niveles no serían dosis letales para toxicidad aguda, aún si se consumiera 1 kg de muestra, ya que la dosis letal de cianuro se estima que es 200-300 mg para un adulto humano, pero habría exposición a ión cianuro y a ión tiocianato por ingestión de P. porrigens. Además, se sabe que la toxicidad de cianuro causa daño cerebral, principalmente en los ganglios basales (109). También cianuro y tiocianato se acumulan en la hemodiálisis de pacientes fumadores de tabaco (110), y el riesgo de infarto cerebral aumenta en individuos con alta concentración sérica de tiocianato (111), que se logra por la reacción endógena de desintoxicación de cianuro que se puede acelerar ante condiciones de carga de cianuro como en fumadores. Por lo tanto, la ingestión de hongos con cianuro podría inducir la acumulación de cianuro y de tiocianato en la sangre de los pacientes con deficiencia renal crónica y podría asociarse con los problemas cerebrales observados.
Es probable que pueda haber actividad conjunta de la aziridina y de cianuro/tiocianato.
Exámenes cerebrales de los pacientes. Los pacientes son sometidos a electroencefalogramas y a exámenes por tomografía computada y resonancia magnética de imágenes para evaluar las lesiones cerebrales. Generalmente esos exámenes no presentan nada especial en las primeras etapas de la enfermedad.
A los 3 a 8 días después del inicio de los síntomas suelen aparecer lesiones, como las observadas en las áreas de la ínsula y los ganglios basales en seis pacientes. En la resonancia magnética, estas lesiones cerebrales fueron hiperintensas en las imágenes ponderadas en T2 y en las de recuperación de inversión atenuada de fluido (FLAIR; sigla del inglés: Fluid Attenuation Inversion Recovery) e hipointensas en las imágenes ponderadas en T1 (T1 y T2 son los tiempos de relajación) (103).
Los electroencefalogramas de seis pacientes mostraron hallazgos anormales. Se observaron descargas sincrónicas periódicas en dos de ellos, complejos de punta-onda en un paciente y ondas lentas no específicas en tres de ellos (103).
Examen anátomo-patológico post mortem. El paciente intoxicado en Japón en 2009 murió de encefalopatía aguda después de ingerir P. porrigens y se realizó la autopsia. El examen anátomo-patológico del cerebro reveló necrosis quística cerebral extensa tipo postinfarto en el putamen (bilateral) y múltiples necrosis irregulares en las cortezas cerebelosa y cerebral profunda (104).
Especies causantes del micetismo. Reino: Fungi; División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Marasmiaceae: Pleurocybella porrigens (Pers.) Singer. Sinónimos: Pleurotus porrigens, Phyllotus porrigens, Dendrosarcus porrigens, Pleurotellus porrigens y Nothopanus porrigens.
2.4. Toxíndrome cardiovascular con muerte súbita o Síndrome de Yunnan (China). Micetismo por Trogia venenata
Este síndrome de muerte repentina inesperada se observó en la Provincia de Yunnan, en el suroeste de China, donde se registraron alrededor de 400 muertes súbitas durante cada verano desde fines de los años 70. Se describió a Trogia venenata (“pequeño hongo blanco”; “hongo tipo uña”) (Familia: Marasmiaceae) como responsable. Es una especie saprófita común que crece en la madera en descomposición, en el sudoeste, centro y noroeste de Yunnan en áreas montañosas subtropicales entre los 1.700 y 3.000 metros de altitud (112). Se encuentra en bosques mixtos caducifolios; tiene un aspecto muy frágil y una vez recolectado, rápidamente vira de color blanco/rosa pálido a marrón; carece de valor comercial. Los análisis morfológicos y filogenéticos moleculares revelaron que se trata de una especie nueva del género Trogia, estrechamente relacionada con Trogia infundibuliformis paleotrópica (112).
La campaña pública para educar contra el consumo de T. venenata ha reducido drásticamente la incidencia de la muerte súbita injustificada en Yunnan (113)(114).
Período de latencia. Es una latencia muy larga, de 1 a 15 días, y puede alcanzar casi 3 semanas. Hay registros de 3-5 días de síncope o mareos antes de la muerte súbita.
Síntomatología. Inicialmente, los pacientes informaron trastornos gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal y fatiga), seguidos de síntomas cardíacos. Muchos pacientes informaron palpitaciones, molestias en el pecho, mareos, síncope recurrente y convulsiones en las horas anteriores a la muerte. La taquicardia ventricular y la fibrilación pueden preceder a la muerte. Sistema primario afectado: cardiovascular (115)(116).
En el 68% de los casos investigados por Shi (117), no se documentó ningún síntoma en las 3 semanas previas a la manifestación de la enfermedad. En los dos últimos días que precedieron al fallecimiento, el 63% de los individuos presentaron síntomas cardíacos, como mareos, debilidad y palpitaciones. En otros casos, antes de la muerte no se detectó ningún signo de advertencia.
Ante la inconstancia de los síntomas prodrómicos, fue imposible definir unas características clínicas que permitieran caracterizar este síndrome. La única certeza es que aparece durante el día y raramente durante el sueño. Por otra parte, no se encontró ningún factor infeccioso o hereditario (113).
La hipoglucemia intensa y la muerte súbita son características del micetismo por T. venenata, y es un patrón único entre los hongos tóxicos (116).
Historia de las intoxicaciones. Primeros casos clínicos. Desde hace casi cincuenta años se registran casos de muerte súbita en la provincia de Yunnan, en el suroeste de China. La gran mayoría de estas muertes ocurrieron en aldeas remotas, abarcando una veintena de condados de esa provincia. Las aldeas donde se produjeron estos casos de muerte súbita, se encuentran ubicadas en el centro y en el noroeste de la provincia mencionada y entre 1.800 y 2.400 metros de altura.
Las personas afectadas estaban aparentemente sanas y más del 90% de los casos se produjeron durante la temporada de lluvias, entre junio y septiembre de cada verano (118). La cantidad de T. venenata ingerida por dos víctimas de muerte súbita, en varias ocasiones a lo largo de una semana, fue estimada en un total de 400 g y 1.500 g (113).
Yunnan es la octava provincia de China en lo referente a superficie. En 2011, Yunnan tenía una población de más de 46 millones de personas, con el mayor número de grupos étnicos que vivían en ciudades, pueblos o en lugares alejados, en las montañas (119).
A partir de 1975, fecha en la que se reportaron los primeros casos, el número de muertes fue aumentando. El estudio realizado en el período 1975-2008 mostró que numerosos casos de muerte súbita ocurrían en una misma familia, en pequeños grupos, en el mismo lugar geográfico y en un intervalo de tiempo más bien corto (horas o días) (120).
En un estudio retrospectivo en el que se identificaron 116 casos de muerte súbita, la tasa de incidencia anual de muertes osciló de 0,2 a 8,9 por cada 1.000 habitantes. Esta tasa de incidencia fue significativamente mayor en los jóvenes (el grupo de edad de 10 a 39 años presentó una tasa de incidencia de 1,6 por 1.000 habitantes), y fue más frecuente en mujeres que en hombres (117).
En 2002 un equipo dirigido por Huang Wen-li, subdirector del “Instituto de Control y Prevención de Enfermedades Endémicas de Yunnan” registró todos los factores potenciales de riesgo en la región que pudieran estar relacionados con el llamado “Síndrome de Muerte Súbita de Yunnan” (114). También se revisaron de manera retrospectiva en 23 condados todos los casos de muerte súbita desde 1975 al 2004 para analizar y tener la máxima información posible sobre los fallecimientos (121). Otros diez condados de la provincia, no afectados por este síndrome, participaron como grupo control. En el período de 30 años se registraron 356 casos, de los cuales 299 correspondieron a este síndrome (121).
A fines de 2004 aún no se conocía la etiología del síndrome y las muertes aumentaban, por lo que se pidió ayuda a Beijing (119). En 2005, el gobierno chino decidió confiar este problema a los expertos del Programa de Capacitación en Epidemiología de Campo de China (CFETP: China Field Epidemiology Training Program), una unidad de élite de investigadores médicos del Centro Chino de Control y Prevención de Enfermedades.
En 2005, también, los expertos de Beijing, en un análisis retrospectivo del período de 1975 a 2008, identificaron un total de 374 casos de muerte súbita (120). Se ubicaron 97 pueblos en los que se había producido al menos un caso de muerte súbita, los cuales estaban principalmente situados en zonas montañosas hacia el centro y el noroeste de la región, en una superficie aproximada de 60.000 kilómetros cuadrados y entre 1.800 y 2.400 metros de altura. El 97% de las muertes se produjeron de junio a septiembre, durante la temporada de lluvias (118).
En 2006, estos expertos de CFETP intensificaron el sistema de monitoreo existente, para identificar las nuevas víctimas de muerte súbita (113). En cada caso se realizaron entrevistas a los testigos presenciales del fallecimiento, a los miembros de la familia y a los médicos locales. Se recogió información sobre actividades diarias, exposición a hongos y a otras sustancias potencialmente tóxicas, como pesticidas, raticidas, productos químicos, drogas, plantas silvestres, harina de maíz fermentado, grano mohoso o en mal estado o práctica de medicina tradicional. También se registraron los síntomas y signos de la enfermedad.
En el primer año, de las encuestas surgió que la mayoría de las víctimas bebían agua corriente, tenían estrés emocional y comían hongos. No se encontraron otros posibles tóxicos. La provincia de Yunnan es famosa por su gran variedad de hongos silvestres, muchos de los cuales se exportan a precios elevados. Familias enteras salen a recolectarlos durante los meses de verano (118).
En julio de 2006, cuando se registraron los primeros casos de muerte súbita del año, los expertos de CFETP encontraron que dos personas que habían fallecido, habían comido los carpóforos de un mismo hongo, llamado por la población local “pequeño hongo blanco”. En un caso, se encontraron carpóforos en la casa donde se había producido una muerte súbita. En el segundo, los miembros de la familia del fallecido admitieron que había comido ese hongo. Ambos casos ocurrieron en diferentes pueblos y apartados uno del otro (113). En 2007, hubo dos nuevos casos de muerte súbita; los familiares y vecinos de los fallecidos reconocieron imágenes del “pequeño hongo blanco” como el consumido.
Entre 2006 y 2009, en los meses de junio a septiembre, el sistema de vigilancia identificó 33 casos de muerte súbita. Se presentaron agrupados en 7 clusters, con edad media de 39 años (rango: 8-56). En 6 de ellos, las víctimas habían estado expuestas al “pequeño hongo blanco”. En el séptimo grupo que apareció en un pueblo donde no se encontró el hongo mencionado, la autopsia de las víctimas, mostró una displasia arritmogénica del ventrículo derecho (113), que es una enfermedad cardíaca hereditaria responsable de arritmias cardíacas y de muerte súbita.
Los casos fatales disminuyeron en 73% respecto a los detectados en la misma área de vigilancia desde 2002 hasta 2005, debido a la advertencia de no consumir hongos desconocidos. En mayo de 2008, se amplió la restricción de este consumo con énfasis en la descripción del “pequeño hongo blanco”, logrando así reducir drásticamente el número de muertes. Sólo algunos casos han sido reportados en los últimos años, y ninguno en el último año.
Los expertos decidieron estudiar detenidamente este “pequeño hongo blanco”. Se recolectaron varios ejemplares en la provincia de Yunnan y se enviaron al Instituto de Botánica de Kunming, donde un micólogo experto encontró que no pertenecía a ninguna especie previamente descripta. Se la denominó Trogia venenata (112).
En resumen, los casos de muerte súbita de Yunnan se caracterizaron por presentarse en zonas montañosas y en el período entre junio y agosto (122); las muertes ocurrían en pequeños grupos, dentro de una misma familia, en una misma localidad y en un intervalo de tiempo muy corto (de varias horas a varios días) (120); las víctimas de muerte súbita fueron de todas las edades y de todos los grupos étnicos que se encontraban realizando actividades diurnas (113). Este síndrome afectó a niños, adultos y personas de edad avanzada (123).
Toxinas. El consumo de T. venenata es mortal para los pacientes, ya que el hongo contiene tres aminoácidos tóxicos: ácido 2R-amino-4S-hidroxi-5-hexinoico, ácido 2R-amino-5-hexinoico y el compuesto tóxico conocido: ácido g-guanidinobutírico (Fig. 18), que fueron aislados de los carpóforos (124). Se encontró que en una muestra de sangre post mortem de un paciente de 27 años, fallecido por muerte súbita en el Condado de Xiangyun, provincia de Yunnan, China, se detectó ácido 2R-amino-4S-hidroxi- 5-hexinoico mediante cromatografía líquida combinada con espectrometría de masa en tándem (CL-EM/EM). Este hallazgo sirvió como evidencia directa de que el paciente había comido el hongo antes de morir (124).

Figura 18. Estructuras químicas de los compuestos tóxicos: ácido 2R-amino-4S-hidroxi-5-hexinoico, ácido 2R-amino-5-hexinoico y ácido g-guanidinobutírico, así como de hipoglicina A.
Mecanismo de acción de los aminoácidos tóxicos. Los dos aminoácidos tóxicos inusuales, ácido 2R-amino-4S-hidroxi-5-hexinoico y ácido 2R-amino-5-hexinoico, que presentaron similitud estructural con hipoglicina A, resultaron ser letales en ratones (124). El extracto de T. venenata produce una marcada hipoglucemia. Este nivel tan bajo de glucosa en suero conduce rápidamente a la depleción del ATP y a la muerte celular neuronal, y por lo tanto puede explicar el desenlace fatal en humanos y en animales de experimentación.
La similitud estructural de estos aminoácidos tóxicos con hipoglicina A y los valores de hipoglucemia obtenidos, indican comportamientos similares, si bien se requieren investigaciones adicionales.
La toxina botánica, hipoglicina A de la fruta de Jamaica, se sabe que reduce la glucemia en valores similares a los dos aminácidos tóxicos. La hipoglicina A (Fig. 18) y su metabolito inhiben varias enzimas implicadas en la descomposición de los compuestos de acilCoA. Generalmente se unen de modo irreversible a la coenzima A (CoA), carnitina y carnitina-aciltransferasas I y II, lo cual disminuye su biodisponibilidad y en consecuencia se produce la inhibición de la β-oxidación de los ácidos grasos. La β-oxidación normalmente proporciona al cuerpo ATP, NADH y acetil-CoA, que se utiliza para complementar la energía producida por la glicólisis. Por lo tanto, las reservas de glucosa se agotan y se produce hipoglucemia (124).
En resumen, hipoglicina A es un inhibidor específico de la enzima isovaleril-CoA deshidrogenasa y bloquea la β-oxidación lipídica. En consecuencia, las células ya no pueden usar los lípidos como fuente de energía y se produce una hipoglucemia profunda (125).
Los exámenes post mortem de los casos de muerte súbita de Yunnan muestran que la toxina responsable afecta al músculo cardíaco. Por lo tanto, los niveles de creatín-quinasa sérica fueron usados como un marcador de la toxicidad cardíaca y del músculo esquelético.
Estos hongos también contienen la toxina proconvulsiva, ácido g-guanidinbutírico (Fig. 18), que es estructuralmente similar a GABA (114)(123)(124).
Análisis clínicos. Se informaron niveles elevados de las enzimas aspartato transaminasa (AST), alanina transaminasa (ALT), lactato deshidrogenasa (LDH) y creatín-quinasa (CK) (113)(115)(125); sin embargo, sólo el aumento de AST resultó estadísticamente significativo, en comparación con los controles (113).
Las concentraciones de las transaminasas séricas son normalmente bajas, pero si el hígado está dañado, la membrana celular de los hepatocitos se hace más permeable y algunas enzimas se filtran en el torrente sanguíneo. Los niveles elevados de estas enzimas son indicadores de daño hepático, pero también aumentan debido a otros trastornos. Las fuentes no hepáticas de anormalidades de estas enzimas son: AST (v.n.: 10-45 U/L en el hombre y 5-31 U/L en la mujer): está en la mayoría de los órganos del cuerpo humano, pero se concentra sobre todo en el hígado; su presencia es también significativa en los músculos (esquelético y cardíaco) y en los glóbulos rojos; AST solía usarse para diagnosticar ataques cardíacos, si bien actualmente hay enzimas y proteínas que son más específicas para el daño cardíaco; ALT (v.n.: 10- 43 U/L en el hombre y 5-36 U/L en la mujer): músculo esquelético, músculo cardíaco, riñones; LDH: corazón, glóbulos rojos (ejemplo: hemólisis).
Se determinó la glucosa en sangre (glucemia), cuyos valores normales (v.n.) corresponden a:
a) Antes de las comidas: 90-130 mg/dL (5-7,2 mmol/L) para adultos y niños/jóvenes de 13 a 19 años; 90- 180 mg/dL (5-10 mmol/L) para niños de 6 a 12 años; 100-180 mg/dL (5,5-10 mmol/L) para niños menores de 6 años de edad.
b) De 1 a 2 horas después de comer: <180 mg/dL (<10 mmol/L) en adultos.
c) A la hora de acostarse: 90-150 mg/dL (5-8,3 mmol/L) para adultos y niños/jóvenes de 13 a 19 años; 100 -180 mg/dL (5,5-10 mmol/L) para niños de 6 a 12 años; 110-200 mg/dL (6,1-11,1 mmol/L) para niños menores de 6 años de edad.
Los valores en los pacientes resultaron muy bajos, menores de 1 mmol/L poco tiempo antes de la muerte, indicando una hipoglucemia muy marcada. La hipoglucemia en humanos y animales de experimentación da lugar a coma, si la glucosa en suero es menor de 2,7 mmol/L y produce muerte cerebral si está por debajo de 1,0 mmol/L (125)(126). En pacientes, la muerte súbita por hipoglucemia se atribuye a arritmias cardíacas (126).
Exámenes post mortem. En 29 casos estos exámenes revelaron miocarditis linfocítica focal leve, con rotura de las fibras musculares (113). También se observó infiltración linfocítica ocasional del hígado, edema alveolar pulmonar, necrosis renal aguda, necrosis de hepatocitos y congestión del hígado, pulmón o bazo (113).
Ensayos en ratones. Los dos aminoácidos tóxicos inusuales, ácido 2R-amino-4S-hidroxi-5-hexinoico y ácido 2R-amino-5-hexinoico, que presentaron similitud estructural con hipoglicina A, resultaron ser letales en ratones, con valores de DL50 de 71 y 84 mg/kg respectivamente (124).
Más aún, se estudió la toxicidad aguda y la dosis letal; se observó que diez ratones alimentados mediante una sonda nasogástrica con una dosis única de 1.500 hasta 3.500 mg/kg de extracto de T. venenata murieron en un período de cinco horas, mientras que los ratones expuestos a una dosis de 500 mg/kg sobrevivieron todos, así como los ratones control (alimentados con el hongo comestible local Laccaria vinaceoavellanea) durante el período de observación de siete días (125).
La toxicidad también se caracterizó por un umbral relativamente estrecho entre la dosis no tóxica y la dosis letal (118)(125).
En otro grupo de ratones alimentados con 2.000 mg/ kg de extracto de T. venenata se realizaron análisis de sangre. Los ratones desarrollaron una hipoglucemia profunda (media=0,66 mmol/L) dos horas después de la exposición (125). Todas las otras determinaciones fueron normales. No se detectaron alteraciones hepáticas ni renales.
Este nivel de glucosa en suero conducirá rápidamente a la depleción del ATP y a la muerte celular neuronal, y por lo tanto puede explicar el desenlace fatal en humanos y en animales de experimentación (125).
Las observaciones de casos de muerte súbita inesperada de Yunnan sugieren que la toxina responsable podría afectar al músculo cardíaco. En consecuencia, se determinaron los niveles de creatín-quinasa en el suero de ratones, como un marcador de la toxicidad cardíaca y del músculo esquelético. Los ratones tratados con los dos aminoácidos tóxicos, ácido 2R-amino-4S-hidroxi- 5-hexinoico y ácido 2R-amino-5-hexinoico, tuvieron un aumento de 1,1-1,6 veces en los niveles séricos de creatín-quinasa en relación con los ratones control (124). La magnitud de este aumento no fue consistente con el aumento de cinco veces o más por encima del límite superior del nivel normal de creatín-quinasa que se ha propuesto para un diagnóstico de rabdomiólisis (por lo que se descartó como causa de muerte), o en otros casos en los que un nivel elevado de creatín-quinasa puede ser el resultado de una muerte más generalizada de células, que incluye las células cerebrales, y podría indicar una toxicidad metabólica general.
Los valores obtenidos por el tratamiento con los dos aminoácidos de T. venenata fueron similares a los obtenidos con hipoglicina A.
Análisis de los electrocardiogramas. Se estudiaron las características electrocardiográficas de los habitantes de tres poblaciones (Dayao, Ningland y Heqing), que vivían en un área con alta incidencia de muerte súbita en la provincia de Yunnan, China (127). Se analizaron los electrocardiogramas de 338 individuos, residentes en las tres aldeas y los de una aldea (Dali) sin antecedentes de muerte súbita, como grupo control. La incidencia de arritmias cardíacas fue similar en todos los grupos (127).
Los residentes de las tres zonas con alta incidencia de muerte súbita presentaron un intervalo QTc significativamente más prolongado que el grupo control: Ningland 428,92±25,71 msg; Heqing 440,67±28,03 msg; Dayao 417,70±24,00 msg. Control: Dali 386,80±27,22 msg (118)(127).
La incidencia de onda U fue más elevada, de una forma significativa en Heqing que en el grupo control.
Estos cambios electrocardiográficos en la población de riesgo estudiada sugieren que estos individuos presentan una repolarización cardíaca alterada y por lo tanto, son más susceptibles de padecer muerte súbita (118)(127).
Análisis anátomo-patológico. La autopsia pudo realizarse en 29 casos de muerte súbita aparecidos entre 1991 y 2006 [16 hombres y 13 mujeres; edad media de 32 años (8-69)] que correspondieron al 10% de todas las muertes súbitas aparecidas en ese tiempo (128). Los resultados se clasificaron en 7 grupos según la histología: Grupo 1 (11 casos; 38%): miocarditis linfocitaria focal. Grupo 2 (3 casos; 10%): miocarditis focal con neutrófilos. Grupo 3 (4 casos; 14%): displasia arritmogénica del ventrículo derecho. Grupo 4 (2 casos; 7%): enfermedad isquémica, con focos de necrosis miocárdica. Grupo 5 (2 casos; 7%): hipertrofia del ventrículo izquierdo con obstrucción muscular del tracto de salida. Grupo 6 (2 casos, 7%): bronquitis crónica y enfisema pulmonar. Grupo 7 (5 casos; 17%): sin hallazgos patológicos significativos (118)(128).
No se encontró ningún caso con la enfermedad de Keshan (miocardiopatía dilatada).
Como puede notarse, los hallazgos patológicos son diversos y podría haber más de un factor etiológico. No hay un patrón característico. Los hallazgos de los grupos 3 y 5 corresponden a enfermedades cardíacas hereditarias, que pueden ser responsables de la muerte súbita.
En algunos cortes histopatológicos se observaron infiltrados linfocitarios en el músculo cardíaco (113). Es decir que, en algunos casos, a nivel cardíaco, se han descripto infiltrados inflamatorios locales; en otros, lesiones anatómicas de carácter hereditario y en un 17% de los casos ningún tipo de lesión (118).
Se debe recordar que la muerte súbita siempre tiene una causa multifactorial, desde la cardiopatía isquémica hasta algunas cardiopatías hereditarias. En estos casos, los estudios anátomo-patológicos de los pacientes fallecidos de muerte súbita, han mostrado algunos casos de displasia arritmogénica de ventrículo derecho, miocardiopatía hipertrófica o enfermedad coronaria. Por lo tanto, el hecho de que algunos pacientes hayan fallecido de muerte súbita, sin exposición comprobada a T. venenata, tampoco invalida la hipótesis de la responsabilidad de este hongo en la mayoría de los casos.
La mayor prevalencia de alteraciones de la repolarización (intervalo QTc prolongado y presencia de onda U) podría indicar que se trata de una población más predispuesta a los fenómenos arrítmicos. Ya sea de una manera directa, o bien por la intervención de las toxinas de T. venenata.
Búsqueda de la posible etiología del síndrome de muerte súbita de Yunnan:
Se han propuesto varias causas hipotéticas, como:
a) Enfermedad de Keshan: Es una forma endémica de miocardiopatía dilatada, que se observó por primera vez en 1935 como brote justamente en la región de Keshan, China (129). Puede presentarse en forma aguda, subaguda, crónica o latente. El estudio histopatológico del tejido cardíaco presentó necrosis multifocal, con diferentes grados de infiltración celular y calcificación, dependiendo de la etapa de la enfermedad. Clínicamente, puede manifestarse en forma de shock cardiogénico, con arritmias y/o con insuficiencia cardíaca. En cualquier etapa de la enfermedad existe el riesgo de muerte súbita. Su etiología podría deberse a una deficiencia de ciertos nutrientes, como selenio (130) y/o a una infección por virus Coxsackie del Grupo B (131).
La enfermedad de Keshan fue descartada como causa de la muerte súbita de Yunnan debido a que cursa en forma de miocardiopatía dilatada, que es una alteración anatómica que no se ha observado en ningún caso en los pacientes con el síndrome de Yunnan.
b) Otras enfermedades cardíacas. Se conocen otras enfermedades cardíacas hereditarias que también pueden causan muerte súbita, como el síndrome de QT largo, el síndrome de QT corto, la displasia arritmogénica del ventrículo derecho, la miocardiopatía hipertrófica, el síndrome de Brugada y la taquicardia ventricular polimórfica catecolaminérgica. Sin embargo, el patrón habitual de muerte súbita de Yunnan parece relacionarse con la exposición a un agente ambiental (128).
En occidente, la cardiopatía isquémica es una causa frecuente de muerte súbita arritmogénica.
c) Envenenamiento por metales pesados. Antes de aislar e identificar los aminoácidos tóxicos de T. venenata, se pensó que su toxicidad podría deberse a su alta concentración de bario, un metal pesado que es conocido por sus efectos arritmogénicos, que está presente en el suelo, de donde es absorbido por los carpóforos. En 2009 y 2010, Zhang (132) recolectó carpóforos de T. venenata en cinco aldeas que habían presentado casos de muerte súbita y en dos comunidades que no registraron muerte súbita. Los resultados mostraron que las concentraciones de bario en T. venenata eran bajas, de 0,5 a 22 μg/g de hongos secos. En todos los carpóforos recolectados en diferentes zonas, las concentraciones medias de bario fueron de 5,4 a 12,2 μg/g. Para alcanzar la dosis letal por consumo de T. venenata (dosis letal mínima de 11,4 mg/kg de peso corporal) se tendrían que consumir varios kg de hongos secos y varios cientos de kg de hongos frescos, lo cual es bastante improbable.
La posibilidad de que el contenido de bario en los carpóforos contribuyera a la toxicidad fue descartada, dado que las concentraciones de bario determinadas en muestras de T. venenata de Yunnan recolectadas en varios lugares y en distintos tiempos fueron bajas y comparables con las de otros alimentos comunes, como aves de corral y pescados (132).
No obstante, se han encontrado altas concentraciones de bario en sangre, orina y cabellos de algunas víctimas (114), pero no se conoce su origen.
Queda claro que la totalidad de los casos con el síndrome de Yunnan no tienen como origen el bario presente en T. venenata, lo cual ha sido confirmado por estudios genéticos recientes (133).
d) Síndrome de muerte súbita inexplicada nocturna. Este síndrome fue descripto en 1970 en el sudeste de Asia y Filipinas (134)(135) y se considera que se trata de una alteración genética (136).
Afecta principalmente a varones adultos jóvenes, previamente sanos. La necropsia no muestra ninguna afectación orgánica. La muerte suele producirse de noche durante el sueño, o bien, si la muerte se produce durante el día, ocurre en el período de descanso.
Esta causa fue descartada ya que, primeramente, su forma de presentación no coincide con el síndrome de muerte súbita de Yunnan que se produce durante las actividades diurnas. Tampoco hay coincidencia en las alteraciones electrocardiográficas. En la muerte súbita nocturna el electrocardiograma de los pacientes muestra una elevación del segmento ST en las derivaciones precordiales derechas (137), mientras que en la muerte súbita de Yunnan se ha observado, en algunos casos, alargamiento del intervalo QTc y presencia de onda U.
e) Sospecha de rabdomiólisis. En los casos de muerte súbita de Yunnan se observó que había una afectación cardíaca. Por este motivo se intentó relacionar este síndrome con la intoxicación por Tricholoma equestre y Russula subnigricans, descriptas en Francia (71) y en Japón (138) respectivamente, que cursaban con rabdomiólisis. Sin embargo, los estudios analíticos, especialmente los niveles de creatín-quinasa (124), realizados en los animales de experimentación, han descartado el fenómeno de rabdomiólisis.
Los ratones que fueron alimentados con los aminoácidos tóxicos mostraron un incremento de 1,1 a 1,6 en los niveles de CK en suero, al ser comparados con los ratones control. En cambio, para el diagnóstico de rabdomiólisis se requiere un incremento cinco veces superior al límite de la normalidad, y aún mayor como los niveles observados en las intoxicaciones descriptas en Francia y en Japón (124).
Especie causante del micetismo. Reino: Fungi; División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Marasmiaceae: Trogia venenata Yang, Li & Tang.
Análisis filogenéticos, morfológicos y moleculares revelaron que se trataba de una nueva especie del género Trogia, estrechamente relacionada con T. infundibuliformis. En la actualidad se ha descripto como T. venenata (Número de registro MycoBank MB 561711) (112) y sólo se encuentra en montañas en partes centrales y occidentales de la provincia de Yunnan, China.
Recientemente se analizó la variación de la secuencia en cuatro fragmentos de ADN entre 232 carpóforos del hongo saprófito T. venenata recolectados en siete sitios en la provincia de Yunnan, China, que representan el amplio rango de distribución geográfica de los casos de síndrome de muerte súbita, como contribución al conocimiento de la genética de este hongo (133). Estos análisis de secuencias en las regiones del espaciador transcripto interno (ITS: internal transcribed spacer) del gen de ARN ribosomal nuclear confirmaron que todos los aislados pertenecían a la misma especie. La presencia generalizada de heterocigosidad de secuencia dentro de muchas cepas en cada uno de los tres genes codificantes de proteínas (rpb2, tef1-α y β-tub) sugirió que los carpóforos son diploides, dicarióticos o heterocarióticos. Dentro de las poblaciones geográficas individuales, se encontraron desviaciones significativas de las frecuencias de genotipos desde las expectativas de Hardy-Weinberg, con la heterocigosidad general observada más baja que la esperada en el apareamiento aleatorio, consistente con la endogamia prevalente dentro de las poblaciones locales.
Las poblaciones geográficas fueron en general diferenciadas genéticamente. Se encontró una correlación positiva entre la distancia genética de la población y la distancia geográfica. En cambio, la falta de correlación estadísticamente significativa entre la distancia genética de la población y la diferencia de concentración de bario entre las siete poblaciones geográficas de T. venenata sugieren que la diferenciación genética observada en los tres loci entre las poblaciones locales, es poco probable que sea un contribuyente significativo a los efectos tóxicos de T. venenata en humanos (133).
En su conjunto, estos resultados sugieren una endogamia frecuente, estructuración geográfica y flujo genético limitado entre las poblaciones geográficas de T. venenata del sudoeste de China (133).
Tratamientos
El diagnóstico de intoxicación con hongos se basa principalmente en datos anamnésicos, identificación de carpóforos de las sobras de la comida preparada con hongos, análisis de esporas y/o análisis químicos (13)(139).
Las estrategias terapéuticas incluyen desintoxicación primaria por emesis inducida, lavado gástrico y carbón activado, desintoxicación secundaria, tratamiento sintomático y antídotos rara vez específicos (139).
Tratamiento del toxíndrome orellánico
No existe un antídoto específico para la intoxicación con orellanina. El tratamiento es difícil y sólo comprende medidas sintomáticas, como la rehidratación y depuración extrarrenal de la sangre.
Si el paciente acude precozmente al centro de salud más cercano, el tratamiento de esta grave intoxicación se basa en intentar disminuir la absorción del tóxico orellanina, como se realiza en el síndrome hepatotóxico (aspiración gastrointestinal continua, empleo de carbón activado, etc.) (1); se intenta remover la toxina mediante la plasmaféresis o en su defecto forzando la diuresis con manitol en las primeras horas y en los casos en los que exista insuficiencia renal establecida, realizar su tratamiento específico (53).
Los primeros síntomas de intoxicación por orellanina son generalmente imprecisos o vagos, por lo que inicialmente puede pasarse por alto la posibilidad de intoxicación o los síntomas pueden malinterpretarse. Desafortunadamente, esto significa que los pacientes afectados usualmente aparecen en la clínica con daño renal ya establecido y la atención de apoyo es la única opción terapéutica, que ante la insuficiencia renal grave culmina con el trasplante renal (96).
La base del tratamiento es la prevención de las complicaciones secundarias de la insuficiencia renal, la diálisis adecuada y, en el caso de una recuperación incompleta, el tratamiento de la insuficiencia renal crónica (11).
En el 75% de los casos de insuficiencia renal aguda se realiza hemodiálisis o diálisis peritoneal (4). Si hay cuadro anémico, los pacientes reciben terapia con eritropoyetina; el aumento en gran medida de la presión arterial requiere terapia antihipertensiva (15). El tratamiento sintomático no puede evitar que en un 10-15% de casos se llegue a la falla renal irreversible, que conduce irremediablemente al trasplante de riñón (140).
En la literatura sólo un pequeño número de casos presenta resultados favorables, observándose que la función renal se normaliza en semanas o meses (16)(141)(142), ya que el 70% de los pacientes intoxicados con Cortinarius spp. progresan hacia la insuficiencia renal, mientras que aproximadamente la mitad de estos pacientes (un tercio del total) evoluciona hacia la insuficiencia renal crónica dependiente de diálisis (3).
Hay 5-7% de fallecimientos. En la actualidad la hemodiálisis debería prevenir la muerte en la mayoría de los casos.
Se requiere un mejor conocimiento de la toxicocinética y de los mecanismos de su toxicidad, para avanzar en un tratamiento más adecuado.
Si bien el resultado favorable de diferentes tratamientos se describe en casos individuales, parece más probable que se deba a la variabilidad individual de respuesta y al curso clínico (142)(143). Se ha intentado eliminar la toxina mediante hemoperfusión combinada con hemodiálisis sin resultado (14). Algunos autores consideran que el procesamiento rápido de hemoperfusión puede evitar el daño renal y la diálisis duradera (23).
Para la desintoxicación los métodos como hemodiálisis, hemoperfusión y plasmaféresis pueden considerarse efectivos sólo si se realizan al poco tiempo de la ingestión de los hongos. Así, un paciente desarrolló insuficiencia renal crónica a pesar de un intercambio completo de volumen plasmático 44 horas después de la ingestión de los hongos (144). La razón de esto es probablemente la unión temprana de la toxina al epitelio tubular del riñón, que no permite la eliminación de la toxina (15).
Horn et al. (141) plantearon la hipótesis de que la posibilidad de recuperación renal depende de la cantidad de toxina ingerida, la edad y la salud general del paciente individual, y la demora hasta iniciar la terapia.
Se ha propuesto la utilización de furosemida y diltiazem, pero los resultados no muestran beneficios. Más aún, en animales de experimentación (ratas) se observó que el tratamiento con furosemida aumentaba el daño tubular inducido por C. speciosissimus; además, la furosemida no tuvo efecto alguno sobre la inflamación inducida por este hongo tóxico (145).
Recientemente, Dinis-Oliveira et al. (11) hicieron una revisión de las especies de Cortinarius, incluidos los estudios epidemiológicos, las estructuras químicas, la toxicocinética, las dosis tóxicas, los mecanismos de toxicidad, el diagnóstico, el pronóstico y las opciones de tratamiento.
La patología renal presenta necrosis tubular con nefritis intersticial y se propuso que el daño de la toxina a nivel celular es causado por la producción de radicales (9). Justamente, se ha demostrado que la orellanina rápidamente se concentra en los riñones donde forma radicales libres, y éste el probable mecanismo de acción (50). Se demostró in vitro que la oxidación de orellanina por agentes oxidantes biológicos conduce a la producción de un radical anión y especies reactivas de oxígeno tras el consumo de oxígeno y la depleción del glutatión. Parece razonable plantear la hipótesis de que la terapia antioxidante, como N-acetilcisteína, que actúa como donante de glutatión, podría reducir el grado de nefrotoxicidad a través de la reducción del estrés oxidativo (50). Hay informes individuales que muestran mejoras bajo esta terapia (142)(146), sin establecer una relación causal.
Se ha observado recuperación en casos de intoxicación con especies del género Cortinarius mediante la adición de esteroides al tratamiento sintomático y antioxidante (51). Así, por ejemplo, un paciente con insuficiencia renal aguda debida a la ingestión de Cortinarius sp., que inicialmente tuvo que someterse a diálisis y fue tratado con éxito con prednisolona y N-acetilcisteína, logró la recuperación renal después de 2 meses (142). La terapia antioxidante también se utilizó satisfactoriamente en Munich, Alemania, en dos pacientes, un hombre de 30 años y su esposa de 29 años, con insuficiencia aguda causada por ingestión de los hongos C. speciosissimus (146).
Se informó, además, que una pareja con insuficiencia renal aguda después de la ingesta accidental de C. rubellus tuvo una recuperación casi completa con terapia antioxidante con altas dosis de N-acetilcisteína y esteroides (3). Ambos pacientes comenzaron con prednisolona 1 mg/kg una vez al día y se trataron con N-acetilcisteína por vía intravenosa en la dosis utilizada para la intoxicación con paracetamol (150 mg/ kg durante 15 min, seguidos por 50 mg/kg durante 4 horas y 100 mg/kg durante 16 horas). La función renal de ambos pacientes mejoró significativamente en el transcurso de los siguientes 8 días y fueron dados de alta. Después de 59 días, se determinó la creatinina sérica de ambos pacientes, por lo que se repitió la terapia antioxidante con N-acetilcisteína en la misma dosis que en el día 1 y la paciente tuvo que comenzar a tomar medicamentos antihipertensivos. La prescripción de prednisolona se detuvo 103 días después de la intoxicación. Un examen 306 días después de la intoxicación mostró valores estables de creatinina en ambos pacientes. Es decir que, debido a este tratamiento antioxidante intensivo no fue necesaria la diálisis en ambos pacientes y la función renal fue casi normal al final del seguimiento (3).
Sin embargo, otros autores como Grebe et al. (147) al estudiar la asociación entre la cantidad ingerida de C. orellanus y el resultado, y al evaluar el efecto del tratamiento con N-acetilcisteína y corticosteroides sobre el resultado en pacientes con lesión renal aguda y enfermedad renal crónica, observaron que la cantidad ingerida de C. orellanus se correlacionaba con la gravedad de la lesión renal aguda y la enfermedad renal crónica. En cambio, el tratamiento con N-acetilcisteína y corticosteroides, realizado según los lineamientos de la intoxicación con paracetamol, no pareció tener un efecto beneficioso sobre ambas lesiones (147).
Estudios recientes sugieren fuertemente que la administración temprana de esteroides (dentro de los 7 días posteriores al diagnóstico) mejora la recuperación de la función renal, disminuyendo el riesgo de insuficiencia renal crónica (51). El tratamiento tardío con esteroides, cuando se ha producido fibrosis intersticial, tendría un beneficio terapéutico menos pronunciado o nulo (51).
En resumen, el tratamiento temprano con terapia antioxidante y esteroides podría ser efectivo para reducir el riesgo de desarrollar insuficiencia renal en etapa terminal (3).
Es evidente que los factores pronósticos no están asegurados claramente en este micetismo. Además de la cantidad registrada de la toxina juega un rol la susceptibilidad individual a la toxicidad (15)(16).
Las estrategias terapéuticas para el micetismo por orellanina son: tratamiento sintomático, hemodiálisis, plasmaféresis o terapia antioxidante con corticosteroides y N-acetilcisteína (3)(15)(16)(23)(141)(142)(144), todo lo cual ha dado variados resultados (146).
Tratamiento del toxíndrome por Tricholoma equestre
Dado que hay dudas sobre las toxinas responsables, no hay un tratamiento específico para esta intoxicación. El tratamiento debe ser sintomático y de soporte, y debe realizarse lo antes posible. Es recomendable la internación, en especial si se presenta disnea, o signos de afectación cardíaca o de insuficiencia renal. El tratamiento es entonces sintomático con especial vigilancia de las complicaciones renales y cardíacas.
En cuanto al tratamiento de la rabdomiólisis, el clearance de la mioglobina circulante es una medida crítica para evitar daños adicionales en pacientes con rabdomiólisis y lesión renal aguda. La hemofiltración venosa-venosa continua ha resultado ser un enfoque adecuado para este propósito (148). Los pacientes son tratados con esta hemofiltración durante al menos 48 horas hasta alcanzar condiciones estables, y luego se realiza terapia de reemplazo renal intermitente (hemofiltración intermitente o hemodiálisis). Mientras tanto, se realiza expansión del volumen intravascular, alcalinización urinaria y diuresis forzada. Durante el procedimiento, se miden las concentraciones séricas de mioglobina, creatinina y creatín-quinasa simultáneamente a distintos tiempos, por ejemplo: a las 2, 6, 12 y 24 horas (148), observándose su disminución hasta alcanzar los niveles normales estables.
Conclusiones
En esta Parte 2 de esta serie de cuatro artículos sobre micetismos se han analizado los síndromes demorados, con períodos de latencia de un día o más, que son poco comunes, en general fatales, y poco tratados en la literatura. Dado que en los últimos años se han realizado aislamientos e identificaciones de los compuestos importantes, en especial los tóxicos, en este trabajo se muestran sus estructuras, lo que se conoce hasta el momento sobre su mecanismo de acción y se discuten los tratamientos posibles, con énfasis en los del toxíndrome orellánico y en el provocado por Tricholoma equestre.
Resulta de valor la presentación de los primeros casos clínicos, los análisis anátomo-patológicos, los dosajes enzimáticos, los exámenes post mortem y la discusión de electroencefalogramas y electrocardiogramas, según el caso.
Dado que en el presente artículo se han tratado micetismos que demoran en mostrar la sintomatología y que en general tienen desenlace fatal, es de importancia realizar un diagnóstico rápido y preciso para lo cual contribuye la anamnesis en el centro médico y la identificación de los carpóforos por servicios micológicos especializados. Cada país debe tener seguramente los propios, en el caso de la Ciudad de Buenos Aires (Argentina) actualmente funciona el “Servicio de Identificación de Hongos Tóxicos”, en la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (FCEN-UBA; Pabellón 2, Departamento de Biodiversidad y Biología Experimental), con micólogos investigadores del Instituto de Micología y Botánica (INMIBO), ex PROPLAME-PRHIDEB (UBA-CONICET) que colabora con servicios médicos, estatales y privados, identificando los hongos remitidos en casos de micetismos, permitiendo así, en muchos casos, realizar el tratamiento médico adecuado (149).
Agradecimientos
Al Hospital de Clínicas y a la Universidad de Buenos Aires por la infraestructura brindada; a la Secretaría de Ciencia, Tecnología e Innovación Productiva (ex Mincyt, Argentina) por las facilidades de acceso a la biblioteca electrónica. A.B.P. es Investigadora Superior del Consejo Nacional de Investigaciones Científicas y Técnicas de Argentina (CONICET).
1. Pomilio AB, Battista SM, Alonso A. Micetismos. Parte 1: Síndromes con período de latencia tardía. Acta Bioquím Clín Latinoam 2018; 52: 459-87.
2. Herrmann A, Hedman H, Rosén J, Jansson D, Haraldsson B, Hellenäs KE. Analysis of the mushroom nephrotoxin orellanine and its glucosides. J Nat Prod 2012; 75: 1690-6. [ Links ]
3. Kerschbaum J, Mayer G, Maurer A. High-dose antioxidant therapy and steroids might improve the outcome of acute renal failure from intoxication by Cortinarius rubellus: report of two cases. Clin Kidney J 2012; 5: 576-8. [ Links ]
4. Serés Garcia L. Intoxicación por Cortinarius spp. Barcelona, 2017. http://www.micocat.org/UNCINULA09/micologia09/Toxicologia/Intoxicacion_por_Cortinarius_spp.pdf. Fecha de acceso: 25 de julio de 2018. [ Links ]
5. Shao D, Tang S, Healy RA, Imerman PM, Schrunk DE, Rumbeiha WK. A novel orellanine containing mushroom Cortinarius armillatus. Toxicon 2016; 114: 65-74. [ Links ]
6. Bresinsky A, Besl H. A Colour Atlas of Poisonous Fungi: a Handbook for Pharmacists, Doctors, and Biologists. 1st ed. London: Wolfe Publishing Ltd., 1990; pp. 50-61. [ Links ]
7. Niskanen T, Kytövuori I, Liimatainen K. Cortinarius sect. Brunnei (Basidiomycota, Agaricales) in North Europe. Mycol Res 2009; 113: 182-206. [ Links ]
8. Niskanen T, Kytövuori I, Liimatainen K. Cortinarius sect. Armillati in northern Europe. Mycologia 2011; 103: 1080-101. [ Links ]
9. Frank H, Zilker T, Kirchmair M, Eyer F, Haberl B, Tuerkoglu-Raach G, et al. Acute renal failure by ingestion of Cortinarius species confounded with psychoactive mushrooms: a case series and literature survey. Clin Nephrol 2009; 71: 557-62. Erratum in: Clin Nephrol 2009; 71: 727. [ Links ]
10. Álvarez Tundidor S, González López A, Nava Rebollo A, Andrés Martín B, Diego Martín JV, Santana Zapatero H, et al. Intoxicación por setas: síndrome orellánico. Nefrologia 2011; 31: 495-6. [ Links ]
11. Dinis-Oliveira RJ, Soares M, Rocha-Pereira C, Carvalho F. Human and experimental toxicology of orellanine. Hum Exp Toxicol 2016; 35: 1016-29. [ Links ]
12. Frantzeskaki F, Theodorakopoulou M, Mavrou I, Armaganidis A. Acute renal failure and neurological manifestations following ingestion of wild mushrooms. Indian J Nephrol 2009; 19: 175-7. [ Links ]
13. Danel VC, Saviuc PF, Garon D. Main features of Cortinarius spp. poisoning: a literature review. Toxicon 2001; 39: 1053-60. [ Links ]
14. Holmdahl J, Blohmé I. Renal transplantation after Cortinarius speciosissimus poisoning. Nephrol Dial Transplant 1995; 10: 1920-2. [ Links ]
15. Wessely M, Schönermarck U, Raziorrouh B, Jung MC, Samtleben W. Orellanus-Syndrom – seltene Ursache eines akuten Nierenversagens [Orellanus syndrome: a rare cause of acute renal failure]. Dtsch Med Wochenschr 2007; 132: 1880-2.
16. Bouget J, Bousser J, Pats B, Ramee MP, Chevet D, Rifle G, et al. Acute renal failure following collective intoxication by Cortinarius orellanus. Intensive Care Med 1990; 16: 506-10. [ Links ]
17. Prast H, Pfaller W. Toxic properties of the mushroom Cortinarius orellanus (Fries). II. Impairment of renal function in rats. Arch Toxicol 1988; 62: 89-96. [ Links ]
18. Grzymala S. Massenvergiftung durch den Orangefuchsigen Hautkopf. Z Pilzkd 1957; 23: 139-42. [ Links ]
19. Grzymala S. L’isolement de l’Orellanine poison du Cortinarius orellanus Fries et l’étude de ses effets anatomo-pathologiques. Bull Trimest Soc Mycol Fr 1962; 78: 394-404.
20. Grzymala S. Étude clinique des intoxications par les champignons du genre Cortinarius orellanus Fr Bull Med Leg Toxicol Med 1965; 8: 60-70. [ Links ]
21. Short AK, Watling R, Macdonald MK, Robson JS. Poisoning by Cortinarius speciosissimus. The Lancet 1980; 316: 942-4. [ Links ]
22. Rohrmoser M, Kirchmair M, Feifel E, Valli A, Corradini R, Pohanka E, et al. Orellanine poisoning: rapid detection of the fungal toxin in renal biopsy material. J Toxicol Clin Toxicol 1997; 35: 63-6. [ Links ]
23. Fischer H, Höcherl E, Franke J, Mann JFE. Dialysepflichtige Niereninsuffizienz nach Pilzessen. [End stage renal disease after ingestion of mushrooms]. Der Internist (Berl) 2006; 47: 423-6. [ Links ]
24. Antkowiak WZ, Gessner WP. The structures of orellanine and orelline. Tetrahedron Lett 1979; 20: 1931-4. [ Links ]
25. Matthies L, Laatsch H. Cortinarins in Cortinarius speciosissimus? A critical revision. Experientia 1991; 47: 634-40. [ Links ]
26. Holmdahl J, Ahlmén J, Bergek S, Lundberg S, Persson SA. Isolation and nephrotoxic studies of orellanine from the mushroom Cortinarius speciosissimus. Toxicon 1987; 25: 195-9. [ Links ]
27. Cohen-Addad C, Richard J-M, Guitel J-C. Structure of orellanine-trifluoroacetic acid complex: evidence of a very short O-H.--O hydrogen bond. Acta Crystallogr 1987; C43: 504-7. [ Links ]
28. Antkowiak WZ, Gessner WP. Photodecomposition of orellanine and orellinine, the fungal toxins of Cortinarius orellanus Fries and Cortinarius speciossimus. Experientia 1985; 41: 769-71. [ Links ]
29. Spiteller P, Spiteller M, Steglich W. Occurrence of the fungal toxin orellanine as a diglucoside and investigation of its biosynthesis. Angew Chem Int Ed Engl 2003; 42: 2864-7. [ Links ]
30. Tebbett IR, Caddy B. Mushroom toxins of the genus Cortinarius. Experientia 1984; 40: 441-6. [ Links ]
31. Sontag B, Fröde R, Bross M, Steglich W. Chromogenic triterpenoids from Cortinarius fulvoincarnatus, C. sodagnitus and related toadstools (Agaricales). Eur J Org Chem 1999; 1: 255-60. [ Links ]
32. Nicholas GM, Blunt JW, Munro MHG. Cortamidine oxide, a novel disulfide metabolite from the New Zealand basidiomycete (mushroom) Cortinarius species. J Nat Prod 2001, 64: 341-4. [ Links ]
33. Laatsch H, Matthies L. Fluorescent compounds in Cortinarius speciossimus: investigation for the presence of cortinarins. Mycologia 1991; 83: 492-500. [ Links ]
34. Gill M, Gimenez A, Strauch R. J. 6-Nitro-iso-vanillic acid, an unusual chromogen from the genus Cortinarius. Phytochemistry 1987; 26: 2815-7. [ Links ]
35. Hu L, Tan J-W, Liu J-K. Chemical constituents of the basidiomycete Cortinarius umidicola. Z Naturforsch 2003; 58c: 659-62. [ Links ]
36. Steglich W, Kopanski L, Wolf M, Moser M, Tegtmeyer G. Indolealkaloide aus dem Blätterpilz Cortinarius infractus (Agaricales). Tetrahedron Lett 1984; 25: 2341-4. [ Links ]
37. Teichert A, Schmidt J, Porzel A, Arnold N, Wessjohann L. Brunneins A–C, β-carboline alkaloids from Cortinarius brunneus. J Nat Prod 2007; 70: 1529-31.
38. Patocka J. Natural cholinesterase inhibitors from mushrooms. Mil Med Sci Lett (Voj Zdrav Listy) 2012; 81: 40-4. [ Links ]
39. Tan J-W, Dong Z-J, Liu J-K. New cerebrosides from the basidiomycete Cortinarius tenuipes. Lipids 2003; 38: 81-4. [ Links ]
40. Arnold N, Palfner G, Schmidt J, Kuhnt C, Becerra J. Chemistry of the aroma bouquet of the edible mushroom “lebre” (Cortinarius lebre, Basidiomycota, Agaricales) from Chile. J Chilean Chem Soc 2012; 58: 1333-5.
41. Kleofas V, Popa F, Fraatz MA, Rühl M, Kost G, Zorn H. Aroma profile of the anise-like odour mushroom Cortinarius odorifer. Flavour Fragr J 2015; 30: 381-6. [ Links ]
42. Arnold N, Palfner G, Kuhnt C, Schmidt J. Chemistry of the earthy odour of basidiomata of Cortinarius hinnuleus (Basidiomycota, Agaricales). Österr Z Pilzk (Austrian J Mycol) 2016; 25: 5-10. [ Links ]
43. Moser M, Keller G. Dermocybe saligna spec. nov., eine mit Salix assoziierte Dermocybe-Art. Z Pilzkd 1977; 43: 207-12. [ Links ]
44. Keller G. Pigmentationsuntersuchungen bei europäischen Arten aus der Gattung Dermocybe (Fr.) Wünsche. Sydowia 1982; 35: 110-26. [ Links ]
45. Arnold N, Bresinsky A, Kemmer H. Notizen zur Chemotaxonomie der Gattung Dermocybe (Agaricales) und zu ihrem Vorkommen in Bayern. Z Mykol 1987; 53: 187-94. [ Links ]
46. Sánchez Macias E, Pérez-Silva E, Pérez-Amador C. Consideraciones quimiotaxonómicas para el estudio de algunas especies del género Dermocybe (Cortinariaceae) en México. Rev Mex Micol 1987; 3: 189-202. [ Links ]
47. Oertel B, Laber D. Die Laugenreaktion an der Unterseite der Stielknolle bei Fruchtkörpern der Gattung Cortinarius, Untergattung Phlegmacium. Z Mykol 1986; 52: 139-54. [ Links ]
48. Richard J-M, Creppy EE, Benoit-Guyod J-L, Dirheimer G. Orellanine inhibits protein synthesis in Madin-Darby canine kidney cells, in rat liver mitochondria and in vitro: indication for its activation prior to in vitro inhibition. Toxicology 1991; 67: 53-62. [ Links ]
49. Oubrahim H, Richard JM, Cantin-Esnault D. Peroxidase-mediated oxidation, a possible pathway for activation of the fungal nephrotoxin orellanine and related compounds. ESR and spin-trapping studies. Free Radic Res 1998; 28: 497-505. [ Links ]
50. Richard JM, Cantin-Esnault D, Jeunet A. First electron spin resonance evidence for the production of semiquinone and oxygen free radicals from orellanine, a mushroom nephrotoxin. Free Radic Biol Med 1995; 19: 417-29. [ Links ]
51. Praga M, González E. Acute interstitial nephritis. Kidney Int 2010; 77: 956-61. [ Links ]
52. Pöder R, Moser M. Eine einfache, empfindliche Methode zum makrochemischen Nachweis von Orellanin. Mycol Helv 1989; 3: 283-90. [ Links ]
53. Arrillaga Anabitarte P, Laskibar Urkiola X. Setas tóxicas e intoxicaciones. Munibe, Suplemento 22, Gehigarria, Ed. Aranzadi, Zientzi elkartea, Sociedad de Ciencias, España, 2006. [ Links ]
54. Kirchmair M, Pöder R. Fatal renal failure caused by Cortinarius mushrooms. Pediatr Nephrol 2011; 26: 487-8. author reply 489-90. Comment on: Talmud et al. 2011a (ref. 58). [ Links ]
55. Rapior S, Delpech N, Andary C, Huchard G. Intoxication by Cortinarius orellanus: detection and assay of orellanine in biological fluids and renal biopsies. Mycopathologia 1989; 108: 155-61. [ Links ]
56. Anantharam P, Shao D, Imerman PM, Burrough E, Schrunk D, Sedkhuu T, et al. Improved tissue-based analytical test methods for orellanine, a biomarker of Cortinarius mushroom intoxication. Toxins (Basel) 2016; 8: pii: E158. [ Links ]
57. O’Donnell M, Fleming S. The renal pathology of mushroom poisoning. Histopathology 1997; 30: 280-2.
58. Talmud D, Wynckel A, Grossenbacher F, Saad S, Motte J, Abély M, et al. Four family cases of acute renal failure. Diagnosis: Orellanus syndrome. Pediatr Nephrol 2011a; 26: 385-6. [ Links ]
59. Talmud D, Wynckel A, Grossenbacher F, Saad S, Motte J, Abély M, et al. Four family cases of acute renal failure: answer. Pediatr Nephrol 2011b; 26: 387-9. [ Links ]
60. Mount P, Harris G, Sinclair R, Finlay M, Becker GJ. Acute renal failure following ingestion of wild mushrooms. Intern Med J 2002; 32: 187-90. [ Links ]
61. Gérault A. Intoxication collective de type Orellanien provoquée par Cortinarius splendens R. Hy. Bull Soc Mycol France 1981; 97: 67-72. [ Links ]
62. Niveiro N, Albertó E. Checklist of the Argentine Agaricales 7. Cortinariaceae and Entolomataceae. Check List 2014; 10: 72-96. [ Links ]
63. Judge BS, Ammirati JF, Lincoff GH, Trestrail JH 3rd, Matheny PB. Ingestion of a newly described North American mushroom species from Michigan resulting in chronic renal failure: Cortinarius orellanosus. Clin Toxicol (Phila) 2010; 48: 545-9. [ Links ]
64. Pérez-Silva E, Esqueda M, Herrera T. Macromicetos tóxicos de Sonora, México. Revista Mexicana de Micología 2008; 28: 81-8. [ Links ]
65. Index fungorum. http://www.indexfungorum.org/. Fecha de acceso: 25 julio 2018. www.speciesfungorum.org/Names/SynSpecies.asp?RecordID=166839. Synonymy Contributor(s): Kew Mycology (2015); Basidiomycota Checklist. http://www.basidiochecklist.info/DisplayResults.asp?intGBNum=37486. Fecha de acceso: 25de julio de 2018. [ Links ]
66. Kirk P. Index Fungorum Partnership. CABI, 2016. http://www.indexfungorum.org. Fecha de acceso: 25 de julio de 2018. [ Links ]
67. Robertson CP, Wright L, Gamiet S, Machnicki N, Ammirati J, Birkebak J, et al. Cortinarius rubellus Cooke from British Columbia, Canada and western Washington, USA. Pac Northwest Fungi 2006; 1: 1-7. [ Links ]
68. Chodorowski Z, Anand JS, Grass M. Acute poisoning with Tricholoma equestre of five-year old child. Przegl Lek 2003; 60: 309-10. [ Links ]
69. Nieminen P, Mustonen AM, Kirsi M. Increased plasma creatine kinase activities triggered by edible wild mushrooms. Food Chem Toxicol 2005; 43: 133-8. [ Links ]
70. Nieminen P, Karja V, Mustonen AM. Indications of hepatic and cardiac toxicity caused by subchronic Tricholoma flavovirens consumption. Food Chem Toxicol 2008; 46: 781-6. [ Links ]
71. Bedry R, Baudrimont I, Deffieux G, Creppy EE, Pomies JP, Ragnaud JM, et al. Wild-mushroom intoxication as a cause of rhabdomyolysis. N Engl J Med 2001; 345: 798-802. [ Links ]
72. Jo WS, Hossain MA, Park SC. Toxicological profiles of poisonous, edible, and medicinal mushrooms. Mycobiology 2014; 42: 215-20. [ Links ]
73. Hahn A, Michalak H, Begemann K, Preußner K, Engler A, Rüdiger T, et al. Ärztliche Mitteilungen bei Vergiftungen nach §16e Chemikaliengesetz 2001. Bericht der “Zentralen Erfassungsstelle für Vergiftungen, gefährliche Stoffe und Zubereitungen, Umweltmedizin” im Bundesinstitut für gesundheitlichen Verbraucherschutz und Veterinärmedizin (bgvv) für das Jahr 2001. https://www.bfr.bund.de/cm/350/aerztliche_mitteilungen_bei_vergiftungen_2001.pdf. Fecha de acceso: 2 de Julio de 2018.
74. Chodorowski Z, Waldman W, Anand JS. Acute poisoning with Tricholoma equestre. Przegl Lek 2002; 59: 386-7. [ Links ]
75. Laubner G, Mikulevičienė G. A series of cases of rhabdomyolysis after ingestion of Tricholoma equestre. Acta Med Lituanica 2016; 23: 193-7. [ Links ]
76. Matsuura M, Saikawa Y, Inui K, Nakae K, Igarashi M, Hashimoto K, et al. Identification of the toxic trigger in mushroom poisoning. Nat Chem Biol 2009; 5: 465-7. [ Links ]
77. Matsuura M, Kato S, Saikawa Y, Nakata M, Hashimoto K. Identification of cyclopropylacetyl-(R)-carnitine, a unique chemical marker of the fatally toxic mushroom Russula subnigricans. Chem Pharm Bull (Tokyo) 2016; 64: 602-8. [ Links ]
78. Janković SR, Stosić JJ, Vucinić S, Vukcević NP, Ercegović GV. Causes of rhabdomyolysis in acute poisonings. Vojnosanit Pregl 2013; 70: 1039-45. [ Links ]
79. Yin X, Feng T, Shang JH, Zhao YL, Wang F, Li ZH, et al. Chemical and toxicological investigations of a previously unknown poisonous European mushroom Tricholoma terreum. Chemistry 2014; 20: 7001-9. [ Links ]
80. Cho JT, Han JH. A case of mushroom poisoning with Russula subnigricans: development of rhabdomyolysis, acute kidney injury, cardiogenic shock, and death. J Korean Med Sci 2016; 31: 1164-7. [ Links ]
81. Ministero Della Salute, Italia. Ordinanza 20 agosto 2002. Divieto di raccolta, commercializzazione e conservazione del fungo epigeo denominato Tricholoma equestre. Gazzetta Ufficiale Italiana n. 201, 2002. [ Links ]
82. Ministère des Solidarités et de la Santé, République Française. NOR: ECOC0400035A Arrété du 16 juin 2004 portant suspension d’importation et de mise sur le marché du Tricholoma equestre et ordonnant son retrait. Journal Officiel de la République Française 2004; 142: 11099.
83. Ministerio de Sanidad y Consumo, España. ORDEN SCO/3303/2006, de 23 de octubre, por la que se prohíbe cautelarmente la comercialización de la seta Tricholoma equestre. Boletín Oficial del Estado (España) 2006; 258: 37607-8. http://www.boe.es/boe/dias/2006/10/28/pdfs/A37607-37608.pdf. Fecha de acceso: 2 de agosto de 2018. [ Links ]
84. Real Decreto 30/2009, del 16 de enero, por el que se establecen las condiciones sanitarias para la comercialización de setas para uso alimentario. Boletín Oficial del Estado (España) 2009; (20): 7861-7871. [ Links ]
85. Seeger R, Wiedmann R. Zum Vorkommenn von Hämolysinen and Agglutininen in höheren Pilzen (Basidiomyceten): Untersuchungen an 293 Arten. Arch Toxikol 1972; 29: 189-217. [ Links ]
86. Końska G. A survey of domestic species of Basidiomycetes fungi for the presence of lectins in their carpophores. Acta Soc Bot Poloniae 1988; 57: 247-60. [ Links ]
87. Moliszewska E. Mushroom flavor. Folia Biol Oecol 2014; 10: 80-8. [ Links ]
88. Rapior S, Breheret S, Talou T, Pélissier Y, Milhau M, Bessière JM. Volatile components of fresh Agrocybe aegerita and Tricholoma sulfureum. Cryptogam Mycol 1998; 19: 15-23. [ Links ]
89. Davoli P, Floriani M, Assisi F, Kob K, Sitta N. Comment on “Chemical and toxicological investigations of a previously unknown poisonous European mushroom Tricholoma terreum”. Chemistry 2016; 22: 5786-8.
90. Yin X, Feng T, Li ZH, Liu JK. Response to the “Comment on Chemical and toxicological investigations of a previously unknown poisonous european mushroom Tricholoma terreum”. Chemistry 2016; 22: 5789-92.
91. Frichert A, Jones PG, Brönstrup M, Lindel T. Oxidation of the meroterpenoid (−)-terreumol c from the mushroom Tricholoma terreum: discovery of cytotoxic analogues. J Nat Prod 2017; 80: 2652-8.
92. Feng T, He J, Ai H-L, Huang R, Li Z-H, Liu J-K. Three new triterpenoids from European mushroom Tricholoma terreum. Nat Prod Bioprospect 2015; 5: 205-8. [ Links ]
93. Vanholder R, Sever MS, Erek E, Lameire N. Rhabdomyolysis. J Am Soc Nephrol 2000; 11: 1553-61. [ Links ]
94. Elsayed EF, Reilly RF. Rhabdomyolysis: a review, with emphasis on the pediatric population. Pediatr Nephrol 2010; 25: 7-18. [ Links ]
95. Bosch X, Poch E, Grau JM. Rhabdomyolysis and acute kidney injury. N Engl J Med 2009; 361: 62-72. [ Links ]
96. Karlson-Stiber C, Persson H. Cytotoxic fungi--an overview. Toxicon 2003; 42: 339-49. [ Links ]
97. Anand JS, Chwaluk P, Sut M. Acute poisoning with Tricholoma equestre. Przegl Lek 2009; 66: 339-40. [ Links ]
98. Anand JS, Chwaluk P. Acute intoxication with Tricholoma equestre – clinical course. Przegl Lek 2010; 67: 617-8.
99. Moukha S, Férandon C, Beroard E, Guinberteau J, Castandet B, Callac P, et al. A molecular contribution to the assessment of the Tricholoma equestre species complex. Fungal Biol 2013; 117: 145-55. [ Links ]
100. Lechner BE, Albertó E. Especies tóxicas de Agaricales halladas en la Argentina: nueva cita de Amanita pantherina y reevaluación de la comestibilidad de Tricholoma equestre. Bol Soc Argent Bot 2008; 43: 227-35. [ Links ]
101. Gejyo F, Homma N, Higuchi N, Ataka K, Teramura T, Alchi B, et al. A novel type of encephalopathy associated with mushroom Sugihiratake ingestion in patients with chronic kidney diseases. Kidney Int 2005; 68: 188-92. [ Links ]
102. Saviuc P, Danel V. New Syndromes in mushroom poisoning. Toxicol. Rev 2006; 25: 199-209. [ Links ]
103. Kato T, Kawanami T, Shimizu H, Kurokawa K, Sato H, Nakajima K, et al. [An outbreak of encephalopathy after eating autumn mushroom (Sugihiratake; Pleurocybella porrigens) in patients with renal failure: a clinical analysis of ten cases in Yamagata, Japan] [Artículo en idioma japonés]. No to shinkei = Brain and nerve 2004; 56: 999-1007. [ Links ]
104. Obara K, Wada C, Yoshioka T, Enomoto K, Yagishita S, Toyoshima I. Acute encephalopathy associated with ingestion of a mushroom, Pleurocybella porrigens (angel’s wing), in a patient with chronic renal failure. Neuropathology 2008; 28: 151-6.
105. Kawaguchi T, Suzuki T, Kobayashi Y, Kodani S, Hirai H, Nagai K, et al. Unusual amino acid derivatives from the mushroom Pleurocybella porrigens. Tetrahedron 2010; 66: 504-7. [ Links ]
106. Kawaguchi H. [Bioactive compounds from mushrooms]. [Artículo en idioma japonés]. Mushroom Sci Biotechnol 2013; 21: 11-5. [ Links ]
107. Wakimoto T, Asakawa T, Akahoshi S, Suzuki T, Nagai K, Kawagishi H, et al. Proof of the existence of an unstable amino acid: pleurocybellaziridine in Pleurocybella porrigens. Angew Chem Int Ed 2011; 50: 1168-70. [ Links ]
108. Akiyama H, Toshihko T, Shinobu S, Yoshiaki A, Kazunari K, Yoshiko S-K, et al. Determination of cyanide and thiocyanate in Sugihiratake mushroom using HPLC method with fluorometric detection. J Health Sci-Tokyo 2006; 52: 73. [ Links ]
109. Rachinger J, Fellner FA, Stieglbauer K, Trenkler J. MR changes after acute cyanide intoxication. Am J Neuroradiol 2002; 23: 1398-401. [ Links ]
110. Hasuike Y, Nakanishi T, Moriguchi R, Otaki Y, Nanami M, Hama Y, et al. Accumulation of cyanide and thiocyanate in haemodialysis patients. Nephrol Dial Transplant 2004; 19: 1474-9. [ Links ]
111. Wang H, Sekine M, Yokokawa H, Hamanishi S, Chen X, Sayama M, et al. The relationship between new stroke onset and serum thiocyanate as an indicator to cigarette smoking. J Epidemiol 2001; 11: 233-7. [ Links ]
112. Yang ZL, Li YC, Tang LP, Shi GQ, Zeng G. Trogia venenata (Agaricales), a novel poisonous species which has caused hundreds of deaths in southwestern China. Mycol Progr 2012; 11: 937-45. [ Links ]
113. Shi GQ, Huang WL, Zhang J, Zhao H, Shen T, Fontaine RE, et al. Clusters of sudden unexplained death associated with the mushroom, Trogia venenata, in rural Yunnan Province, China. PLoS One 2012; 7: e3589 [ Links ]
114. Stone R. Heart-stopping revelation about how Chinese mushroom kills. Science 2012; 335: 1293. [ Links ]
115. Zhang J, Shi GQ, Huang WL, Bao JZ, Ye SD, Ren JM, et al. [Clinical features of unexpected sudden death clustered in 7 families in Yunnan Province]. [Artículo en idioma chino]. Zhonghua Xin Xue Guan Bing Za Zhi (Chin J Cardiol) 2008; 36: 613-7. [ Links ]
116. Graeme KA. Mycetism: a review of the recent literature. J Med Toxicol 2014; 10: 173-89. [ Links ]
117. Shi GQ, Zhang J, Huang WL, Yang T, Ye SD, Sun XD, et al. [Retrospective study on 116 unexpected sudden cardiac deaths in Yunnan, China] [Artículo en idioma chino] Zhonghua Liu Xing Bing Xue Za Zhi (Chin J. Epidemiol) 2006; 27: 96-101. [ Links ]
118. Serés Garcia L. Trogia venenata y síndrome de muerte súbita de Yunnan (China). Barcelona, 2015. www.micocat.org/UNCINULA09/micologia09/Toxicologia/Intoxicacion_por_Trogia_venenata.pdf. Fecha de acceso: 2 de agosto de 2018. [ Links ]
119. Manenti C. Trogia venenata, nouvelle espèce de la flore mycologique, est-il responsable des morts subites du Yunnan? Sciences pharmaceutiques. 2013. <dumas-00865831>https://dumas.ccsd.cnrs.fr/dumas-00865831/document. Fecha de acceso: 2 de agosto de 2018. [ Links ]
120. Lu BL, Shi GQ, Huang WL, Wang JF, Shen T, Yang L, et al. Study on spatial-temporal distribution characteristics of Yunnan unexplained sudden death. Chin J Dis Control Prev 2010; 14: 305-9. [ Links ]
121. Yang L, Huang WL, Li ZX, Li JG, Zhao S, et al. Retrospective research on unexpected sudden cardiac death in Yunnan from 1975 to 2004. J Prev Med Inf 2008; 21: 110-3. [ Links ]
122. Huang WL, Li ZX, Yang L, Zhao S, Ma L, Wang YB, et al. [Investigation and analysis on the incidence of “Yunnan unknown-cause sudden cardiac death” during 2002- 2004]. [Artículo en idioma chino]. Zhonghua Liu Xing Bing Xue Za Zhi (Chin J Epidemiol) 2007; 28: 233-6.
123. Stone R. Will a midsummer’s nightmare return? Science 2010; 329: 132-4.
124. Zhou ZY, Shi GQ, Fontaine R, Wei K, Feng T, Wang F, et al. Evidence for the natural toxins from the mushroom Trogia venenata as a cause of sudden unexpected death in Yunnan Province, China. Angew Chem Int Ed 2012; 51: 2368-70. [ Links ]
125. Shi GQ, He J, Shen T, Fontaine RE, Yang L, Zhou Z, et al. Hypoglycemia and death in mice following experimental exposure to an extract of Trogia venenata mushrooms. PLoS One 2012; 7: e38712. [ Links ]
126. Cryer PE. Hypoglycemia, functional brain failure, and brain death. J Clin Invest 2007; 117: 868-70. [ Links ]
127. Feng L, Ren JM, Zhang J, Yang YJ, Huang WL, Yang CF, et al. Electrocardiogram analysis in high risk population of unexplained sudden death in Yunnan province. Chin J Cardiol 2007; 35: 1155-8. [ Links ]
128. Wang HY, Zhao H, Song LF, Huang WL, Niu CL, Li ZX, et al. [Pathological study of unexpected sudden death clustered in family or village in Yunnan province: report of 29 cases of autopsy]. [Artículo en idioma chino]. Zhonghua Yi Xue Za Zhi (Natl Med J China) 2007; 87: 2209-14. [ Links ]
129. Wei HL, Pei JR, Jiang CX, Zhou LW, Lan T, Liu M, et al. Analysis of glutathione peroxidase 1 gene polymorphism and Keshan disease in Heilongjiang Province, China. Genet Mol Res 2011; 10: 2996-3001. [ Links ]
130. Ge K, Yang G. The epidemiology of selenium deficiency in the etiological study of endemic diseases in China. Am J Clin Nutr 1993; 57 (2 Suppl): 259S-63S. [ Links ]
131. Ren Lq, Li Xj, Li Gs, Zhao Zt, Sun B, Sun F. Coxsackievirus B3 infection and its mutation in Keshan disease. World J Gastroenterol 2004; 10: 3299-302. [ Links ]
132. Zhang Y, Li Y, Wu G, Feng B, Yoell S, Yu Z, et al. Evidence against barium in the mushroom Trogia venenata as a cause of sudden unexpected deaths in Yunnan, China. Appl Environ Microbiol 2012; 78: 8834-5. [ Links ]
133. Mi F, Zhang Y, Yang D, Tang X, Wang P, He X, et al. Evidence for inbreeding and genetic differentiation among geographic populations of the saprophytic mushroom Trogia venenata from Southwestern China. PLoS One 2016; 11: e0149507. [ Links ]
134. Munger RG, Booton EA. Bangungut in Manila: sudden and unexplained death in sleep of adult Filipinos. Int J Epidemiol 1998; 27: 677-84. [ Links ]
135. Gervacio-Domingo G, Punzalan FE, Amarillo ML, Dans A. Sudden unexplained death during sleep occurred commonly in the general population in the Philippines: a sub study of the National Nutrition and Health Survey. J Clin Epidemiol 2007; 60: 567-71. [ Links ]
136. Cheng J, Makielski JC, Yuan P, Shi N, Zhou F, Ye B, et al. Sudden unexplained nocturnal death syndrome in Southern China: epidemiological survey and SCN5A gene screening. Am J Forensic Med Pathol 2011; 32: 359-63. [ Links ]
137. Vatta M, Dumaine R, Varghese G, Richard Ta, Shimizu W, Aihara N, et al. Genetic and biophysical basis of sudden unexplained nocturnal death syndrome (SUNDS), a disease allelic to Brugada syndrome. Hum Mol Genet 2002; 11: 337-45. [ Links ]
138. Lee PT, Wu ML, Tsai WJ, Ger J, Deng JF, Chung HM. Rhabdomyolysis: an unusual feature with mushroom poisoning. Am J Kidney Dis 2001; 38: E17. [ Links ]
139. Köppel C. Clinical symptomatology and management of mushroom poisoning. Toxicon 1993; 31: 1513-40. [ Links ]
140. Esposito P, La Porta E, Calatroni M, Bianzina S, Libetta C, Gregorini M, et al. Renal involvement in mushroom poisoning: The case of Orellanus syndrome. Hemodial Int 2015; 19: E1-5. [ Links ]
141. Horn S, Horina JH, Krejs GJ, Holzer H, Ratschek M. End-stage renal failure from mushroom poisoning with Cortinarius orellanus: report of four cases and review of the literature. Am J Kidney Dis 1997; 30: 282-6. [ Links ]
142. Kilner RG, D’Souza RJ, Oliveira DB, MacPhee IA, Turner DR, Eastwood JB. Acute renal failure from intoxication by Cortinarius orellanus: recovery using anti-oxidant therapy and steroids. Nephrol Dial Transplant 1999; 14: 2779-80.
143. Holmdahl J, Mulec H, Ahlmén J. Acute renal failure after intoxication with Cortinarius mushrooms. Hum Toxicol 1984; 3: 309-13. [ Links ]
144. Montoli A, Confalonieri R, Colombo V. Lack of efficacy of early plasma exchange in renal toxicity from Cortinarius orellanus. Nephron 1999; 81: 248. [ Links ]
145. Nieminen L, Pyy K, Hirsimäki Y. The effect of furosemide on the renal damage induced by toxic mushroom Cortinarius speciosissimus in the rat. Br J Exp Path 1976; 57: 400-3. [ Links ]
146. Wörnle M, Angstwurm MW, Sitter T. Treatment of intoxication with Cortinarius speciosissimus using an antioxidant therapy. Am J Kidney Dis 2004; 43: e3-6. [ Links ]
147. Grebe SO, Langenbeck M, Schaper A, Berndt S, Aresmouk D, Herget-Rosenthal S. Antioxidant treatment and outcome of Cortinarius orellanus poisoning: a case series. Ren Fail 2013; 35: 1436-9. [ Links ]
148. Zhang L, Kang Y, Fu P, Cao Y, Shi Y, Liu F, et al. Myoglobin clearance by continuous venous-venous haemofiltration in rhabdomyolysis with acute kidney injury: a case series. Injury 2012; 43: 619-23. [ Links ]
149. Romano GM, Iannone L, Novas MV, Carmarán C, Romero AI, Lopez SE, et al. Hongos tóxicos en la ciudad de Buenos Aires y alrededores. Medicina (Buenos Aires) 2013; 73: 406-10. [ Links ]
Recibido: 16 de agosto de 2018
Aceptado: 23 de noviembre de 2018














