Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.2 La Plata jun. 2019
TOXICOLOGÍA
Herramientas farmacométricas para antichagásicos, aplicadas a estudios fármaco y toxicocinéticos en contexto pediátrico
María Elena Marson1
1 Bioquímica, Dra. de la Facultad de Ciencias Exactas (Departamento de Ciencias Biológicas), Universidad Nacional de La Plata (UNLP). Beneficiaria de beca Doctoral CONICET.
Lugar de realización:
Departamento de Ciencias Biológicas. Área de Toxicología. Facultad de Ciencias Exactas- UNLP- Calle 47 y 115, La Plata. Buenos Aires, Argentina.
Unidad Plapimu-Laseisic- Comisión de Investigaciones Científicas de la Provincia de Buenos Aires. Camino Centenario entre 505 y 508, Gonnet, Buenos Aires, Argentina.
Servicio de Parasitología-Enfermedad de Chagas, Hospital de Niños Ricardo Gutiérrez, Sánchez de Bustamante 1399, CABA, Argentina.
Correspondencia Dra. MARÍA ELENA MARSON Unidad Plapimu/Laseisic - CICpBA Camino Centenario entre 505 y 508 1897 GONNET, Buenos Aires, Argentina Correo electrónico: emarson@biol.unlp.edu.ar
Resumen
La enfermedad de Chagas afecta aproximadamente a 10 millones de personas en Sudamérica y 1,5 millones en la Argentina. La transmisión congénita es la más importante en áreas urbanas. Existen dos drogas aprobadas para el tratamiento: nifurtimox (Laboratorios Bayer) y benznidazol (BNZ) (Laboratorios Roche, LAFEPE y Elea) que fueron desarrolladas hace más de 40 años y cuya farmacología y metabolismo en humanos han sido poco estudiados. La información disponible es virtualmente inexistente en niños y mujeres embarazadas. Se busca aportar estudios sistemáticos hacia una farmacoterapéutica racional en niños ya que empíricamente ha demostrado gran efectividad. Se desarrollaron métodos bioanalíticos aplicables a matrices biológicas como plasma, orina y leche materna para las drogas madres y la identificación de metabolitos en muestras de pacientes bajo terapéutica. La farmacocinética poblacional pediátrica descripta aquí para BNZ es concluyente respecto de sus diferencias con la farmacocinética en adultos. Se identificaron tres compuestos presentados como metabolitos del BNZ. La transferencia de dicho fármaco a la leche materna no supone riesgo para el lactante. Estos resultados brindan información para mejorar los protocolos de tratamiento existentes buscando una farmacoterapéutica adaptada a la edad y un uso más seguro de los fármacos en niños y eventualmente en adultos.
Palabras clave: Enfermedad de Chagas; Metabolismo de fármacos; Farmacoterapéutica; Bioanalítica; Benznidazol; Nifurtimox; Pediatría; Riesgo en lactancia.
Abstract
Pharmacometric tools for antichagasic drugs applied to pharmaco and toxicokinetic studies in a paediatric context
Chagas disease affects approximately 10 million people in South America and 1.5 million in Argentina. Congenital transmission is most important in urban areas. There are two drugs approved for treatment: nifurtimox (Bayer) and benznidazole (BNZ) (Roche, LAFEPE, Elea),developed more than 40 years ago. Their pharmacology and metabolism in humans have been seldom studied. The information available on children and pregnant women is virtually non-existent. The aim of this study is to provide systematic studies towards a rational pharmacotherapeutic sin children, which has been empirically proven to be highly effective. Bioanalytical methods were developed for plasma, urine and breast milk for parent drugs and for the identification of their metabolites in samples of patients under treatment. The pediatric population pharmacokinetics described here for BNZ is conclusive about their differences from adult pharmacokinetics. Three compounds presented as BNZ metabolites were identified. The transfer of this drug to the breast milk does not present a risk to the infant. These evidences offer information to improve the existing treatment protocols, seeking a pharmacotherapy adapted to the age and a safer use of the drugs in children and eventually in adults.
Key words: Chagas disease; Drug metabolism; Pharmacotherapeutics; Bioanalytics; Benznidazole; Nifurtimox; Pediatrics; Lactation risk.
Resumo
Ferramentas farmacométricas para antichagásicos, aplicadas a estudos fármaco e toxicocinéticos em contexto pediátrico
A doença de Chagas afeta aproximadamente 10 milhões de pessoas na América do Sul e 1,5 milhão na Argentina. A transmissão congênita é a mais importante em áreas urbanas. Existem dois medicamentos aprovados para o tratamento: nifurtimox (Laboratórios Bayer) e benznidazol (BNZ) (Laboratórios Roche, LAFEPE e Elea), desenvolvidas há mais de 40 anos, e sua farmacologia e seu metabolismo em humanos têm sido pouco estudados. A informação disponível é praticamente inexistente em crianças e mulheres grávidas. O objetivo é fornecer estudos sistemáticos para uma farmacoterapêutica racional em crianças visto que foram comprovadas empiricamente como sendo altamente eficazes. Métodos bioanalíticos aplicáveis a matrizes biológicas como plasma, urina e leite materno para fármacos-mãe e para a identificação de metabólitos em amostras de pacientes em tratamento terapêutico foram desenvolvidos. A farmacocinética da população pediátrica aqui descrita para BNZ é conclusiva em relação às suas diferenças com a farmacocinética de adultos. Três compostos apresentados como metabólitos do BNZ foram identificados. A transferência do referido medicamento para o leite materno não representa risco para o lactente. Essas evidências oferecem informações para melhorar os protocolos de tratamento existentes, buscando uma farmacoterapia adaptada à idade e um uso mais seguro dos medicamentos em crianças e eventualmente em adultos.
Palavras-chave: Doença de Chagas; Metabolismo de fármacos; Farmacoterapêutica; Bioanalítica; Benznidazol; Nifurtimox; Pediatria; Risco em amamentação.
Introducción
El presente artículo se propone como una comunicación breve sobre los trabajos realizados en el marco del plan de trabajo de Tesis Doctoral de la autora de la publicación (1).
La tripanosomiasis humana americana o enfermedad de Chagas es causada por un protozoo, Trypanosoma cruzi; se transmite a los hombres fundamentalmente a través de la picadura de triatominidos infectados, mediante transfusiones de sangre de un individuo infectado, por consumo de alimentos contaminados con insectos portadores o por la madre infectada al hijo, como principales vías.
Afecta aproximadamente a 10 millones de personas en Sudamérica y 1,5 millones en la Argentina. Hoy la transmisión congénita es la más importante en áreas densamente pobladas (que incluye al 90% de la población argentina). Es una enfermedad silenciosa y en parte desconocida. Existe una activa investigación alrededor del insecto transmisor, las formas de controlarlo y el estudio de su hábitat. Se conoce su etiología, sus formas de transmisión, su clínica, la forma de diagnosticarla, cómo tratarla en algunas fases de su evolución, las limitaciones de los actuales fármacos empleados en su tratamiento y el impacto económico y social que tiene entre la población latinoamericana. El Banco Mundial ha calculado la pérdida anual debido a la enfermedad de Chagas en 2.740.000 AVAC (Años de Vida Ajustados por Discapacidad), lo que representa una pérdida económica para los países endémicos de América Latina equivalente a más de 6.500 millones de dólares norteamericanos al año (2).
Actualmente sólo existen dos drogas aprobadas para el tratamiento de la enfermedad de Chagas: nifurtimox (NFX) (Laboratorios Bayer) y benznidazol (BNZ) (Laboratorios Roche, LAFEPE y Elea). Ambas fueron desarrolladas hace más de 40 años pero sus propiedades farmacológicas no han sido estudiadas en detalle. La información disponible acerca de estas drogas en humanos es rudimentaria en el mejor de los casos, y virtualmente inexistente en poblaciones especiales como niños, ancianos y mujeres embarazadas. Hay escasos datos respecto al metabolismo de dichos fármacos y de sus metabolitos, sobre todo aplicados a estudios en niños.
Los estudios expuestos son parte del trabajo de un grupo de investigación clínica con acceso frecuente a pacientes, cuyo objetivo es la búsqueda de mejoras en el tratamiento de pacientes (en especial pediátricos), por aumento de la tasa de respuesta a la terapéutica y la disminución de la incidencia de eventos adversos.
Materiales y Métodos
Con el propósito de estudiar la farmacoterapéutica se desarrollaron técnicas de laboratorio mediante HPLC-UV para la extracción, detección y cuantificación de BNZ y NFX en muestras biológicas como plasma, orina y leche materna. En esta última matriz se abordó un estudio protocolizado de evaluación de riesgo de exposición del lactante a los fármacos a través de la leche materna. A su vez, mediante el uso de espectroscopía de masa se buscó detectar e identificar candidatos a metabolitos de los fármacos en orina (previo tratamiento con las enzimas beta-glucuronidasa y arilsulfatasas) y plasma de pacientes bajo terapéutica, y se evaluaron estrategias para su síntesis como patrón de referencia analítica.
Con las herramientas desarrolladas validadas y mediante estudio clínico protocolizado se evaluó la farmacocinética poblacional del BNZ en plasma de pacientes pediátricos con enfermedad de Chagas. El muestreo de pacientes tanto pediátricos como madres en lactancia se desarrolló en el Servicio de Parasitología y Chagas del Hospital de Niños “Ricardo Gutiérrez”.
Todos los estudios clínicos presentados en este trabajo se encuentran aprobados y/o conducidos mediante procedimientos establecidos por los entes competentes según corresponda:
• Comités de Ética y de Docencia e Investigación del Hospital de Niños “Ricardo Gutiérrez”.
• Administración Nacional de Medicamentos, Alimentos y Tecnologías Médicas (ANMAT).
• Normas tripartitas estandarizadas (ICH 6) para la buena práctica clínica (GCP), decreto 5330/97-ANMAT.
• El código de Nuremberg, la declaración de Helsinki, V enmienda (2000).
• Convención de los Derechos del Niño amparados por nuestra Constitución Nacional.
Instrumental
Para el desarrollo de los trabajos experimentales se utilizaron drogas sólidas, solventes orgánicos e inorgánicos y consumibles analíticos e instrumental de uso habitual en laboratorios en asociación con técnicas cromatográficas.
Los análisis de cromatografía líquida de alta performance fueron desarrollados mediante un equipo de HPLC Merck-Hitachi LC-6200A y un detector Merck- Hitachi UV/Vis L-4250 (Japón). La integración de áreas de los picos se analizó en una primera instancia mediante un equipo Merck-Hitachi D-2500 Chromato- Integrator y luego se trabajó con un adquisidor de datos electrónico WinPCChrom 30_ XYReal, mediante CPU. Los estudios de espectrometría de masa se efectuaron mediante HPLC-MS/MS en cromatógrafo líquido Agilent 1200 RRLC con un detector DAD en serie con un espectrómetro de alta resolución Bruker micrOTOF-QII con fuente de ionización electrospray (ESI). Se trabajó en modo positivo. Para MS se utilizó gas seco a una temperatura de 200 °C con un flujo de 7,0 L/min, con un nebulizador de gas a una presión de 3,5 Bar y un voltaje capilar de 150,0 V en modo full-scan en un rango de m/z de 50 a 800.
Resultados
Las cifras de mérito para los métodos desarrollados en BZN y NFX, los resultados analizados de muestras bajo tratamiento y los criterios clínicos que se debían abordar desde el laboratorio analítico, arrojaron resultados aceptables (Tabla I)(Tabla II).
Tabla I. Parámetros analizados en los métodos desarrollados para BZN.
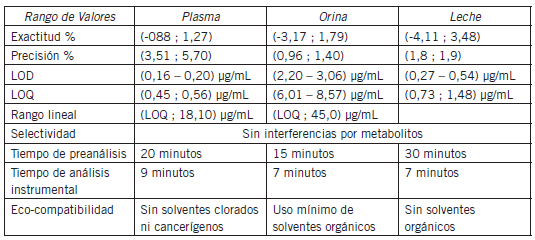
Tabla II. Parámetros analizados de los métodos desarrollados para NFX.
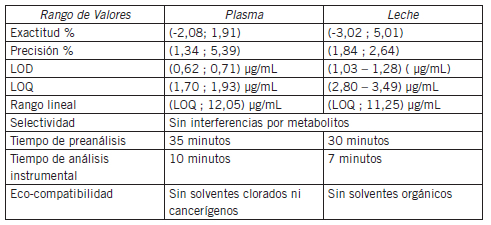
Las curvas de calibración realizadas fueron evaluadas en función de los siguientes criterios establecidos para su validación:
• Selectividad: ausencia de interferencia
• Sensibilidad: límite de detección y cuantificación <0,01 mg/mL (en función de datos bibliográficos de valores hallados en pacientes adultos: promedio de concentración para BZN en adultos: en torno a 0,01 mg/mL).
• Exactitud: coeficiente de variación (CV) <20% en cada punto del intervalo de trabajo.
• Precisión y reproducibilidad en curvas interdías: CV de la pendiente <5% para cada recta.
• Estabilidad de muestra control de calidad (QC): CV <5% luego de los distintos períodos de conservación en freezer.
Con las metodologías validadas (3) se cuantificó BZN en plasma pediátrico de 117 muestras pertenecientes a 38 pacientes. Las muestras correspondían a las distintas etapas del tratamiento (inicio, estado estacionario, después de la última dosis) según los criterios de selección de pacientes y obtención de muestras descriptos en el protocolo del estudio.
La concentración plasmática media de BZN hallada en niños fue de 4,53 mg/L (rango: 3,73–5,58 mg/L) que comparada con la media hallada en adultos (4) (10,96 mg/L, rango: 7,74–15,43 mg/L) fue significativamente más baja. Asimismo, dentro de la población pediátrica, se pudo observar que los niños menores de 7 años presentaron concentraciones plasmáticas más bajas (concentración media de 3,61 mg/L) comparada con niños mayores (concentración media de 6,88 mg/L), lo que implica que la eliminación de BNZ sería significativamente mayor en niños pequeños (5). Del análisis de perfiles cromatográficos de estas muestras se aislaron algunas de ellas para la búsqueda e identificación de metabolitos mediante HPLC-MS/MS.
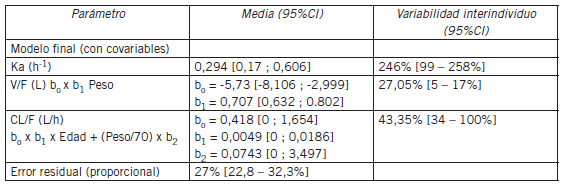
Los parámetros farmacocinéticos obtenidos para el modelo final, unicompartimental con covariables se presentan en la Tabla III.
Tabla III. Modelo unicompartimental con covariables: peso en el volumen, edad y peso en el clearence.
Mediante HPLC-MS/MS se identificaron posibles metabolitos del BZN en orina pediátrica que aportaron evidencias para avanzar en el conocimiento del metabolismo del BZN (6).
Las estructuras halladas en orina correspondían a los compuestos amino-BZN (propuesto en la literatura como un posible metabolito) (7) y N-hidroxiamino- BZN. Estos fueron hallados únicamente en los extractos de las orinas tratadas enzimáticamente (con β-glucuronidasa y arilsulfatasa), pero estuvieron ausentes en todos los extractos sin tratar de este estudio. Ensayos con estas enzimas podrían aportar información inicial respecto de la presencia de metabolitos de fase II del BZN en muestras de orina humanas. Ambas enzimas convierten metabolitos de fase II (xenobióticos conjugados con ácido glucurónico o sulfatos) nuevamente en sus respectivos metabolitos de fase I. En este sentido, la identificación de ambos compuestos únicamente en aquellos extractos que fueron tratados con alguna de estas dos enzimas, plantea la posibilidad de proponer que el N-hidroxiamino-BNZ y el amino-BNZ podrían ser eliminados en la orina de manera glucuronizada.
De los estudios por espectrometría de masa en muestras de plasma de pacientes pediátricos, dos especies pudieron ser detectadas e identificadas: BZN y N-bencilacetamida (NBAA). Los espectros de masas presentaron un ion molecular principal con un m/z de 261 coincidente con la estructura del BZN y el otro pico identificado como ion principal de m/z de 150 presentó un patrón de fragmentación compatible con los reportados en bibliografía (8). La formación de la NBAA se propone como producto de clivaje en el grupo alquilo del BZN (9).
En la Figura 1 se propone un flujo de reacciones desde el BNZ hasta la formación de estos compuestos presentados de manera esquemática. El BZN se reduce a N-hidroxiamino-BNZ para luego reducirse aún más formando el amino-BNZ, que luego mediante una ruta de clivaje podría formar el metabolito NBAA hallado en plasma.

Figura 1. Esquema del flujo de reacciones de la reducción del BNZ para dar N-hidroxiamino-BNZ, amino-BNZ y la obtención por clivaje de la N-bencilacetamida.
Evaluación de riesgo del lactante para BZN
Un total de 12 mujeres y sus respectivos bebés fueron enrolados en el estudio. La edad y el peso promedio para las madres fue de 27 años (con rango entre 20- 34 años) y 56 kg (con rango entre 45-110 kg) respectivamente. La edad promedio para los lactantes fue de 5,2 meses (con rango de 20 días a 13 meses) y un peso promedio de 7,35 kg (con rango de 4,4-10,2 kg). La dosis promedio materna de BZN fue de 5,65 mg/kg/ día (con rango de 3,6-6,6 mg/kg/día).
Las muestras de leche materna fueron tomadas en promedio a los 9 días de tratamiento (con rango de 6-34 días) por lo que se puede asumir que todas las pacientes se encontraban en un estado estacionario de la terapéutica.
La concentración plasmática de BZN promedio fue de 6,26 mg/L (6,26 μg/mL) (con rango de 0,3- 12,6 mg/L) y 3,8 mg/L (3,8 μg/mL) (rango de 0,3- 5,9 mg/L) en leche materna. La media del cociente entre la concentración de BZN en leche y en plasma fue de 0,52 (con rango de 0,3-2,79). Se halló una correlación positiva entre plasma BZN y leche BZN (Fig. 2).
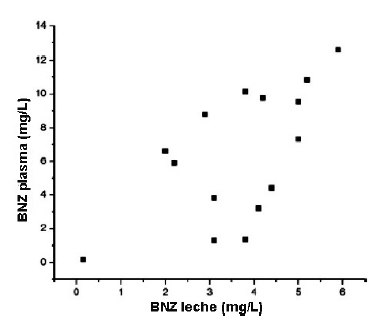
Figura 2. Correlación entre la concentración BZN en plasma vs. en leche materna.
Si se asume una toma de leche diaria de 150 mL/kg de peso/día y se multiplica la concentración puntual en leche se obtiene la dosis de BZN absoluta del lactante en mg/kg/día. La estimación de la dosis de BZN promedio recibida por los bebés a través de la leche sería de 0,65 mg/kg/día, valor que representa un promedio de la dosis relativa del lactante de 12,3% (con rango de 5,5%–17,0%) de la dosis diaria materna corregida por peso. El 45% de las madres tuvo reacciones adversas al medicamento, dos de ellas (18%) de carácter moderado, por lo que debieron discontinuar el tratamiento luego de 19 y 22 días. Una paciente tuvo reacciones adversas al medicamento de carácter severo luego de 26 días de tratamiento, por lo que también éste se suspendió. Luego de la hospitalización la paciente se recuperó completamente y su hijo no presentó señales de reacciones adversas en ningún momento. Estos fueron los únicos casos en los que la lactancia tuvo que ser discontinuada debido a la severidad de las reacciones maternas.
Discusión y Conclusiones
El desarrollo de técnicas de laboratorio que permitan el dosaje de fármacos en matrices como las expuestas aquí, permiten dotar de herramientas necesarias para el monitoreo terapéutico de estas drogas, evaluar nuevos marcadores farmacométricos tempranos de eventos adversos a la terapéutica, y finalmente son la base analítica necesaria para nuevos estudios clínicos.
En cuanto a los alcances farmacológicos, el estudio de la farmacocinética poblacional del BZN persigue mejorar los protocolos actualmente existentes para permitir un uso más seguro y racional de los fármacos en niños y eventualmente en adultos.
Respecto de los resultados encontrados en la leche materna para BZN, éstos habilitarían la farmacoterapia para Chagas en madres en etapa de amamantamiento, que al momento, por principio de precaución –ausencia de datos– se encuentra no indicada (fuera de prospecto). Al momento del cierre del trabajo de tesis, no se encontraba concluido un estudio análogo en leche materna para el NFX. Sin embargo, los dosajes realizados para este fármaco en leche materna fueron significativamente bajos y luego en trabajos propios posteriores se proponen resultados coincidentes para este fármaco respecto a lo concluido para el BZN.
Por otro lado, los metabolitos hallados en plasma y orina, si bien requieren confirmación y cuantificación en los distintos compartimentos orgánicos y la dilucidación de la ruta metabólica correspondiente, tienen un gran significado para la clínica y la farmacología del tratamiento de la enfermedad de Chagas. Efectivamente, es la primera vez que se identifican posibles metabolitos de la droga madre, a partir de estudios realizados en pacientes bajo terapéutica, reportados antes desde estudios con animales. Finalmente, es la primera vez que se propone la glucuronización como una ruta probable de metabolización del BNZ, para su eliminación por orina. En busca de corroborar estas afirmaciones, se pueden plantear estudios a futuro con el fin de buscar y/o detectar estos compuestos glucuronizados en muestras de orina de 24 h.
Es de suma importancia para las políticas de salud pública asociadas al monitoreo terapéutico de fármacos, el hecho de poder contar con personal técnico-profesional entrenado y capacitado para el dosaje en matrices biológicas de interés clínico y en el área pediátrica mediante técnicas por HPLC.
1. Marson ME. Herramientas farmacométricas para antichagásicos, aplicadas a estudios fármaco y toxicocinéticos en contexto pediátrico. [Tesis de Doctorado de la Facultad de Ciencias Exactas, Universidad Nacional de La Plata]; 2016. [ Links ]
2. Schofield CJ, Dias JCP. The Southern Cone programme against Chagas disease. Adv Parasitol 1999; 42: 1-25. [ Links ]
3. Marson ME, Dana DD, Altcheh J, García-Bournissen F, Mastrantonio G. Development of UV/HPLC methods for quantitative analysis of benznidazole in human plasma and urine for application in pediatric clinical studies. J Clin Lab Anal 2013; 27: 384–90.
4. Raaflaub J. Multiple-dose kinetics of the trypanosomicide benznidazole in man. Arzneimittelforschung 1980; 30: 2192–4.
5. Altcheh J, Moscatelli G, Mastrantonio G, Moroni S, Giglio N, Marson ME, et al. Population pharmacokinetic study of benznidazole in pediatric Chagas disease suggest efficacy despite lower plasma concentrations than in adults. PLoS Negl Trop Dis 2014; 8: e2907. [ Links ]
6. Marson ME, Moscatelli G, Moroni S, Altcheh J, García-Bournissen F, Mastrantonio GE. Presence of benznidazole conjugated metabolites in urine identified by β-glucuronidase treatment. Braz J Pharm Sci (aceptado para publicación en mayo de 2018).
7. Raauflaub J, Ziegler WH. Single-dose pharmacokinetics of the trypanomicide benznidazole in man. Arzneim Forsch Drug Res 1979; 29: 1611–4.
8. Gilbert JR, Potter E, Stace AJ. The mass spectrometric fragmentation of N-benzylacetamide. Organic Mass Spectrometry 1975; 10: 320. [ Links ]
9. Marson ME, Moscatelli GE, Moroni S, Altcheh J, García-Bournissen F, Mastrantonio GE. Identification of N-benzylacetamide as a major component of human plasmatic metabolic profiling of benznidazole. Eur J Drug Metab Pharmacokinet 2014; doi 10.1007/s13318-014- 0195-8. [ Links ]
Recibido: 21 de enero de 2019
Aceptado: 12 de marzo de 2019














