Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.2 La Plata jun. 2019
VIROLOGÍA
Síndrome cardiopulmonar por Hantavirus luego del brote de Epuyén, Argentina: la necesidad de investigar nuevas formas de intervención terapéutica
Carlos Marcelo Barclay1a
1 Médico Infectólogo.
a Sanatorio San Carlos. San Carlos de Bariloche, Río Negro, Argentina.
Resumen
Los Hantavirus son virus con ARN de cadena simple pertenecientes a la familia Bunyaviridae. A diferencia de otros virus de la familia, no tienen artrópodos como vectores; sus hospederos en la naturaleza son roedores y algunos mamíferos pequeños. La transmisión al hombre ocurre por la inhalación de excretas de los animales infectados, rara vez por mordeduras y se ha documentado la posibilidad de transmisión persona a persona. Existen dos formas clínicas de la enfermedad: fiebre hemorrágica con síndrome renal (FHSR) distribuida en Europa y Asia, y síndrome cardiopulmonar por Hantavirus (SCPH), en las Américas. El SCPH se presenta clinicamente en cuatro fases: incubación, prodrómica, cardiopulmonar y convalescencia. En el laboratorio es frecuente el hallazgo de trombocitopenia, junto con otros cambios hematológicos y bioquímicos. El diagnóstico se realiza por la detección de anticuerpos o PCR. Recientemente en Epuyén, Provincia de Chubut, Argentina, ocurrió un brote que afectó a 34 personas con 12 muertes asociado a la transmisión interpersonal. Se revisa la situación actual con respecto al tratamiento y las posibilidades futuras de intervención. Aunque se trate de una enfermedad con una baja prevalencia, la alta tasa de letalidad y el alto impacto emocional y económico que sufren las localidades afectadas hacen necesario seguir investigando la búsqueda de nuevas alternativas de tratamiento.
Palabras clave: Síndrome cardiopulmonar; Hantavirus; Epuyén.
Abstract
Cardiopulmonary syndrome due to Hantavirus after the outbreak in Epuyén, Argentina: the need to investigate new forms of therapeutic intervention
Hantaviruses are single-stranded RNA viruses that belong to the Bunyaviridae family. Unlike other viruses in the family, they do not have arthropods as vectors; their hosts in the wild are rodents and some small mammals. Human transmission takes place through inhalation of excreta from infected animals, rarely from bites, and the possibility of person-to-person transmission has been documented. There are two clinical forms of the disease: hemorrhagic fever with renal syndrome (HFRS) distributed in Europe and Asia, and cardiopulmonary Hantavirus syndrome (HCPS) distributed in the Americas. The HCPS presents clinically in four phases: incubation, prodromal, cardiopulmonary and convalescence. In the laboratory, a thrombocytopenia is common, together with other hematological and biochemical changes. Diagnosis is made through the detection of antibodies or PCR. Recently, in Epuyén, Province of Chubut, Argentina, an outbreak occurred, affecting 34 people with 12 deaths associated with interpersonal transmission. The current situation is reviewed with respect to the treatment and the future possibilities of intervention. Although it is a disease with a low prevalence, the high rate of lethality and the high emotional and economic impact suffered by the affected areas make it necessary to continue investigating in search of new treatment alternatives.
Keywords: Cardiopulmonary syndrome; Hantavirus; Epuyén.
Resumo
Síndrome cardiopulmonar por Hantavírus depois do surto de Epuyén, Argentina: a necessidade de investigar novas formas de intervenção terapêutica
Os Hantavírus são vírus RNA de cadeia simples pertencentes à família Bunyaviridae. Diferente de outros vírus da família, não têm artrópodes como vetores; seus anfitrões na natureza são roedores e alguns mamíferos pequenos. A transmissão para o homem acontece através da inalação de excrementos dos animais infectados, raras vezes por mordeduras e foi documentada a possibilidade de transmissão de pessoa para pessoa. Existem duas formas clínicas da doença: febre hemorrágica com síndrome renal (FHSR) distribuída na Europa e Ásia, e síndrome cardiopulmonar por Hantavírus (SCPH), nas Américas. O SCPH apresenta-se clinicamente em quatro fases: incubação, prodrômica, cardiopulmonar e convalescença. No laboratório é frequente o achado de trombocitopenia, junto a outras mudanças hematológicas e bioquímicas. O diagnóstico é realizado pela detecção de anticorpos ou PCR. Recentemente em Epuyén, Província de Chubut, Argentina, houve um surto que afetou 34 pessoas com 12 mortes associado à transmissão interpessoal. Revê-se a situação atual relativa ao tratamento e às possibilidades futuras de intervenção. Embora se trate de uma doença com uma baixa prevalência, a alta taxa de letalidade e o alto impacto emocional e econômico que sofrem as localidades afetadas tornam necessário continuar investigando em busca de novas alternativas de tratamento.
Palavras-chave: Síndrome cardiopulmonar; Hantavírus; Epuyén.
El virus y su epidemiología
Los Hantavirus son virus con ARN de cadena simple pertenecientes a la familia Bunyaviridae. Son virus esféricos de 80-100 nm con un genoma que consta de tres segmentos: S (codifica la proteína de la nucleocápside), M (codifica las glicoproteínas de la envoltura GN y GC) y L (codifica la polimerasa viral).
A diferencia de otros virus de la familia Bunyaviridae, no tienen artrópodos como vectores; sus hospederos en la naturaleza son roedores y algunos mamíferos pequeños y cada uno de los genotipos de Hantavirus se encuentra predominantemente asociado a una especie de roedor. Éstos cursan una infección crónica con alta tasa de replicación viral, a pesar de la presencia de anticuerpos neutralizantes, pero no tienen síntomas de la enfermedad. La población de roedores varía de acuerdo a factores climáticos, disponibilidad de alimento y otras condiciones. El aumento en la densidad de la población se ha asociado a un incremento en los casos humanos.
La transmisión ocurre por la inhalación de excretas de roedores infectados, rara vez por mordeduras y se ha documentado la posibilidad de transmisión persona a persona en el caso del virus Andes Sur en la región patagónica de la Argentina y Chile y por el virus Andes Buenos Aires, en la Provincia de Buenos Aires, Argentina (1-3).
Se conocen más de 40 especies de Hantavirus en el mundo, 22 de las cuales son consideradas patógenas para el hombre. Existen dos formas clínicas de la enfermedad: fiebre hemorrágica con síndrome renal (FHSR) o Hantavirus del ”Viejo Mundo” distribuida en Europa y Asia con una mortalidad promedio del 15%, y síndrome cardiopulmonar por Hantavirus (SCPH) del ”Nuevo Mundo”, en las Américas, con una mortalidad que oscila entre el 30 y el 40% (Fig. 1) (4).

Figura 1. Distribución mundial de la enfermedad por Hantavirus en casos/año (modificado de 4).
HCPS: fiebre hemorrágica con síndrome renal; HCPS: síndrome cardiopulmonar por Hantavirus.
Aunque existen reportes que son compatibles con la presencia de la enfermedad desde hace más de 100 años, el primer virus fue aislado en 1976 por Lee et al. en el ratón de campo Apodemus agrarius y lo denominó virus Hantaan identificado como uno de los responsables de fiebre hemorrágica con síndrome renal (5). La primera descripción del síndrome pulmonar se realizó en 1993 en el sudoeste de Estados Unidos (región de Four Corners), causado por el virus denominado Sin Nombre hospedado en el ratón Peromyscus maniculatus (6)(7). En Sudamérica fue reconocido por primera vez en 1995 en la Argentina; el agente responsable se identificó como virus Andes y el huésped natural como el ”ratón colilargo” Oligoryzomys longicaudatus (8)(9). Otros Hantavirus han sido reconocidos en América del Norte, América Central y Sudamérica.
Anualmente se reportan de 150.000 a 200.000 casos en el mundo; más del 70% corresponden a fiebre hemorrágica con síndrome renal y la mayoría se registran en China.
Como antecedente epidemiológico se rescata la exposición ocupacional como la más frecuente, seguida de la exposición recreacional y peridoméstica; el contagio interpersonal es generalmente el menos frecuente. Dos grandes brotes asociados al contagio persona a persona han sido descriptos en la Argentina: en 1996 (20 casos) en El Bolsón-San Carlos de Bariloche, Provincia de Río Negro y recientemente en 2018-2019 (34 casos) en Epuyén, Provincia de Chubut.
En la Argentina existe la circulación de dos especies virales, Andes y Laguna Negra, distribuidas predominantemente en cuatro zonas: noroeste (Salta, Jujuy y recientemente Tucumán) con el 48,7% de los casos asociados a los genotipos Andes-Orán, Andes-Bermejo y Laguna Negra, nordeste (Corrientes, Formosa y Misiones) con 0,4% de los casos, asociado a los genotipos Andes Juquitiba y Lechiguanas, zona central (Buenos Aires, Santa Fe y Entre Ríos) con 36,7% de los casos, donde circulan los genotipos Andes-Lechiguanas, Buenos Aires y Plata y en la zona patagónica (Neuquén, Río Negro y Chubut) con 14,1% y asociados al genotipo Andes-Sur. La gran mayoría de los casos está asociada al virus Andes y unos pocos casos son secundarios a Laguna Negra. Cada uno de los linajes tiene un hospedero diferente en la naturaleza (10)(11).
La patogenia de la enfermedad no es totalmente conocida. Su principal característica es el compromiso de la permeabilidad capilar a través de la interacción con β3-integrinas de diferentes endotelios de los órganos blanco involucrados en las dos formas clínicas (pulmón en el SCPH, riñón en el FHSR).
Presentación clínica
La enfermedad cardiopulmonar tiene cuatro fases (Fig. 2):
1. Período de incubación, que tiene una duración de 5-45 días y cursa en forma asintomática.
2. Fase prodrómica con una duración de 3-6 días y se caracteriza por la presencia de fiebre, decaimiento, artromialgias y, en 1/3 de los casos, síntomas gastrointestinales como náuseas, vómitos y dolor abdominal, que en ocasiones puede confundirse con otras etiologías de resolución quirúrgica.
3. Fase cardiopulmonar, cuyo comienzo está marcado por el inicio brusco de la hipoxemia y el shock.
4. Fase de convalecencia, en los sobrevivientes, que se caracteriza por la rápida mejoría de la hipoxemia y de la función hemodinámica y está acompañada de poliuria. Los pacientes que se recuperan suelen manifestar astenia que se puede prolongar por varias semanas.
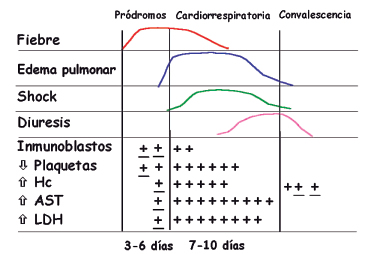
Figura 2. Fases del síndrome pulmonar por Hantavirus.
La ausencia de síntomas respiratorios altos como congestión nasal y rinorrea, otitis, amigdalitis purulenta, dolor torácico o tos son elementos de ayuda en el planteo de los diagnósticos diferenciales (12)(13).
La enfermedad debe ser sospechada en los pacientes con los síntomas descriptos y los factores de riesgo de exposición en zonas de riesgo.
Alteraciones que se observan en el laboratorio
Es frecuente la presencia de plaquetopenia o la caída brusca en su recuento en un intervalo corto, que suele registrarse en más del 80% de los pacientes durante la fase prodrómica. La mayoría de ellos tienen otras alteraciones hematológicas como la presencia de inmunoblastos, leucocitosis con neutrofilia y hematocrito elevado. En el período prodrómico tardío y en el comienzo de la fase cardiopulmonar se observa elevación de la LDH, transaminasas, CPK, creatinina, tiempo de protrombina, hipoalbuminemia, proteinuria y microhematuria. Algunos pacientes presentan los hallazgos clásicos asociados a coagulación intravascular diseminada.
Radiología
Desde el punto de vista radiológico, en la fase cardiopulmonar se observa la aparición de un infiltrado pulmonar bilateral de rápida progresión, similar a lo observado en el síndrome de distrés respiratorio del adulto. Otro elemento de ayuda en la diferenciación con otras etiologías es la ausencia de infiltrados alveolares lobares unilaterales.
¿Cómo se establece el diagnóstico?
La detección de anticuerpos IgM/IgG contra el antígeno de la nucleocápside es la herramienta diagnóstica tradicional. Se emplea ELISA, inmunofluorescencia indirecta o tiras de inmunoblot. La prueba empleada en la Argentina es el ELISA (14), que ha tenido una sensibilidad del 96,6% y una especificidad del 90,6%. La sensibilidad se acerca al 100% de los casos cuando se realiza en el período prodrómico tardío y en la fase cardiopulmonar; puede ser menor en los primeros días de la fase prodrómica en la que la ausencia de anticuerpos no descarta la enfermedad.
Otro método utilizado es la RT-PCR que no sólo permite la detección de ARN viral sino que también permite conocer el genotipo involucrado. Puede ser realizada tanto del suero como de la sangre completa, la que ofrece la ventaja de una detección más precoz. En un estudio realizado en Chile con el seguimiento prospectivo de contactos de casos infectados con virus Andes Sur, Ferres et al. (15) lograron detectar PCR positiva en muestras de sangre entera 5 a 15 días antes de la aparición de la sintomatología y de la aparición de anticuerpos en 6 personas seguidas prospectivamente desde el contacto con el caso índice. Se volverá a tocar este punto que es de crucial importancia al plantear nuevas estrategias de tratamiento.
En muestras de tejidos se ha empleado la inmunohistoquímica.
¿Qué sucedió en Epuyén, Provincia de Chubut, Argentina a finales de 2018 y comienzo de 2019?
El Laboratorio Nacional de Referencia de Hantavirus ANLIS Malbrán, de la República Argentina, el 19 de febrero de 2019 emitió un comunicado oficial, del cual se rescatan algunos de sus puntos más importantes (16):
- El brote, de magnitud sin precedentes, ha involucrado 34 casos con 12 personas fallecidas.
- La tasa de letalidad resultó casi el doble en mujeres que en hombres (40% contra 21,4%).
- En diciembre de 2018, con el objetivo de cortar la cadena de transmisión persona a persona, se impusieron aislamientos domiciliarios a aquellas personas que estuvieron en contacto con casos confirmados.
- El Laboratorio Nacional de Referencia para Hantavirus del ANLIS inició un estudio para confirmar el mecanismo de transmisión por secuenciación completa de los 3 segmentos (S, M y L) del genoma viral, utilizando tecnología de secuenciación de nueva generación.
- El genotipo viral causante fue Andes Sur.
- El porcentaje de identidad genética fue del 99,9%.
- Este hallazgo confirmó unívocamente el mecanismo de transmisión persona a persona.
- La cepa involucrada en el brote de Epuyén presentaba una mayor identidad nucleotídica con la cepa del brote del año 1996 de El Bolsón y Bariloche.
- En este análisis comparativo con otras cepas presentes en la región, han podido identificarse además, cambios “exclusivos” en el genoma viral de la cepa involucrada en este brote, que podrían conferirle un mayor potencial de dispersión.
¿Cuál es la situación actual en relación al tratamiento?
Hasta el momento actual no hay tratamiento específico con utilidad demostrada y todos los esfuerzos se han centrado en medidas de sostén del paciente hasta la salida de la fase cardiopulmonar.
Se han probado algunas estrategias específicas que no han dado resultados beneficiosos.
En 1999 Chapman et al. (17) en los EE.UU. probaron, en un estudio observacional, la eficacia de la ribavirina EV en 30 pacientes con infección confirmada, en la fase cardiopulmonar. La mortalidad en este grupo fue del 47%, similar a la de otros 34 pacientes que sufrieron la enfermedad en el mismo período no enrolados en el estudio.
En 2004, Mertz et al. (18) publicaron los resultados de un estudio prospectivo, doble ciego con el uso de ribavirina EV versus placebo. No hubo diferencias estadísticamente significativas en la mortalidad entre los pacientes que recibieron ribavirina y los que recibieron placebo. Este estudio presentó varias dificultades, lograron reclutar pocos pacientes, 10 en el grupo tratado y 13 en el placebo y el tiempo medio transcurrido entre el inicio del tratamiento y la muerte o el ingreso a ECMO (extracorporeal membrane oxygenation) fue sólo de 4 h lo que evidenció que la ribavirina en la fase cardiopulmonar de la enfermedad no es efectiva.
Vial et al. (19) realizaron en Chile un nuevo proyecto de investigación con el objetivo de probar la acción de un tratamiento con corticoides en pacientes con SCPH. Desarrollaron un estudio prospectivo, aleatorizado, doble ciego en el que se comparó la eficacia de la metilprednisolona versus placebo. Los resultados se publicaron en 2013. No hubo diferencias en la evolución de la enfermedad ni en la tasa de mortalidad entre los dos grupos.
Se sabe que tanto la ribavirina, un antiviral de amplio espectro con actividad in vitro frente a Hantavirus, empleada en pacientes con enfermedad avanzada, como el intento de modular la respuesta inflamatoria con corticoides, no han sido eficaces y, por lo tanto, no están indicados en la actualidad.
Sin embargo, hubo otras investigaciones con resultados prometedores. En 2015 se conocieron los datos de una nueva estrategia de tratamiento con el empleo de suero de convalecientes en 29 pacientes con SCPH en Chile (20). Consistió en un estudio multicéntrico no aleatorizado que comparaba el impacto del uso de este tipo de terapia inmune contra el tratamiento de sostén habitual utilizado en 3 grupos: los pacientes internados en todo el país en el mismo período (2008-2012), en los mismos sitios en los que se realizó el estudio (2005- 2012) y con el grupo histórico del trabajo con metilprednisolona. La mortalidad fue del 14% en los tratados y del 32% en la población no tratada en ese período con una p de 0,049, en el límite de la significación estadística. No hubo diferencias con los otros dos grupos de comparación.
La experiencia con ECMO del grupo de la Universidad de Nuevo México fue publicado por Crowley en 2011 (21). Estos autores incorporaron 51 pacientes con SCPH refractarios al tratamiento habitual, definidos por varios parámetros que se asocian habitualmente a un 100% de mortalidad. En estos casos lograron resultados sorprendentes, con un 66,6% de sobrevida y si se desdoblan los resultados obtenidos en dos períodos de tiempo diferentes, la sobrevida en el período más reciente fue de 20/25 casos (80%). El procedimiento se realiza en la actualidad en otros centros de alta complejidad. En países como Chile, con una problemática similar, se ha organizado una red nacional de derivación de los pacientes a centros que cuenten con esta metodología de tratamiento.
¿Existen otras formas posibles de intervención terapéutica?
Como ya se ha descripto previamente, se sabe que las personas infectadas que cursan el período de incubación tienen RT-PCR postiva en sangre entre 5 y 15 días antes del comienzo de la sintomatología. ¿Podría la ribavirina ser efectiva en esta etapa? Dos grupos de trabajo han investigado esta hipótesis en el modelo animal del hamster sirio en el que la enfermedad tiene muchas similitudes con lo que sucede en el humano. En ambos casos se demostró que el antiviral administrado precozmente, antes de la aparición de la sintomatología, tuvo un impacto muy significativo sobre la mortalidad. Con la dosis adecuada y hasta un tiempo posterior a la inoculación del virus por via intraperitoneal o intranasal, la ribavirina logró bajar la mortalidad a cero (22)(23).
Resultados similares se obtuvieron empleando anticuerpos policlonales transcromosómicos y monoclonales (24).
Estos dos tipos de estrategias podrían ser utilizadas en contactos de alto riesgo y en situaciones de coexposición.
En la medida en que se avance en el conocimiento de la patogenia de la enfermedad es posible que se puedan desarrollar otros tipos de tratamientos más selectivos dirigidos a diferentes sitios blanco involucrados en el desarrollo de la misma.
Conclusiones
El SCPH es una enfermedad con una alta tasa de letalidad y una baja prevalencia que se presenta en forma endémica en gran parte del territorio americano y está asociada al contagio por el contacto con el hábitat del roedor y la inhalación de sus excretas. No obstante, también se ha presentado en algunas zonas de la Argentina y Chile, en forma de ”brotes” y asociada al contagio interhumano por parte de algunos genotipos. Estas situaciones generan un gran impacto en la comunidad desde el punto de vista humano y económico.
Tal como se ha descripto, es probable que no haya una sola estrategia de tratamiento válida para todas las fases de la enfermedad. Es necesario encontrar la herramienta más adecuada para cada etapa de la misma (Tabla I). Algunos de los estudios mencionados abren una luz de esperanza para el manejo de los casos futuros. Se necesita seguir investigando para dar respuesta a estos interrogantes.
Tabla I. Síndrome cardiopulmonar por Hantavirus. Estrategias terapéuticas a investigar de acuerdo al estadio evolutivo.

Conflicto de intereses
El autor declara no tener conflictos de intereses respecto de este trabajo.
Referencias bibliográficas
1. Padula PJ, Edelstein A, Miguel SD, López NM, Rossi CM, Rabinovich RD. Hantavirus pulmonary syndrome outbreak in Argentina: molecular evidence for person-to-person transmission of Andes virus. Virology 1998; 241: 323-30. [ Links ]
2. Martínez VP, Bellomo C, San Juan J, Pinna D, Forlenza R, Elder M, et al. Person-to-person transmission of Andes virus. Emerg Infect Dis 2005; 11: 1848-53. [ Links ]
3. Martínez-Valdebenito C, Calvo M, Vial C, Mansilla R, Marco C, Palma RE, et al. Person-to-person household and nosocomial transmission of Andes hantavirus, Southern Chile. Emerg Infect Dis; 2011; 20: 1629-36. [ Links ]
4. Jiang H, Zheng X, Wang L, Du H, Wang P, Bai X. Hantavirus infection: a global zoonotic challenge. Virol Sin 2017; 32: 32-43. [ Links ]
5. Lee HW, Lee PW, Johnson KM. Isolation of the etiologic agent of Korean hemorrhagic fever. J Infect Dis 1978; 137: 298–308.
6. Nichol ST, Spiropoulou CF, Morzunov S, Rollin PE, Ksiazek TG, Feldmann H, et al. Genetic identification of a hantavirus associated with an outbreak of acute respiratory illness. Science 1993; 262: 914–7.
7. Ksiazek TG, Peters CJ, Rollin PE, Zaki S, Nichol S, Spiropoulou C, et al. Identification of a new North American hantavirus that causes acute pulmonary insufficiency. Am J Trop Med Hyg 1995; 52: 117–23.
8. López N, Padula P, Rossi C, Lázaro ME, Franze-Fernández MT. Genetic identification of a new hantavirus causing severe pulmonary syndrome in Argentina. Virology 1996; 220: 223-6. [ Links ]
9. López N, Padula P, Rossi C, Miguel S, Edelstein A, Ramírez E, et al. Genetic characterization and phylogeny of Andes virus and variants from Argentina and Chile. Virus Res 1997; 50: 77-84. [ Links ]
10. MartÍnez VP, Bellomo CM, Cacace ML, Suárez P, Bogni L, Padula PJ. Hantavirus pulmonary syndrome in Argentina, 1995-2008. Emerg Infect Dis 2010; 16: 1853-60. [ Links ]
11. Alonso DO, Iglesias A, Coelho R, Periolo N, Bruno A, Córdoba MT, et al. Epidemiological description, case-fatality rate, and trends of Hantavirus pulmonary syndrome: 9 years of surveillance in Argentina. J Med Virol 2019; 91: 1173-81. [ Links ]
12. Duchin JS, Koster FT, Peters CJ, Simpson GL, Tempest B, Zaki SR, et al. Hantavirus pulmonary syndrome: a clinical description of 17 patients with a newly recognized disease. The Hantavirus Study Group. N Engl J Med 1994; 330: 949–55.
13. Lazaro ME, Resa AJ, Barclay C, Calanni L, Samengo L, Martínez L, et al. Síndrome pulmonar por Hantavirus en el sur andino argentino. Medicina (B Aires) 2000; 60: 289–301.
14. Padula PJ, Rossi CM, Della Valle MO, Martínez PV, Colavecchia SB, Edelstein A, et al. Development and evaluation of a solid-phase enzyme immunoassay based on Andes hantavirus recombinant nucleoprotein. J Med Microbiol 2000; 49: 149-55. [ Links ]
15. Ferres M, Vial P, Marco C, Yañez L, Godoy P, Castillo C, et al. Prospective evaluation of household contacts of persons with hantavirus cardiopulmonary syndrome in Chile. J Infect Dis 2007; 195: 1563-71. [ Links ]
16. Ministerio de Salud y Desarrollo Social. https://www.argentina.gob.ar/noticias/anlis-confirma-la-transmision-persona-persona-en-el-brote-de-hantavirus-de-epuyen. Fecha de acceso: 19 de febrero de 2019. [ Links ]
17. Chapman LE, Mertz GJ, Peters CJ, Jolson HM, Khan AS, Ksiazek TG, et al. Intravenous ribavirin for hantavirus pulmonary syndrome: safety and tolerance during 1 year of open-label experience. Ribavirin Study Group. Antivir Ther 1999; 4: 211-9. [ Links ]
18. Mertz GJ, Miedzinski L, Goade D, Pavia AT, Hjelle B, Hansbarger CO, et al. Placebo-controlled, double-blind trial of intravenous ribavirin for the treatment of hantavirus cardiopulmonary syndrome in North America. Clin Infect Dis 2004; 39: 1307–13.
19. Vial PA, Valdivieso F, Ferres M, Riquelme R, Rioseco ML, Calvo M, et al. High-dose intravenous methylprednisolone for hantavirus cardiopulmonary syndrome in Chile: a double-blind, randomized controlled clinical trial. Clin Infect Dis 2013; 57: 943–51.
20. Vial PA, Valdivieso F, Calvo M, Rioseco ML, Riquelme R, Araneda A, et al. A non-randomized multicentre trial of human immune plasma for treatment of hantavirus cardiopulmonary syndrome caused by Andes virus. Antivir Ther 2015; 20: 377-86. [ Links ]
21. Wernly JA, Dietl CA, Tabe CE, Pett SB, Crandall C, Milligan K, et al. Extracorporeal membrane oxygenation support improves survival of patients with Hantavirus cardiopulmonary syndrome refractory to medical treatment. Eur J Cardiothorac Surg 2011; 40: 1334–40.
22. Ogg M, Jonsson CB, Camp JV, Hooper JW. Ribavirin protects Syrian hamsters against lethal hantavirus pulmonary syndrome after intranasal exposure to Andes virus. Viruses 2013; 5: 2704–20.
23. Safronetz D, Haddock E, Feldmann F, Ebihara H, Feldmann H. In vitro and in vivo activity of ribavirin against Andes virus infection. PLoS One 2011; 6: e23560. [ Links ]
24. Hooper JW, Brocato RL, Kwilas SA, Hammerbeck CD, Josleyn MD, Royals M, et al. DNA vaccine-derived human IgG produced in transchromosomal bovines protect in lethal models of hantavirus pulmonary syndrome. Sci Transl Med 2014; 6: 264ra162 [ Links ]
Recibido: 2 de junio de 2019
Aprobado: 7 de junio de 2019














