Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.3 La Plata Sept. 2019
MICROBIOLOGÍA
Caracterización fenotípica de variantes pequeñas de Staphylococcus aureus: un nuevo desafío
Sabina Lissarrague1, Judith Bernstein2, Juan Pablo Stagnaro3, Celia Schell1, Alejandra Córdoba4, Nora Molina5, Verónica Vila Roza6, Juan Ángel Basualdo Farjat2, Mónica Sparo7*
1 Bioquímica.
2 Dr./a. en Medicina.
3 Médico. Especialista en Infectología.
4 Dra. en Ciencias Médicas.
5 Bioquímica. Msc. en Ciencias del Laboratorio Clínico (UNLP).
6 Bacterióloga Clínica e Industrial.
7 Bioquímica. Dra. de la Universidad de Buenos Aires.
Cátedra de Microbiología y Parasitología (CUDEMyP), Facultad de Ciencias Médicas, UNLP, sede Tandil - Hospital Municipal Ramón Santamarina. Calle Paz 1400 (CP 7000), Ciudad de Tandil, Provincia de Bs. As., República Argentina.
* Autor para correspondencia.
Correspondencia Dra. MÓNICA SPARO Cátedra de Microbiología y Parasitología (CUDEMyP) Facultad de Ciencias Médicas, UNLP, sede Tandil, Hospital Municipal Ramón Santamarina Calle Paz 1400 (CP 7000), Ciudad de TANDIL, Provincia de Bs. As. Correo electrónico: monicasparo@gmail.com
Resumen
En infecciones crónicas y recurrentes por Staphylococcus aureus se han descripto subpoblaciones de colonias pequeñas (VCPSa). El objetivo de este trabajo fue reconocer las características fenotípicas de VCPSa para optimizar su detección y caracterización a partir de materiales clínicos provenientes de infecciones crónicas. Se analizaron n=3 VCPSa de pacientes adultos con infecciones crónicas de tejidos blandos. Las muestras se inocularon en agar nutritivo, agar sangre, agar chocolate y agar Schaedler suplementado. Se realizaron tinción de Gram, catalasa, coagulasa libre, pruebas de dependencia para hemina, menadiona y timidina y, desarrollo/ataque del manitol en agar manitol salado. La sensibilidad antibiótica se efectuó en agar Mueller Hinton suplementado, según las pruebas de dependencia. Se investigó la presencia de proteína ligadora de penicilina anómala (PBP2´) por aglutinación con látex. Las VCPSa se detectaron en los medios de cultivo enriquecidos. Estas bacterias dieron positivas las pruebas de catalasa y coagulasa, y eran dependientes de menadiona y hemina. En los tres aislamientos se observó resistencia a cefoxitina y se detectó la PBP2´.
Palabras clave: Staphylococcus aureus; Variante colonias pequeñas; Infecciones crónicas de tejidos blandos; Caracterización fenotípica.
Abstract
Phenotypic characterization of small colony variants of Staphylococcus aureus: a new challenge
In chronic and recurrent infections, small colonies of Staphylococcus aureus subpopulations (SCVSa) have been observed. The objective of the present study was to recognize the phenotypic characteristics of SCVSa isolated from patients with chronic infections to optimize their detection. SCVSa of adult patients n=3 with chronic soft tissue infections were analyzed. Samples were inoculated on nutritive agar, blood-agar, chocolate agar and supplemented Schaedler agar. Subsequently, Gram stain, catalase, free coagulase, dependence tests for hemin, menadione and thymidine, and growth/fermentation of mannitol on salt mannitol agar were performed. Antibiotic susceptibility tests were performed by the agar diffusion method on supplemented Mueller Hinton agar, according to dependence assays results. Anomalous penicillin binding protein (PBP2’) was investigated by latex agglutination. SCVSa were detected in all enriched culture media. They showed catalase and coagulase activities, and menadione and hemin dependence. By the agar diffusion test, cefoxitin resistance was found in all isolates; PBP2’ was detected as well.
Keywords: Staphylococcus aureus; Small colony variants; Chronic soft tissue infections; Phenotypic characterization.
Resumo
Caracterizaçao fenotípica de pequenas variantes de Staphylococcus aureus: um novo desafio
Nas infecções crônicas e recorrentes por Staphylococcus aureus, subpopulações de pequenas colônias (VCPSa) foram descritas. O objetivo desse trabalho foi reconhecer as características fenotípicas de VCPSa para otimizar sua detecção e caracterização a partir de materiais clínicos provenientes de infecções crônicas. Foram analisados n=3 VCPSa de pacientes adultos com infecções crônicas de tecidos moles. As amostras foram inoculadas em agar nutritivo, agar sangue; agar chocolate e agar Schaedler enriquecido. Foram realizados testes de coloração de Gram, catalase, coagulase livre, testes de dependência para hemina, menadiona e timidina, e desenvolvimento/fermentação do manitol em agar manitol salgado. A sensibilidade antibiótica foi realizada em agar Mueller Hinton suplementado, de acordo com os testes de dependência. Foi investigada a presença de proteína ligante de penicilina anômala (PBP2´) por aglutinação com látex. Os VCPSa foram detectados em meios de cultura enriquecidos. Estas bactérias deram positivas nos testes de catalase e coagulase positivos e eram dependentes de menadiona e hemina. A resistência à cefoxitina foi detectada nos três isolados e detectou-se a PBP2’.
Palavras-chave: Staphylococcus aureus; Variante colônias pequenas; Infecções crônicas de tecidos moles; Caracterização fenotípica.
Introducción
Staphylococcus aureus es una bacteria gram positiva que coloniza la piel y mucosas del hombre y que puede ocasionar infecciones de la comunidad y asociadas a los cuidados de la salud. El espectro de patologías que puede producir abarca desde infecciones agudas localizadas leves hasta enfermedades con elevada morbi-mortalidad, como son neumonía, osteomielitis y endocarditis. Cuando S. aureus es agente causal de infecciones crónicas y recurrentes, han sido descriptas subpoblaciones visualizadas en los medios de aislamiento como colonias pequeñas (variantes colonias pequeñas, VCPSa) y que se pueden originar por mutación espontánea o pueden estar inducidas por la presencia de antibióticos. Las mutaciones suceden en genes implicados en la biosíntesis de menadiona, hemina o timidina, sustratos involucrados en la cadena transportadora de electrones y en la síntesis de ADN. Esta anomalía tiene como consecuencia una producción disminuida de ATP. Las VCPSa presentan crecimiento lento con rasgos distintivos fenotípicos y patogénicos (1-4).
El grupo con riesgo para adquirir infecciones con VCPSa está integrado por pacientes con terapia antimicrobiana prolongada como los que padecen fibrosis quística, infecciones osteoarticulares crónicas e infecciones originadas por la introducción de dispositivos médicos permanentes como marcapasos (5-7).
El lento y deficiente crecimiento in vitro de las VCPSa representa un desafío para el laboratorio de Microbiología Clínica, ya sea para su aislamiento inicial y caracterización fenotípica de especie como para la realización de las pruebas de sensibilidad a los antimicrobianos. Un problema particular para la terapia antimicrobiana es la combinación del fenotipo VCPSa y la resistencia a la meticilina (8). El objetivo de este trabajo fue reconocer las características fenotípicas de VCPSa para optimizar su detección y caracterización a partir de materiales clínicos provenientes de infecciones crónicas.
Materiales y Métodos
Características de los pacientes y muestras clínicas
Se analizaron tres aislamientos significativos provenientes de muestras clínicas obtenidas durante dos años, del 1 de julio de 2016 al 30 de junio de 2018, de pacientes adultos atendidos en el Hospital Ramón Santamarina de la Ciudad de Tandil (Provincia de Buenos Aires). Todos los pacientes fueron de género masculino, mayores de 65 años, con infecciones crónicas de tejidos blandos y habían recibido terapia antimicrobiana previa prolongada. Todos presentaron enfermedades de base: dos pacientes con diabetes tipo I y uno con insuficiencia renal crónica.
Muestras clínicas: Un absceso en tejido blando adyacente a prótesis de rodilla izquierda (HRS16341); un absceso en tejido blando adyacente a prótesis de cadera derecha (HRS17352), y una colección en tejido subcutáneo adyacente a marcapasos (HRS18378).
Aislamiento y caracterización fenotípica de VCPSa
Para la detección de VCPSa las muestras se inocularon en agar nutritivo, agar base Columbia sangre de carnero al 5% y agar chocolate. Los cultivos se incubaron 96 h a 35 ºC±2 ºC en atmósfera ordinaria y enriquecida con 5% de CO2 con observación diaria. Además, las muestras se inocularon en agar Schaedler (Biokar Diagnostics) con 0,1% de vitamina K1 y 5% de sangre de carnero desfibrinada y fueron incubadas en microaerobiosis.
Para la caracterización fenotípica de los aislamientos compatibles con VCPSa se efectuó: tinción de Gram, prueba de catalasa (H2O2 al 3%), coagulasa libre en tubo (plasma de conejo estéril con EDTA) con lectura a las 2 h, 24 h, 48 h, 72 h y desarrollo y ataque al manitol en agar manitol salado (Laboratorios Britania, Buenos Aires, Argentina). De forma simultánea se realizó la caracterización de género y especie mediante el sistema automatizado VITEK Compact 2 (bioMèrieux®, Argentina). Se consideraron a las colonias como puntiformes cuando su diámetro fue diez veces menor (≤0,5 mm) que el fenotipo normal de la bacteria.
Auxotrofia para hemina, menadiona y timidina
Para los ensayos de dependencia se utilizó agar Mueller Hinton (MH) suplementado con timidina (MHT, 5 μg/mL), menadiona (MHM, 1 μg/mL) y con hemina (MHH, 1 μg/mL), de acuerdo a Precit et al. (9). Además, se utilizaron combinaciones de suplementos (MHMH, MHMT, MHTH). Los medios se incubaron en atmósfera ordinaria a 35±2 °C durante 24 h y se reincubaron hasta 72 h en caso de resultado negativo. Un aislamiento fue considerado dependiente cuando creció en el medio MH suplementado con el correspondiente sustrato y no en agar MH sin suplemento.
Sensibilidad antimicrobiana
La sensibilidad antimicrobiana fue estudiada mediante el sistema VITEK (panel GP, bioMèrieux®, Argentina) y por difusión con discos (Laboratorios Britania, Buenos Aires, Argentina) en medio MH suplementado, según el resultado de las pruebas de dependencia. Se ensayaron los discos de cefoxitina (30 μg), eritromicina (15 μg), clindamicina (2 μg), linezolid (30 μg), ciprofloxacina (5 μg), minociclina (30 μg), gentamicina (10 μg), trimetoprima-sulfametoxazol (1,25/23,75 μg) y rifampicina (5 μg), de acuerdo a las recomendaciones del CLSI (10).
Como complemento para la búsqueda de resistencia a meticilina, en los tres aislamientos se investigó la presencia de la proteína ligadora de penicilina anómala (PBP2´) mediante aglutinación con látex (Oxoid) con un inóculo bacteriano equivalente al tubo Nro. 2 de la escala de McFarland (6 x 108 UFC/mL), siguiendo posteriormente las instrucciones del fabricante.
Para el control de calidad de todos los ensayos fenotípicos se utilizó la cepa S. aureus ATCC 25923.
Aspectos éticos
Los aislamientos bacterianos analizados provinieron de muestras clínicas utilizadas para el diagnóstico microbiológico de infecciones de tejidos blandos. Fueron manipulados en forma anónima, asegurando la absoluta confidencialidad de la información obtenida y a los únicos fines de la presente investigación, de acuerdo a la Ley de Protección de Datos Personales Nº 25.326, art. 11, inciso 3, punto d, en línea con la Declaración de Helsinki.
Resultados
Las VCPSa se detectaron como pequeñas colonias puntiformes (≤0,5 mm) blancas en agar sangre y agar chocolate, en atmósfera ordinaria o enriquecida con CO2 al 5%, a partir de las 48 h de incubación. No se obtuvo desarrollo en agar nutritivo y agar MH. Las colonias incubadas con atmósfera enriquecida con CO2 no tuvieron mayor tamaño que las que desarrollaron en atmósfera ordinaria. Ninguno de los aislamientos presentó hemólisis ni pigmento. En los tres aislamientos la inoculación en agar Schaedler suplementado permitió restaurar el fenotipo normal de S. aureus. Cuando se realizó la coloración de Gram de las colonias desarrolladas en todos los medios de aislamiento enriquecidos se observaron cocos gram positivos compatibles con Staphylococcus spp.
En relación a su caracterización fenotípica, no se obtuvo desarrollo en agar manitol salado en los tres aislamientos. La catalasa fue positiva débil y la prueba de coagulasa libre dio positiva en todos los aislamientos de forma retardada, entre las 48-72 h de incubación (Tabla I).
Tabla I. Características fenotípicas de los aislamientos de VCPSa.

Todos los aislamientos fueron dependientes de menadiona y hemina (Fig. 1); no se observó dependencia de timidina. El desarrollo en agar MHMH se detectó a partir de las 24 h de incubación con recuperación del fenotipo normal de S. aureus (Tabla I).
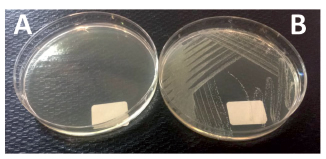
Figura 1. Ensayos de dependencia.
A: MH sin suplementar. B: MH suplementado con menadiona y hemina (MHMH), luego de 24 h de incubación en atmósfera ordinaria.
Las lecturas de los resultados utilizando el sistema VITEK (tarjetas GP) fueron las siguientes: HRS16341 y HRS18378, Kocuria kristinae y HRS17352, sin identificación.
Sensibilidad a los antibióticos
Mediante el método de difusión en agar MHMH los tres aislamientos resultaron resistentes a gentamicina y cefoxitina. En uno de ellos (HRS18378), además, se observó resistencia a ciprofloxacina. Se detectó la PBP2’ en los tres aislamientos. El sistema VITEK informó a los tres aislamientos como sensibles a todos los antimicrobianos ensayados, interpretándolos como S. aureus sensibles a meticilina.
Discusión y Conclusiones
En esta investigación se han descripto las características fenotípicas de tres VCPSa aisladas de infecciones crónicas de piel y partes blandas. Este fenotipo ha sido observado por otros autores en infecciones respiratorias provenientes de pacientes con fibrosis quística, infecciones osteoarticulares y otras relacionadas con dispositivos médicos permanentes (5)(8)(11).
En los pacientes del presente estudio el único fenotipo presente en el cultivo inicial fue VCPSa. Sin embargo se ha descripto que las VCPSa en ocasiones pueden coexistir con S. aureus de apariencia normal. La utilización de medios suplementados y la incubación prolongada son fundamentales para su detección (2).
En el presente estudio todos los pacientes con VCPSa habían recibido gentamicina (local en la prótesis o sistémica) de forma prolongada y presentaron dependencia de menadiona y hemina. Kahl (12) observó que la exposición continua a los aminoglucósidos favorece la selección de VCPSa dependientes de hemina y menadiona; la disminución en el potencial transmembrana observado en estas bacterias afecta la actividad de los aminoglucósidos (11). Este evento es más frecuente en pacientes con infecciones de piel y tejidos blandos. La reversión obtenida en los tres aislamientos con el agregado de suplementos, menadiona y hemina, concuerda con lo que ha sido descripto en la literatura (6)(12)(13). Proctor et al (2) postularon que se originan a través de mutaciones en los genes menD y hemB que bloquean la síntesis de menaquinona, menadiona y hemina.
En esta investigación se comprobó que un medio indefinido, nutricionalmente rico, como el agar Schaedler suplementado, fue adecuado para restaurar el fenotipo normal de S. aureus, probablemente porque es una fuente de precursores metabólicos para la población de VCPSa. Este hecho también fue observado por otros autores (5)(14). Sin embargo, Delgado-Valverde et al. (15) con aislamientos de VCPSa dependientes de timidina, provenientes de pacientes con fibrosis quística no observaron la reversión fenotípica.
Es importante destacar que también han sido descriptos aislamientos de VCPSa que solamente eran dependientes de CO2. Estos fenotipos pueden revertir a uno normal cuando se incuban en atmósfera con CO2 (16). No ha sido el caso de los aislamientos de este trabajo de investigación.
De acuerdo a la apariencia de las colonias de la VCPSa en los medios enriquecidos (agar sangre, agar chocolate) se pudieron caracterizar inicialmente como corinebacterias comensales o estreptococos no hemolíticos. La coloración de Gram habilitó la presunción de pertenencia al género Staphylococcus. Además, la prueba de catalasa positiva permitió diferenciar inicialmente VCPSa de Enterococcus spp. y Streptococcus spp., que son catalasa negativos.
Las características de desarrollo, con colonias pequeñas no hemolíticas y no pigmentadas, así como la producción lenta de coagulasa y la ausencia de ataque al manitol observados en este trabajo están en línea con lo encontrado por otros autores (6). La ausencia de hemólisis y la reacción de coagulasa lenta pueden estar relacionadas en parte con la disminución de la biosíntesis de aminoácidos y son las responsables de la identificación errónea como estafilococo coagulasa negativo (17)(18).
En esta investigación el sistema VITEK falló en la identificación y resistencia antimicrobiana en todos los aislamientos. Otros autores también han encontrado que los sistemas de identificación automáticos a menudo no logran caracterizar las VCPSa a nivel de género y especie. El lento desarrollo y su actividad bioquímica reducida podrían ser la causa del error. También se ha resaltado la falla en la determinación de la resistencia antimicrobiana de los sistemas automáticos (15) (19).
Kipp et al. (20) demostraron que los métodos de difusión y de microdilución pueden dar resultados de falsa sensibilidad a meticilina; la búsqueda de la proteína PBP2´ resultó un método confiable para su pesquisa. En este trabajo de investigación la resistencia a meticilina con la utilización de medio suplementado (MHMH) coincidió con la presencia de la PBP2´. Delgado-Valverde et al. (15) y Precit et al. (9) también comprobaron la utilidad del medio MH suplementado para las pruebas de sensibilidad antimicrobiana.
Las VCPSa son más resistentes a algunos grupos de antibióticos que la cepa salvaje, como es el caso de los aminoglucósidos (9)(21)(22). Además, su lento crecimiento reduce la efectividad de los antibióticos β-lactámicos, con actividad sobre la pared celular en fase logarítmica de crecimiento (23).
En la actualidad hay evidencias que demuestran que S. aureus, y en especial las VCPSa, pueden persistir intracelularmente en el huésped por décadas (18). Esto modifica el concepto de S. aureus como un patógeno extracelular a uno con posibilidad de persistencia intracelular (24).
Finalmente, el tiempo de generación de VCPSa es de seis a nueve veces más prolongado que el de los fenotipos normales de S. aureus, lo que resulta en pequeñas colonias que con frecuencia no son visibles antes de 48 a 72 h de incubación. La utilización de agar Schaedler suplementado es una herramienta útil para su pesquisa. En consecuencia, el aislamiento, la identificación bioquímica y las pruebas de sensibilidad antimicrobiana representan un desafío para el laboratorio de Microbiología Clínica ya que puede ocurrir una subestimación en su diagnóstico y por lo tanto contribuir así a la falla terapéutica.
Financiamiento de la investigación
El presente trabajo de investigación ha sido realizado en el marco del proyecto acreditado Código M201, del Programa de incentivos Docentes-Investigadores SECyT-UNLP.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
1. Proctor RA, Bates DM, McNamara PJ. Emerging Infections 5. En: Scheld W, Craig W, Hughes J, editors. Electron transport deficient Staphylococcus aureus small-colony variants as emerging pathogens. Washington: ASM Press; 2001. p. 95-110. [ Links ]
2. Proctor RA, Von Eiff C, Kall BC, Becker K, Mcnamara P, Herrmann M, et al. Small colony variants: a pathogenic form of bacteria that facilitates persistent and recurrent infections. Nature Rev Microbiol 2006; 4: 295–305.
3. Chatterjee I, Kriegeskorte A, Fischer A, Deiwick S, Theimann N, Proctor RA, et al. In vivo mutations of thymidylate synthase (encoded by thyA) are responsible for thymidine dependency in clinical small-colony variants of Staphylococcus aureus. J Bacteriol 2008; 190: 834–42.
4. Lånnergard J, Von Eiff C, Sander G, Cordes T, Seggewiss J, Hughes D, et al. Identification of the genetic basis for clinical menadione-auxotrophic small-colony variant isolates of S. aureus. Antimicrob Agents Chemother 2008; 52: 4017–22.
5. Kahl B, Hermann M, Everding AS, Kroch HG, Becker K, Proctor RA, et al. Persistent infection with small colony variants strains of Staphylococcus aureus in patients with cystic fibrosis. J Infect Dis 1998; 177: 1023-9. [ Links ]
6. Melter O, Radojevič B. Small colony variants of Staphylococcus aureus—review. Folia Microbiol 2010; 55: 548–58.
7. Maduka-Ezeh A, Seville MT, Kusne S, Vikram HR, Blair JE, Patel R, et al. Thymidine auxotrophic Staphylococcus aureus small-colony variant endocarditis and left ventricular assist device infection. J Clin Microbiol 2012; 50: 1102–5.
8. Seifert H, Wisplinghoff H, Schnabel HP, von Eiff C. Small colony variants (SCVs) of Staphylococcus aureus as a cause of pacemaker-related infection. Emerg Infect Dis 2003; 9: 1316–8.
9. Precit MR, Wolter DJ, Griffith A, Emerson J, Burns JL, Hoffman LR. Optimized in vitro antibiotic susceptibility testing method for small-colony variant Staphylococcus aureus. Antimicrob Agents Chemother 2016; 60: 1725–35.
10. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 27th. ed. M100. Wayne, PA. CLSI. 2017. [ Links ]
11. von Eiff C, Bettin D, Proctor RA, Rolauffs B, Lindner N, Winkelmann W, et al. Recovery of small colony variants of Staphylococcus aureus following gentamicin bead placement for osteomyelitis. Clin Infect Dis 1997; 25: 1250–1.
12. Kahl B. Small colony variants (SCVs) of Staphylococcus aureus-a bacterial survival strategy. Infect Genet Evol 2014; 21: 515-22. [ Links ]
13. von Eiff C. Staphylococcus aureus small colony variants: a challenge to microbiologist and clinicians. Int J Antimicrob Agents 2008; 31: 507–10.
14. Scheneider M, Mühlemann K, Droz S, Couzinet S, Casaulta C, Zimmerli S. Clinical characteristics associated with isolation of small-colony variants of Staphylococcus aureus and Pseudomonas aeruginosa from respiratory secretions of patients with cystic fibrosis. J Clin Microbiol 2008; 46: 1832–4.
15. Delgado-Valverde M, Fernández-Echauri P, Batista-Díaz N, Pascual-Hernández A. Variantes pequeñas de Staphylococcus aureus: utilidad de distintas pruebas para su diagnóstico y estudio de sensibilidad. Enferm Infecc Microbiol Clin 2014; 32: 96-9. [ Links ]
16. Gómez-González C, Acosta J, Villa J, Barrado L, Sanz F, Chaves F, et al. Clinical and molecular characteristics of infections with CO2-dependent small-colony variants of Staphylococcus aureus. J Clin Microbiol 2010; 48: 2878-84. [ Links ]
17. Proctor RA, van Langevelde P, Kristjansson M, Maslow JN, Arbeit RD. Persistent and relapsing infections associated with small colony variants of Staphylococcus aureus. Clin Infect Dis 1995; 20: 95–102.
18. Proctor RA, Peters G. Small colony variants in staphylococcal infections: diagnostic and therapeutic implications. Clin Infect Dis 1998; 27: 419–23.
19. Becker K, Harmsen D, Mellmann A, Meier C, Schumann P, Peters G, et al. Development and evaluation of a quality controlled ribosomal sequence database for 16S ribosomal DNA-based identification of Staphylococcus species. J Clin Microbiol 2004; 42: 4988–95.
20. Kipp F, Becker K, Peters G, von Eiff C. Evaluation of different methods to detect methicillin resistance in small-colony variants of Staphylococcus aureus. J Clin Microbiol 2004; 42: 1277–9.
21. Balwit JM, van Langevelde P, Vann JM, Proctor RA. Gentamicin-resistant menadione and hemin auxotrophic Staphylococcus aureus persist within cultured endothelial cells. J Infect Dis 1994; 170: 1033–7.
22. Baumert N, von Eiff C, Schaaff F, Peters G, Proctor RA, Sahl HG. Physiology and antibiotic susceptibility of Staphylococcus aureus small colony variants. Microb Drug Resist 2002; 8: 253–60.
23. Chambers HF, Miller MM. Emergence of resistance to cephalothin and gentamicin during combination therapy for methicillin-resistant Staphylococcus aureus endocarditis in rabbits. J Infect Dis 1987; 155: 581-5. [ Links ]
24. Sendi P, Proctor RA. Staphylococcus aureus as an intracellular pathogen: the role of small colony variants. Trends Microbiol 2009; 17: 54–8.
Recibido: 21 de noviembre de 2018
Aceptado: 11 de julio de 2019














