Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.3 La Plata set. 2019
PARASITOLOGÍA
Evaluación del método de ELISA para detección de anticuerpos anti-cisticercos en sueros humanos
Osvaldo Germán Astudillo1a,b*, Rodolfo Gustavo Diego2b, Lucia Irazu2b, Marcelo Rodriguez2b
1 Especialista en Bioquímica Clínica en Parasitología.
2 Bioquímico/a.
a Hospital de Enfermedades Infecciosas “Dr. Francisco Javier Muñiz”, Laboratorio de Parasitología.
b Administración Nacional de Laboratorios e Institutos de salud “Dr. Carlos G. Malbrán”. Instituto Nacional de Enfermedades Infecciosas. Departamento de Parasitología, Ciudad Autónoma de Buenos Aires, Argentina.
* Autor para correspondencia.
Correspondencia Dr. OSVALDO G. ASTUDILLO Correo electrónico: astudillogerman@yahoo.com.ar
Resumen
La neurocisticercosis (NCC) es la localización en el sistema nervioso central (SNC) humano de la parasitosis provocada por el estadio larvario de la Taenia solium, el cisticerco, que prevalece en áreas urbanas y rurales y constituye un problema de salud pública. El diagnóstico puede efectuarse por exploración imagenológica del SNC con resonancia magnética o tomografía axial computarizada, no siempre disponible, y por pruebas de inmunoensayo (EIA) en sangre, que aportan al diagnóstico rapidez, bajo costo y transferibilidad. Para evaluar su capacidad diagnóstica y validar la precisión de la técnica de ELISA (ensayo inmunoabsorbente ligado a enzimas), en la detección de anticuerpos anti-cisticercos en sueros humanos, se diseñó una seroteca en forma aleatoria y en doble ciego, y se realizó el ELISA con las muestras, utilizando placas sensibilizadas con antígenos obtenidos del fluido vesicular de cisticercos de T. solium. Para la validación se realizaron 20 ensayos empleando controles positivos y negativos, por cuadruplicado en diferentes días, y realizados por más de un operador; el punto de corte para este método fue una densidad óptica de 0,325. La precisión intralaboratorio para el control débil (media=0,532±0,09) fue de %CV=17,51±0,09, y un valor de repetibilidad de %CV=7,04±0,04, cifras que se encuentran dentro de los límites esperados para el método. Con estos resultados se puede concluir que la precisión del ELISA para el serodiagnóstico de NCC se encuentra validada. El ensayo validado proporcionó resultados coherentes y repetidos que permitieron discriminar entre dos resultados dicotómicos y establecer con exactitud la condición de una posible infección, con un nivel de certidumbre estadística predeterminado.
Palabras clave: Cisticercosis; Inmunoensayo; Anticuerpos anti-cisticerco; Neurocisticercosis; Validación.
Abstract
Evaluation of the ELISA method for the detection of anti-cysticercus antibodies in human sera
Neurocysticercosis (NCC) is the location in the human central nervous system (CNS) of the parasitosis caused by the larval stage of Taenia solium, the cysticercus which prevails in urban and rural areas, constituting a public health problem. Diagnosis can be made by CNS imaging with magnetic resonance or computerized axial tomography, not always available, and by blood immunoassay (EIA) tests, which provide rapidity, low cost and transferability. In order to evaluate its diagnostic capacity and validate the ELISA (Enzyme- Linked ImmunoSorbent Assay) technique in the detection of anti-cysticercus antibodies in human sera, a collection of sera was designed in a randomized and double-blind manner, and the ELISA was performed with the samples, using plates sensitized with antigens obtained from the vesicular fluid of T. solium cysticerci. Twenty trials were conducted, using positive and negative controls, in quadruplicate, on different days, and performed by more than one operator; the cutoff for this method was an optical density of 0.325. The intralaboratory precision for the weak control (mean=0.532±0.09) was %CV=17.51±0.09, and a repeatability value of %CV=7.04±0.04, figures that are within the expected limits for the method, It can be concludedthat the accuracy of the ELISA for serodiagnosis of NCC is validated. The validated test provided consistent and repeated results, which made it possible to discriminate between two dichotomous outcomes, and to establish with accuracy the condition of a possible infection, with a predetermined level of statistical certainty.
Keywords: Cysticercosi; Immunoassay; Anti-cysticercus antibodies; Neurocysticercosis; Validation.
Resumo
Avaliação do método ELISA para a detecção de anticorpos anti-cisticercos em soros humanos
A neurocisticercose (NCC) é o local no sistema nervoso central (SNC) humano de parasitose causada pelo estágio larval da Taenia solium, o cisticerco, prevalecente em áreas urbanas e rurais, constituindo um problema de saúde pública. O diagnóstico pode ser feito por varredura imagenológica do SNC com ressonância magnética ou tomografia axial computadorizada, nem sempre disponível, e por testes de imunoensaio (EIA) em sangue, que fornecem ao diagnóstico rapidez, baixo custo e portabilidade. Para avaliar a sua capacidade de diagnóstico e validar a precisão da técnica de ELISA (ensaio imunoabsorvente ligado a enzimas), na detecção de anticorpos anti-cisticercos em soros humanos, um serrarium foi projetado em forma aleatória e em duplo cego, e foi realizado com as amostras o ELISA, utilizando placas sensibilizadas com antígenos derivados do fluido vesicular de cisticercos de T. solium. 20 testes para validação foram realizados, utilizando controles positivos e negativos, em quadruplicado, em dias diferentes, e realizados por mais de um operador; o ponto de corte para este método era uma densidade óptica de 0,325. A precisão intralaboratorial para o controle fraco (média=0,532±0,09) foi de CV%=17,51±0,09, e um valor de repetibilidade de CV%=7,04±0,04, valores que estão dentro dos limites esperados para o método, podendo concluir com esses resultados que a precisão do ELISA para diagnóstico sorológico de NCC é validado. O ensaio validado forneceu resultados consistentes e repetidos, o que permitiu discriminar entre dois resultados dicotômicos e identificar com exatidão a condição de possível infecção com um nível de certeza pré-determinado estatisticamente.
Palavras-chave: Cisticercose; Imunoensaio; Anticorpos anti-cisticerco; Neurocisticercose; Validação.
Introducción
La cisticercosis humana, causada por el estadio larvario de Taenia solium, prevalece en áreas urbanas y rurales, asociada a prácticas tradicionales de crianza de cerdos y a malas condiciones sanitarias e higiénicas, lo cual constituye un problema de salud pública (1).
Se halla en África, Asia y Latinoamérica y en esta última, la incidencia es más elevada en México, Perú y Brasil (2). La contribución de la cisticercosis humana en las tasas de morbilidad y mortalidad es producto de la localización del cisticerco en el sistema nervioso central (SNC) o neurocisticercosis (NCC), causante de discapacidad física y en ocasiones de muerte (3).
El diagnóstico de la NCC se realiza por la exploración del SNC con resonancia magnética nuclear (RMN) o tomografía axial computarizada (TAC), no siempre disponibles, sobre todo en centros asistenciales de baja complejidad (4).
En un gran número de casos, la NCC es asintomática, como lo evidencian relevamientos epidemiológicos efectuados en zonas rurales de países endémicos, mediante estudios de TAC (4).
Su diagnóstico es imposible a partir de criterios clínicos, aunque ciertos cuadros (epilepsia o hipertensión endocraneana) en regiones endémicas son orientadores (5).
Hay diferentes técnicas serológicas como fijación de complemento, inmunoelectroforesis, hemaglutinación pasiva, inmunofluorescencia y la doble inmunodifusión. No obstante, no se dispone de un enzimoinmunoensayo suficientemente sensible, específico y reproducible.
Actualmente, las pruebas más usadas son el ensayo inmunoabsorbente ligado a enzimas (ELISA) y el immunoblot (Western blot), que detectan anticuerpos anti-cisticerco en suero y LCR (6), con diferencias estadísticas no significativas entre las sensibilidades de ambos métodos (7)(8).
Se han comunicado resultados falsos positivos por reacciones cruzadas con otros helmintos, por la existencia de cisticercosis no neurológica, o contacto previo con el parásito, pero sin infección. Estudios epidemiológicos en comunidades rurales de zonas endémicas han estimado que muchos de sus habitantes presentan anticuerpos específicos, en ausencia de una imagen por TAC, compatible con NCC (9).
Pueden ocurrir resultados falsos negativos con ELISA en suero y LCR, en casos con lesiones calcificadas, en localizaciones parenquimatosas o cuando los quistes son escasos. El diagnóstico de NCC a partir de la serología es de limitada utilidad, aunque una prueba positiva fortalece el diagnóstico en un individuo proveniente de zona endémica con un cuadro clínico y radiológico sugestivo (9).
El desarrollo de tecnología sensible y específica para el diagnóstico de esta patología en suero es de gran utilidad, sobre todo por razones de reducción de costos en estudios epidemiológicos, y en los casos en los cuales las TAC y RMN son de difícil acceso (10).
El objetivo de este trabajo fue evaluar la precisión de la técnica de ELISA para la detección de anticuerpos anti-cisticercos en sueros de humanos que padecen NCC.
Materiales y Métodos
El trabajo se realizó en el Laboratorio de Enteroparásitos, Departamento de Parasitología, Instituto Nacional de Enfermedades Infecciosas, Administración Nacional de Laboratorios e Institutos de Salud “Dr. Carlos G. Malbrán”, Ciudad Autónoma de Buenos Aires.
Para su ejecución se trabajó con muestras de sueros, remitidas según los estándares para investigación en sujetos humanos, captados como casos clínicos. Al laboratorio se remitieron las muestras de suero, acompañadas de una ficha epidemiológica y una petición médica que solicitaba realizar serología para NCC. Todas las muestras fueron dispuestas en forma de seroteca, diseñada en forma aleatoria y a doble ciego, sin individualizar de ningún modo a las personas de las cuales provenían. Se almacenaron a -20 °C hasta el momento de ser procesadas.
Diseño experimental
Las placas de ELISA fueron sensibilizadas con antígenos obtenidos a partir del fluido vesicular de cisticercos de T. solium (7), y el método usado para el ajuste de condiciones fue el de Chessboard Checkerboard, ejecutado sobre un soporte sólido de polivinilo con pocillos de fondo plano (11)(12).
Las muestras de suero utilizadas provenían de la seroteca del Instituto Nacional de Enfermedades Infecciosas “Dr. Carlos G. Malbrán”, y los sueros para control positivo y negativo fueron provistos por el Instituto de Investigaciones Biomédicas, UNAM, México.
Criterios para la selección de controles
• Criterios de inclusión para la selección de los controles positivos: sueros de pacientes que cumplieran con los criterios diagnósticos de neurocisticercosis (13).
• Criterios de inclusión para la selección de los controles negativos: pacientes sin sintomatología clínica compatible y sin epidemiología de cisticercosis, y con resultado coproparasitológico seriado negativo.
Preparación de la seroteca
La seroteca fue compuesta por controles negativos, positivos y muestras de suero con patologías relacionadas a imágenes cerebrales, tales como toxoplasmosis, enfermedad de Chagas, abscesos tuberculosos y micóticos, y tumores.
Se preparó un stock de controles positivos fuertes, débiles y controles negativos, los que se fraccionaron y mantuvieron a -20 °C para ser utilizados en los sucesivos ensayos.
Los controles de reacción fueron realizados a partir de un pool de sueros positivos y negativos, respectivamente. El control positivo débil fue configurado por medio de la dilución de los sueros positivos con sueros negativos para obtener una lectura de densidad óptica más baja.
Punto de corte (cut off) a partir de curvas ROC
El cálculo del cut off se realizó a partir de curvas TG-ROC (Two graph receiver operator characteristics). El mismo fue realizado con una población de referencia negativa (n=56), y con una población de referencia positiva (n=30) y se seleccionó un nivel de exactitud del 95%.
Los resultados de las lecturas obtenidas fueron dispuestos en un software IBM® SPSS® Statistics (versión 24) para el análisis correspondiente. Una vez estimado el valor de corte, la interpretación de los resultados se hizo en base a una escala cualitativa: negativo, indeterminado o positivo.
Proceso de validación
Se realizaron 20 ensayos, en diferentes días, y por más de un operador. Cada control fue procesado por cuadruplicado al igual que los blancos. Las lecturas de las densidades ópticas en cada una de las pruebas fueron dispuestas en una planilla de datos y analizadas con posterioridad.
Evaluación de la capacidad diagnóstica
Una vez seleccionado el punto de corte, la seroteca fue evaluada por ambos operadores; al estudio se le agregaron muestras con interferentes conocidos (hemoglobina, bilirrubina, triglicéridos) para evaluar el impacto de éstos sobre las densidades ópticas. Los resultados fueron dispuestos en la base de datos y posteriormente analizados.
Análisis estadístico
Se creó una base de datos con el software de Excel 10,0 (Microsoft). Se registraron los hallazgos de resonancia magnética y/o tomografía, la clínica del paciente, los datos personales y los resultados serológicos. El análisis estadístico se realizó con los programas IBM® SPSS® Statistics (versión 24).
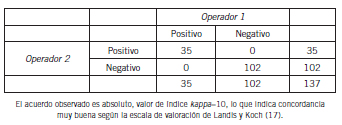
Se realizó estadística paramétrica (media y desviación estándar) y el coeficiente kappa (k) y los intervalos de confianza del 95% se calcularon para evaluar el acuerdo cualitativo entre los operadores. Este coeficiente varía entre -1 y +1. Cuanto más cercano a 1 es el valor, más fuerte es el acuerdo. Epidat 3.0.
Con la lectura de cuadruplicados se calculó la precisión intralaboratorio y la repetibilidad, expresando el resultado como coeficiente de variación porcentual (%CV).
Resultados
El punto de corte calculado para este método, en las condiciones seleccionadas, obtenido por curvas ROC, arrojó la siguiente distribución según lectura de DO; negativo≤0,325, indeterminado=0,325-0,441, positivo≥0,441 (Tabla I).
Tabla I. Estimación del punto de corte del ELISA para NCC, con un IC95%.

La precisión intralaboratorio para el control débil (media=0,532±0,09), importante por su cercanía al valor de corte, obtuvo un CV%=17,51±0,09, y un valor de repetibilidad de CV%=7,04±0,04 (Tabla II).
Tabla II. Registro de resultados: prueba de repetibilidad y precisión para el ensayo de ELISA.

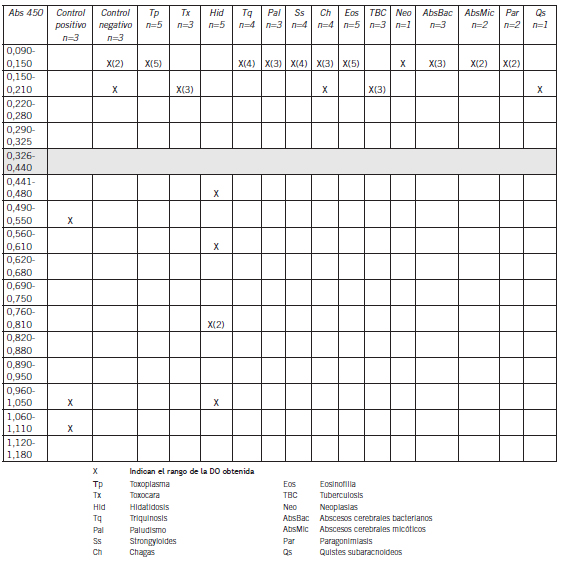
Las interferencias analizadas no impactaron en los resultados de DO de manera significativa. Se observó también, en el análisis de la especificidad, que la serología tenía reacciones cruzadas con hidatidosis, y no así, con las otras patologías estudiadas (Tabla III)(Tabla IV).
Tabla III. Evaluación del impacto de los interferentes en la lectura de DO en el diagnóstico de NCC.

Tabla IV. Evaluación de la capacidad diagnóstica del método.
El coeficiente kappa calculado entre los resultados obtenidos por los operadores, se consideró como muy bueno o casi perfecto (k=1); la sensibilidad y especificidad diagnóstica, calculada a partir de las TG-ROC (Fig. 1), con el diseño de este trabajo expresó un 100% para ambos indicadores.

Figura 1. TG-ROC a partir de los datos utilizados para estimar el cut off.
Tabla V. Cálculo de la concordancia entre observadores.
Discusión y Conclusiones
La NCC es la causa prevenible más frecuente de epilepsia en el mundo en desarrollo y un problema de salud pública en alza. Por tal motivo, es necesario disponer de un método de alta especificidad y sensibilidad para la detección de los casos, que permita también estimar con precisión la magnitud de la transmisión de la parasitosis en áreas endémicas y el impacto de diferentes intervenciones dirigidas para su prevención.
Un ensayo validado proporciona resultados coherentes y repetidos que permiten discriminar entre dos resultados dicotómicos y dictaminar con exactitud la condición de una posible infección.
Los métodos basados en la detección de anticuerpos anti-cisticercos han sido extensamente evaluados y se destacan el ELISA y el immunoblot, semejantes en sensibilidad y especificidad (9).
Los ensayos de ELISA disponibles para la detección de anticuerpos se basan en el uso de antígenos nativos de cisticercos, muchos de los cuales son compartidos por diferentes cestodos (Taenia hydatigena, Echinococcus granulosus) y son reconocidos, tanto por individuos que han estado en contacto con el parásito pero no resultaron infectados, como por aquellos que sí están infectados (14)(15). Las mencionadas características de los ensayos disponibles limitarían su uso; sin embargo, los criterios diagnósticos de NCC avalan su utilización (13).
En esta serie, todas las interferencias analizadas no impactaron significativamente en los resultados de DO obtenidos, y se pudo observar que con la serología se obtienen reacciones cruzadas con hidatidosis, y no así con las otras patologías estudiadas. Si bien es un problema la posibilidad de un falso positivo, producto de una hidatidosis, no es menos cierto que la localización en el SNC de esta patología es rara y se presenta con características particulares (16).
Al análisis, los parámetros estimados de concordancia entre operadores mostraron ser muy buenos (17); de igual modo, la repetibilidad y precisión intralaboratorio se encontraron dentro de los valores esperados para el método.
Esto permite concluir que la precisión del ELISA para serodiagnóstico de NCC se encuentra validada.
Es trascendental proseguir con la validación de la sensibilidad y especificidad analítica a partir de trabajos de campo, debida cuenta que la obtenida con este diseño no es un resultado ajustado.
Los esfuerzos puestos en la optimización del inmunodiagnóstico de la NCC contribuyen a la definición de caso y mejoran la metodología disponible para estudios seroepidemiológicos de cisticercosis.
1. Alarcon Leanez R, Martinez Revollo O, Flores Artunduaga B, Aguilera Riquelme G, López G, Quisberth B. Tratamiento y control de la teniasis/cisticercosis en la población de la zona de San Luis en la ciudad de Tarija. Rev Vent Cient [online]. 2013, vol.1, pp.48-52. Disponible en: <http://www.revistasbolivianas.org.bo/scielo.php?script=sci_arttext&pid=S2305-60102013000100007&lng=es&nrm=iso>. ISSN 2305-6010 (Fecha de acceso 30 de abril de 2019). [ Links ]
2. Toquero M, Morocoima A, Ferrer E. Seroprevalencia y factores de riesgo de cisticercosis en dos comunidades rurales del norte del estado Anzoátegui. Venezuela Biomédica 2017; 37: 66-74. [ Links ]
3. Rojas G, Aguilar C, Ferrer E. Cisticercosis humana: una dolencia olvidada. Salus [Internet]. 2007; 11: 53-57. Disponible: http: //salus-online.fcs.uc.edu.ve/ contenido_salus11_s1.pdf. (Fecha de acceso 1º de octubre de 2018). [ Links ]
4. Saavedra H, Gonzales I, Alvarado MA, Porras MA, Vargas V, Cjuno R, et al. Diagnóstico y manejo de la neurocisticercosis en el Perú. Rev Peru Med Exp Salud Pública 2010; 27: 586-91. [ Links ]
5. Flisser A. Teniosis and cysticercosis due to T. solium. Progress in Clinical Parasitology. Boca Ratón (FL): CRC Press Inc 1994; 4: 77-116. [ Links ]
6. Sciutto E, Fragoso G, Hernández M, Rosas G, Martínez JJ, Fleury A, et al. Development of the S3Pvac vaccine against porcine Taenia solium cysticercosis: a historical review. J Parasitol 2013; 99: 686-92. [ Links ]
7. Romo ML, Carpio A, Parkhouse RM, Cortez MM, Rodríguez-Hidalgo R. Comparison of complementary diagnostic tests in cerebrospinal fluid and serum for neurocysticercosis. Heliyon 4. (2018); e00991. [ Links ]
8. Michelet L, Fleury A, Sciutto E, Kendjo E, Fragoso G, Paris L, et al. Human neurocysticercosis: comparison of different diagnostic tests using cerebrospinal fluid. J Clin Microbiol 2011; 49: 195-200. [ Links ]
9. Fleury A, Kushki A, Tanel N, Anagnostou E, Chau T. Statistical persistence and timing characteristics of repetitive circle drawing in children with ASD. Dev Neurorehabil 2013; 16: 245-54. [ Links ]
10. Larralde C, Aluja S. Cisticercosis. Guía para profesionales de la salud. FCE, Secretaría de Salud, Instituto Nacional de Salud Pública, Fundación Mexicana para la Salud; 2006: 252. [ Links ]
11. Butner J, Borth R, Boutwell JH, Broughton PMG. Approved Recommendation on Quality Control in Clinical Chemistry. Part 2. Assessment of Analytical Methods for Routine Use. Clin Chim 1979; 98: 145-62. [ Links ]
12. Rodriguez MA, Irazu L, Ramirez JC, Schijman AG, Miliwebsky E, Rivas M, et al. Estimación de acordancia y concordancia para evaluar “repetibilidad” de métodos PCR cualitativos en laboratorios de diagnóstico molecular. Acta Bioquím Clín Latinoam 2016; 2: 97.
13. Del Brutto OH, Rajshekhar V, White Jr AC, Tsang VCW, Nash TE, Takayanagui OM, et al. Proposed diagnostic criteria for neurocysticercosis. Neurology 2001; 57: 177-83. [ Links ]
14. Sarti E. La taeniasis y cisticercosis en México (revisión bibliográfica). Salud Pública Mex 1986; 28: 556-63. [ Links ]
15. Schantz P, Sarti E. Diagnostic methods and epidemiologic surveillance of Taenia solium infection. Acta Leiden 1989; 57: 153-63. [ Links ]
16. Tapia EO, Vidal TA, Antonio PL. Hidatidosis cerebral: aspectos clínicos e imagenológicos. Reporte de 4 casos. Rev Méd. Chile [Internet]. 2012; 140: 358-63. [ Links ]
17. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977; 33: 159-74. [ Links ]
Recibido: 21 de enero de 2019
Aceptado: 8 de mayo de 2019














