Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.3 La Plata Sept. 2019
TOXICOLOGÍA
Micetismos. Parte 4: Síndromes tempranos con síntomas complejos
Alicia Beatriz Pomilio1a*, Stella Maris Battista2b, Ángel Alonso3c
1 Doctora de la Universidad de Buenos Aires (Ph. D.), Investigadora Superior del CONICET. Profesora de la Universidad de Buenos Aires.
2 Médica. Doctorando en la Facultad de Medicina, Universidad de Buenos Aires. Docente en la Facultad de Medicina (UBA).
3 Doctor en Medicina (Ph. D.), Médico, Facultad de Medicina, Universidad de Buenos Aires (UBA). Profesor Emérito UBA. Investigador en Histología, Microbiología e Inmunología.
a Departamento de Bioquímica Clínica, Área Hematología, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires, Av. Córdoba 2351, C1120AAF Buenos Aires, Argentina. Tel: (+54) (11) 4814 3952. abpomilio@sinectis.com.ar ; pomilio@ffyb.uba.ar
b Microbiología I, Cátedra 2 (Inmunología), Facultad de Medicina, Universidad de Buenos Aires. Correo electrónico: battistasm@yahoo.com.ar
c División Alergia e Inmunología, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires. Correo electrónico: administracion@cientifica.org.ar
* Autor para correspondencia.
Correspondencia Prof. Dra. ALICIA B. POMILIO Departamento de Bioquímica Clínica, Área: Hematología Hospital de Clínicas “José de San Martín” Universidad de Buenos Aires Av. Córdoba 2351 C1120AAF CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina. Tel: (+54) (11) 4814 3952. Correo electrónico: pomilio@ffyb.uba.ar
Resumen
En esta Parte 4 de la serie de cuatro artículos sobre micetismos se analizan los síndromes que se caracterizan por presentar un período de latencia muy corto, con la aparición de síntomas complejos en menos de 6 horas después de la ingestión de los macromicetos. Se discuten los siguientes micetismos: 1) Toxíndrome muscarínico o colinérgico periférico por especies de Inocybe y Clitocybe. 2) Toxíndrome inmunohemolítico o hemolítico por Paxillus. 3) Toxíndrome neumónico alérgico por Lycoperdon perlatum y por Pholiota nameko. 4) Toxíndrome panterínico o neurotóxico glutaminérgico por compuestos isoxazólicos o síndrome pantherina/muscaria. 5) Toxíndrome coprínico o cardiovascular. 6) Toxíndrome neurotóxico alucinogénico por psilocibina y derivados indólicos. 7) Toxíndrome psicotrópico por estirilpironas y gimnopilinas de Gymnopilus spectabilis o G. junonius. 8) Toxíndrome agudo de rabdomiólisis por Russula subnigricans. 9) Toxíndrome cianogénico por Marasmius oreades. 10) Toxíndrome inmunosupresor por tricotecenos macrocíclicos de Podostroma cornu-damae. 11) Toxíndrome hemolítico debido a ostreolisina de Pleurotus ostreatus y especies relacionadas. Se analizan los síntomas, las toxinas involucradas, los mecanismos de acción, cuando se conocen, y las especies causantes de los micetismos.
Palabras clave: Micetismos tempranos; Toxíndromes con síntomas complejos; Lycoperdon perlatum; Pholiota nameko; Amanita pantherina/Amanita muscaria; Gymnopilus spectabilis (G. junonius); Russula subnigricans; Marasmius oreades; Podostroma cornu-damae; Pleurotus ostreatus; Inocybe; Clitocybe; Paxillus; Coprinopsis; Coprinus; Psilocybe; Panaeolus; Conocybe; Pluteus; Stropharia; Toxinas; Tratamiento.
Abstract
Mushroom poisonings. Part 4: early-onset syndromes with complex symptoms
This Part 4 of the series of four articles on mushroom poisonings refers to early-onset syndromes, which are characterized by a very short latency period, and the appearance of complex symptoms in less than 6 hours after mushroom ingestion. The following mycetisms are discussed, (1) Peripheral cholinergic, or muscarinic syndrome due to Inocybe and Clitocybe species. (2) Immunohaemolytic or haemolytic syndrome by Paxillus. (3) Allergic pneumonic syndrome due to Lycoperdon perlatum, and Pholiota nameko. (4) Glutaminergic neurotoxic, or pantherinic syndrome by isoxazole compounds or pantherina/muscaria syndrome. (5) Coprinic or cardiovascular syndrome. (6) Hallucinogenic neurotoxic syndrome due to psilocybin and indole derivatives. (7) Psychotropic syndrome by styrylpirones and gymnopilins of Gymnopilus spectabilis or G. junonius. (8) Rhabdomyolysis acute syndrome due to Russula subnigricans. (9) Cyanogenic syndrome by Marasmius oreades. (10) Immunosuppressive syndrome by macrocyclic trichothecenes of Podostroma cornu-damae. (11) Haemolytic syndrome due to ostreolisine of Pleurotus ostreatus, and related species. The symptoms, toxins involved, mechanisms of action, when known, and the species of mushrooms responsible for the mycetisms are analyzed.
Keywords: Early-onset mycetisms; Toxindromes with complex symptoms; Lycoperdon perlatum; Pholiota nameko; Amanita pantherina/Amanita muscaria; Gymnopilus spectabilis (G. junonius); Russula subnigricans; Marasmius oreades; Podostroma cornu-damae; Pleurotus ostreatus; Inocybe; Clitocybe; Paxillus; Coprinopsis; Coprinus; Psilocybe; Panaeolus; Conocybe; Pluteus; Stropharia; Toxins; Treatment.
Resumo
Intoxicações por cogumelos. Parte 4: Síndromes precoces com sintomas complexos
Nesta parte 4 da série de quatro artigos sobre intoxicação por cogumelos são analisadas síndromes que se caracterizam por apresentar um período de latência muito breve, com aparecimento de sintomas complexos em menos de 6 horas após a ingestão dos macromicetos. As seguintes intoxicações com cogumelos são discutidas: (1) Toxíndrome muscarínico ou colinérgico periférico por espécies de Inocybe e Clitocybe. (2) Toxíndrome imuno-hemolítica ou hemolítica por Paxillus. (3) Toxíndrome pneumônica alérgica por Lycoperdon perlatum e por Pholiota nameko. (4) Toxíndrome panterínica ou neurotóxica glutaminérgica por compostos isoxazólicos ou síndrome pantherina/muscaria. (5) Toxíndrome coprínica ou cardiovascular (6) Toxíndrome neurotóxico-alucinogênica por psilocibina e derivados indólicos. (7) Toxíndrome psicotrópica por estirilpironas e gimnopilinas de Gymnopilus spectabilis ou G. junonius. (8) Toxíndrome aguda de rabdomiólise por Russula subnigricans. (9) Toxíndrome cianogênica por Marasmius oreades. (10) Toxíndrome imunossupressora por tricotecenos macrocíclicos de Podostroma cornu-damae. (11) Síndrome hemolítica por ostreolisina de Pleurotus ostreatus e espécies relacionadas. São analisados os sintomas, as toxinas envolvidas, os mecanismos de ação, quando conhecidos, e as espécies de cogumelos responsáveis pelas intoxicações.
Palavras-chave: Intoxicações precoces por cogumelos; Toxíndromes com sintomas complexos; Lycoperdon perlatum; Pholiota nameko; Amanita pantherina/Amanita muscaria; Gymnopilus spectabilis (G. junonius); Russula subnigricans; Marasmius oreades; Podostroma cornu-damae; Pleurotus ostreatus; Inocybe; Clitocybe; Paxillus; Coprinopsis; Coprinus; Psilocybe; Panaeolus; Conocybe; Pluteus; Stropharia; Toxinas; Tratamento.
1. Introducción
En esta Parte 4 de la serie de cuatro artículos sobre micetismos (1-3) se analizan los síndromes tempranos con sintomatología compleja, ya que los toxíndromes gastrointestinales o resinoides se han tratado en la parte 3 de esta serie de artículos.
El grupo 3, Parte 4, comprende los siguientes micetismos tempranos:
1) Toxíndrome muscarínico o colinérgico periférico. Micetismo por especies de Inocybe y Clitocybe.
2) Toxíndrome inmunohemolítico o hemolítico. Micetismo por Paxillus.
3) Toxíndrome neumónico alérgico. Licoperdonosis o micetismo por Lycoperdon perlatum y por Pholiota nameko.
4) Toxíndrome panterínico o neurotóxico glutaminérgico. Micetismo por compuestos isoxazólicos o síndrome pantherina/muscaria.
5 Toxíndrome coprínico o cardiovascular. Micetismo inducido por alcohol o reacción tipo disulfiram.
6) Toxíndrome neurotóxico alucinogénico. Micetismo por psilocibina y derivados indólicos.
7) Toxíndrome psicotrópico por estirilpironas y gimnopilinas. Micetismo debido al hongo alucinogénico Gymnopilus spectabilis o Gymnopilus junonius.
8) Toxíndrome agudo de rabdomiólisis. Micetismo por Russula subnigricans.
9) Toxíndrome cianogénico. Micetismo por Marasmius oreades.
10) Toxíndrome inmunosupresor. Micetismo por tricotecenos macrocíclicos de Podostroma cornu-damae.
11) Toxíndrome hemolítico debido a ostreolisina de Pleurotus ostreatus y especies relacionadas.
2. Análisis de cada síndrome del micetismo principal considerado
Grupo 3, Parte 4: Micetismos tempranos con síntomas complejos
2.1. Toxíndrome muscarínico o colinérgico periférico. Micetismo por especies de Inocybe y Clitocybe
Los hongos responsables de este micetismo son especies de Inocybe y Clitocybe.
Período de latencia. Es muy breve, pues los primeros síntomas aparecen entre los 15 y 30 minutos hasta 2 horas después de la ingestión.
Sintomatología. En general, los síntomas son moderados y desaparecen de manera natural dentro de las 24 horas; en los casos leves los pacientes se recuperan a las 6 horas. Los síntomas usuales son: sudoración intensa que empapa al paciente, aumento importante de salivación, lagrimeo, micción, secreciones bronquiales (broncorrea), diaforesis, broncoespasmo, miosis y visión borrosa. También náuseas, vómitos, diarrea escasa, dolor abdominal, cólicos y dificultad para respirar. Los efectos cardiovasculares corresponden a bradicardia, hipotensión, pulso irregular y/o shock en los casos más graves (4).
A diferencia de la acetilcolina, la muscarina no es hidrolizada por las acetilcolinesterasas plasmáticas y sus efectos colinérgicos periféricos generalmente duran varias horas después de la ingestión de hongos crudos o cocidos que contienen muscarina.
En algunos casos graves, como los debidos a Inocybe patouillardii, se produce la muerte debido a insuficiencia respiratoria.
Toxinas. La toxina responsable es la muscarina (Fig. 1). Su nombre deriva de haber sido encontrada en Amanita muscaria, aunque, en muy pequeñas cantidades.

Figura 1: Estructura química de la muscarina.
Las pequeñas especies blancas de Clitocybe contienen muscarina en cantidades peligrosas, y dos especies en particular, las estrechamente relacionadas Clitocybe dealbata y Clitocybe rivulosa, contienen muscarina en cantidades tales que se han registrado muertes por ingerirlas.
Mecanismo de acción. La muscarina es estructuralmente similar a la acetilcolina y causa toxicidad al unirse a las neuronas colinérgicas posganglionares en el sistema nervioso autónomo. La muscarina no puede estimular a los receptores colinérgicos nicotínicos ni cruzar la barrera hematoencefálica para causar un síndrome colinérgico central (4).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Tricholomataceae: especies del género Clitocybe: Clitocybe candicans (Pers.) P. Kumm. crece en Europa; Clitocybe dealbata (Sowerby) Gillet [Bas.: Agaricus dealbatus Sowerby] crece en Europa, en Norteamérica y en la Argentina (Tierra del Fuego); Clitocybe ericetorum Quél. crece en Francia; Clitocybe gracilipes Lamoure; Clitocybe phyllophila (Pers.) P. Kumm. [Basónimo: Agaricus phyllophilus Pers.; sinónimos: Clitocybe cerussata (Fr.) P. Kumm., C. cerussata var. pithyophila (Fr.) J.E. Lange, C. pithyophila (Fr.) Gillet] crece en Europa, en Norteamérica y en América del Sur (Brasil); Clitocybe rivulosa (Pers.) P. Kumm. [Bas.: Agaricus rivulosus Pers.] crece en Europa, Norteamérica y en la Argentina (Buenos Aires) (5). Familia: Cortinariaceae: especies del género Inocybe (6): Inocybe asterospora Quél.; Inocybe bongardii (Weinm.) Quél.; Inocybe caesariata (Fr.) P. Karst.; Inocybe cervicolor (Pers.) Quél.; Inocybe erubescens A. Blytt. [Sin.: I. patouillardii Bres.] intoxicaciones en Reino Unido y en Israel; Inocybe rimosa (Bull.) P. Kumm. [Bas.: Agaricus rimosus Bull.; sin.: Agaricus fastigiatus Schaeff., Inocybe fastigiata (Schaeff.) Quél.] crece en Buenos Aires (Argentina) (6), en Israel y en Europa; Inocybe geophylla (Sowerby) P. Kumm. crece en Europa, Israel, Australia y América del Norte; I. geophylla var. lilacina Gillet crece en Buenos Aires (6-8) y en América del Norte; Inocybe geophyllomorpha Singer crece en la Argentina (provincias de Neuquén, Río Negro y Tierra del Fuego) (6)(7); Inocybe godeyi Gillet; Inocybe griseolilacina J.E. Lange; Inocybe hirtella Bres.; Inocybe lacera (Fr.) P. Kumm. crece en Europa; Inocybe lacera f. gracilis J.E. Lange [Sin.: Agaricus lacerus Fr.] crece en Buenos Aires (6-9); Inocybe langei R. Heim crece en Buenos Aires (6) (7) (9) y en Europa (España, Italia, Francia); Inocybe maculata Boud.; Inocybe mixtilis (Britzelm.) Sacc.; Inocybe mixtiliformis Singer [Sin.: Astrosporina mixtiliformis (Singer) Raithelh.] crece en la Argentina (provincias de Neuquén y Río Negro) (6) (7); Inocybe napipes J.E. Lange [= Astrosporina napipes (J.E. Lange) A. Pearson] crece en la Argentina (provincia de Tucumán) (6) (7) y en Europa; Inocybe praetervisa Quél.; Inocybe pusio P. Karst.
2.2. Toxíndrome inmunohemolítico o hemolítico. Micetismo por Paxillus
El síndrome de Paxillus es una reacción inmunoalérgica rara y potencialmente mortal que puede ocurrir por el consumo de varias especies de hongos no comestibles, como: Paxillus involutus y posiblemente Suillellus luridus (anteriormente denominado Boletus luridus) y Clitocybe claviceps (10) (11). Hasta hace algunos años, se consideraba que el carpóforo de P. involutus era comestible, pero el hecho de que haya causado varias muertes en Europa ha llevado a países como Alemania a prohibir su venta.
Período de latencia. De media hora hasta tres o cuatro horas después de la ingestión.
Sintomatología. Este síndrome se caracteriza por un inicio agudo de síntomas de gastroenteritis (dolores abdominales, diarrea, náuseas, vómitos, sudores, fatiga y frío en brazos y piernas) después del período de latencia, seguido de una anemia hemolítica aguda, mediada por un complejo inmune, con hemoglobinuria, oliguria, anuria e insuficiencia renal por nefritis de complejo inmune, posiblemente iniciada por una respuesta alérgica a un componente de proteína antigénica común en Paxillus y Boletus, la involutina (10) (11). En el caso de consumir los carpóforos crudos, mal cocidos, en gran cantidad o repetidamente, aún cocinándolos, puede producirse una hemólisis grave, que puede ser mortal. El ejemplo clásico es la muerte del micólogo austríaco F. Neumann, quien en 1945, durante la segunda guerra mundial, murió como consecuencia del consumo de carpóforos crudos de P. involutus, por falta de combustible para cocinarlos.
La anemia, que es el síndrome esencial (síndrome paxílico o paxiliano) es de naturaleza inmunohemolítica. Es frecuente que la persona intoxicada, siguiendo un tratamiento adecuado, se recupere al cabo de siete días; sólo en los casos de hemólisis grave puede sobrevenir la muerte.
En los casos graves la intoxicación cursa con intensa pigmentación de la orina, hipotensión grave, dolor lumbar, oligoanuria posterior y colapso.
Toxinas. La toxina responsable de la intoxicación es la involutina (Fig. 2), que es una diarilciclopentenona termolábil, que por lo tanto es destruida en parte por la cocción prolongada y que se encuentra en algunos hongos del género Paxillus, entre ellos P. involutus (12). Esta sustancia es tóxica y responsable del síndrome paxílico, síndrome alérgico causado por la ingestión del hongo (13). En contacto con el aire, la involutina se oxida y da lugar a compuestos que determinan el color marrón de los hongos que la contienen (14).

Figura 2: Estructuras químicas de 5-(3,4-dihidroxifenil)-2-(4-hidroxifenil)-2-(2-pirrolidon-5-íl)-4-ciclopenten-1,3-diona, (4Z)-5-hidroxi- 2-(3,4-dihidroxifenil)-5-(4-hidroxifenil)-2,4-pentadien-4-ólido, involutona e involutina.
Los compuestos químicos obtenidos de carpóforos de P. involutus correspondieron a: ácidos grasos, hidratos de carbono, esteroides, péptidos y otros compuestos con nitrógeno (entre ellos, trazas de muscarina) y los pigmentos involutina [(4S,5R)-5-(3,4- dihidroxifenil)-2-(4-hidroxifenil)-3,4-dihidroxiciclopent-2-en-1-ona], involutona [5-(3,4-dihidroxifenil)- 2-(4-hidroxifenil)-2-hidroxi-4-ciclopenten-1,3-diona], 5-(3,4-dihidroxifenil)-2-(4-hidroxifenil)-2-(2-pirrolidon-5-íl)-4-ciclopenten-1,3-diona y (4Z)-5-hidroxi-2-(3,4- dihidroxifenil)-5-(4-hidroxifenil)-2,4-pentadien-4-ólido (Fig. 2) (12) (15) (16).
Mecanismo de acción. Se ha demostrado que la intoxicación mortal debida a P. involutus, en particular la hemólisis grave, es causada por anticuerpos contra el hongo en pacientes sensibilizados (11). Es por eso que los cuadros tóxicos afectan a determinadas personas y a otras no. Más aún, mucha gente ha comido este hongo alguna vez, previa cocción, sin ningún problema.
Los anticuerpos de convalecientes [inmunoglobulinas G (IgG) séricas contra un extracto de Paxillus que contenía involutina] se han detectado mediante el ensayo de inhibición de la hemaglutinación en varios pacientes con el síndrome de Paxillus agudo (10) (11). También se detectaron anticuerpos IgG específicos contra partículas de la membrana de P. involutus mediante esos ensayos en el suero de pacientes.
La secuencia de reacciones resultante de los ensayos sugiere fuertemente la formación de complejos inmunes. Es probable que estos complejos se unan a los eritrocitos que han estado presentes sin intervenir. La activación del sistema del complemento finalmente produce hemólisis y shock. Además del tratamiento adecuado del shock, la eliminación de estos complejos inmunes circulantes mediante separación del plasma parece ser la terapia de elección (11).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Boletales; Familia: Paxillaceae: P. involutus (Batsch) Fr. [Bas.: Agaricus involutus Batsch] crece en la Argentina (provincias de Salta, Tucumán, Córdoba, Neuquén, Río Negro y Tierra del Fuego) (7) (9) (17) y en bosques de coníferas en el hemisferio norte, en toda Europa y Asia, América del Norte, Japón y en el este de Anatolia en Turquía; Paxillus filamentosus (Scop.) Fr. [Bas.: Agaricus filamentosus Scop.; sin.: Paxillus rubicundulus P.D. Orton] crece en el norte de Europa, sudoeste de Groenlandia y América del Norte. Familia: Tapinellaceae: Tapinella panuoides (Batsch) E.- J. Gilbert [Sin.: Agaricus panuoides Fr.; Paxillus panuoides (Fr.) Fr.; Tapinella panuoides f. ionipus (Quél.) Šutara] crece en la Argentina (provincias de Buenos Aires, Río Negro y Tierra del Fuego) (7) (17) y en Europa; Tapinella atrotomentosa (Batsch) Šutara [Bas.: Agaricus atrotomentosus Batsch; Paxillus atrotomentosus (Batsch) Fr.] crece en Asia, América Central, Europa y América del Norte.
2.3. Toxíndrome neumónico alérgico. Licoperdonosis o micetismo por Lycoperdon perlatum y por Pholiota nameko
Los hongos del género Lycoperdon (llamados “hongos polvera” en la Argentina; en inglés: “puffballs”) son hongos gasteroides u hongos con forma o aspecto de estómago, que comparten una morfología similar, la forma globosa, al menos durante la fase juvenil. El desarrollo de estos hongos es angiocárpico, es decir que forman un basidiocarpo en el que el himenio o gleba (lugar donde se desarrollan las esporas) permanece encerrado por una capa externa o envoltura, llamada peridio, que mantiene a las esporas en el interior hasta alcanzar su madurez (18) (19). La dispersión de esporas ocurre a través de una abertura o desintegración del peridio. Por ejemplo, en el caso de especies del género Lycoperdon es por medio de un orificio en la parte superior por el que salen expulsadas las esporas, que tienen espinas externas microscópicas afiladas, en forma de un polvo muy fino, que al ser inhalado provoca el toxíndrome (20). Esta condición afecta a humanos en forma casual o intencional y en especial a los que trabajan en la industria y comercialización de hongos. También ocurre en perros (21-23).
Los hongos gasteroides degradan la materia orgánica, por lo que participan en el reciclaje de nutrientes (24).
Las especies de Lycoperdon se encuentran distribuidas prácticamente en todo el mundo. Sus esporas se usan en medicina tradicional como cicatrizantes y para aliviar quemaduras, lastimaduras y picaduras. Varias especies se encuentran en toda América del Norte y gran parte de América del Sur, como la Argentina, Brasil, Paraguay y otros países. Estos hongos son comestibles en su fase juvenil, tanto crudos como cocidos, de muy buen aroma y sabor, cuando la gleba es aún homogénea, carnosa y blanca como en Lycoperdon perlatum o en Calvatia cyathyformis; se los fríe y reboza, o bien reemplazan a las albóndigas en las sopas. L. perlatum es una de las varias especies comestibles que se venden en los mercados de los estados mejicanos, como el de Puebla (25). Se realizó un análisis filogenético molecular de la familia Lycoperdaceae, actualmente Agaricaceae, de taxones del norte europeo (19), pero no se incluyeron las especies del Hemisferio Sur, y quedó por lo tanto su filogenia sin resolver (26).
Otro tipo de hongo, Pholiota nameko de la familia Strophariaceae ha provocado también el toxíndrome neumónico alérgico (27).
Sintomatología. La progresión típica de la licoperdonosis incluye síntomas de un resfrío pocas horas después de la inhalación de las esporas, seguido de náuseas, pulso rápido, estertores crepitantes y disnea. Esos síntomas están acompañados muchas veces por fiebre, mialgia y fatiga. Los pacientes generalmente requieren internación e intubación.
Esta enfermedad respiratoria presenta síntomas de neumonía y densidades generalizadas en los pulmones y puede conducir a un diagnóstico erróneo. El curso es bastante prolongado, pero de buen pronóstico.
Las radiografías de tórax de todos los pacientes con licoperdonosis demostraron infiltración pulmonar bilateral, a menudo nodular, y las biopsias pulmonares revelaron inflamación pulmonar y estructuras compatibles con esporas de Lycoperdon. Todos los pacientes se recuperaron después de períodos variables de internación, generalmente con tratamiento con esteroides y/o antimicrobianos (20) (28).
Características de la licoperdonosis (enfermedad por inhalación de esporas). La licoperdonosis se clasifica como una neumonitis por hipersensibilidad (también llamada alveolitis alérgica extrínseca) que es una inflamación de los alvéolos o broncoalveolitis causada por la inhalación repetida de antígenos específicos que se encuentran en una gran variedad de entornos (29); en este caso, las esporas naturales inhaladas. La enfermedad es rara, posiblemente debido a la gran cantidad de esporas que deben inhalarse para que se produzcan los efectos clínicos (28).
Los primeros pocos casos de neumonitis por hipersensibilidad se describieron a principios del siglo XX en agricultores expuestos a heno o paja enmohecidos (30).
La reacción inflamatoria en los casos de licoperdonosis podría representar una respuesta reactiva a la presencia de un material extraño, como las esporas, o ser una reacción alérgica o una respuesta a una infección fúngica activa o a una toxina, o por último, alguna combinación de estos procesos. Por los estudios histopatológicos en pacientes, en perros y ensayos en hamsters, se sabe actualmente que las esporas fúngicas, especialmente las menores de 10 μm, se depositan ampliamente en el pulmón después de la inhalación. En un estudio en hamsters (ver abajo, ensayos en animales) se demostró que las esporas de 3 μm de diámetro eran desplazadas de una manera específica que facilitaba la fagocitosis por los macrófagos (31) (32). En consecuencia, se considera que la licoperdonosis representa una reacción de hipersensibilidad a las esporas y, por lo tanto, se la ha denominado con mayor frecuencia neumonitis (28).
La neumonitis por hipersensibilidad es el resultado de una respuesta inmune exagerada, que da lugar a síntomas agudos similares a la infección o al daño pulmonar progresivo, a veces irreversible. El diagnóstico se basa en una combinación de características clínicas de la enfermedad. Los mecanismos inmunes que conducen a la neumonitis por hipersensibilidad aún no se conocen por completo. Inicialmente se creía que era una respuesta inmune de las clases III y IV, ahora se tiene una comprensión más clara de los complejos eventos inflamatorios involucrados. Estos incluyen la liberación de citoquinas proinflamatorias y una disminución de los mecanismos de control inmune a través de las células T reguladoras, tensioactivas y dendríticas. A pesar del mayor conocimiento sobre el tema, no han cambiado ni el tratamiento ni el resultado de la neumonitis por hipersensibilidad. Los corticosteroides orales siguen siendo los únicos medicamentos efectivos además de evitar el contacto con el agente causante. Si no se controla, la neumonitis por hipersensibilidad puede ocasionar daño pulmonar irreversible en forma de fibrosis o enfisema, insuficiencia respiratoria e incluso la muerte (30).
La neumonitis por hipersensibilidad representa un riesgo ocupacional significativo para las personas que trabajan en empresas de cultivo, cosecha y elaboración de hongos que están crónicamente expuestas a esporas de hongos; sin embargo, la mayoría de los casos de licoperdonosis ocurrieron después de una sola inhalación grande, en lugar de exposición repetida (27) (33).
Componentes químicos de especies de Lycoperdon. En la búsqueda de algún compuesto químico que pudiera contribuir a este micetismo, se aislaron e identificaron de carpóforos de Lycoperdon perlatum: el pigmento melanina (34), ácidos grasos como ácido linoleico (37% de los ácidos grasos totales), ácido oleico (24%), ácido palmítico (14,5%) y ácido esteárico (6,4%) (35), ácido cinámico (36), esteroides derivados del ergosterol y del lanosterol, y compuestos volátiles responsables del olor y sabor de estos hongos como 3-octanona, 1-octen-3-ol y (Z)-3-octen-1-ol (37).
Los extractos presentaron actividad antimicrobiana relativamente alta contra bacterias patógenas humanas (Bacillus subtilis, Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa), con una actividad comparable a la del antibiótico ampicilina (38); también presentaron actividad contra Salmonella enterica serovar Typhimurium, Streptococcus pyogenes y Mycobacterium smegmatis (39) y actividad antifúngica contra Candida albicans, Candida tropicalis, Aspergillus fumigatus, Alternaria solani, Botrytis cinerea y Verticillium dahliae (40).
El aminoácido ácido licopérdico (Fig. 3) [3-(5(S)- carboxi-2-oxotetrahidrofuran-5(S)-íl)-2(S)-alanina] se aisló de L. perlatum en 1978 (41). Debido a la similitud estructural de este aminoácido con el ácido (S)-glutámico, se considera que el ácido (S)-(+)-licopérdico puede presentar actividad sobre el receptor de glutamato en el sistema nervioso central de los mamíferos.
Además, L. perlatum bioacumula metales pesados presentes en el suelo (42), por lo que puede usarse como un bioindicador de la contaminación del suelo (43). Se ha demostrado experimentalmente que la biomasa de L. perlatum remueve los iones mercurio de las soluciones acuosas, y se está investigando su posible uso como material biosorbente, renovable y de bajo costo en el tratamiento de agua y de aguas residuales que contienen mercurio (44).

Figura 3: Estructura química del ácido licopérdico.
Historia del micetismo. Casos clínicos. La enfermedad fue descripta por primera vez en la literatura médica en 1967, cuando se registraron los dos primeros casos de un niño y de un adolescente que inhalaron intencionalmente las esporas como tratamiento de epistaxis (hemorragia nasal) (45). Con el mismo fin, en 1976, un niño de 4 años desarrolló la enfermedad en Noruega después de inhalar deliberadamente una gran cantidad de esporas (46).
En 1994 se registraron ocho casos de adolescentes, entre 16 y 19 años, del sureste de Wisconsin que inhalaron esporas de L. perlatum en una fiesta y presentaron síntomas clínicos como tos, fiebre, respiración corta, mialgia y fatiga. Cinco de los ocho requirieron internación y dos fueron intubados para ayudar a la respiración (20).
En 1997 se registraron varios casos de adolescentes que inhalaron esporas. En un caso grave, el paciente inhaló suficientes esporas como para poder expulsarlas por su boca; se sometió a una broncoscopía y tuvo que recibir soporte vital antes de recuperarse en unas cuatro semanas. En otro caso, un adolescente pasó 18 días en coma, le extirparon porciones de su pulmón y sufrió daño hepático grave (28).
Se registraron varios casos de origen ocupacional, aunque no todos debidos a especies del género Lycoperdon. Así por ejemplo, se demostró neumonitis por hipersensibilidad debida a la inhalación de esporas del hongo comestible Pholiota nameko (27). Un trabajador de una empresa de hongos de 52 años sufrió tos, disnea de esfuerzo y fiebre alta varias horas después de trabajar en la sala de cultivo de estos hongos. Su examen reveló crepitaciones basilares bilaterales, sombras granulares finas en ambos campos pulmonares de la radiografía de tórax y una ligera disminución en la capacidad de difusión. Se encontraron factores de inhibición de la migración de macrófagos y precipitina contra el extracto de esporas del hongo y no con otros contaminantes y mohos. El hallazgo histológico por biopsia pulmonar transbronquial mostró alveolitis granulomatosa. Se encontró un aumento manifiesto de linfocitos en su fluido de lavado broncoalveolar. El test de inhalación provocativa con el extracto reveló síntomas y signos similares en su lugar de trabajo ocho horas después de la inhalación (27).
Casos en animales. La licoperdonosis también ocurre en perros; en los pocos casos reportados, los animales habían estado jugando o cavando en áreas con Lycoperdon pyriforme (21-23). El diagnóstico se basó en la historia de un perro que había jugado en un lecho de estos hongos y en la presencia de estructuras vacuoladas dentro de un aspirado transtraqueal.
En el año 2010 se describieron la progresión clínica y la histopatología de dos casos confirmados de licoperdonosis canina mortal en EE.UU. (22). En el examen histológico, los bronquiolos y las grandes regiones del intersticio alveolar adyacente de ambos perros estaban gravemente infiltrados por numerosos macrófagos. A lo largo de todas las secciones, los macrófagos ocasionalmente contenían dentro de su citoplasma 1-3 esporas redondas de 3-5 μm de diámetro, las cuales se tiñeron fuertemente tanto con metenamina de plata de Gomori como con ácido periódico-Schiff. Por la morfología de las esporas y por el análisis genético a partir de un fragmento de ADN se pudo determinar que eran esporas de L. pyriforme (18).
Ensayos en animales. Las respuestas biológicas a las esporas fúngicas portadoras de alérgenos transportadas en el aire e inhaladas, se entenderían mejor si se tuviera una idea de su patrón de distribución e interacción con las estructuras pulmonares. Por lo tanto, se hicieron ensayos en hamsters intubados y anestesiados que inhalaron aerosoles de esporas de Calvatia excipuliformis, de 3,1 µm de diámetro, ya sea por respiración espontánea (grupo A, n=3) o mediante ventilación continua con presión negativa (grupo B, n=4). Los pulmones se fijaron mediante perfusión intravascular de solución de fijación dentro de los 29 minutos de la inhalación inicial y las muestras de tejido se procesaron luego para microscopio óptico y electrónico (31).
El análisis estereológico del tejido pulmonar reveló que el mayor número de esporas se depositaron dentro de los alvéolos (67,2% en el grupo A y 89,8% en el grupo B). Las vías respiratorias conductoras intrapulmonares conservaron una proporción intermedia (32,3% en el grupo A y 10,0% en el grupo B), mientras que los bronquios y la tráquea tuvieron la proporción más baja (0,5% o menos). Las esporas depositadas se alojaron dentro de la capa acuosa de revestimiento y muy cerca de las células epiteliales. En las vías respiratorias conductoras intrapulmonares, el 22,3% de las esporas en el grupo A y el 9,0% de las del grupo B fueron captadas por macrófagos (31).
Así se demostró que las basidiosporas inhaladas, de 3 µm de diámetro, se distribuyeron en una gran área superficial y además se desplazaron hacia la capa acuosa de revestimiento de las vías respiratorias y los alvéolos, con lo cual se facilitó la fagocitosis subsiguiente por los macrófagos. Esta interacción de las esporas con las estructuras pulmonares es importante en el desarrollo de alergias respiratorias inducidas por alérgenos fúngicos transportados por el aire. Los experimentos subsiguientes confirmaron estos resultados (32).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Agaricaceae: Lycoperdon perlatum Pers. (“hongo polvera”, “caja de rapé del diablo”, en inglés: “puffball”) [Sin.: Lycoperdon gemmatum Batsch, L. gemmatum var. perlatum (Pers.) Fr., L. bonordenii Massee, L. perlatum var. bonordenii (Massee) Perdeck] es una especie sapróbica, que crece solitaria, dispersa o en grupos en el suelo, en bosques, áreas verdes y caminos; también puede crecer en anillos de hadas, es cosmopolita (47), desde África (Kenia, Ruanda, Tanzania), Asia [China, Himalaya, Japón (48), sur de la India (49)], Oceanía [Nueva Zelanda y Australia], Europa (19), América del Norte [desde Alaska hasta Méjico (50)] y América del Sur [Paraguay, Brasil (51) y Argentina (52)]. Se ha recolectado en las zonas subárticas de Groenlandia y en las regiones subalpinas de Islandia (53). La especie es popular en las estampillas (sellos postales) y ha sido representada en estampillas de Guinea, Paraguay, Rumania, Sierra Leona y Suecia (54); Apioperdon pyriforme (Schaeff.) Vizzini & Ercole según estudios moleculares recientes (55) [Bas.: Lycoperdon pyriforme Schaeff.; sin.: Morganella pyriforme (Schaeff.) Kreisel & D. Krüger] especie de distribución mundial, crece en la Argentina [provincias de Misiones (56) (57), Córdoba (58) y Catamarca]; los basidiomas se desarrollan sobre madera muerta en lugares sombríos (59) (60); Calvatia fragilis (Vittad.) Morgan [Bas.: Lycoperdon fragile Vittad.; sin.: Utraria fragilis (Vittad.) Quél., Calvatia cyathiformis subsp. fragilis (Vittad.) Dring, C. cyathiformis f. fragilis (Vittad.) A.H. Sm., Bovista amethystina Cooke & Massee, B. cinerea Ellis, B. dealbata Berk.: Massee] crece en la provincia de Catamarca, Argentina (60); Calvatia gigantea (Batsch: Pers.) Lloyd (nombre común en inglés: “giant puffball”) [Sin.: Langermannia gigantea (Batsch: Pers.) Rostk.] se encuentra en áreas templadas de todo el mundo. Familia: Strophariaceae: Pholiota nameko (T. Itô) S. Ito & S. [Bas.: Collybia nameko T. Itô; sin.: Kuehneromyces nameko (T. Itô) S. Ito] crece en China, Japón y Rusia (27).
2.4. Toxíndrome panterínico o neurotóxico glutaminérgico. Micetismo por compuestos isoxazólicos o síndrome pantherina/muscaria
Este micetismo se debe a las especies Amanita pantherina y Amanita muscaria, por eso a veces se lo denomina síndrome pantherina/muscaria. También producen este síndrome otras especies de Amanita como: Amanita gemmata y Amanita regalis.
Período de latencia. Corto, de 30 minutos a 2 horas después de la ingestión.
Sintomatología. Este micetismo se caracteriza por su acción sobre el sistema nervioso central. Los síntomas de los compuestos isoxazólicos (ácido iboténico y muscimol) aparecen con bastante rapidez y pueden incluir náuseas, vómitos y dolores abdominales, pero afectan principalmente al sistema nervioso central. Suelen ser muy variables, debido no sólo a la cantidad ingerida de carpóforos, sino también a la reacción individual del consumidor, a la presencia de otras sustancias bioactivas no psicotrópicas en los carpóforos, a las zonas de recolección y variedades fúngicas (61). Los síntomas se pueden prolongar hasta 6 a 8 horas después de la ingestión, según la dosis ingerida. Algunas personas han tenido dolores de cabeza hasta 10 horas después.
Los síntomas neurológicos típicos son desorden mental, euforia, dificultad de coordinación y de habla, estado de embriaguez, agresividad, alucinaciones y confusión mental (9) (62). Son frecuentes los trastornos motrices como: vértigos, ataxia, incoordinación, agitación, trastornos de la visión, midriasis y, en ocasiones, enrojecimiento de la piel y taquicardia.
Según los compuestos presentes: sensación de embriaguez, alteraciones visuales y auditivas de la percepción, disociación (separación del cuerpo y la mente), somnolencia, estado comatoso (muscimol); o hiperactividad, sacudidas miotónicas, agitación, confusión, delirios y alucinaciones (ácido iboténico) (62). El ácido iboténico evoca efectos enteógenos en el ser humano; el pico de la intoxicación es alcanzado aproximadamente entre dos y tres horas después de la ingestión. A. muscaria contiene más ácido iboténico excitador y menos muscimol depresivo, en comparación con A. pantherina; por lo tanto, los pacientes presentan cuadros clínicos diferentes, como los descriptos y se considera entonces que el llamado síndrome iboténico o síndrome pantherina/muscaria podría dividirse en dos subtipos (63).
La intoxicación por grandes dosis puede llegar a ser mortal. Normalmente, las alteraciones no duran más de un día y acaban con un sueño profundo más o menos reparador, de 10 a 15 horas, al final del cual el paciente no recuerda lo sucedido. Al despertar, la persona intoxicada generalmente tiene la sensación de reencarnación; siente dolor de cabeza, debilidad y se encuentra en estado depresivo. Los trastornos de la coordinación de movimiento, habla y visión a veces persisten durante varios días. La causa más común de muerte es insuficiencia cardíaca y paro respiratorio. La intoxicación aleatoria con A. muscaria termina en muerte en sólo el 2-5% de los casos. Los niños y los ancianos son la población de riesgo (61).
Recientemente se realizó una revisión retrospectiva de este micetismo en un centro regional de intoxicaciones de los EE.UU. en el período 2002-2016 (64). La intoxicación por ingestión de A. pantherina presenta mayor cantidad de síntomas que la de A. muscaria, es de mayor gravedad y, aunque rara vez, puede llegar a ser mortal.
Toxinas. Las sustancias responsables de la intoxicación son los isoxazoles psicoactivos: ácido iboténico, muscimol (el más potente) y muscazona (Fig. 4).

Figura 4: Estructuras químicas de ácido iboténico, muscimol y muscazona.
Muscimol (5-aminometil-3-hidroxiisoxazol; llamado antiguamente panterina) es un componente del atractivo hongo psicotrópico A. muscaria (“hongo de los enanitos”; sombrero rojo con “pintas” blancas) que ha sido objeto de considerable interés farmacológico y de síntesis orgánica de derivados y análogos (65).
Muscazona es un aminoácido tóxico presente en A. muscaria europea, que se considera que proviene de la reacción fotoquímica del ácido iboténico y que se produce durante el aislamiento (61).
El ácido iboténico y muscimol se encontraron en Amanita cothurnata, A. muscaria, A. pantherina y en concentraciones más bajas en A. gemmata (62) (66).
A. muscaria, a pesar de ser una especie tóxica, se ha utilizado en diversas culturas desde la antigüedad asociada con el misticismo por sus propiedades alucinogénicas, con una historia que data de al menos el siglo XIII y que aún hoy es objeto de investigaciones por los cambios perceptuales, conductuales, emocionales y volitivos producidos por su ingestión (61) (65) (67).
A. muscaria contiene altos niveles de ácido iboténico, que es tóxico si se ingiere y cuando los carpóforos se secan, se descarboxila para dar el compuesto psicoactivo muscimol (68).
También si el hongo se expone a la luz ultravioleta el ácido iboténico se convierte en muscazona, que es además un bioacumulador del metal pesado vanadio, llegando a niveles de vanadio de hasta 400 veces mayores que los encontrados en plantas (69). Si bien aún se está estudiando la importancia biológica de la bioacumulación, es bien conocida la naturaleza nociva de los metales pesados por ingestión.
Pero además, las especies de Amanita contienen un complejo azul pálido de vanadio que es la amavadina, que contiene un ion vanadio (IV) (coordinación ocho) y dos moléculas de N-(1-carboxietil)-N-hidroxialanina; se aisló por primera vez de extractos acuosos de A. muscaria y su estructura revisada se muestra en la Fig. 5.

Figura 5: Estructura química del complejo amavadina.
Amavadina se encuentra en tres especies de hongos tóxicos del género Amanita: A. muscaria, Amanita regalis y Amanita velatipes. La función biológica de la amavadina aún se desconoce, si bien se cree que utiliza peróxido de hidrógeno (H2O2) y actúa como una peroxidasa para ayudar a la regeneración de los tejidos dañados (70). En el hongo, la amavadina puede servir como una toxina para la protección del carpóforo (69).
A. muscaria también tiene la capacidad de acumular cationes del suelo en los carpóforos (71), como altas concentraciones de Cd, Cu, Hg y Mn en los sombreros, pero depende fuertemente de su cantidad en el suelo o sustrato sobre el que está creciendo (72). Recientemente, se estudió el contenido de cationes geogénicos en la capa superior del suelo en regiones de Polonia, demostrando que en todos los casos A. muscaria pudo regular la captación y acumulación de Ag, Al, Ba, Ca, K, Mg, Na, Rb y Zn, que tenían niveles de concentración similares en los sombreros, pero no necesariamente en los estípites (71).
A. muscaria y A. pantherina contienen además una serie de aminoácidos no proteicos. En A. muscaria se encontró (-)-(R)-4-hidroxipirrolidona-2 (Fig. 6), cuya estructura está muy relacionada con las del ácido iboténico y de muscimol (73).

Figura 6: Estructura química de (-)-(R)-4-hidroxipirrolidona-2.
Los ácidos estizolóbico y estizolobínico (Fig. 7) son aminoácidos 2-oxo-piranos no proteinogénicos bioactivos que se han encontrado en A. pantherina y en niveles bajos en A. gemmata y A. muscaria (66).

Figura 7: Estructuras químicas del ácido estizolóbico y del ácido estizolobínico.
La muscarina es un compuesto quiral que se puede presentar en ocho estereoisómeros. Justamente, la muscarina, la epi-muscarina y la allo-muscarina (Fig. 8) se han detectado en el micelio de A. muscaria (74). No se demostró inequívocamente la presencia de epi, allo-muscarina (65). El renovado interés en esta molécula se debe, en parte, a que varios subtipos de receptores muscarínicos parecen estar implicados en la enfermedad de Alzheimer (73). Se debe tener en cuenta que es la primera sustancia parasimpaticomimética que fuera estudiada; causa una profunda activación parasimpática que puede terminar en convulsiones y muerte. Pero, en A. muscaria se encuentran sólo ínfimas cantidades de muscarina (0,0002-0,0003%) en comparación con las encontradas en algunas especies de Inocybe (0,43%) y de Clitocybe (0,15%) (ver sección 2.1). Debido a las trazas en los carpóforos, A. pantherina y A. muscaria no podrían inducir un síndrome muscarínico sin un consumo excesivo (65). También hay otras sustancias de amonio cuaternario en A. muscaria (colina, acetilcolina, betaína, hercinina, sal de buteniltrimetilamonio), pero sólo en trazas, por lo que su contribución a los efectos biológicos de A. muscaria es aparentemente insignificante (74).

Figura 8: Estructuras químicas de muscarina, epi-muscarina, allo-muscarina y epi,allo-muscarina.
A. muscaria contiene una mezcla de pigmentos (75): el principal es el derivado de terfenilquinona muscarrufina (Fig. 9) (color amarillo) (76); los pigmentos muscaaurinas I-VII (Fig. 9) son betalaínas responsables del característico color rojo-anaranjado de los sombreros de varias especies de Amanita (65); muscaflavina (Fig. 9) (pigmento amarillo, antibiótico y antifúngico natural (61), muscapurpurina (Fig. 9) (pigmento púrpura; estructura relacionada con muscaaurinas) (65) (75). También se encontró una tetrahidro-b-carbolina bioactiva como el ácido 1,2,3,4-tetrahidro-1-metil-b-carbolin- 3-carboxílico (Fig. 9) (65).

Figura 9: Estructuras químicas de muscaaurinas I-VII, muscapurpurina, muscarrufina, muscaflavina y ácido 1,2,3,4-tetrahidro-1-metil-b-carbolin-3-carboxílico.
Mecanismo de acción. Los compuestos isoxazólicos, ácido iboténico y muscimol, son los componentes biológicamente activos más importantes, pero otros principios activos contribuyen a la bioactividad observada en este micetismo.
El ácido iboténico o ibotenato es un análogo conformacionalmente restringido del glutamato (ácido glutámico) que es el neurotransmisor excitador más abundante en los vertebrados. Debido a esa similitud estructural el ácido iboténico actúa como un agonista no selectivo de los receptores de glutamato, específicamente en los sitios del receptor N-metil-D-aspartato (NMDA) en el sistema nervioso central (77). Justamente la toxicidad del ácido iboténico proviene de la activación de los receptores NMDA; es por eso que es un fuerte excitador neuronal (78) y una poderosa neurotoxina (79), aunque unas cinco veces menos potente que el ácido kaínico en causar la degeneración de los cuerpos celulares neuronales del hipocampo.
El ácido iboténico actúa como un potente agonista de los receptores metabotrópicos de glutamato NMDA y del grupo I (mGluR1 y mGluR5) y II (mGluR2 y mGluR3) (77); es inactivo en los mGluRs del grupo III. El ácido iboténico también actúa como un agonista débil de los receptores de AMPA y kainato (77).
Los receptores NMDA están relacionados con la plasticidad sináptica y trabajan con los receptores metabotrópicos de glutamato para establecer la potenciación a largo plazo, que se cree que está relacionada con la adquisición de información. Como el ácido iboténico es un potente agonista del receptor NMDA, lo activa al unirse al mismo, y permite así un influjo excesivo de iones calcio (Ca2+) en el sistema, que causan entonces lesiones graves e incluso la muerte neuronal. Los iones calcio también activan a la CaM-KII o Ca2+/ calmodulina quinasa que fosforila múltiples enzimas. Las enzimas activadas luego comienzan a producir especies reactivas de oxígeno que dañan el tejido circundante. El exceso de Ca2+ causa el aumento del sistema de transporte de electrones mitocondrial, lo cual aumenta aún más el número de especies reactivas de oxígeno (80).
Debido a que el ácido iboténico se dirige a estos sistemas, los síntomas asociados con esta intoxicación se relacionan con la percepción y el control, por lo que provoca distorsiones visuales, espaciales y auditivas, hiperactividad, sacudidas miotónicas, convulsiones y amnesia retrógrada (63).
El ácido iboténico se emplea como un “agente de lesión cerebral” mediante inyecciones intracraneales en investigación científica (79). La administración estereotáxica intrahipocámpica de ácido iboténico en ratas perjudica la transmisión colinérgica, el desempeño del aprendizaje y de la memoria, lo cual está relacionado con la enfermedad de Alzheimer, por lo que es un modelo adecuado para ensayar la eficacia de fármacos para esa enfermedad. Dado que el ácido iboténico es un agonista del glutamato, se espera que presente un efecto excitotóxico por alterar los receptores glutamatérgicos, como el receptor NMDA (78). Un estudio reciente (81) también mostró alteraciones significativas en la expresión de ARNm de las subunidades NR2A y NR2B de los receptores NMDA, y que los receptores colinérgicos disminuyeron en la expresión particularmente de a7- nAChR con m1AChR incrementado.
Muscimol es el isoxazol psicoactivo más importante de A. pantherina y A. muscaria que causa sedación y delirio. Es un análogo estructural del neurotransmisor inhibidor ácido g-aminobutírico (GABA), debido a lo cual es un potente agonista de los receptores GABAA y GABAA-ρ (conocidos antes como GABAC; tienen alta expresión en la retina) (82). Al ser potente agonista de los receptores GABAA muscimol causa incoordinación, sensación de embriaguez, mareos y somnolencia simulando un coma que puede durar 24 horas. Pero generalmente se produce una recuperación total con el tiempo.
Los receptores GABAA se encuentran en la membrana de sus neuronas postsinápticas, si bien algunas isoformas se pueden encontrar extrasinápticamente. El muscimol puede activar a los receptores tanto postsinápticos como extrasinápticos de GABAA (83). Cuando se administra muscimol, éste es particularmente activo en el cerebro, corteza cerebral y en el hipocampo.
A. muscaria y A. pantherina, por la acción del ácido iboténico y muscimol se usan asiduamente en determinados ritos chamánicos, como sacramento, en Méjico, Guatemala y en Rusia (Siberia), entre otros países. Al ser ingerido, el ácido iboténico se convierte en parte en muscimol que se excreta prácticamente inalterado por orina, de allí la práctica de beber la orina de los chamanes por parte de los asistentes a los ritos. La orina tendría el mismo efecto que A. muscaria, sin los efectos negativos de náuseas y vómitos provocados por la muscarina, que no se encuentra en la orina ya que se metaboliza en el organismo (61).
Muscazona es un aminoácido tóxico que en investigaciones farmacológicas resultó ser menos activo que el ácido iboténico o el muscimol. Su consumo causa lesiones visuales, confusión mental y pérdida de memoria.
En los pacientes, la mayor parte del ácido iboténico ingerido se excreta sin cambios en orina, con sólo una fracción que se metaboliza a muscimol, que es 5-10 veces más potente (84).
Los dos aminoácidos no proteinogénicos 2-oxo-piranos, ácido estizolóbico y ácido estizolobínico (66), son aminoácidos excitadores en las neuronas centrales de los mamíferos que se unen preferentemente a otros receptores distintos del receptor de tipo NMDA; así, han presentado acción excitadora en la médula espinal aislada de rata (73) (85). Ambos aminoácidos son antagonistas competitivos del receptor tipo quiscualato en la unión neuromuscular del cangrejo de río, por lo que disminuyeron las respuestas al glutamato y quiscualato de manera competitiva en esa unión, sin afectar las respuestas a GABA (86). El ácido estizolobínico fue aproximadamente 5 veces menos potente que el ácido estizolóbico (85) (86).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Amanitaceae. Amanita muscaria (L.) Lam. [Bas.: Agaricus muscarius L.] crece en las regiones templadas y boreales del hemisferio norte, pero también en América del Sur, en Brasil (87) y en la Argentina (provincias de Mendoza, Córdoba, Buenos Aires y Andes patagónicos argentinos) (7) (9) (88) en todas sus variedades; Amanita pantherina Gonn. & Rabenh. (sección Amanita) se encuentra en la Argentina (en Cariló, Partido de Pinamar, Provincia de Buenos Aires) entre pinocha, en bosque implantado de Pinus maritimus y en distintas áreas del continente americano, como Méjico (89), EE.UU. y Uruguay, así como en el continente europeo (90). En Europa, A. pantherina fue encontrada asociada con distintas especies de Quercus, Pinus y Castanea sativa, entre otras (91), mientras que en EE.UU. sólo fue encontrada asociada con especies de Pinus. Existe una importante cantidad de variedades y formas de A. pantherina; Amanita gemmata (Fr.) Bertill. [Bas.: Agaricus gemmatus Fr.] (sección Amanita) crece en el hemisferio norte y en América del Sur, en Buenos Aires y en el sur de la Argentina, en bosque implantado de Pinus maritimus (88) (92); Amanita regalis (Fr.) Michael [Bas.: Agaricus muscarius ß regalis Fr; sin.: Agaricus muscarius var. umbrinus (Pers.) Fr.; Amanita muscaria var. regalis (Fr.) Sacc.; A. emilii Riel; A. umbrina Pers.] crece en los países escandinavos, noreste de Europa y en Alaska, principalmente; A. velatipes G. F. Alk. crece en el este de América del Norte; A. cothurnata G. F. Atk. [Sin.: Venenarius cothurnensis (G.F. Atk.) Murrill] crece en América del Norte.
2.5. Toxíndrome coprínico o cardiovascular. Micetismo inducido por alcohol o reacción tipo disulfiram
Las dos especies más importantes que causan este micetismo son Ampulloclitocybe clavipes y Coprinopsis atramentaria, pero hay otras especies sospechosas, como Coprinus comatus (“sombrero lanudo de tinta”, o en inglés: “shaggy inkcap”, “lawyer’s wig”) (93) (94).
Coprinopsis atramentaria (“sombrero común de tinta”, o en inglés: “common inkcap”) no es un hongo comestible, si bien fue considerado comestible y algunos autores aún hoy así lo registran, siempre y cuando no haya consumo concomitante de alcohol (95); lo mismo ocurre con C. comatus.
Han ocurrido varias intoxicaciones después del consumo de los carpóforos combinados con la ingesta de bebidas alcohólicas.
Período de latencia. Por lo general treinta minutos después de la ingestión. El micetismo es inducido por el consumo de alcohol. Sin embargo, los primeros síntomas pueden aparecer dentro de los 15 minutos a 2 horas tras la ingestión; generalmente 3-6 horas después de la exposición combinada, pero la sensibilidad al alcohol puede persistir 2-3 días después del consumo de los carpóforos.
Sintomatología. Los síntomas duran cerca de dos horas, con recuperación completa y pueden repetirse siempre que se tomen bebidas alcohólicas durante unos días.
Los síntomas típicos son: rubefacción de cara, cuello, tronco y extremidades, sofocones, dolor de cabeza, palpitaciones, náuseas y vómitos, dolor de pecho, disnea. También se presentan de manera variable, sabor metálico, diarrea, sudoración, taquicardia, arritmias cardíacas, hipotensión, vértigos y alteraciones visuales. En casos muy raros se pueden llegar a producir lesiones hepáticas o renales.
La gravedad de los síntomas depende de la cantidad consumida de carpóforos y alcohol, así como del tiempo entre estas ingestas. Los síntomas también aparecen si el alcohol fue consumido con una anterioridad de cuatro horas a la comida, o si su consumo es posterior (incluso hasta cuatro días después). Según el grado de alcohol ingerido, los síntomas pueden ser muy leves o no llegar a producirse.
Las intoxicaciones más graves, o más alarmantes, se refieren a Coprinopsis atramentaria (96), el resto de las especies únicamente producen molestias y vómitos, como es el caso de C. comatus que causa trastornos gastrointestinales y escalofríos entre media hora y 8 horas después del consumo de los carpóforos (97).
Además, en pruebas cutáneas se han registrado casos de reacciones alérgicas por el contacto con extractos de tejidos de estos hongos (98) (99).
Toxina. La sustancia responsable de este micetismo es la coprina (Fig. 10), que fue aislada e identificada como el agente causal en 1975 por dos grupos de investigación que acordaron darle ese nombre (100) (101) y su estructura se confirmó por síntesis (102).

Figura 10: Estructura química de coprina.
Los carpóforos de C. atramentaria contienen un rango de coprina de 160-360 mg/kg de carpóforos frescos. La cantidad es mayor en los carpóforos viejos y en los jóvenes es la mitad (102) (103). Coprina puede también estar presente en menores cantidades, ~10-15 mg/ kg hasta 26 mg/kg de peso fresco, como en C. comatus (96) (103). La presencia de coprina fue confirmada por espectrometría de masa (93).
La coprina (Fig. 10) es un aminoácido no proteico con una estructura inusual, pues contiene un anillo de ciclopropano y es relativamente estable ya que no se destruye durante la cocción de los carpóforos.
Esta intoxicación producida por coprina también se denomina de tipo “antabús” o disulfiram, porque los síntomas son parecidos a los provocados por dicho medicamento, utilizado para tratar el alcoholismo crónico.
También se aislaron dos iludinas, C2 y C3 (Fig. 11), de cultivos de C. atramentaria, con efectos antimicrobianos in vitro (104). Las iludinas C2 y C3 son muy similares a iludina S que es responsable de las intoxicaciones por consumir Omphalotus olearius (ver sección 2.1.5 de la Parte 3), particularmente en el centro y sur de Europa (14). No se conoce la toxicidad de las iludinas C2 y C3.

Figura 11: Estructuras químicas de iludina C2 e iludina C3.
En carpóforos de C. comatus, además de coprina, se identificaron otros compuestos bioactivos, como melaninas, estatinas, furanos y furanonas nematicidas y ergotioneína (Fig. 12) (105). También se demostró actividad de lectina en eritrocitos de conejo, pero no se caracterizó a la lectina con respecto a la capacidad de unión, estabilidad o masa molecular (106).
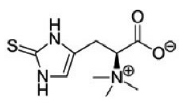
Figura 12: Estructura química de ergotioneína.
C. comatus es un hongo nematófago que forma esferas espinosas en las hifas vegetativas, que aumentan su actividad nematicida al dañar mecánicamente la cutícula del nematodo, lo que causa la pérdida del fluido pseudocoelómico (107). La infección fúngica de los nematodos ocurre sólo después de ser inmovilizados por toxinas del hongo; un nematodo infectado es digerido y consumido en cuestión de días y las hifas crecen en su interior. Se aislaron seis furanos y furanonas nematicidas en micelios cultivados de C. comatus (107) (108) que inmovilizan a los nematodos: ácido 5-metilfuran-3-carboxílico, 5-hidroxi-3,5-dimetilfuran-2(5H)- ona, 5-hidroxi-3-(hidroximetil)-5-metilfuran-2(5H)-ona, 4,6-dihidroxiisobenzofuran-1,3-diona, 4,6-dihidroxibenzofuran-3(2H)-ona, 4,6-dimetoxiisobenzofuran-1(3H)- ona y acetato de 3-formil-2,5-dihidroxibencilo (Fig. 13). Los dos primeros mostraron la actividad nematicida más potente (107).

Figura 13: Estructuras químicas de furocompuestos, furanonas y derivados que inmovilizan nematodos.
Mecanismo de acción de la coprina. La coprina se metaboliza en ácido glutámico y en 1-aminociclopropanol (Fig. 14), que es la sustancia biológicamente activa que inhibe a la enzima acetaldehído-deshidrogenasa que participa en el metabolismo oxidativo del alcohol (109).

Figura 14: Metabolismo de coprina.
Las enzimas acetaldehído-deshidrogenasas (EC 1.2.1.10) catalizan la oxidación de acetaldehído a ácido acético que en presencia de coenzima A (CoA) forma acetil-CoA (Fig. 15). En los seres humanos hay genes que codifican esta actividad enzimática.
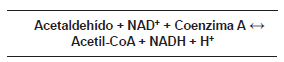
Figura 15: Reacción de oxidación de acetaldehído a ácido acético catalizada por acetaldehído-deshidrogenasa.
Por hidrólisis de coprina se forma hidrato de ciclopropanona (Fig. 16), además de 1-aminociclopropanol. Ambos compuestos han demostrado actividad in vitro e in vivo. El metabolismo adicional puede producir metabolitos muy reactivos que pueden reaccionar con un grupo tiol de la deshidrogenasa y bloquear la enzima, aumentando la concentración de acetaldehído en sangre. Esto puede explicar muchos de los síntomas de intoxicación aguda observados después del consumo de C. atramentaria junto con bebidas alcohólicas (96) (110).

Figura 16: Estructura química del hidrato de ciclopropanona.
Cuando se bloquea esta enzima, se acumula acetaldehído en sangre, y causa una condición similar a la que sufren los asiáticos orientales (chinos, japoneses y coreanos) por variaciones de los genes que codifican las dos enzimas de metabolización del alcohol, alcohol-deshidrogenasa y acetaldehído-deshidrogenasa, que es la “reacción de arrebato por alcohol”, llamada en inglés “alcohol flush reaction” (111). La persona desarrolla arrebatos o sofocones, eritema en la cara, el cuello, los hombros y, en algunos casos, en todo el cuerpo después de consumir bebidas alcohólicas. La reacción es el resultado de una acumulación de acetaldehído, que es un subproducto metabólico del catabolismo del etanol y es causada por una deficiencia o mal funcionamiento de las enzimas deshidrogenasas mencionadas.
Ensayos de coprina en animales. Se demostró que los animales de experimentación, como ratas y ratones, después de la ingesta combinada de etanol y C. atramentaria alcanzaron un nivel elevado de acetaldehído en sangre, con algunos de los mismos síntomas registrados en humanos, como caras hinchadas, lagrimeo y disminución de la presión sanguínea en ratas (100-102).
Estudios con coprina administrada por vía oral en diferentes dosis en combinación con etanol (inyección intraperitoneal) y con diferentes intervalos de tiempo demostraron el bloqueo de la enzima acetaldehído-deshidrogenasa, que causa diferentes niveles de acetaldehído en sangre (102).
En un estudio de 14 días de toxicidad oral en dosis repetidas en ratas macho se aplicaron dosis de 20 y 200 mg de coprina por kg de peso corporal (20 y 200 mg/kg) (112). A la dosis de 200 mg/kg, la coprina causó cambios graves en los testículos, probablemente debido a los efectos directos sobre las células germinales. A esta dosis alta de coprina se registraron linfopenia y trombocitopenia pronunciadas y el examen histológico mostró depresión de médula ósea e hipercelularidad del bazo, el timo y los nódulos linfáticos. A la dosis baja (20 mg/kg) no se observaron efectos relacionados con el tratamiento, excepto una reducción pequeña pero significativa en el recuento de trombocitos.
De acuerdo con los estudios en animales, la dosis oral más baja farmacológicamente activa de coprina es de 10 mg/kg de peso corporal en ratas y el “nivel sin efecto adverso observable” o índice de toxicidad NOAEL (sigla correspondiente en inglés a: No Observed Adverse Effect Level) es inferior a 20 mg/kg de peso corporal en ratas (95).
Además, los efectos causados por coprina son similares a los observados después de la exposición a agentes alquilantes. También la coprina es mutagénica in vitro en el test de Ames que utiliza Salmonella serovar Typhimurium como organismo indicador para la actividad mutagénica (112). Estas observaciones indican que probablemente la coprina sea un carcinógeno genotóxico, y de acuerdo con los estudios disponibles, no es posible proporcionar un nivel de ingesta segura de carpóforos de C. atramentaria.
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Hygrophoraceae (113): Ampulloclitocybe clavipes (Pers.) Redhead, Lutzoni, Moncalvo & Vilgalys [Bas.: Agaricus clavipes Pers.; sin.: Agaricus comitialis Pers., Clitocybe clavipes (Pers.) P. Kumm., Clitocybe comitialis (Pers.) P. Kumm., Omphalia clavipes (Pers.) Quél., Clavicybe clavipes (Pers.) Harmaja, Clitocybe squamulosoides P.D. Orton]. Familia: Coprinaceae: Coprinopsis atramentaria (Bull.) Redhead, Vilgalys & Moncalvo [Bas.: Agaricus atramentarius Bull.; sin.: Coprinus atramentarius (Bull.) Fr.] es un hongo saprótrofo de crecimiento solitario o fasciculado alrededor de la madera muerta, que crece en zonas templadas a boreales, en los países nórdicos europeos, en las regiones urbanas y a lo largo de los caminos en EE.UU. (95) (97), en la Argentina (Buenos Aires y en las provincias de Córdoba, Neuquén, Río Negro y Tierra del Fuego) (7) (9) (94); Coprinopsis insignis (Peck) Redhead, Vilgalys & Moncalvo [Bas.: Coprinus insignis Peck]; Coprinopsis variegata (Peck) Redhead, Vilgalys & Moncalvo [Bas.: Coprinus variegatus Peck; sin.: C. ebulbosus Peck, C. quadrifidus Peck, C. atramentarius var. variegatus (Peck) Rick]; Coprinus comatus (O.F. Müll.) Pers. [Bas.: Agaricus comatus O.F. Müll.; sin.: Coprinus ovatus (Schaeff.) Fr., C. columellifer Speg.] es un hongo saprótrofo y nematófago, que crece en campo abierto, jardines, bosques, manglares y otras áreas fertilizadas; tiene la misma distribución geográfica en Europa, EE.UU. y la Argentina que C. atramentaria (93) (97), pero en la Argentina se extiende además a provincias del noroeste, centro y noreste (provincias de Salta, Tucumán, Catamarca, Entre Ríos, Santa Fe, Córdoba, Buenos Aires, Mendoza, Neuquén y Río Negro) (7) (9) (94).
2.6. Toxíndrome neurotóxico alucinogénico. Micetismo por psilocibina y derivados indólicos
Este micetismo es provocado por especies de los géneros Psilocybe, Panaeolus, Conocybe y Pluteus. Las variedades alucinógenas de Psilocybe fueron utilizadas por los pueblos prehistóricos con fines religiosos y de curación. En la actualidad, la mayoría de las personas que consumen hongos de psilocibina buscan intencionalmente una experiencia psicodélica.
Los hongos alucinogénicos suelen denominarse “hongos mágicos”, refiriéndose a aquellos que contienen los componentes psicoactivos psilocina y psilocibina, los principales componentes activos de especies de Psilocybe (114). El uso de “hongos mágicos” se ha vuelto popular entre los jóvenes, especialmente de EE.UU., porque son relativamente baratos y hay menos conciencia de culpa que con otras drogas.
Psilocybe semilanceata y P. subbalteatus están presentes abundantemente en el centro y el norte de Europa y son tóxicos (115).
Varias especies tóxicas que contienen psilocibina se encuentran en regiones tropicales y subtropicales de todo el continente americano [América del Sur, América Central y América del Norte (Méjico y EE.UU.)] (116).
Período de latencia. El período de latencia es muy corto; de 15 a 30 minutos después de la ingestión. Se dice que es de unos treinta minutos después de la ingestión de ~ 20 g de carpóforos frescos o 4-8 mg de psilocibina pura (117).
Sintomatología. Presentan alteraciones sensoriales, pulso lento, tensión baja, visión borrosa, midriasis, sudoración, debilidad, mareos, escasos síntomas digestivos.
Aumento de la percepción del color, percepciones alteradas de espacio-tiempo, trastornos del estado de ánimo, efectos emocionales que van desde el éxtasis a la ansiedad y, a veces, alucinaciones o delirios, risas involuntarias, bienestar.
Las respuestas a la toxina pueden variar en cada individuo. Un paciente puede sentirse relajado, mientras que otro puede experimentar ansiedad, mareos, o tensión. En algunos casos, puede ocurrir malestar abdominal y náuseas junto con diarrea y vómitos.
Alucinaciones auditivas y visuales, desorientación, taquicardia, trastornos mentales, agresividad, pérdida de control, euforia, actos de violencia, convulsiones, coma mortal si son dosis altas. Tanto las alucinaciones como los cambios de comportamiento, dependen del estado de ánimo y de la personalidad del intoxicado.
Pueden ocurrir respuestas de pánico que incluyen locura o miedo a la muerte. Los efectos visuales aumentan a lo largo de los períodos posteriores y desaparecen más tarde. También se han registrado hipertensión, midriasis, taquicardia, disritmias e infarto de miocardio (118).
Los síntomas duran generalmente unas 6 horas, en algunos casos nueve horas y raramente 12 horas, después de la ingestión, generalmente sin secuelas, salvo en niños pequeños, a los que les puede producir la muerte.
Toxinas. El efecto narcótico que producen por ingestión ciertas especies de hongos se debe a compuestos indólicos derivados del 4-hidroxiindol (sustitución que rara vez se observa en plantas), como: psilocibina (4-fosforiloxi-N,N-dimetiltriptamina), psilocina, baeocistina y norbaeocistina (Fig. 17) que provienen del metabolismo del aminoácido triptofano. La psilocina es el compuesto desfosforilado que se oxida y se descompone fácilmente y no es de naturaleza alucinogénica. Además, norbaeocistina y baeocistina son derivados sin N-metilo y N-monometilado de psilocibina respectivamente.

Figura 17: Estructuras químicas de psilocina, psilocibina, baeocistina, norbaeocistina y aeroginascina.
Todos estos compuestos son triptaminas, activas en el sistema nervioso central, con efectos alucinogénicos (119). Psilocina es un alcaloide indólico que se encuentra en especies del género Psilocybe que presenta una bioactividad similar a la dietilamida del ácido lisérgico (LSD), harmina y otras triptaminas psicoactivas [bufotenina, DMT (N,N-dimetiltriptamina), etc.], que inducen efectos psicoactivos, tales como: cambios en la percepción, alteración del estado de ánimo y alucinaciones con colores brillantes (120). Se han estudiado las alteraciones de la percepción por acción exógena con sustancias alucinogénicas y por producción endógena por compuestos indólicos como DMT, que se ha obtenido también en orina de pacientes esquizofrénicos (121) (122) y se ha estudiado la cinética a corto y largo plazo mediante estudios de radiomarcación
Son sustancias hidrosolubles, desaparecen con el agua de cocción, pero no con la desecación de los hongos.
El compuesto fosforilado psilocibina también está presente y se convierte fácilmente en psilocina in vivo. La baeocistina y norbaeocistina se encuentran como componentes menores en hongos psicoactivos del género Psilocybe. El derivado trimetilado de psilocibina, aeruginascina (Fig. 17), se ha aislado de otro hongo alucinogénico, Inocybe aeruginascens (124).
Los compuestos psilocibina y psilocina y sus derivados se han aislado de más de 150 especies de hongos, pero se encuentran principalmente en los siguientes géneros: Psilocybe, Panaeolus, algunos Gymnopilus y Stropharia aeruginosa. La mayor concentración de psilocibina se encuentra en Psilocybe azurescens de EE.UU. (Oregon) con hasta 1,8% de psilocibina, 0,5% de psilocina y 0,4% de baeocistina en peso seco. Este hongo es cultivado en EE.UU., Nueva Zelanda y Alemania. Todos estos compuestos indólicos pueden determinarse en los fluidos biológicos de los pacientes (125).
Conocybe cyanopus, Panaeolus subbalteatus, Pluteus salicinus y Psilocybe semilanceata tienen cantidades moderadas (>0,5% de peso seco) de psilocibina. P. semilanceata y P. subbalteatus son los únicos carpóforos que contienen psilocibina que están presentes abundantemente en el centro y el norte de Europa y son tóxicos (115). P. semilanceata, Psilocybe cubensis, Psilocybe mexicana, Psilocybe bohemica y Psilocybe baeocistis son los más comúnmente consumidos. Pequeñas cantidades de psilocina y 0,2%- 0,4% de psilocibina se encuentran en los carpóforos de P. mexicana.
Los valores de DL50 de psilocibina en ratones vía i.v. e i.p. son 275 y 420 mg/kg respectivamente (126).
Mecanismo de acción. Estos compuestos indólicos presentan una similitud estructural con el neurotransmisor serotonina y el efecto alucinogénico de los “hongos mágicos” es por lo tanto causado por su interferencia con las acciones normales de la serotonina cerebral, como se demostrara mediante tomografía de emisión de positrones (127).
La psilocibina se convierte rápidamente en psilocina en el cuerpo a través de la desfosforilación. La psilocina es un agonista de receptor mixto y varios receptores serotoninérgicos, como 5-HT1A, 5-HT2A y 5-HT2C, son parcialmente inhibidos por esta toxina. Tiene una alta afinidad por el receptor de serotonina 5-HT2A en el cerebro, donde imita los efectos de serotonina (5-HT o 5-hidroxitriptamina). La psilocina se une menos fuertemente con otros receptores serotoninérgicos 5-HT1A, 5-HT2C y 5-HT1D.
Se considera que el modo de acción de todas las triptaminas alucinogénicas mencionadas ocurre a través del agonismo no selectivo de varios receptores serotoninérgicos del sistema nervioso central, específicamente los receptores 5-HT1A, 5-HT2A y 5-HT2C (119) (128) (129).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Strophariaceae (o Hymenogastraceae según la clasificación): Psilocybe cubensis (Earle) Singer [Bas.: Stropharia cubensis Earle] crece en la Argentina (provincias de Entre Ríos y Buenos Aires e Islas Malvinas; también crece en otros países de América Central y del Sur: Belice, Brasil, Colombia, Costa Rica, Cuba, República Dominicana, Dominica, Ecuador, El Salvador, Guadalupe, Guatemala, Guyana francesa, Martinica; Panamá; Perú; Puerto Rico; Trinidad Tobago y Venezuela (9)(94)(130) (131); Psilocybe mexicana R. Heim crece en Colombia, Costa Rica y Guatemala (131) (132) como P. subacutipilea (131); Psilocybe cyanescens Wakef. crece en Guatemala (131); Psilocybe semilanceata (Fr.) P. Kumm. crece en Chile, centro y el norte de Europa (131); Psilocybe caerulipes Peck; Psilocybe coprophila (Bull.) P. Kumm. [Bas.: Agaricus coprophilus Bull.; sin.: Deconica coprophila (Bull.) Fr.] crece en la Argentina (provincias de Córdoba, Buenos Aires y Tierra del Fuego, e Islas Malvinas) (7) (94) (130) (131); S. aeruginosa (Curtis) Quél. crece en Francia y Brasil (131); Stropharia aeruginosa var. neuquenensis M.M. Moser & Singer crece en la Argentina (7) (94) (131); Protostropharia semiglobata (Batsch) Redhead, Moncalvo & Vilgalys [Bas.: Agaricus semiglobatus Batsch; sin.: Stropharia semiglobata (Batsch) Quél., Psilocybe semiglobata (Batsch) Noordel.]; Stropharia coronilla (Bull.) Quél. crece en Francia, Argentina (provincia de Córdoba) y Brasil (7) (9) (94) (131); S. coronilla var. magnispora Raithelh. crece en la Argentina (7) (94) (131). Familia: Coprinaceae: Panaeolus papilionaceus (Bull.) Quél. [Bas.: Agaricus papilionaceus Bull.; sin.: Panaeolus sphinctrinus (Fr.) Quél., P. campanulatus (L.) Quél., P. retirugis (Fr.) Gillet] crece en Francia y la Argentina (provincias de Salta, Tucumán, Catamarca, Chaco, San Juan, Mendoza, Córdoba, Buenos Aires, Neuquén, Río Negro, Santa Cruz y Tierra del Fuego, e Islas Malvinas) (7) (9) (94) (130); Panaeolus cyanescens (Berk. & Broome) Sacc.; Panaeolus fimicola (Pers.) Gillet [Bas.: Agaricus fimicola Pers.] crece en la Argentina (provincia de Córdoba) (94); Panaeolus cinctulus (Bolton) Sacc. [Bas.: Agaricus cinctulus Bolton; sin.: Panaeolus subbalteatus (Berk. & Broome) Sacc., P. alveolatus Peck, P. acidus Sumstine, P. semiglobatus (Murrill) Sacc. & Trotter, P. rufus Overh., P. variabilis Overh., P. venenosus Murrill, P. pumilus (Murrill) Murrill, P. dunensis Bon & Courtec, Psilocybe vernalis Velen.] crece en Europa, Asia (Japón, India, Rusia), África (Sudáfrica), Oceanía (Australia y Nueva Zelanda), América del Norte (Canadá, EE.UU. y Méjico), América del Sur [Argentina (provincia de Misiones), Brasil y Chile] (94) (133); Psathyrella candolleana (Fr.) Maire [Bas.: Agaricus candolleanus Fr.; sin.: Hypholoma candolleanum (Fr.) Quél., Agaricus appendiculatus Bull., Hypholoma appendiculatum (Bull.) Quél.] crece en Europa, América del Norte y en América del Sur [Argentina (provincias de Tucumán, Misiones, Córdoba, Buenos Aires, Tierra de Fuego y Andes Patagónicos)] (7) (9) (94).
2.7. Toxíndrome psicotrópico por estirilpironas y gimnopilinas. Micetismo debido al hongo alucinogénico Gymnopilus spectabilis o Gymnopilus junonius
El hongo alucinogénico Gymnopilus spectabilis (=Gymnopilus junonius) es conocido como “hongo grande de la risa” en Japón (“Ohwaraitake” en japonés) ya que puede causar ese efecto en aquellos que lo ingieren crudo (134- 136). El extraño comportamiento de las personas intoxicadas por ingestión de este hongo se ha registrado en la literatura (“Konjaku Monogatari”) en el siglo XII (135).
Esta especie carnosa de gran porte, de sombrero color castaño-amarillento a anaranjado, que al tocar los ejemplares maduros deja las manos manchadas de color anaranjado, es muy amarga y muy tóxica (134). El sabor amargo desaparece por secado y por cocción en agua o vinagre.
Se lo consume mucho en el norte de la Argentina y en Uruguay para acompañar carnes (en Uruguay el llamado “chivito”) (134).
Puede producir alteraciones de tipo alucinatorio y sedante por contener sustancias psicotrópicas (varias diferentes a las de otros hongos alucinogénicos, sumadas a la psilocibina en algunos), por lo que su consumo puede acarrear problemas serios para la salud.
Tiempo de latencia. Es de 15 a 30 minutos.
Sintomatología. Estos hongos provocan un efecto embriagador en las personas que los comen, las cuales pueden entusiasmarse mucho, bailar y cantar, y tener diversos tipos de visiones. Las personas que ingieren los carpóforos de este hongo suelen tener alucinaciones visuales y auditivas. Los consumidores describen efectos marcadamente diferentes a las especies de Psilocybe, ya que G. spectabilis aumenta la claridad, mientras que Psilocybe la quita (136).
Este hongo causa intoxicaciones con predominio alucinogénico, debido a la presencia de psilocibina en algunos ejemplares según su ubicación geográfica (o variedad), a estirilpironas como bis-noryangonina e hispidina que producen estado de embriaguez y alucinaciones, así como a los compuestos neurotóxicos denominados gimnopilinas con actividad despolarizante en el sistema nervioso central.
Toxinas. G. spectabilis o G. junonius es una fuente de metabolitos únicos, varios alucinogénicos, que le dan el sabor fuertemente amargo, que lo hace indeseable como comestible. De los carpóforos de G. spectabilis de Corea se aislaron 4,6-decadiín-1,3,8-triol, ergosta- 4,6,8(14),22-tetraen-3-ona (Fig. 18) y las estirilpironas antioxidantes y antimicrobianas bis-noryangonina e hispidina (Fig. 18) (137), que están relacionadas estructuralmente con las a-pironas que se encuentran en la bebida psicoactiva “kava” (136). Hispidina es un inhibidor potente, permeable a las células y reversible de la isoforma Cβde proteínquinasa C (PKCβ; CI50 = 2 µM); con efecto citotóxico mayor en células tumorales.

Figura 18: Estructuras químicas de bis-noryangonina, hispidina, 4,6-decadiín-1,3,8-triol y ergosta-4,6,8(14),22-tetraen-3-ona.
Los primeros compuestos que se aislaron de los carpóforos de G. spectabilis o G. junonius de Japón fueron gimnoprenoles (gimnoprenol-A, -B y -F), que son un tipo novedoso de polisoprenpolioles con 45 a 50-60 átomos de carbono (138-141) que suelen llamarse gimnopilinas. De la misma especie recolectada en Alemania se aisló gimnoprenol F, redesignado como gimnopilina, un principio amargo, que resultó ser un medio éster del ácido b-metil-b-hidroxiglutárico con gimnoprenol-A
(138)(139). También se aislaron y se caracterizaron cerevisterol, compuestos acetilénicos (142), el esteroide ergosterol, que es un metabolito muy frecuente en hongos, y el ácido (E,E)-7,12-dioxooctadeca-8,10-dienoico (ácido ostopánico, C18 H28O4) que es un ácido graso citotóxico que inhibe in vitro el crecimiento de células de leucemia linfocítica P-388 con una (DE: dosis efectiva) DE50 de 1,5 mg/mL (143).
De los carpóforos se aislaron como principios amargos algunas gimnopilinas activas sobre el sistema nervioso central por seguimiento de la actividad despolarizante mediante una preparación de médula espinal de rata recién nacida (135). Mediante separación y purificación completa de la mezcla de gimnopilinas se obtuvieron tres grupos de gimnopilinas con respecto al número de dobles enlaces centrales: gimnopilina 1 (m=1), gimnopilina 2 (m=2) y gimnopilina 3 (m=3) (Fig. 19). La actividad despolarizante sólo se encontró para las gimnopilinas 2 y 3. La separación adicional de la gimnopilina 2 dio las gimnopilinas 2a, 2b y 2c (Fig. 19), cuya actividad despolarizante disminuyó en el siguiente orden: 2a>2b>2c. La muestra de gimnopilina 2a mostraba actividad despolarizante aún a una concentración de 10 μM. La gimnopilina 3 exhibió actividad en una solución más diluida (135).

Figura 19: Estructuras químicas de gimnopilina K, gimnopilina A9, gimnopilina A10, gimnopileno y gimnoprenol A9.
Posteriormente, se obtuvo una nueva gimnopilina llamada gimnopilina K (Fig. 19), junto con cuatro compuestos conocidos, como: gimnopilina A9 o gimnopilina (135), gimnopilina A10 (135), gimnopileno (141) y gimnoprenol A9 (135) (Fig. 19), que presentan actividad citotóxica contra las líneas celulares tumorales humanas A549, SK-OV-3, SK-MEL-2 y HCT-15 (144).
Si bien se identificó psilocibina como sustancia alucinogénica en algunos hongos norteamericanos (este de EE.UU.) y europeos de G. spectabilis y en otras especies de Gymnopilus (145), no es común en los carpóforos de G. spectabilis o G. junonius que crecen en Japón (142).
Los especímenes que se encuentran en Corea o en el este de EE.UU. suelen contener psilocibina, contrariamente a los del oeste de EE.UU. En Italia, el consumo de esta especie está prohibido, al igual que el de las especies de los géneros Stropharia y Psilocybe, por contener sustancias alucinogénicas en una cantidad variable.
Mecanismo de acción. Se considera que las gimnopilinas son un factor clave en la intoxicación por G. spectabilis o G. junonius. Se encontró que las gimnopilinas de carpóforos de esta especie actúan sobre el sistema circulatorio en base a los efectos de estos compuestos sobre la presión sanguínea y la actividad contráctil del músculo liso vascular (preparados de aorta) de rata (146). La norepinefrina y la angiotensina II contraen la aorta mediante la activación de sus receptores específicos en las células del músculo liso vascular. La estimulación mediante concentración alta de K+ contrae la aorta por despolarización de la membrana celular que activa directamente los canales de Ca2+ dependientes de voltaje. Las gimnopilinas relajaron las tiras de aorta que fueron contraídas mediante estos tres tipos diferentes de estimulación, lo que indica que las gimnopilinas no compiten con la norepinefrina ni la angiotensina II por la unión a los receptores para relajar la aorta. Los resultados sugieren que el mecanismo de la vasodilatación inducida por gimnopilina es independiente de las cascadas de señales para la contracción que preceden a un aumento en la concentración de Ca2+ intracelular.
A diferencia de muchos vasodilatadores de origen vegetal que actúan mediante estimulación del endotelio, se demostró que las gimnopilinas tienen un mecanismo directo de vasodilatación sobre las células del músculo liso vascular (146).
Como las gimnopilinas provocan un fuerte efecto vasodilatador, podrían disminuir la presión sanguínea. Por el contrario, las gimnopilinas causaron hipertensión y ligera disminución de la frecuencia cardíaca después de ser inyectadas. Es decir que, las gimnopilinas podrían aumentar el volumen sistólico del corazón y/o la tensión de la arteria a través de la excitación del nervio vasomotor que supera el efecto relajante directo sobre el músculo liso vascular.
Además, se demostró que las gimnopilinas activan los receptores ligados a proteína G (GPCRs, en inglés: G protein–coupled receptors) en particular los acoplados a proteína Gq expresados en neuronas y células gliales en los ganglios de la raíz dorsal y la corteza cerebral de la rata (147). Este efecto puede llevar a la despolarización de las motoneuronas. Es decir, las gimnopilinas pueden distribuirse en el sistema nervioso central al cruzar la barrera hematoencefálica y entonces actuar directamente sobre las células del sistema nervioso central para excitar al centro vasomotor. Esto podría ser causa de los síntomas del micetismo.
Se demuestra que gimnopilina moviliza el ion calcio (Ca2+) intracelular en las células ganglionares de la raíz dorsal. Para ello, se examinaron los efectos de la gimnopilina sobre las concentraciones intracelulares del ion calcio ([Ca2+]i) de células (neuronas y células no neuronales) cultivadas aisladas del ganglio de la raíz dorsal de rata (147). Estos resultados indican que gimnopilina activó a la fosfolipasa C y movilizó Ca2+ del almacenamiento intracelular de Ca2+ en las células no neuronales del ganglio de la raíz dorsal. Es decir que la gimnopilina actúa directamente sobre las células aisladas del sistema nervioso de los mamíferos (147).
Posteriormente, se demostró que las gimnopilinas actúan directamente sobre los receptores nicotínicos de acetilcolina e inhiben su actividad (148). Esta acción biológica de gimnopilinas puede ser una de las causas de la intoxicación por G. spectabilis o G. junonius.
Especie causante del micetismo. División: Basidiomycota, Clase: Agaricomycetes, Orden: Agaricales, Familia: Cortinariaceae: Gymnopilus spectabilis (Fr.) Singer; actualmente el nombre correcto es Gymnopilus junonius (Fr.) Ort. [Bas.: Agaricus junonius Fr.; sin.: Agaricus aureus Sowerby, Agaricus aureus Bull., Lepiota aurea Gray, Gymnopilus spectabilis A.H. Smith, G. spectabilis var. junonius (Fr.) Kühner & Romagn., Pholiota junonia (Fr.) P. Karst., Pholiota grandis Rea, Pholiota spectabilis var. junonia (Fr.) J.E. Lange] crece en Asia (Corea, Japón), Norte de África, Australia, algunos países europeos, América del Norte (algunos estados de EE.UU.) y América del Sur (Uruguay, Argentina, Paraguay y Chile) (149) por lo general en densos grupos o a veces solitario, en tocones y troncos de caducifolios y más frecuente en coníferas; es muy común en los bosques de Eucalyptus spp., donde suele crecer en la base de los troncos de los árboles vivos (hongo parásito), aunque también en tocones muertos (hongo saprófito). Su sombrero puede alcanzar más de 20 cm de diámetro y el estipe puede medir hasta 25 cm de largo y unos 2,5 cm de grosor.
Algunos autores consideran a G. junonius (Fr.: Fr.) Ort. como una variedad de G. spectabilis (Fr.) Singer. Esta especie era conocida anteriormente como G. spectabilis o Pholiota spectabilis var. junonia (Fr.) J.E. Lange.
2.8. Toxíndrome agudo de rabdomiólisis. Micetismo por Russula subnigricans
Russula subnigricans es un hongo tóxico conocido como Nisekurohatsu en Japón, que se encuentra muy distribuido en Asia, en países como Japón, China, Taiwán, Corea y Nepal. La especie fue nombrada por el micólogo japonés Tsuguo Hongo en 1955. La ingestión de los carpóforos ha provocado intoxicaciones graves en Taiwán, Japón, Corea y China, causando rabdomiólisis (150-153).
Dado que R. subnigricans es muy similar a un hongo comestible, Russula nigricans, plantea un riesgo para los humanos. Su carne se torna de color rojo pálido cuando se corta, tiñéndose de rojo lentamente, pero no se vuelve negra como ocurre con R. nigricans.
La identificación de las especies del género Russula es difícil y es considerada un desafío, porque las especies se distinguen entre sí por diferencias sutiles, arbitrarias y muy variables (154). Afortunadamente, la mayoría de las especies de Russula no son tóxicas, si bien varias provocan dolor de estómago, pero la excepción es la especie mortal R. subnigricans. Período de latencia. Latencia muy corta. Los síntomas se inician entre 30 minutos y 2 horas después del consumo de los carpóforos.
Sintomatología. Los síntomas consisten en náuseas, vómitos, diarrea y dolor abdominal. Estos son síntomas comunes e inespecíficos de intoxicación por ingestión de hongos. Sin embargo, dentro de las 6-12 horas las víctimas también tienen debilidad, dolores musculares, deterioro del habla, convulsiones, contracción de la pupila, rigidez en los hombros, dolores de espalda, dificultad para respirar y mioglobinuria, debido a la rabdomiólisis, en que es un síndrome doloroso de degradación y necrosis del tejido muscular, que da como resultado el volcado de los componentes intracelulares en la circulación y en el líquido extracelular, lo que convierte a la orina en color rojo y contribuye a la insuficiencia renal (155). La rabdomiólisis también puede ser inducida por daño físico al tejido muscular o abuso de drogas como la cocaína. Se estima que ~10-50% de los pacientes con rabdomiólisis desarrollan insuficiencia renal aguda.
Los casos más graves pueden presentar insuficiencia respiratoria, insuficiencia renal aguda, edema pulmonar, taquicardia ventricular, shock circulatorio y muerte (150-152) (156). Justamente los hongos que causan rabdomiólisis pueden producir miocarditis, miocardiopatía, disritmias y colapso cardiovascular (4) (156) (157). La mayoría de las muertes ocurren 12 a 24 horas después de la ingestión (155).
El estudio bioquímico muestra un aumento de la enzima creatínfosfoquinasa y alteración electrolítica severa (hipercalemia, hipocalcemia) (156).
Historia de la intoxicación. Primeros casos clínicos y valores de laboratorio clínico. Las intoxicaciones por R. subnigricans son conocidas en Japón desde 1954. En el período 2005 a 2007 se produjeron 5 fallecimientos, seguidos de 2 más hasta 2009 (150).
En octubre de 2001 se describió que el consumo de carpóforos de R. subnigricans provocaba rabdomiólisis. Se pensaba que era la primera vez que se describía un micetismo con rabdomiólisis (156), pues se desconocía que un mes antes se había publicado la intoxicación por el consumo de Tricholoma equestre, que cursaba con rabdomiólisis y tiempos de latencia muy largos, como se ha analizado en la Parte 2 de esta serie de artículos (2).
El brote de rabdomiólisis publicado en 2001 se debió al consumo de una sopa cocinada con R. subnigricans (156). De nueve comensales, dos presentaron rabdomiólisis grave pero no mortal. Inicialmente, todos tuvieron dos horas después de la ingesta un cuadro gastrointestinal (náuseas, vómitos y diarrea) que en siete individuos remitió de manera espontánea a las 24 horas. En cambio, los dos restantes, seis horas más tarde, presentaron además un cuadro de rabdomiólisis. Uno de ellos presentó al segundo día un pico máximo de creatínfosfoquinasa de 2.225 U/L; no desarrolló otras complicaciones y fue dado de alta totalmente recuperado. En cambio el otro presentó un pico máximo de creatínfosfoquinasa de 204.500 U/L, y se acompañó de debilidad, dolores musculares generalizados, disnea, insuficiencia respiratoria, trastornos electrolíticos [iones potasio (K+) 6,5 mEq/L], insuficiencia renal, taquicardia ventricular y shock circulatorio. Requirió ventilación asistida y hemodiálisis. Respondió al tratamiento médico y fue dado de alta 33 días después de su ingreso (156).
En Japón, en 2010 hubo un nuevo caso de un hombre de 62 años de edad, que fue internado con dolor de espalda, debilidad muscular y mialgias, síntomas que aparecieron 20 horas después de haber consumido una comida con R. subnigricans (158). La debilidad muscular persistió durante más de una semana; el pico máximo de creatínquinasa fue de 42.689 U/L. La rabdomiólisis fue confirmada mediante resonancia magnética nuclear (158). En 2015 se describió la intoxicación de siete miembros de una familia con R.subnigricans. Sus manifestaciones clínicas variaron desde síntomas gastrointestinales a rabdomiólisis, con una muerte (159).
En 2016 se describió el primer caso en Corea de rabdomiólisis por R. subnigricans. El paciente de 51 años padeció rabdomiólisis, insuficiencia renal aguda, hipocalcemia severa, insuficiencia respiratoria, taquicardia ventricular, shock cardiogénico y muerte (152).
Se investigaron casos de micetismos en el sur de China desde 1994 a 2012, que involucraron a 852 pacientes y 183 muertes; R. subnigricans fue la especie que causó la cuarta parte de todas las intoxicaciones presentadas (155).
Una clave para la supervivencia de los pacientes con rabdomiólisis causada por R.subnigricans es el reconocimiento precoz y el cuidado intensivo de apoyo (159).
Toxina. El compuesto responsable de la rabdomiólisis por ingestión de R. subnigricans es el ácido cicloprop- 2-en-carboxílico (Fig. 20), con un ciclo muy pequeño y muy tensionado; tiene como marcador un aumento en la actividad de la enzima creatínfosfoquinasa sérica tanto en ratones como en humanos (150). Al ser administrado en forma oral a ratas provocó rabdomiólisis. El valor de DL100 (dosis letal que mata al 100% de las ratas) de este ácido por vía oral es de 2,5 mg/kg, que correspondería en humanos al consumo de dos a tres carpóforos. El ácido cicloprop-2-en-carboxílico es muy inestable y al concentrar soluciones de esta toxina se produce su polimerización que causa la pérdida de su toxicidad (150).

Figura 20: Estructura química del ácido cicloprop-2- en-carboxílico.
Los carpóforos también poseen un compuesto polifenólico tetraclorado con actividad citotóxica, denominado rusufelina A (Fig. 21) (160).

Figura 21: Estructura química de rusufelina A.
Cuando se aisló por primera vez rusufelina A se creyó que era la toxina responsable de la intoxicación hasta que se obtuvo el ácido ciclopropen-2-carboxílico (150).
Las otras especies que producen rabdomiólisis por ingestión pertenecen al género Tricholoma y son: Tricholoma equestre y Tricholoma terreum. Sin embargo ambas no parecen contener el ácido descripto en R. subnigricans. Además, a diferencia de esta última, las dos especies de Tricholoma presentan sintomatología demorada con tiempos de latencia muy largos como se ha visto en la Parte 2 de esta serie de artículos (2).
De R. subnigricans se aislaron también el aminoácido (2S,3R)-(-)-3-hidroxibaikiaína, junto con baikiaína y ácido pipecólico (Fig. 22) (73).

Figura 22: Estructuras químicas de (2S,3R)-(-)-3-hidroxibaikiaína, junto con baikiaína y ácido pipecólico.
Recientemente, se determinó que ciclopropilacetil- (R)-carnitina (Fig. 23) es un componente de R. subnigricans que sirve como marcador químico específico de esta especie, ya que provee señales en el espectro de resonancia magnética nuclear protónica (1H-RMN) que aparecen en la región de campos altos, que son fácilmente reconocibles y no se superponen con las numerosas señales del extracto crudo (151). De esta manera, se puede discriminar R. subnigricans auténtica de especies similares de Russula no identificadas.

Figura 23: Estructura química de ciclopropilacetil-(R)-carnitina.
Mecanismo de acción. Si bien no se conoce el mecanismo de acción del ácido cicloprop-2-en-carboxílico, esta toxina parece desencadenar una cascada de reacciones en el cuerpo, lo que provoca una descomposición generalizada del músculo y conduce a problemas respiratorios y cardíacos (problemas en músculos del diafragma y del corazón). Debido a la degradación del tejido muscular, se transportan cantidades masivas de uno de sus componentes químicos (mioglobina) a los riñones (150).
La rabdomiólisis provocada por ingestión de R. subnigricans parece ser diferente a la causada por T. equestre (157), ya sea por la toxina o por el mecanismo de acción.
Especie causante del micetismo. División: Basidiomycota; Clase: Homobasidiomycetae; Subclase: Hymenomycetes; Orden: Russulales; Familia: Russulaceae: R. subnigricans Hongo proviene del Este Asiático.
2.9. Toxíndrome cianogénico. Micetismo por Marasmius oreades
Las plantas y hongos cianogénicos están muy distribuidos en la naturaleza. Uno de los hongos cianogénicos es Marasmius oreades (“senderuela”; forma anillos de hadas) que es, por lo tanto, muy tóxico si se lo come crudo por los efectos del cianuro. Tanto los carpóforos como los micelios de M. oreades producen grandes cantidades de cianuro de hidrógeno (así se llama en estado gaseoso) o ácido cianhídrico (cuando se encuentra en solución acuosa) (HCN), lo cual ya había sido demostrado en el siglo XIX (161).
Este hongo es muy apreciado por su sabor, cuando está cocido la carne es dulce, de olor a almendras y de color claro. El sabor dulce se debe a la presencia de trehalosa [α-D-glucopiranosil-(1→1)-α-D-glucopiranósido], que es un azúcar disacárido que permite que el hongo reviva al contacto con el agua, tras haber sido deshidratado, y permite la creación de esporas para volver a reproducirse.
Compuesto químico precursor del ácido cianhídrico. Se identificó la cianhidrina del ácido glioxílico (Fig. 24) como precursor del ácido cianhídrico en el hongo M. oreades y otros hongos cianogénicos (162). De manera similar a las bacterias, la biosíntesis del ácido cianhídrico se inicia a partir de glicina, pero a diferencia de las bacterias, muchos hongos cianogénicos almacenan ácido cianhídrico en forma de cianhidrina, como en este caso lo es la cianhidrina del ácido glioxílico. Por lo tanto, la cianogénesis de M. oreades y otros hongos es diferente a la de las plantas, en las que el precursor es generalmente un glicósido. En cambio, los animales, especialmente los artrópodos, al igual que los hongos superiores, pueden usar cianhidrinas como precursores de ácido cianhídrico (163).

Figura 24: Formación de ácido cianhídrico a partir de su precursor, la cianhidrina del ácido glioxílico.
La cianhidrina del ácido glioxílico sirve como precursor en la defensa química parcialmente constitutiva y parcialmente activada ante lesiones. La detección de ácido cianhídrico en carpóforos aparentemente intactos podría atribuirse a la baja estabilidad de la cianhidrina de ácido glioxílico, que está en equilibrio con el ácido cianhídrico y ácido glioxílico (Fig. 24). El mecanismo de defensa química basado en cianhidrina de ácido glioxílico como precursor de ácido cianhídrico parece estar muy extendido en los hongos, ya que este compuesto se detectó no sólo en M. oreades, sino también en los carpóforos de Marasmius wynnei, Marasmius androsaceus, Leucopaxillus giganteus, Clitocybe gibba, Clitocybe geotropa y Collybia confluens.
Acción en el área circundante a los carpóforos. Se demostró mediante experimentos in vitro y de campo que el cianuro producido por M. oreades y, además, concentrado por una disminución en la humedad del suelo cerca de los anillos de hadas (~25 cm), alcanzaría niveles inhibidores de la raíz del césped y del crecimiento de los carpóforos de algunos hongos (164). Es decir que M. oreades es un hongo parásito fitopatógeno que destruye especies de Poáceas (ex Gramíneas), como Poa pratensis y Festuca rubra en las proximidades del anillo de hadas (164). Además del ácido cianhídrico, los poliacetilenos y los terpenos también son responsables de los efectos nocivos sobre las Poáceas (162).
Se ha observado además que la cianhidrina de ácido glioxílico es capaz de formar complejos de potasio estables en fase gaseosa en base al comportamiento de la cianhidrina en el espectrómetro de masa. Por lo tanto, las características quelantes del ácido glioxílico liberado por el hongo en el suelo podrían retener los iones metálicos que son requeridos por las raíces del césped, complicando su desarrollo (165).
Se demostró que el ácido cianhídrico se produce en M. oreades a partir de un precursor inactivo estable debido a una lesión, ya que los carpóforos dañados producen cantidades significativamente más altas de HCN que los intactos. También se verificó que la liberación de ácido cianhídrico ocurre enzimáticamente tras lesión de los carpóforos (162).
Especie causante del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Subclase: Hymenomycetes; Orden: Agaricales; Familia: Marasmiaceae: Marasmius oreades (Bolt.) Fr. crece en Europa y en toda América del Norte, incluido Méjico, generalmente formando anillos de hadas.
2.10. Toxíndrome inmunosupresor. Micetismo por tricotecenos macrocíclicos de Podostroma cornu-damae
El hongo Podostroma cornu-damae es de color rojo intenso, con forma de cuernos de ciervo. Sus carpóforos son muy tóxicos y han sido responsables de varias muertes en Asia, especialmente en Japón, China y Corea. En una serie de casos, este hongo mortal fue confundido en su forma inmadura con Ganoderma lucidum, que no es tóxico y es consumido por sus propiedades curativas (166).
La Enciclopedia Británica enumera a Podostroma cornu-damae como el segundo hongo superior más tóxico del mundo (167).
Período de latencia. Menor de 6 horas.
Sintomatología. La ingestión de P. cornu-damae produce malestar gastrointestinal, diarrea, vómitos y deshidratación en las primeras etapas, seguidos por hipotensión, oliguria, cambios en la percepción y alteración del estado mental. Sin tratamiento, los pacientes presentan una disminución de glóbulos blancos (leucopenia) y de plaquetas (trombocitopenia), descamación de la piel de las palmas y la cara y también pérdida de cabello (166). Los pacientes finalmente mueren por disfunción orgánica múltiple; pueden sucumbir a la sepsis secundaria a la pancitopenia.
En conclusión, los sistemas primarios afectados por este micetismo son el inmunológico y el hematológico. Se han registrado varios casos fatales de intoxicaciones en Japón como resultado del consumo de este hongo (168).
Historia del micetismo. Casos clínicos. En 2001 se describió la primera intoxicación producida por este hongo en 1999, cuando una persona de un grupo de cinco en Japón, murió dos días después de consumir un gramo de P. cornu-damae empapado en sake. En 2000, un individuo también en Japón, murió después de comer el hongo frito. Los síntomas en estos casos incluyen los signos gastrointestinales, hematológicos, cutáneos y de percepción ya mencionados, pero además encogimiento del cerebelo que causa impedimentos en el habla y problemas con el movimiento voluntario (169). En otro caso posterior, la autopsia reveló insuficiencia orgánica múltiple, que incluía insuficiencia renal aguda, necrosis hepática y coagulación intravascular diseminada (170).
En un caso de intoxicación por ingestión de P. cornu-damae, el paciente (varón de 62 años) sufrió diarrea intensa, vómitos y deshidratación marcada en una primera etapa y, siete días después de haber ingerido el hongo, hemofagocitosis, además de leucocitopenia y trombocitopenia graves (171). Este paciente al día siguiente de haber ingerido P. cornu-damae, por la fuerte deshidratación que sufriera, recibió unos 9 litros de solución por vía intravenosa durante un período de 12 horas y fue trasladado a un centro médico general ese mismo día. Cuando llegó, se observó hipotensión debido a la alta permeabilidad capilar acompañada de fuga de proteínas, leucocitosis y eritema leve en el cuerpo. Inmediatamente el paciente fue tratado con hemodiafiltración continua y se administraron grandes cantidades de solución salina con monitoreo de la presión capilar pulmonar y del gasto cardíaco. En el séptimo día, la leucocitopenia y la trombocitopenia se volvieron severas y se observó hemofagocitosis. Se utilizaron eficazmente intercambio de plasma y factor estimulante de colonias de granulocitos para tratar estos trastornos hematológicos. Además, se observó hipouricemia, pérdida severa de pelo y las lesiones cutáneas cambiaron gradualmente a descamación de la piel. El paciente sobrevivió, si bien necesitó más de 30 días para recuperarse de la leucocitopenia (171).
En 2009 se registró la intoxicación de 13 pacientes, con dos muertes, desde 1983 a 2008, por ingerir varios centímetros de P. cornu-damae (172). En 2013 se publicó un caso de intoxicación mortal en Corea, por consumo de P. cornu-damae (173). Un hombre de 73 años, tres horas después del consumo del hongo hervido presentó un cuadro gastrointestinal; al cuarto día de su ingreso presentó hipotensión, pancitopenia, dificultad respiratoria, hipoxemia y neumonía necrotizante. Se le practicó neumectomia izquierda. Posteriormente, presentó insuficiencia renal, hepática, coagulopatía intravascular diseminada y shock. A pesar de tratamiento intensivo falleció por disfunción multiorgánica al día 13 de su ingreso. La histología pulmonar mostró necrosis hemorrágica, infiltración pulmonar inflamatoria masiva, proliferación de fibroblastos y formación de una membrana hialina a lo largo de la pared alveolar (173).
En ese mismo año, también en Corea, hubo otros dos casos que ocurrieron por recolectar una pieza de P. cornu-damae mezclada con carpóforos del hongo medicinal Ganoderma lucidum (168). Hirvieron los carpóforos y bebieron el agua durante un mes, hasta ser internados. Uno de los pacientes ingresó con un cuadro febril de 10 días de duración y falleció al sexto día de su ingreso, con pancitopenia, descamación de las palmas de las manos y pies, sepsis, neumonía y falla multiorgánica. El otro paciente sobrevivió después de un mes de tratamiento conservador (168).
Toxinas. De los carpóforos de P. cornu-damae se aislaron los tricotecenos macrocíclicos: satratoxina H, satratoxina H 12’,13’-diacetato, satratoxina H 12’-acetato y satratoxina H 13’-acetato (Fig. 25). Cuando se cultiva en cultivo líquido, el hongo produce además roridina E, verrucarina J y satratoxina H (Fig. 25). Con excepción de verrucarina J, una dosis de 0,5 mg de cada uno de estos compuestos por vía intraperitoneal en ratones, produjo la muerte de los mismos al día siguiente (169).

Figura 25: Estructuras químicas de satratoxina H, satratoxina H 12’,13’-diacetato, satratoxina H 12’-acetato, satratoxina H 13’- acetato, roridina E y verrucarina J.
Especie causante del micetismo. División: Ascomycota; Clase: Sordariomycetes; Orden: Hypocreales; Familia: Hypocreaceae: Podostroma cornu-damae (Pat.) Hongo & Izawa [Bas.: Hypocrea cornu-damae Pat.; sin.: Podocrea cornu-damae (Pat.) Sacc. & D. Sacc.] crece en Japón, China, Corea y Java.
2.11.Toxíndrome hemolítico debido a ostreolisina de Pleurotus ostreatus y especies relacionadas
Pleurotus ostreatus (“hongo ostra” o “gírgola”; “Oyster Mushroom”) es uno de los hongos más comúnmente cultivados y consumidos en todo el mundo (174). Se utiliza con frecuencia en la cocina japonesa, coreana y china como parte de las “delikatessen”, y también en Kerala (India) y en la cocina contemporánea checa y eslovaca. Este hongo tiene mejor sabor cuando se cosecha joven. A medida que el hongo envejece la carne se endurece y se vuelve acre y desagradable.
No se han informado intoxicaciones tras el consumo de carpóforos de “hongos ostra” cocidos, sino por el contrario son considerados beneficiosos para la salud (175). Sin embargo, hay algunos indicios de que la ingesta de grandes cantidades de este hongo crudo o insuficientemente cocido puede dar lugar a intoxicaciones (176) (177).
Hay también otras especies similares como Pleurotus citrinopileatus (“hongo ostra dorada”; “Golden Oyster”) y Pleurotus eryngii (“hongo ostra rey”; “King Oyster”) y sus variedades que son también comestibles, comúnmente cultivados y consumidos (110).
Sintomatología. El consumo de estos hongos crudos, en particular de P. ostreatus, produce lesión endotelial con edema en corazón y pulmones, así como hemorragias del miocardio. También hay hemorragias en el intestino y en otros tejidos. El examen histológico presentó cambios hepáticos patológicos (176) (177).
Toxinas. La ostreolisina, una proteína ácida de 15 kDa, termolábil, se obtuvo de carpóforos de P. ostreatus (178). Es una citolisina tóxica que lisa eritrocitos bovinos, ovinos y humanos in vitro y probablemente también tiene efectos similares in vivo, como lo indica el aumento de potasio en suero (179). Se estudiaron sus propiedades tóxicas en roedores y la DL50 en ratones fue de 1.170 µg/kg (178-180).
En 2004, se aisló y caracterizó de P. ostreatus una citolisina formadora de poros, pleurotolisina, que consiste en dos componentes no asociados, pleurolisina A de 17 kDa y pleurolisina B de 52 kDa (181). Cooperativamente, estos dos componentes causan la salida de iones potasio de los eritrocitos humanos y edema pronunciado que conduce a hemólisis (181).
Una lectina dimérica de 32,4 kDa también se ha aislado de P. citrinopileatus (182), con alta actividad de hemaglutinación y estabilidad hasta 60 °C.
También, una hemolisina monomérica, designada eringeolisina de 17 kDa se aisló de carpóforos de P. eryngii, y presentó similitud estructural con la ostreolisina de P. ostreatus. Resultó estable en el rango de pH 4,0- 12,0, pero sólo hasta 30 °C (183). Más recientemente, se obtuvo de P. eryngii una hemolisina termoestable de dos componentes: erilisina A (15 kDa; homodímero) y erilisina B [52 kDa; heterodímero de B1 (15 kDa) y B2 (37 kDa)] (184). Erilisina (A y B) es similar a pleurotolisina (A y B) obtenida de P. ostreatus (181). Ambas hemolisinas requieren la coexistencia de las unidades A y B para exhibir una actividad fuerte.
La falta de registros de intoxicaciones después del consumo de estas especies de Pleorutus completamente cocidas, indica que durante la cocción y/o digestión se elimina cualquier efecto tóxico de las citolisinas. Si bien se sabe que algunas otras lectinas en ciertos alimentos pueden causar efectos gastrointestinales.
Además se identificaron pequeñas cantidades de cianuro de hidrógeno en P. ostreatus, P. citrinopileatus (161) y en P. eryngii (185). Durante la cocción el compuesto cianogénico es destruido casi completamente y, en consecuencia, no implica riesgo alguno para la salud de los consumidores. Así, al cocinar en agua a 95 °C durante 6 minutos los carpóforos de P. eryngii cortados en rodajas, se pierde el 89% del cianuro de hidrógeno original (185).
P. ostreatus contiene una serie de compuestos indólicos simples, biológicamente activos (5-hidroxitriptofano, serotonina y triptamina) (186) que por ebullición de los carpóforos cambian significativamente, ya que el 5-hidroxitriptofano y la serotonina se descomponen y forman triptofano y 5-metiltriptofano. Algunos de estos componentes son hormonas tisulares y neurotransmisores; altas ingestas de triptofano pueden dañar al sistema nervioso (187).
P. ostreatus contiene pequeñas cantidades de arabitol, un glicitol que puede causar malestar gastrointestinal en algunas personas. La ergotioneína y la estatina lovastatina se han encontrado en los carpóforos y en los micelios de P. ostreatus, P. citrinopileatus y de P. eryngii (105). Por el proceso de cocción la lactona lovastatina puede hidrolizarse al ácido hidroxicarboxílico correspondiente, que es la forma activa hipolipidémica (188). Pero las estatinas, en ciertos casos, causan miopatía que se caracteriza por debilidad y/o dolor muscular y, en casos muy raros, rabdomiólisis (189).
Se han aislado e identificado tres lactonas α,β- insaturadas bioactivas a partir de un cultivo sólido de P. eryngii: eringiólido A, 1,2-dihidroximintlactona y 5-hidroxi-3,4,5-trimetilfuran-2(5H)-ona. Se considera que la estructura de cetona α,β-insaturada es un alerta estructural de genotoxicidad. Sólo el eringiólido A (Fig. 26) mostró toxicidad contra las líneas celulares de cáncer humano, HeLa y HepG2 (190). El eringiólido A es un diterpenoide con un esqueleto de ciclododecano sustituido y fusionado con dos grupos lactona.

Figura 26: Estructura química del eringiólido A.
Otra lactona α,β-insaturada, la pleurona (4H-1,3-dioxin-2,4-diona) ha sido aislada de carpóforos de P. eryngii var. ferulae, que resultó ser un inhibidor moderado in vitro de elastasa de neutrófilos humanos (191). Recientemente también se obtuvieron ergostanos de P. eryngii (192).
P. ostreatus, P. pulmonarius y P. eryngii y sus variedades son representantes de los pocos basidiomicetos carnívoros conocidos, ya que sus micelios pueden matar y digerir nematodos, que es la manera que tienen estos hongos de obtener nitrógeno. P. ostreatus secreta diminutas gotitas que contienen toxinas, que paralizan a un nematodo sin matarlo en 30 segundos de contacto, luego la presa es penetrada por las hifas tróficas del hongo y es digerida en 24 horas (108). El primer nematicida obtenido de P. ostreatus fue el ácido 2E-decendioico (Fig. 27). El ácido (S)-(9Z,11E)-13-hidroxi-9,11-octadecadienoico (o ácido S-coriólico) (Fig. 27) y el ácido linoleico se aislaron de P. pulmonarius y presentaron una muy potente actividad nematicida. También se obtuvieron p-anisaldehído, alcohol p-anisílico, 1-(4-metoxifenil)-1,2- propanodiol y 2-hidroxi(4’-metoxi)-propiofenona (Fig. 27) algo menos activos, de P. pulmonarius (193).

Figura 27: Estructuras químicas de ácido 2E-decendioico, ácido S-coriólico,p-anisaldehído, alcohol p-anisílico, 1-(4-metoxifenil)-1,2-propanodiol y 2-hidroxi(4’-metoxi)propiofenona.
Se aislaron tres compuestos nematicidas de P. eryngii var. ferulae: cheimonofilona E, 5α,8α-epi-dioxiergosta- 6,22-dien-3β-ol y 5-hidroximetilfurancarbaldehído (Fig. 28) (194).

Figura 28: Estructuras químicas de cheimonofilona E, 5a,8a-epi-dioxiergosta- 6,22-dien-3b-ol y 5-hidroximetil-furancarbaldehído.
Mecanismo de acción. Los efectos tóxicos y letales de extractos de P. ostreatus crudos y de ostreolisina se estudiaron en roedores. La administración oral o intraperitoneal de hasta 1.000 mg del extracto de P. ostreatus/kg de peso corporal/día en ratones durante 30 días produjo hemorragias en el intestino y en otros tejidos. Los principales hallazgos histológicos fueron cambios hepáticos patológicos, pero de una manera no dependiente de la dosis (176).
El electrocardiograma, la presión arterial y la actividad respiratoria se registraron bajo anestesia general, en ratas intactas, farmacológicamente vagotomizadas y con respiración artificial inyectadas con una DL50 de ratón. Unos pocos segundos después de la inyección intravenosa de ostreolisina se registró un aumento transitorio de la presión arterial, seguido de una caída progresiva a la presión media circulatoria acompañada de bradicardia, isquemia miocárdica y extrasístoles ventriculares (179).
La ostreolisina indujo lisis de los eritrocitos de rata in vitro, y probablemente también in vivo como lo indica el aumento de potasio sérico. Si bien no se puede excluir la acción directa de la proteína sobre los cardiomiocitos o la circulación cardíaca, la hiperpotasemia resultante de la actividad hemolítica probablemente desempeña un papel importante en su toxicidad (179). La letalidad y la acción tóxica cardiorrespiratoria de ostreolisina pueden explicar los efectos adversos registrados por consumo de P. ostreatus crudo.
Después de la aplicación parenteral de ostreolisina a ratas se pudieron demostrar lesiones endoteliales con edema en corazón y pulmones, así como hemorragias del miocardio (177).
Especies causantes del micetismo. División: Basidiomycota; Clase: Agaricomycetes; Orden: Agaricales; Familia: Pleurotaeae: Pleurotus ostreatus (Jacq.: Fr.) P. Kumm. es un hongo saprotrófico, que crece en grupos sobre troncos de bosques caducos vivos y muertos, raramente en coníferas, en bosques templados y subtropicales de todo el mundo, también en zonas templadas de Europa y en regiones subárticas/subalpinas de los países nórdicos de Europa (110). No se encuentra en el noroeste de América del Norte, donde es reemplazado por P. pulmonarius. Se cultiva en muchas partes del mundo. P. ostreatus crece en la Patagonia Argentina sobre troncos de Araucaria araucana, un árbol nativo poco utilizado por los hongos para desarrollarse (195). Los ensayos de compatibilidad confirmaron que en la Argentina hay, hasta ahora, cinco especies de Pleurotus: Pleurotus albidus (Berk.) Pegler, Pleurotus cystidiosus O.K. Mill. [Sin.: Pleurotus smithii Guzman], Pleurotus djamor (Rumph.: Fr.) Boedijn., P. ostreatus (Jacq.: Fr.) P. Kumm. y P. pulmonarius (Fr.: Fr.) Quél. (196). P. djamor con tres variedades: var. djamor, var. cyathiformis y var. roseus (197); Pleurotus citrinopileatus Singer es un hongo saprotrófico que crece en forma silvestre en bosques de hoja caduca en Japón y el lejano este de Rusia (198); Pleurotus eryngii (DC.) Quél. (“Ostra Rey”, “King Oyster”) [P. eryngii var. ferulae (Lanzi) Sacc.] es un hongo saprotrófico que crece en hierbas umbelíferas altas muertas y también en vivas/ moribundas, en áreas abiertas parecidas a estepas, en forma silvestre en el área del Mediterráneo y hacia el este en China y Asia Central (198).
3. Tratamientos
Tratamiento del toxíndrome muscarínico o sudoriano. Este es el único síndrome que tiene un antídoto específico, la atropina, que se administra por vía intravenosa (4).
El carbón activado se puede usar para el tratamiento (0,5-1 g/kg de peso corporal), para retrasar la captación de la toxina muscarina. Dado que cuadros de toxicidad grave y de muerte son poco comunes, el tratamiento de la intoxicación con muscarina es principalmente de apoyo con rehidratación líquida y control de la secreción con atropina intravenosa, 0,01-0,02 mg/kg.
Tratamiento del síndrome paxiliano. El tratamiento del síndrome de Paxillus es totalmente de apoyo e incluye hemoperfusión o hemodiálisis y la muerte es rara (10) (11). Se usa la terapia por intercambio de plasma (11). Un paciente de 37 años enfermó gravemente después de la ingestión reiterada de Paxillus involutus suficientemente cocido; como resultado de la hemólisis con síntomas reversibles de shock, desarrolló insuficiencia renal aguda. El intercambio de plasma con 3.000 mL de albúmina al 5% se llevó a cabo diariamente durante los primeros 3 días después del ingreso. Cada intercambio de plasma disminuyó la hemoglobina libre y los niveles del complejo inmune en un 60-75%. La insuficiencia renal aguda se trató con éxito con hemodiálisis (11).
Tratamiento de la licoperdonosis. La licoperdonosis generalmente se trata con corticosteroides, que disminuyen la respuesta inflamatoria; a veces se administran junto con antimicrobianos (20) (28).
Los esteroides a menudo exacerban las infecciones fúngicas, sin embargo, en la mayoría de los casos descriptos, la mejoría respiratoria se logró después de la administración de corticosteroides (20) (21) (28) (46). La efectividad de los esteroides es muy respaldatoria de la teoría de que la licoperdonosis representa una reacción de hipersensibilidad; sin embargo, en algunos de estos casos, también se administraron antifúngicos (20). De hecho, la germinación de los elementos fúngicos nunca se ha reportado in vivo y, debido a las temperaturas corporales cálidas, no se cree que ocurra (28), lo que confirma aún más la probabilidad de que la licoperdonosis no represente una infección fúngica activa.
Tratamiento del toxíndrome panterínico o síndrome pantherina/muscaria. El tratamiento es sólo sintomático, y el pronóstico generalmente es bueno. La recuperación es rápida y completa en todos los pacientes. Si transcurrieren menos de cuatro horas después de la ingestión de A. muscaria, se puede usar carbón activado para eliminar los hongos del tracto digestivo lo más rápidamente posible y detener así la captación de ácido iboténico y de muscimol, evitando casi una mayor intoxicación. Simultáneamente se deben controlar los signos vitales del paciente; la toxicidad suele durar entre 6 y 8 horas; sin embargo, algunos síntomas pueden tardar unos días en desaparecer. Si el tratamiento ocurre dentro de la primera hora de la ingestión, el lavado gástrico puede ser efectivo.
A veces, se administran benzodiazepinas para controlar los ataques de pánico y las alucinaciones. En el estado comatoso, es importante controlar la respiración y la circulación. Si los vómitos se vuelven demasiado intensos, se pueden administrar fluidos por vía intravenosa. Si se observan síntomas de síndrome muscarínico al inicio de la intoxicación, se deben administrar pequeñas dosis de fármacos anticolinérgicos, como atropina por vía subcutánea (61) (65).
Tratamiento del toxíndrome alucinogénico por compuestos indólicos. Rara vez se requiere intervención terapéutica en adultos. Los síntomas de intoxicación pueden disminuir naturalmente, con una evolución espontáneamente favorable en 12 a 48 horas. En los casos graves se requiere internación para reanimación.
El tratamiento es sintomático (reposo, sedantes, monitoreo), sin embargo, la aplicación de fenotiazina o diazepam puede ser necesaria en algunos casos.
Las benzodiazepinas y los barbitúricos se han usado para controlar la agitación y las convulsiones.
Tratamiento de la rabdomiólisis causada por Russula subnigricans. El tratamiento para la rabdomiólisis en el caso de micetismo es principalmente de apoyo; no existe un antídoto específico. Los principales factores que determinan la supervivencia son la cantidad de hongos ingeridos y la rapidez con que comienza el tratamiento después de la ingestión.
En la rabdomiólisis se produce daño renal inducido por la mioglobina circulante después de la ruptura de las células musculares, por lo que hay que implementar estrategias terapéuticas para reemplazar la función renal defectuosa y medidas preventivas para evitar un mayor daño debido a obstrucción tubular renal, alteración de la hemodinámica intrarrenal y disfunción de las células tubulares.
Actualmente se usan como medidas de protección renal la expansión del volumen intravascular mediante fluidos alcalinos y la diuresis forzada mediante diuréticos osmóticos, pero no son útiles en el contexto de la oliguria grave. La insuficiencia renal aguda se trata con terapias de reemplazo renal clásicas.
También es importante remover la mioglobina circulante, para lo cual las técnicas extracorpóreas resultan poco efectivas por varias razones que dependen de la naturaleza del compuesto mioglobina, su distribución en el organismo, el mecanismo de transporte y la estructura de la membrana utilizada en la técnica extracorpórea.
La mioglobina tiene una masa molecular de 17 kDa, pero debido a que no es esférica y lleva cargas eléctricas, puede ser considerada un soluto con un radio de Einstein-Stokes mayor de lo esperado. Por lo tanto, no sólo tiene un coeficiente de difusión muy bajo, por lo que requiere transporte por convección, sino que también posee una magnitud estérica que es probable que sea rechazada por los poros de la membrana.
Los intentos previos para remover la mioglobina mediante intercambio de plasma, hemodiálisis intermitente y las terapias continuas de reemplazo renal (CRRT: continuous renal replacement therapies) lamentablemente han tenido un éxito limitado.
Se utilizó el clearance de mioglobina mediante hemofiltración continua con una membrana de “flujo super-alto” en un caso de rabdomiólisis aguda (199) que brindó un reemplazo renal eficiente y remoción rápida de la mioglobina circulante. Esta técnica continua con una membrana hiperpermeable permite un clearance de mioglobina significativamente mayor que el tratamiento control con una membrana estándar de alto flujo. No obstante, una posible limitación es la pérdida de albúmina.
En el caso de pérdidas excesivas de albúmina, la terapia de pulso de flujo súper alto podría usarse junto con hemofiltración veno-venosa continua (CVVH: continuous veno-venous hemofiltration) estándar durante unas pocas horas cada día como un compromiso entre los efectos beneficiosos de la remoción de mioglobina y los efectos negativos de las pérdidas excesivas de albúmina en los tratamientos continuos.
La disponibilidad comercial de tales membranas nuevas en la práctica diaria permitirá la aplicación clínica de las técnicas de hemofiltración de flujo súper alto.
Otra opción para la remoción de mioglobina en el tratamiento de la rabdomiólisis es el uso de un sorbente polimérico que puede usarse tanto en hemoperfusión como en combinación con terapias continuas de reemplazo renal tradicionales.
Se ha utilizado un nuevo adsorbente, CytoSorbTM (CytoSorbents Corp) en hemoperfusión durante 12 horas para remover mioglobina de la sangre en una situación compleja de rabdomiólisis asociada con neumonía por Legionella (200). CytoSorbTM es un polímero poroso biocompatible con alta capacidad de unión y diseñado para disminuir los niveles tóxicos de mediadores pro-y anti-inflamatorios, mioglobina y bilirrubina directamente de la sangre. Además, en un paciente con rabdomiólisis grave e insuficiencia renal aguda, después de una gastrectomía en manga laparoscópica, el cartucho se usó durante 24 horas y se instaló en serie después del dializador en el circuito de terapia continua de reemplazo renal (201).
Los resultados, antes y después del tratamiento, demostraron una disminución importante de los niveles de mioglobina (disminución en HP: 54,6%; CRRT + HP: 83,3%) y una mejora en la función renal tanto en la hemoperfusión (HP) independiente, como en combinación con terapias continuas de reemplazo renal (CRRT).
El uso de nuevos sorbentes en la filtración veno-venosa continua y hemoperfusión podría representar un enfoque novedoso para el tratamiento de la rabdomiólisis aguda.
Tratamiento de la intoxicación con Podostroma cornu-damae. El tratamiento incluye cuidados de apoyo, antibióticos para cubrir la fiebre neutropénica y factor estimulante de colonias de granulocitos para la pancitopenia (168). La plasmaféresis y la administración de factor estimulante de colonias de granulocitos se usaron para tratar los trastornos sanguíneos. Estos tratamientos, además del gran volumen de líquido intravenoso, 9 litros durante un período de 12 horas, administrado por vía intravenosa desde el día siguiente de ingerir el hongo tóxico, fueron los responsables de la recuperación exitosa de pacientes muy graves (171).
Mediante la transfusión de plaquetas, los pacientes pueden ser rescatados (168). Es importante infundir grandes cantidades de fluidos en el tratamiento inicial de la intoxicación por P. cornu-damae, y la terapia de purificación de la sangre (hemodiafiltración continua e intercambio de plasma) es muy recomendable.
4. Conclusiones
En esta Parte 4 de esta serie de cuatro artículos sobre micetismos se han analizado gran parte de los síndromes tempranos, con períodos de latencia menores de 6 horas, que presentan síntomas complejos. Por supuesto que quedan por analizar algunos síndromes menos conocidos y menos relevantes por la cantidad de intoxicados involucrados; pero en esta serie se ha discutido un número destacado de micetismos y con cierta profundidad de análisis.
Si bien en estos cuatro artículos se han enfatizado los aspectos tóxicos y letales de la ingestión de hongos superiores, los autores desean señalar que se conocen una gran variedad de macromicetos comestibles y con capacidad curativa que se han utilizado en distintas comunidades desde la antigüedad, pero que no han sido el objetivo de estos trabajos.
En cuanto a los tratamientos para los micetismos presentados se debe enfatizar la importancia de realizar un diagnóstico rápido y preciso en un centro médico y la identificación de los carpóforos por servicios micológicos especializados. Como ya se ha indicado en los artículos anteriores, en la Ciudad de Buenos Aires (Argentina) funciona el “Servicio de Identificación de Hongos Tóxicos”, en la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (FCEN-UBA; Pabellón 2, Departamento de Biodiversidad y Biología Experimental), con micólogos investigadores que colaboran con servicios médicos, estatales y privados, identificando los hongos en casos de micetismos, para que se pueda realizar el tratamiento médico adecuado (202).
Agradecimientos
Los autores agradecen al Hospital de Clínicas y a la Universidad de Buenos Aires por la infraestructura brindada; a la actual Secretaría de Ciencia, Tecnología e Innovación Productiva (ex Mincyt, Argentina) por las facilidades de acceso a la biblioteca electrónica. A.B.P. es Investigadora Superior del Consejo Nacional de Investigaciones Científicas y Técnicas de Argentina (CONICET).
1. Pomilio AB, Battista SM, Alonso A. Micetismos. Parte 1: Síndromes con período de latencia tardía. Acta Bioquím Clín Latinoam 2018; 52: 459-87. [ Links ]
2. Pomilio AB, Battista SM, Alonso A. Micetismos. Parte 2: Síndromes con sintomatología demorada y latencia muy larga. Acta Bioquím Clín Latinoam 2019; 53: 79-107. [ Links ]
3. Pomilio AB, Battista SM, Alonso A. Micetismos. Parte 3: Síndromes tempranos gastrointestinales. Acta Bioquím Clín Latinoam 2019; 53: 217-44. [ Links ]
4. Diaz JH. Syndromic diagnosis and management of confirmed mushroom poisonings. Crit Care Med 2005; 33: 427-36. [ Links ]
5. Niveiro N, Albertó E. Checklist of the Argentine Agaricales 4. Tricholomataceae and Polyporaceae. Mycotaxon 2012; 121: 499-500. [ Links ]
6. Niveiro N, Albertó E. Checklist of the Argentine Agaricales 7. Cortinariaceae and Entolomataceae. Check List 2014; 10 (1): 72-96. [ Links ]
7. Raithelhuber J. Nueva flora micológica argentina. Mycosur, Stuttgart, 2004. [ Links ]
8. Albertó E. El género Agaricus en la Provincia de Buenos Aires: I (Argentina). Secciones Agaricus y Sanguinolenti. Bol Soc Micol Madrid 1996; 21: 127-44. [ Links ]
9. Wright JE, Albertó E. Guía de hongos de la región pampeana. I. Hongos con laminillas. Editorial L.O.L.A., Buenos Aires, 2002. [ Links ]
10. Flammer R. [Paxillus syndrome: immunohemolysis following repeated mushroom ingestion]. Artículo en idioma alemán. Schweiz Rundsch Med Prax 1985; 74: 997-9. [ Links ]
11. Winkelmann M, Stangel W, Schedel I, Grabensee B. Severe hemolysis caused by antibodies against the mushroom Paxillus involutus and its therapy by plasma exchange. Klin Wochenschr 1986; 64: 935-8. [ Links ]
12. Edwards RL, Elsworthy GC, Kale N. Constituents of the higher fungi. Part IV. Involutin, a diphenylcyclopenteneone from Paxillus involutus (Oeder ex Fries). J Chem Soc C 1967; 405-9. [ Links ]
13. Feling R, Polborn K, Steglich W, Mühlbacher J, Bringmann G. The absolute configuration of the mushroom metabolites involutin and chamonixin. Tetrahedron 2001; 57: 7857-63. Feling R, Polborn K, Steglich W, Mühlbacher J, Bringmann G. Corrigendum. Tetrahedron 2001; 57: 10231. [ Links ]
14. Bresinsky A, Besl H. A colour Atlas of poisonous fungi: a handbook for pharmacists, doctors, and biologists. 1a ed, Wolfe Publishing Ltd.; 1990. [ Links ]
15. Antkowiak R, Antkowiak WZ, Banczyk I, Mikolajczyk L. A new phenolic metabolite, involutone, isolated from the mushroom Paxillus involutus. Can J Chem 2003; 81: 118-24. [ Links ]
16. Zhou Z-Y, Liu J-K. Pigments of fungi (Macromycetes). Nat Prod Rep 2010; 27: 1531-70. [ Links ]
17. Niveiro N, Albertó E. Checklist of the Argentinean Agaricales 6. Paxillaceae, Gomphidiaceae, Boletaceae and Russulaceae. Mycotaxon 2013; 123: 491. [ Links ]
18. Kruger D, Binder M, Fischer M, Kreisel H. The Lycoperdales: a molecular approach to the systematics of some gasteroid mushrooms. Mycologia 2001; 93: 947-57. [ Links ]
19. Larsson E, Jeppson M. Phylogenetic relationships among species and genera of Lycoperdaceae based on ITS and LSU sequence data from north European taxa. Mycol Res 2008; 112 (Pt 1): 4-22. [ Links ]
20. Taft TA, Cardillo RC, Letzer D, Kaufman CT, Kazmierczak JJ, Davis JP. Centers for Disease Control and Prevention (CDC). Respiratory illness associated with inhalation of mushroom spores - Wisconsin, 1994. MMWR Morb Mortal Wkly Rep 1994; 43: 525-6. [ Links ]
21. Rubensohn M. Inhalation pneumonitis in a dog from spores of puffball mushrooms. Can Vet J 2009; 50: 93. [ Links ]
22. Alenghat T, Pillitteri CA, Bemis DA, Kellett-Gregory L, Jackson KV, Kania SA, et al. Lycoperdonosis in two dogs. J Vet Diagn Invest 2010; 22: 1002-5. [ Links ]
23. Buckeridge D, Torrance A, Daly M. Puffball mushroom toxicosis (lycoperdonosis) in a two-year-old dachshund. Vet Rec 2011; 168: 304. [ Links ]
24. Bates ST, Papinutti L. Fungi of Argentina: gasteroid and secotioid taxa. Agaricaceae. Mycology Collections Portal. Disponible en http://mycoportal.org/portal/checklists/checklist.php?cl=31 (Fecha de acceso: 7 de septiembre de 2018). [ Links ]
25. Lemin M, Vasquez A, Chacon S. Etnomicología y comercialización de hongos en mercados de tres poblados del noreste del estado de Puebla, México. Brenesia 2010; (73/74): 58-63. [ Links ]
26. Papinutti L. Morganella sulcastoma en Argentina. Bol Soc Argent Bot 2014; 49: 173-6. [ Links ]
27. Nakazawa T, Tochigi T. Hypersensitivity pneumonitis due to mushroom (Pholiota nameko) spores. Chest 1989; 95: 1149-51. [ Links ]
28. Munson EL, Panko DM, Fink JG. Lycoperdonosis: Report of two cases and discussion of the disease. Clin Microbiol Newsl 1997; 19: 17-24. [ Links ]
29. Peroš-Golubičić T, Sharma OP. Hypersensitivity pneumonitis. Capítulo 16. En: Clinical atlas of interstitial lung disease. London: Springer-Verlag, 2006; pp. 91-5.
30. Girard M, Lacasse Y, Cormier Y. Hypersensitivity pneumonitis. Allergy 2009; 64: 322-34. [ Links ]
31. Geiser M, Leupin N, Maye I, Hof VI, Gehr P. Interaction of fungal spores with the lungs: distribution and retention of inhaled puffball (Calvatia excipuliformis) spores. J Allergy Clin Immunol 2000; 106 (1 Pt 1): 92-100. [ Links ]
32. Geiser M, Schurch S, Gehr P. Influence of surface chemistry and topography of particles on their immersion into the lung’s surface-lining layer. J Appl Physiol 2003; 94:1793-801.
33. Moore JE, Convery RP, Millar BC, Rao JR, Elborn JS. Hypersensitivity pneumonitis associated with mushroom worker’s lung: An update on the clinical significance of the importation of exotic mushroom varieties. Int Arch Allergy Immunol 2005; 136: 98-102.
34. Almendros G, Martín F, González-Vila FJ, Martínez AT. Melanins and lipids in Lycoperdon perlatum fruit bodies. Trans Br Mycol Soc 1987; 89: 533-7. [ Links ]
35. Nedelcheva D, Antonova D, Tsvetkova S, Marekov I, Momchilova S, Nikolova-Damyanova B, et al. TLC and GC‐MS probes into the fatty acid composition of some Lycoperdaceae mushrooms. J Liq Chromatogr Rel Technol 2007; 30: 2717-27. [ Links ]
36. Barros L, Dueñas M, Ferreira ICFR, Baptista P, Santos-Buelga C. Phenolic acids determination by HPLC-DAD-ESI/MS in sixteen different Portuguese wild mushrooms species. Food Chem Toxicol 2009; 47: 1076-9. [ Links ]
37. Szummy A, Adamski M, Winska K, Maczka W. Identyfikacja związków steroidowych i olejków eterycznych z Lycoperdon perlatum. [Identification of steroid compounds and essential oils from Lycoperdon perlatum]. Artículo en idioma polaco. Przemysł Chemiczny 2010; 89: 550-3. [ Links ]
38. Ramesh C, Pattar MG. Antimicrobial properties, antioxidant activity and bioactive compounds from six wild edible mushrooms of western ghats of Karnataka, India. Pharmacognosy Res 2010; 2: 107-12. [ Links ]
39. Dulger B. Antimicrobial activity of ten Lycoperdaceae. Fitoterapia 2005; 76: 352-4. [ Links ]
40. Pujol V, Seux V, Villard J. Research of antifungal substances produced by higher fungi in culture. Ann Pharm Fr 1990; 48: 17-22. [ Links ]
41. Lamotte JL, Oleksyn B, Dupont L, Dideberg O, Campsteyn H, Vermiere M. The crystal and molecular structure of 3-[(5S)-5-carboxy-2-oxotetrahydrofur-5-yl]-(2S)-alanine (lycoperdic acid). Acta Crystallogr B 1978; 34: 3635-8. [ Links ]
42. Falandysz J, Lipka K, Kawano M, Brzostowski A, Dadej M, Jedrusiak A, et al. Mercury content and its bioconcentration factors in wild mushrooms at Łukta and Morag, northeastern Poland. J Agric Food Chem 2003; 51: 2832-6. [ Links ]
43. Quince J-P. Lycoperdon perlatum, un champignon accumulateur de métaux lourds et de selenium. [Lycoperdon perlatum a fungus accumulating heavy metals and selenium]. Mycol Helv 1990; 3: 477-86. [ Links ]
44. Sari A, Tuzen M, Citak D. Equilibrium, thermodynamic and kinetic studies on biosorption of mercury from aqueous solution by macrofungus (Lycoperdon perlatum) biomass. Sep Sci Technol 2012; 47: 1167-76. [ Links ]
45. Strand RD, Neuhauser EB, Somberger CF. Lycoperdonosis. N Engl J Med 1967; 277: 89-91. [ Links ]
46. Henriksen NT. Lycoperdonosis. Acta Paediatr Scand 1976; 65: 643-5. [ Links ]
47. Læssøe T, Pegler DN, Spooner B. British Puffballs, Earthstars and Stinkhorns: An Account of the British Gasteroid Fungi. Kew, UK: Royal Botanic Gardens 1995; p. 152. [ Links ]
48. Kasuya T. Gasteromycetes of Chiba Prefecture, Central Honshu, Japan - I. The family Lycoperdaceae. J Nat Hist Mus Inst Chiba 2004; 8: 1-11. [ Links ]
49. Natarajan K, Purushothama KB. On the occurrence of Lycoperdon perlatum in Pinus patula plantations in Tamil Nadu. Curr Sci 1987; 56: 1117-8. [ Links ]
50. Moreno G, Lizárraga M, Esqueda M, Coronado ML. Contribution to the study of gasteroid and secotioid fungi of Chihuahua, Mexico. Mycotaxon 2010; 112: 291-315. [ Links ]
51. Baseia UG. Some notes on the genera Bovista and Lycoperdon (Lycoperdaceae) in Brazil. Mycotaxon 2005; 91: 81-6. [ Links ]
52. Hongo polvera en la Patagonia. Disponible en: http://www.patagonia-argentina.photo/foto_tag/lycoperdon/ (Fecha de acceso: 3 de septiembre de 2018). [ Links ]
53. Jeppson M. The genus Lycoperdon in Greenland and Svalbard. En: Boertmann D, Knudsen H. Arctic and Alpine Mycology. Meddelelser om Grønland Bioscience. 6. Copenhagen, Denmark: Museum Tusculanum Press, 2006; p. 106.
54. Moss MO. Gasteroid Basidiomycetes on postage stamps. Mycologist 1998; 12: 104-6. [ Links ]
55. Vizzini A, Ercole E. Detecting the phylogenetic position of Bovista acuminate (Agaricales, Basidiomycota) by an ITS-LSU combined analysis: the new genus Bryoperdon and revisitation of Lycoperdon subgen. Apioperdon. Phytotaxa 2017; 299: 77-86. [ Links ]
56. Wright JE, Wright A. Checklist of the mycobiota of Iguazú National Park (Misiones, Argentina). Bol Soc Argent Bot 2005; 40: 23-44. [ Links ]
57. Wright JE, Lechner BE, Popoff OF. Hongos. Atlas pictórico del Parque Nacional Iguazú. Buenos Aires: Editorial L.O.L.A.; 2008. [ Links ]
58. Hernández-Caffot ML, Robledo G, Domínguez LS. Gasteroid mycobiota (Basidiomycota) from Polylepis australis woodlands of central Argentina. Mycotaxon 2013; 123: 491. [ Links ]
59. Dios MM, Albertó E, Moreno G. Catálogo de hongos gasteroides (Basidiomycota) de Catamarca, Argentina. Bol Soc Argent Bot 2011; 46: 5-11. [ Links ]
60. Dios MM, Moreno G, Zamora JC, Altés A. Algunos hongos gasteroides epigeos interesantes de Catamarca (Argentina). Lilloa 2017; 54: 154-69. [ Links ]
61. Patočka J, Kocandrlová B. Pharmacologically and toxicologically relevant components of Amanita muscaria. Mil Med Sci Lett (Voj Zdrav Listy) 2017; 86: 122-34. [ Links ]
62. Piqueras Carrasco J. Intoxicaciones por plantas y hongos. Barcelona: Editorial Masson; 1996. [ Links ]
63. Vendramin A, Brvar M. Amanita muscaria and Amanita pantherina poisoning: two syndromes. Toxicon 2014; 90: 269-72. [ Links ]
64. Moss MJ, Hendrickson RG. Toxicity of muscimol and ibotenic acid containing mushrooms reported to a regional poison control center from 2002–2016. Clin Toxicol 2018; 1-5.
65. Michelot D, Melendez-Howell LM. Amanita muscaria: chemistry, biology, toxicology, and ethnomycology. Mycol Res 2003; 107 (Pt 2): 131-46. [ Links ]
66. Chilton WS, Ott J. Toxic metabolites of Amanita pantherina, A. cothurnata, A. muscaria and other Amanita species. Lloydia 1976; 39: 150-7. [ Links ]
67. Gordeeva OV. Psychological effects of Amanita muscaria. Siberian Historical Res 2017: 152-83. [ Links ]
68. Rubel W, Arora D. A study of cultural bias in field guide determinations of mushroom edibility using the iconic mushroom, Amanita muscaria, as an example. Econ Bot 2008; 62: 223-43. [ Links ]
69. Garner CD, Armstrong EM, Berry RE, Beddoes RL, Collison D, Cooney JJ, et al. Investigations of Amavadin. J Inorg Biochem 2000; 80: 17-20. [ Links ]
70. Hubregtse T, Neeleman E, Maschmeyer T, Sheldon RA, Hanefeld U, Arends IWCE. The first enantioselective synthesis of the amavadin ligand and its complexation to vanadium. J Inorg Biochem 2005; 99: 1264-7. [ Links ]
71. Lipka K, Falandysz J. Accumulation of metallic elements by Amanita muscaria from rural lowland and industrial upland regions. J Environ Sci Health B 2017; 52: 184-90. [ Links ]
72. Mędyk M, Grembecka M, Brzezicha-Cirocka J, Falandysz J. Bio- and toxic elements in mushrooms from the city of Umea and outskirts, Sweden. J Environ Sci Health B 2017; 11: 1-7. [ Links ]
73. Liu J-K. N-Containing compounds of Macromycetes. Chem Rev 2005; 105: 2723-44. [ Links ]
74. Stadelmann RJ, Müller E, Eugster CH. Muscarine (Muscarin, epi- und allo-Muscarin) aus dem Mycel von Amanita muscaria und von Clitocybe-Arten. Sydowia 1976; 29: 15-27. [ Links ]
75. Stintzing F, Schliemann W. Pigments of fly agaric (Amanita muscaria). Z Naturforsch C 2007; 62: 779-85. [ Links ]
76. Depovere P, Moens P. Active principles and pigments of the fly agaric Amanita (Amanita muscaria (Fries) Hooker). J Pharm Belg 1984; 39: 238-42. [ Links ]
77. Madsen U, Frølund B. Excitatory and inhibitory amino acid receptor ligands. En: Krogsgaard-Larsen P, Liljefors T, Madsen U, editors. Textbook of Drug Design and Discovery. 3rd. ed., Chapter 9, London and New York: CRC Press, 2002; pp. 232-71. [ Links ]
78. Ji C, Li Q, Aisa H, Yang N, Dong YL, Liu YY, et al. Gossypium herbaceam extracts attenuate ibotenic acid-induced excitotoxicity in rat hippocampus. J Alzheimers Dis 2009; 16: 331-9. [ Links ]
79. Becker A, Grecksch G, Bernstein HG, Höllt V, Bogerts B. Social behaviour in rats lesioned with ibotenic acid in the hippocampus: quantitative and qualitative analysis. Psychopharmacology (Berl) 1999; 144: 333-8. [ Links ]
80. Sureda FX. “Excitotoxicity and the NMDA receptor”. Disponible en: http://www.eurosiva.org/archive/vienna/abstracts/speakers/sureda.htm (Fecha de acceso: 3 de septiembre de 2018).
81. Kathrick C, Periyasami S, Jayachandran KS, Anusuyadevi M. Intrahippocampal administration of ibotenic acid induced cholinergic dysfunction via NR2A/ NR2B expression: Implications of resveratrol against Alzheimer disease pathophysiology. Front Mol Neurosci 2016; 9: 1-16. [ Links ]
82. Johnston GA. Muscimol as an ionotropic GABA receptor agonist. Neurochem Res 2014; 39: 1942-7. [ Links ]
83. Walton JC, McNeill JK 4th, Oliver KA, Albers HE. Temporal regulation of GABA(A) receptor subunit expression: role in synaptic and extrasynaptic communication in the suprachiasmatic nucleus. eNeuro 2017; 4. pii: ENEURO.0352-16.2017. [ Links ]
84. Nielsen EO, Schousboe A, Hansen SH, Krogsgaard- Larsen P. Excitatory amino acid: studies on the biochemical and chemical stability of ibotenic acid and related compounds. J Neurochem 1985; 45: 725-31. [ Links ]
85. Ishida M, Shinozaki H. Excitatory action of a plant extract, stizolobic acid, in the isolated spinal cord of the rat. Brain Res 1988; 473: 193-7. [ Links ]
86. Shinozaki H, Ishida M. Stizolobic acid, a competitive antagonist of the quisqualate-type receptor at the crayfish neuromuscular junction. Brain Res 1988; 451: 353-6. [ Links ]
87. Wartchow F. O gênero Amanita (Fungi): Sistemática e distribuição no Brasil. Pesqui Ensino Ciênc Exatas Nat 2017; 1: 28-44. [ Links ]
88. Niveiro N, Albertó E. Checklist of the Argentine Agaricales 1. Amanitaceae, Pluteaceae and Hygrophoraceae. Mycotaxon 2012; 119: 493-4. [ Links ]
89. Pérez-Silva E, Esqueda M, Herrera T, Coronado M. 2006. Nuevos registros de Agaricales de Sonora. Rev Mex Biodivers 2006; 77: 23-33. [ Links ]
90. Satora L, Pach D, Ciszowski K, Winnik L. Panther cap Amanita pantherina poisoning case report and review. Toxicon 2006; 47: 605-7. [ Links ]
91. Neville P, Poumarat S. Amanitaceae, Amanita, Limacella & Torrendia. Edizioni Candusso, Alassio, 2004. [ Links ]
92. Albertó E, Pire G, Franco MG. Presencia del hongo tóxico Amanita gemmata (Agaricales, Basidiomicetes) en la costa Bonaerense. Bol Soc Argent Bot 2002; 37: 13-7. [ Links ]
93. Gry J, Andersson C. Coprinus comatus (O.F.Müll.) Pers. En: Mushrooms traded as food. Vol. II, sec. 2. Nordic Council of Ministers, Copenhague, Dinamarca, 2014; 160-3. [ Links ]
94. Niveiro N, Albertó E. Checklist of the Argentine Agaricales 2. Coprinaceae and Strophariaceae. Mycotaxon 2012; 120: 505. [ Links ]
95. Gry J, Andersson C. Coprinopsis atramentaria (Bull.) Redhead, Vilgalys & Moncalvo (Coprinus atramentarius (Bull.) Fr.). En: Mushrooms traded as food. Vol. II, sec. 2. Nordic Council of Ministers, Copenhague, Dinamarca, 2014; 153-9. [ Links ]
96. Michelot D. Poisoning by Coprinus atramentarius. Nat Toxins 1992; 1: 73-80. [ Links ]
97. Beug MW. 2014 NAMA Toxicology Committee Report. North American mushroom poisonings. North American Mycological Association (NAMA). 2014. Disponible en: https://www.namyco.org/2014_nama_toxicology_committee.php (Fecha de acceso: 21 de agosto de 2018). [ Links ]
98. O’Neil CE, Horner WE, Reed MA, Lopez M, Lehrer SB. Evaluation of Basidiomycete and Deuteromycete (Fungi imperfecti) extracts for shared allergenic determinants. Clin Exp Allergy 1990; 20: 533-8.
99. Lehrer SB, Hughes JM, Altman LC, Bousquet J, Davies RJ, Gell L, et al. Prevalence of basidiomycete allergy in the USA and Europe and its relationship to allergic respiratory symptoms. Allergy 1994; 49: 460-5. [ Links ]
100. Lindberg P, Bergman R, Wickberg B. Isolation and structure of coprine, a novel physiologically active cyclopropanone derivative from Coprinus atramentarius and its synthesis via 1-aminocyclopropanol. J Chem Soc, Chem Commun 1975: 946-7. [ Links ]
101. Hatfield GM, Schaumberg JP. Isolation and structural studies of coprine, the disufiram-like constituent of Coprinus atramentarius. Lloydia 1975; 38: 489-96. [ Links ]
102. Lindberg P, Bergman R, Wickberg B. Isolation and structure of coprine, the in-vivo aldehyde dehydrogenase inhibitor in Coprinus atramentarius; syntheses of coprine and related cyclopropanone derivatives. J Chem Soc Perkin 1 1977: 684-91. [ Links ]
103. Matthies L, Laatsch H. Ungewöhnliche Pilzvergiftungen: Coprin, ein Hemmstoff des Alkohol-Abbaus. Pharm Unserer Zeit 1992; 21: 14-20. [ Links ]
104. Lee I-K, Jeong C-Y, Cho S-M, Yun B-S, Kim Y-S, Yu S-H, et al. Illudins C-2 and C-3, new illudin C derivatives from Coprinus atramentarius. J Antibiotics 1996; 49: 821-2. [ Links ]
105. Chen S-Y, Ho K-J, Hsieh Y-J, Wang L-T, Mau J-L. Contents of lovastatin, γ-aminobutyric acid and ergothioneine in mushroom fruiting bodies and mycelia. LWT - Food Sci Technol 2012; 47: 274-8.
106. Mikiashivili N, Elisashvili V, Wasser SP, Nevo E. Comparative study of lectin activity of higher basidiomycetes. Int J Med Mushrooms 2006; 8: 31-3. [ Links ]
107. Luo H, Liu Y, Fang L, Li X, Tang N, Zhang K. Coprinus comatus damages nematode cuticles mechanically with spiny balls and produces potent toxins to immobilize nematodes. Appl Environ Microbiol 2007; 73: 3916-23. [ Links ]
108. Degenkolb T, Vilcinskas A. Metabolites from nematophagous fungi and nematicidal natural products from fungi as alternatives for biological control. Part II: metabolites from nematophagous basidiomycetes and non-nematophagous fungi. Appl Microbiol Biotechnol 2016; 100: 3813-24. [ Links ]
109. Cederbaum AI. Alcohol metabolism. Clin Liver Dis 2012; 16: 667-85. [ Links ]
110. Gry J, Andersson C. Mushrooms traded as food. Vol. II, sec. 2. Nordic Council of Ministers, Copenhague, Dinamarca, 2014. [ Links ]
111. Lee H, Kim SS, You KS, Park W, Yang JH, Kim M, et al. Asian flushing: genetic and sociocultural factors of alcoholism among east asians. Gastroenterol Nurs 2014; 37: 327-36. [ Links ]
112. Jönsson M, Lindquist NG, Plöen L, Ekvärn S, Kronevi T. Testicular lesions of coprine and benzcoprine. Toxicology 1979; 12: 89-100. [ Links ]
113. Lodge DJ, Padamsee M, Matheny PB, Aime MC, Cantrell SA, Boertmann D, et al. Molecular phylogeny, morphology, pigment chemistry and ecology in Hygrophoraceae (Agaricales). Fungal Divers 2014; 64: 1-99. [ Links ]
114. Passie T, Seifert J, Schneider U, Emrich HM. The pharmacology of psilocybin. Addict Biol 2002; 7: 357-64. [ Links ]
115. Stijve T, Kuyper TW. Occurrence of psilocybin in various higher fungi from several European countries. Planta Med 1985; 51: 385-7. [ Links ]
116. Peredy T, Bradford H. Mushroom, Psilocybin. En: Encyclopedia of Toxicology. 3a ed, Reference Module in Biomedical Sciences, 2014; pp. 418-9. [ Links ]
117. Hossain MA, Park S-C. A Review on mushroom toxins. En: Food Toxicology. Chapter 14. 2016; 275-302. [ Links ]
118. Borowiak KS, Ciechanowski K, Waloscyzk P. Psilocybin mushroom (Psilocybe semilanceata) intoxication with myocardial infarction. J Toxicol Clin Toxicol 1998; 36: 47-9. [ Links ]
119. Halberstadt AL, Koedood L, Powell SB, Geyer MA. Differential contributions of serotonin receptors to the behavioral effects of indoleamine hallucinogens in mice. J Psychopharmacol 2011; 25: 1548-61. [ Links ]
120. Araújo AM, Carvalho F, Bastos ML, Guedes de Pinho PG, Carvalho M. The hallucinogenic world of tryptamines: an updated review. Arch Toxicol 2015; 89: 1151-73. [ Links ]
121. Vitale AA, Pomilio AB, Cañellas CO, Vitale MG, Putz EM, Ciprian-Ollivier JO. In vivo long-term kinetics of radiolabeled N,N-dimethyltryptamine and tryptamine. J Nuclear Med 2011; 52: 970-7. [ Links ]
122. Ciprian-Ollivier JO, Vitale AA, Pomilio AB. Génesis neuroquímica molecular de las alucinaciones en la esquizofrenia. Implicancias clínicas. Editorial Académica Española (marca comercial de OmniScriptum GmbH & Co. KG, 66111 Saarbrücken, Alemania), 2015. [ Links ]
123. Vitale AA, Ciprian-Ollivier J, Vitale MG, Romero E, Pomilio AB. Estudio clínico de marcadores de la hipermetilación indólica en las alteraciones de la percepción. Acta Bioquim Clin Latinoam 2010; 44: 627-42. [ Links ]
124. Jensen N, Gartz J, Laatsch H. Aeruginascin, a trimethylammonium analogue of psilocybin from the hallucinogenic mushroom Inocybe aeruginascens. Planta Med 2006; 72: 665-6. [ Links ]
125. Pomilio AB, Vitale AA. Determinación cuali/cuantitativa de drogas de abuso en fluidos biológicos. Eae-publishing, Editorial Académica Española (marca comercial de OmniScriptum GmbH & Co. KG, Bahnhofstrasse 28, 66111 Saarbrücken, Alemania), 2017. [ Links ]
126. Antkowiak WZ. The chemistry and toxicology of mushroom alkaloids. En: Blum MS (ed), Chemistry and toxicology of diverse classes of alkaloids. Fort Collins, CO: Alaken, Inc, 1996. [ Links ]
127. Vollenweider FX, Leenders KL, Scharfetter C, Maguire P, Stadelmann O, Angst J. Positron emission tomography and fluorodeoxyglucose studies of metabolic hyperfrontality and psychopathology in the psilocybin model of psychosis. Neuropsychopharmacology 1997; 16: 357-72. [ Links ]
128. Halberstadt AL, Geyer MA. Multiple receptors contribute to the behavioral effects of indoleamine hallucinogens. Neuropharmacology 2011; 61: 364-81. [ Links ]
129. Halberstadt AL. Recent advances in the neuropsychopharmacology of serotonergic hallucinogens. Behav Brain Res 2015; 277: 99-120. [ Links ]
130. Watling R, Richardson MJ. Coprophilous fungi of the Falkland Islands. Edinburgh J Bot 2010; 67 (3): 399- 423. [ Links ]
131. Coimbra VRM. Checklist of Central and South American Agaricales (Basidiomycota). II: Strophariaceae. Mycosphere 2015; 6: 441-58. [ Links ]
132. Franco-Molano AE, Corrales A, Vasco-Palacios AM. Macrohongos de Colombia II. Listado de especies de los órdenes Agaricales, Boletales, Cantharellales y Russulales (Agaricomycetes, Basidiomycota). Actual Biología 2010; 32: 89-114. [ Links ]
133. Niveiro N, Popoff OF, Albertó EO. Contribución al conocimiento de los Agaricales s.l. de la selva paranaense argentina. Bol Soc Argent Bot 2010; 45: 17-27. [ Links ]
134. Garcia Rollan M. Setas venenosas, intoxicaciones y prevención. Ed. Ministerio de Salud y Consumo, Secretaría General Técnica, Madrid, España, 1990; 213 pp. [ Links ]
135. Tanaka M, Hashimoto K, Okunoa T, Shirahama H. Neurotoxic oligoisoprenoids of the hallucinogenic mushroom, Gymnopilus spectabilis. Phytochemistry 1993; 34: 661-4. [ Links ]
136. Rätsch C. The Encyclopedia of Psychoactive Plants: Ethnopharmacology and Its Applications. Park Street Press, 2005; 944 pp. [ Links ]
137. Lee I-K, Cho S-M, Seok S-J, Yun B-S. Chemical constituents of Gymnopilus spectabilis and their antioxidant activity. Mycobiology 2008; 36: 55-9. [ Links ]
138. Nozoe S, Koike Y, Tsuji E, Kusano G, Seto H. Isolation and structure of gymnoprenols, a novel type of polyisoprenepolyols from Gymnopilus spectabilis. Tetrahedron Lett 1983; 24: 1731-4. [ Links ]
139. Nozoe S, Koike Y, Kusano G, Seto H. Structure of gymnopilin, a bitter principle of an hallucinogenic mushroom, Gymnopilus spectabilis. Tetrahedron Lett 1983; 24: 1735-6. [ Links ]
140. Nozoe S, Koike Y, Ito N, Kusano G. Isolation and structure of gymnoprenol D, a homologous series of fully hydrated polyisoprenepolyol from Gymnopilus spectabilis. Chem Lett 1984; 6: 1001-2. [ Links ]
141. Findlay JA, He ZQ. Minor constituents of Gymnopilus-spectabilis. J Nat Prod 1991; 54: 184-9. [ Links ]
142. Kusano G, Koike Y, Inoue H, Nozoe S. The constituents of Gymnopilus spectabilis. Chem Pharm Bull 1986; 34: 3465-70. [ Links ]
143. Nuñez-Alarcon J, Paredes JCC, Carmona MT, Quinones M. Ostopanic acid, a cytotoxic fatty acid from Gymnopilus spectabilis. Bol Soc Chil Quim 2001; 46: 227-9. [ Links ]
144. Kim KH, Choi SU, Lee KR. Gymnopilin K: a new cytotoxic gymnopilin from Gymnopilus spectabilis. J Antibiot 2012; 65: 135-7. [ Links ]
145. Hatfield GM, Valdes LJ, Smith AH. The occurrence of psilocybin in Gymnopilus species. Lloydia 1978; 41: 140-4. [ Links ]
146. Nishio A, Kitamura N, Tanaka S, Miyazaki S, Ichiyanagi T, Shimomura N, et al. Multiple effects of gymnopilin on circulatory system of the rat. Biol Pharm Bull 2012; 35: 1300-5. [ Links ]
147. Miyazaki S, Kitamura N, Nishio A, Tanaka S, Kayano T, Moriya T, et al. Gymnopilin--a substance produced by the hallucinogenic mushroom, Gymnopilus junonius--mobilizes intracellular Ca(2+) in dorsal root ganglion cells. Biomed Res 2012; 33: 111-8. [ Links ]
148. Kayano T, Kitamura N, Miyazaki S, Ichiyanagi T, Shimomura N, Shibuya I, et al. Gymnopilins, a product of a hallucinogenic mushroom, inhibit the nicotinic acetylcholine receptor. Toxicon 2014; 81: 23-31. [ Links ]
149. Valenzuela E, Ramirez C, Moreno G, Polette M, Garnica S, Peredo H, et al. Agaricales más comunes recolectados en el Campus Isla Teja de la Universidad Austral de Chile. Bosque 1996; 17: 51-63. [ Links ]
150. Matsuura M, Saikawa Y, Inui K, Nakae K, Igarashi M, Hashimoto K, et al. Identification of the toxic trigger in mushroom poisoning. Nat Chem Biol 2009; 5: 465-7. [ Links ]
151. Matsuura M, Kato S, Saikawa Y, Nakata M, Hashimoto K. Identification of cyclopropylacetyl-(R)-carnitine, a unique chemical marker of the fatally toxic mushroom Russula subnigricans. Chem Pharm Bull (Tokyo) 2016; 64: 602-8. [ Links ]
152. Cho JT, Han JH. A case of mushroom poisoning with Russula subnigricans: development of rhabdomyolysis, acute kidney injury, cardiogenic shock, and death. J Korean Med Sci 2016; 31: 1164-7. [ Links ]
153. Serés Garcia L. Intoxicación por Russula subnigricans. Barcelona, 2016. Disponible en: http://www.micocat.org/UNCINULA09/micologia09/Toxicologia/RevisionRussulasubnigricans.pdf (Fecha de acceso: 24 de septiembre de 2018). [ Links ]
154. Kuo M. The genus Russula. 2009. Disponible en: https://www.mushroomexpert.com/russula.html. (Fecha de acceso: 16 de agosto de 2018). [ Links ]
155. Chen Z, Zhang P, Zhang Z. Investigation and analysis of 102 mushroom poisoning cases in Southern China from 1994 to 2012. Fungal Diversity 2014; 64: 123-31. [ Links ]
156. Lee PT, Wu ML, Tsai WJ, Ger J, Deng JF, Chung HM. Rhabdomyolysis: an unusual feature with mushroom poisoning. Am J Kidney Dis 2001; 38: E17. [ Links ]
157. Saviuc P, Danel V. New syndromes in mushroom poisoning. Toxicol Rev 2006; 25: 199-209. [ Links ]
158. Nishiyama K, Ohta Y, Matsuda N, Fujimoto R, Koike K. Back pain after wild mushroom consumption. Emerg Med J 2010; 27: 61. [ Links ]
159. Lin S, Mu M, Yang F, Yang C. Russula subnigricans poisoning: from gastrointestinal symptoms to rhabdomyolysis. Wilderness Environ Med 2015; 26: 380-3. [ Links ]
160. Takahashi A, Agatsuma T, Matsuda M, Ohta T, Nunozawa T, Endo T, et al. Russuphelin A, a new cytotoxic substance from the mushroom Russula subnigricans Hongo. Chem Pharm Bull (Tokyo) 1992; 40 (12): 3185-8. [ Links ]
161. Stijve T, de Meijer AAR. Hydrocyanic acid in mushrooms, with special reference to wild-growing and cultivated edible species. Dtsch Lebensm-Rundsch 1999; 95: 366-73. [ Links ]
162. Caspar J, Spiteller P. A free cyanohydrin as arms and armour of Marasmius oreades. ChemBioChem 2015; 16 (4): 570-3. [ Links ]
163. Zagrobelny M, de Castro ÉCP, Møller BL, Bak S. Cyanogenesis in arthropods: from chemical warfare to nuptial gifts. Insects 2018; 9: 51. [ Links ]
164. Blenis PV, Chow PS, Duncan I, Knowles NR. Cyanide levels near fairy rings affect the growth of grasses and fungi. Can J Bot 2004; 82: 1324-9. [ Links ]
165. Gramss G, Voigt K-D, Bergmann H. Factors influencing water solubility and plant availability of mineral compounds in the tripartite fairy rings of Marasmius oreades (Bolt.: Fr.) Fr. J Basic Microbiol 2005; 45: 41-54. [ Links ]
166. Serés Garcia L. Intoxicación por Podostroma cornu-damae. Barcelona, 2016. Disponible en: http://www.micocat.org/UNCINULA09/micologia09/Toxicologia/Revision_Podostroma_cornu-damae.pdf (Fecha de acceso: 3 de septiembre de 2018). [ Links ]
167. Encyclopaedia britannica. Disponible en: https://www.britannica.com/list/7-of-the-worlds-most-poisonous-mushrooms (Fecha de acceso: 3 de septiembre de 2018). [ Links ]
168. Ahn JY, Seok SJ, Song JE, Choi JH, Han SH, Choi JY, et al. Two cases of mushroom poisoning by Podostroma cornu-damae. Yonsei Med J 2013; 54: 265-8. [ Links ]
169. Saikawa Y, Okamoto H, Inui T, Makabe M, Okuno T, Suda T, et al. Toxic principles of a poisonous mushroom Podostroma cornu-damae. Tetrahedron 2001; 57: 8277-81. [ Links ]
170. Koichi M, Haruo T, Toshihiro Y, Masami O, Sadao N, Koichiro K. [Case report: food poisoning to death by Podostroma cornu-damae, its case history and autopsy findings]. Artículo en idioma japonés. Acta Criminol Med Leg Jpn 2003; 69: 14-20. [ Links ]
171. Suzuki M, Katoh Y, Kumagai H, Saitoh M, Ishikawa H, Itoh H, et al. [Successful treatment in a case of Podostroma cornu-damae poisoning, a deadly poisonous mushroom]. Artículo en idioma japonés. Chudoku Kenkyu 2002; 15: 177-82. [ Links ]
172. Yokoyama K, Gonmori K. [Increase of poisoning by tropical mushrooms in Japan in recent years]. Artículo en idioma japonés. Chudoku Kenkyu 2009; 22: 240-8. [ Links ]
173. Jang J, Kim CH, Yoo JJ, Kim MK, Lee JE, Lim AL, et al. An elderly man with fatal respiratory failure after eating a poisonous mushroom Podostroma cornu-damae. Tuberc Respir Dis (Seoul) 2013; 75: 264-8. [ Links ]
174. Masri HJ, Maftoun P, Malek RA, Boumehira AZ, Pareek A, Hanapi SZ, et al. The edible mushroom Pleurotus spp.: II. Medicinal values. Int J Biotechnol Wellness Ind 2017; 6: 1-11. [ Links ]
175. Paul C, Roy T, Das N. Potentiality of oyster mushroom (Pleurotus spp.) in medicine- a review. Ann Food Process Preserv 2017; 2: 1014. [ Links ]
176. Al-Deen IHS, Twaij HAA, Al-Badr AA, Istarabadi TAW. Toxicologic and histopathologic studies of Pleurotus ostreatus in mice. J Ethnopharmacol 1987; 21: 297-305. [ Links ]
177. Juntes P, Rebolj K, Sepčić K, Maček P, Žužek MC, Cestnik V, et al. Ostreolysin induces sustained contraction of porcine coronary arteries and endothelial dysfunction in middle- and large-size vessels. Toxicon 2009; 54: 784-92.
178. Frangež R, Šuput D, Molgó J, Benoit E. Ostreolysin a/ pleurotolysin b and equinatoxins: structure, function and pathophysiological effects of these pore-forming proteins. Toxins (Basel) 2017; 9: 128.
179. Žužek MC, Maček P, Sepčić K, Cestnik V, Frangež R. Toxic and lethal effects of ostreolysin, a cytolytic protein from edible oyster mushroom (Pleurotus ostreatus), in rodents. Toxicon 2006; 48: 264-71.
180. Deepalakshmi K, Mirunalini S. Toxicological assessment of Pleurotus ostreatus in Sprague Dawley rats. Int J Nutr Pharmacol Neurol Diseases 2014; 4: 139-45. [ Links ]
181. Tomita T, Noguchi K, Mimuro H, Ukaji F, Ito K, Sugawara-Tomita N, et al. Pleurotolysin, a novel sphingomyelin-specific two-component cytolysin from the edible mushroom Pleurotus ostreatus, assembles into a transmembrane pore complex. J Biol Chem 2004; 279: 26975-82. [ Links ]
182. Li YR, Liu QH, Wang HX, Ng TB. A novel lectin with potent antitumor, mitogenic and HIV-1 reverse transcriptase inhibitory activities from the edible mushroom Pleurotus citrinopileatus. Biochim Biophys Acta 2008; 1780: 51-7. [ Links ]
183. Ngai PH, Ng TB. A hemolysin from the mushroom Pleurotus eryngii. Appl Microbiol Biotechnol 2006; 72: 1185-91. [ Links ]
184. Shibata T, Kudou M, Hoshi Y, Kudo A, Nanashima N, Miyairi K. Isolation and characterization of a novel two-component hemolysin erylysin A and B, from an edible mushroom, Pleurotus eryngii. Toxicon 2010; 56: 1436-42. [ Links ]
185. Chou P-Y, Hong C-H, Chen W, Li Y-J, Chen Y-S, Chiou Y-Y. Glass distilling collector applied for HCN recovery from submerged culture broth and fruiting body of Pleurotus eryngii for identification and quantification. J Agric Food Chem 2006; 54: 1551-6. [ Links ]
186. Muszyńska B, Sułkowska-Ziaja K. Analysis of indole compounds in edible Basidiomycota species after thermal processing. Food Chem 2012; 132: 455-9. [ Links ]
187. Stone TW, Mackay GM, Forrest CM, Clark CJ, Darlington LG. Tryptophan metabolites and brain disorders. Clin Chem Lab Med 2003; 41: 852-9. [ Links ]
188. Ulziijargal E, Yang J-H, Lin L-Y, Chen C-P, Mau J-L. Quality of bread supplemented with mushroom mycelia. Food Chem 2013; 138 (1): 70-6. [ Links ]
189. Floyd JS, Heckbert SR, Weiss NS, Carrell DS, Psaty BM. Use of administrative data to estimate the incidence of statin-related rhabdomyolysis. J Amer Med Assoc 2012; 307: 1580-2. [ Links ]
190. Wang S-J, Li Y-X, Bao L, Han J-J, Yang X-L, Li H-R, et al. Eryngiolide A, a cytotoxic macrocyclic diterpenoid with an unusual cyclododecane core skeleton produced by the edible mushroom Pleurotus eryngii. Org Lett 2012; 14: 3672-5. [ Links ]
191. Lee I-S, Ryoo I-J, Kwon K-Y, Ahn JS, Yoo I-D. Pleurone, a novel human neutrophil elastase inhibitor from fruiting bodies of the mushroom Pleurotus eryngii var. ferulae. J Antibiotics 2011; 64: 587-9. [ Links ]
192. Kikuchi T, Motoyashiki N, Yamada T, Shibatani K, Ninomiya K, Morikawa T, et al. Ergostane-type sterols from king trumpet mushroom (Pleurotus eryngii) and their inhibitory effects on aromatase. Int J Mol Sci 2017; 18: 2479. [ Links ]
193. Stadler M, Mayer A, Anke H, Sterner O. Fatty acids and other compounds with nematicidal activity from cultures of basidiomycetes. Planta Med 1994; 60: 128-32. [ Links ]
194. Li G, Wang X, Zheng L, Li L, Huang R, Zhang K. Nematicidal metabolites from the fungus Pleurotus ferulae Lenzi. Ann Microbiol 2007; 57: 527-9. [ Links ]
195. Lechner BE, Petersen R, Rajchenberg M, Albertó E. Presence of Pleurotus ostreatus in Patagonia, Argentina. Rev Iberoam Micol 2002; 19: 111-4. [ Links ]
196. Lechner BE, Wright JE, Albertó E. The genus Pleurotus in Argentina: mating tests. Sydowia 2005; 57: 233-45. [ Links ]
197. Lechner BE, Wright JE, Albertó E. The genus Pleurotus in Argentina. Mycologia 2004; 96: 845-58. [ Links ]
198. Hongo T, Izawa M. Kinoko (Fungi). En idioma japonés. 2006; 1-383. [ Links ]
199. Naka T, Jones D, Baldwin I, Fealy N, Bates S, Goehl H, et al. Myoglobin clearance by super high-flux hemofiltration in a case of severe rhabdomyolysis: a case report. Crit Care 2005; 9: R90-5. [ Links ]
200. Wiegele M, Krenn CG. Cytosorb™ in a patient with Legionella pneumonia-associated rhabdomyolysis: a case report. ASAIO J 2015; 61: e14-6.
201. Laddomada T, Doronzio A, Balicco B. A novel approach to the treatment of acute renal failure associated with rhabdomyolysis. Intensive Care Med Exp 2015; 3 (Suppl 1): A61. [ Links ]
202. Romano GM, Iannone L, Novas MV, Carmarán C, Romero AI, Lopez SE, et al. Hongos tóxicos en la Ciudad de Buenos Aires y alrededores. Medicina (Buenos Aires) 2013; 73: 406-10. [ Links ]
Recibido: 8 de octubre de 2018
Aceptado: 16 de julio de 2019














