Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.4 La Plata dic. 2019
BIOQUÍMICA CLÍNICA
¿Es necesario el ayuno para la determinación del perfil lipídico?
Silvia Fabiana Benozzi1a, Gisela Unger2a, Pablo Gustavo Milano2a, Amparo Campion2ab, Graciela Laura Pennacchiotti3ab*
1 Magister en Bioquímica.
2 Bioquímico/a.
3 Doctora en Bioquímica.
a Bioquímica Clínica I. Departamento de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur, San Juan 670, (8000) Bahía Blanca, Provincia de Buenos Aires, Argentina.
b Hospital Municipal de Agudos ‘‘Dr. Leónidas Lucero’’, Estomba 968, (8000) Bahía Blanca, Provincia de Buenos Aires, Argentina
* Autor para correspondencia.
Correspondencia Dra. GRACIELA LAURA PENNACCHIOTTI Universidad Nacional del Sur San Juan 670. 8000 BAHÍA BLANCA. Argentina. Teléfono: 0291-4595101, Int.2447 Correo electrónico: grapen@uns.edu.ar
Resumen
El propósito de este estudio fue analizar los cambios post prandiales en el perfil lipídico en respuesta a una comida típica argentina. Se extrajo sangre a 33 mujeres voluntarias después de 12 h de ayuno (T0), 1 h después de un desayuno estandarizado (T1) y 1 h después de un almuerzo estandarizado (T2). Se midieron los niveles de: colesterol total, colesterol de lipoproteínas de alta densidad (C-HDL), colesterol de lipoproteínas de baja densidad (C-LDL) y triglicéridos. Los datos se analizaron utilizando la prueba t de Student pareada. Para cada analito se calculó la diferencia porcentual media (DM%) en T1 y T2 respecto de T0 y se comparó con el valor de referencia del cambio (VRC). Las DM% mayores al VRC se consideraron clínicamente significativas. En T1 y T2, los valores de C-HDL fueron más bajos que en T0, mientras que los valores de C-LDL en T1 fueron más bajos que en T0. Los niveles de triglicéridos fueron significativamente más altos en T1 que en T0. En todos los casos, la variabilidad fue estadísticamente significativa, aunque no clínicamente. En este estudio puede observarse que el perfil de lípidos en T1 y T2 no mostró diferencias clínicamente significativas con respecto a los valores basales.
Palabras clave: Ayuno; Lípidos; Recolección de muestras de sangre; Etapa Preanalítica.
Abstract
Is fasting necessary for lipid profile determination?
The purpose of the present study was to analyze postprandial lipid profile changes in response to a typical Argentine meal. Blood was collected from 33 female volunteers after a 12 h fasting period (T0), 1 h after a standardized breakfast (T1) and 1 h after a standardized lunch (T2). The levels of total cholesterol, high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), and triglycerides were measured. Data were analyzed using paired Student’s t-test. Mean difference % (MD %) was calculated for each analyte at T1 and T2 and was further compared with reference change value (RCV). MDs % higher than RCV were considered clinically significant. At T1 and T2, HDL-C values were lower than at T0, whereas LDL-C values at T1 were lower than at T0. Triglycerides levels were significantly higher at T1 than baseline values. In all cases, variability was statistically, though not clinically, significant. This study demonstrates that at T1 and T2 lipid profile showed no clinically significant differences with respect to basal values.
Keywords: Fasting; Lipids; Blood sample collection; Preanalytical stage.
Resumo
O jejum é necessário para a determinação do perfil lipidico?
O objetivo do presente estudo foi analisar as alterações do perfil lipídico pós-prandial em resposta a uma refeição típica argentina. O sangue foi coletado de 33 mulheres voluntárias após um período de jejum de 12 horas (T0),1 h após um café da manhã padronizado (T1) e 1 h após um almoço padronizado (T2). Foram medidos os níveis de: colesterol total (CT), colesterol HDL (C-HDL), colesterol LDL (C-LDL) e triglicérides. Os dados foram analisados utilizando o teste t de Student pareado. A diferença média% (DM%) foi calculada para cada analito em T1 e T2 e foi comparada com o valor de mudança de referência (VRC). Os MDs% maiores que o VRC foram considerados clinicamente significativos. Em T1 e T2, os valores de C-HDL foram menores que em T0, enquanto os valores de C-LDL em T1 foram menores que em T0. Os níveis de triglicérides foram significativamente maiores em T1 do que os valores basais. Em todos os casos, a variabilidade foi estatisticamente, embora não clinicamente, significativa. Este estudo demonstra que no perfil lipídico em T1 e T2 não houve diferenças clinicamente significativas em relação aos valores basais.
Palavras-chave: Jejum; Lipídeos; Coleta de amostras de sangue; Variabilidade pré-analítica.
Introducción
Las actividades preanalíticas son cruciales para la calidad de las pruebas bioquímicas. Constituyen la principal fuente de errores médicos atribuibles al laboratorio (1) y tienen un importante impacto clínico y económico tanto en los pacientes como en el sistema de salud (2). Los errores que se producen en la etapa preanalítica representan hasta el 75% del total de los errores de laboratorio. Para mitigar su efecto es necesario implementar políticas basadas en evidencias tendientes a estandarizar y armonizar los procedimientos involucrados en esta fase, en pos de una mejora continua de la calidad (3). Desafortunadamente, los procedimientos preanalíticos no están estandarizados ni armonizados a nivel mundial (3).
En los últimos años se han realizado esfuerzos para estandarizar la preparación del paciente y los requisitos de recolección de muestras de sangre con el fin de minimizar la incertidumbre en esta etapa (4). En este sentido, en 2014 el Grupo de Trabajo de Fase Preanalítica (WG-PRE) de la Federación Europea de Química Clínica y Medicina de Laboratorio (EFLM) emitió una serie de recomendaciones, entre las que se encuentran la recolección de muestras de sangre entre las 7 y las 9 de la mañana y el cumplimiento de un período de ayuno de 12 h para la realización de las pruebas bioquímicas de rutina (3). Dicho documento estuvo respaldado por los resultados de investigaciones previas que documentaron cambios en marcadores bioquímicos y hematológicos en respuesta al estado posprandial (5) (6). Sobre la base de resultados de estudios preexistentes (7) (8), la Sociedad Europea de Aterosclerosis y la EFLM emitieron en 2016 una declaración de consenso que enfatizaba que no se requería ayuno para las determinaciones del perfil de lípidos de rutina (9).
Por lo tanto, los profesionales de laboratorio se enfrentan actualmente a dilemas cruciales, a saber: i) ¿Es necesario indicar el ayuno para las pruebas de lípidos? ii) ¿Es necesario que los pacientes acudan al laboratorio de análisis clínicos con un período de ayuno de 12 h para los análisis de lípidos de rutina? y iii) ¿Es necesario tener en cuenta las diferentes idiosincrasias para finalmente armonizar y llegar a un consenso general? Los estudios disponibles sobre ayuno o no ayuno han utilizado diferentes protocolos y metodologías para la evaluación de la importancia clínica. Esto ha dificultado la posibilidad de realizar comparaciones y de llegar a conclusiones definitivas sobre la necesidad de ayunar o no para la valoración del perfil lipídico. Además, se debe tener en cuenta el posible impacto de otros factores relacionados, tales como las respuestas individuales a la ingesta de alimentos y el hecho de que las diferencias en los hábitos culturales y dietéticos son extremadamente heterogéneas en todo el mundo (9) (10). En este contexto, el propósito del presente estudio fue analizar los cambios en el perfil lipídico posprandial en respuesta a una comida típica argentina.
Materiales y Métodos
Se efectuó un estudio experimental, longitudinal, estandarizado (6) (11) (12). El mismo se realizó en el laboratorio del Hospital Municipal de Agudos “Dr. Leónidas Lucero” de la ciudad de Bahía Blanca, provincia de Buenos Aires, República Argentina, en el año 2018. La población objeto de estudio estuvo constituida por 33 mujeres “aparentemente sanas”, edad [mediana (rango)]: 25 (21-32) años. Todas ellas fueron informadas respecto del objetivo del estudio, de los procedimientos involucrados en el mismo, y expresaron por escrito su consentimiento informado para participar en forma voluntaria. El estudio contó con la aprobación del Comité de Bioética de la mencionada institución de salud.
Criterio de inclusión: ausencia de patologías crónicas o agudas.
Criterio de exclusión: embarazo, tratamiento médico farmacológico y/o haber realizado actividad física en las 24 h anteriores a la flebotomía.
Las muestras de sangre para realizar las pruebas de lípidos en estado basal (T0) se obtuvieron entre las 7 y las 9 de la mañana, luego del reposo nocturno, con 12 h de ayuno (3). Las participantes permanecieron en reposo y sentadas durante los 15 min previos a la punción venosa. Todas las muestras fueron obtenidas por un flebotomista con experiencia en el procedimiento y según las pautas publicadas por el Clinical and Laboratory Standards Institute (CLSI)/National Committee for Clinical Laboratory Standards (NCCLS) H03-A6 (13) con las adaptaciones sugeridas por Lima-Oliveira et al. (14).
Inmediatamente después de la flebotomía, las voluntarias tomaron un desayuno estandarizado que incluyó 200 mL de capuchino y 4 galletitas dulces tipo “pepas”, cuya información nutricional se muestra en la Tabla I. Trascurrida una hora de la ingesta se repitió la extracción de sangre (T1). Con posterioridad a esta segunda extracción las voluntarias se retiraron para realizar sus actividades diarias habituales y retornaron al mediodía (13 horas) para recibir un almuerzo estandarizado que consistió en 3 empanadas de carne, 300 mL de gaseosa y un postre dulce (Tabla I). Luego de una hora de la ingesta se tomó una nueva muestra sanguínea (T2). La medición plasmática de lípidos se realizó una hora pos ingesta porque estudios previos habían demostrado que ese tiempo está comprendido en el período de tiempo posprandial en el que se producen los cambios máximos de los analitos estudiados (7) y además es posible que los pacientes concurran al laboratorio para realizar las pruebas bioquímicas una hora después de haber ingerido alimentos. En total se dispuso de tres muestras de sangre (T0, T1, T2), de 5 mL cada una, de cada mujer que participó del estudio. Las muestras sanguíneas se obtuvieron por punción de la vena antecubital con jeringa de 10 mL (Hongda, Jiangxi Hongda Medical Equipment Group Ltd., Nanchang, China) y aguja (21Gx1, NEOJET, Zhejiang Ougian Medical Apparatus Co, Wenzhou, China). Posteriormente los especímenes se distribuyeron en tubos plásticos con heparina de litio de 2,5 mL (TECNON, Laboratorios Argentinos, Berisso, Argentina) que se centrifugaron a 1500 x g durante 15 min a temperatura ambiente. El plasma se separó del paquete globular inmediatamente después de la centrifugación y se fraccionó en dos tubos de polipropileno sin aditivos (TECNON, Laboratorios Argentinos, Berisso, Argentina).
Tabla I. Información nutricional provista por el fabricante.

Las muestras estaban libres de hemólisis, lipemia o ictericia, lo que se demostró mediante la evaluación de los índices séricos en un autoanalizador Vitros® 4600 (Ortho Clinical Diagnostics, New Jersey, EE.UU.), en el que también se realizaron las mediciones de los lípidos. Se llevó a cabo un procedimiento estandarizado en el que todas las determinaciones se efectuaron en el mismo momento, empleando reactivos y calibradores del mismo lote y fabricante y se procesaron controles de calidad internos y externos.
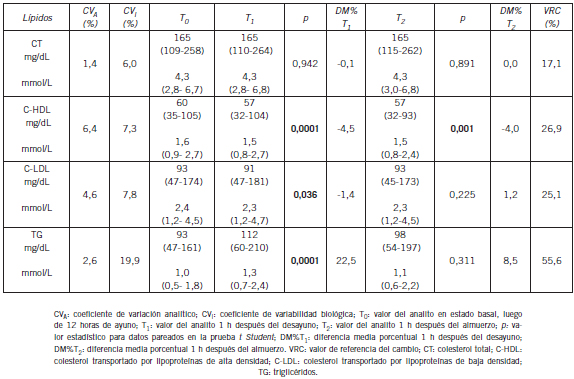
Los lípidos estudiados y los métodos usados fueron: colesterol total (CT) (enzimático/colorimétrico), colesterol transportado por lipoproteínas de alta densidad (C- HDL) (ensayo directo), colesterol transportado por lipoproteínas de baja densidad (C-LDL) (ensayo directo), y triglicéridos (TG) (enzimático/colorimétrico). La Tabla II muestra el coeficiente de variación analítico (CVA) de cada analito que se obtuvo empleando un reactivo de tercera opinión (BIORAD, Irvine, EE.UU.). Para el análisis estadístico de los datos se dispuso de un software Statistical Package for Social Science for Windows (SPSS) (Versión 15,0. Chicago, IL, EE.UU.) con el que se comprobó la normalidad de cada variable aplicando la prueba de Kolgomorov-Smirnov. Las diferencias entre T0 y Tx se analizaron con la prueba t de Student para muestras relacionadas. La significación estadística usada para el análisis de datos fue p<0,05. Para cada analito se calculó el cambio clínicamente significativo usando el valor de referencia del cambio (VRC) según la siguiente fórmula (11) (15) (16):
![]()
donde Z es una constante para el nivel de confianza estadística (1,96 para á=0,05), CVI es la variabilidad biológica intraindividual obtenida de la base de datos de Westgard (17) y CVA es el coeficiente de variación analítico obtenido del control de calidad interno del laboratorio. Esos datos se muestran en la Tabla II. Para cada prueba bioquímica y en cada tiempo estudiado, se calculó la diferencia porcentual media (DM%), según la siguiente fórmula (18-22):

donde: n=33 (número total de individuos incluidos en el estudio); i: individuo; T1(i): valor de la medición del analito en la muestra de cada individuo 1 h después de la comida Tx; T0(i): valor de la medición del analito en la muestra T0 (basal) de cada individuo. Estos datos se muestran en la Tabla II.
Tabla II. Variabilidad de los lípidos una hora después del desayuno y del almuerzo, ambos estandarizados.
Resultados
Los resultados de este trabajo se muestran en la Tabla II. Luego del desayuno y del almuerzo los niveles de C-HDL fueron más bajos que en el estado basal T0 [media T0 vs. T1 (mg/dL), p: 60 vs. 57, 0,000; media T0 vs. T2 (mg/dL), p: 60 vs. 57, 0,001]. Esos cambios fueron estadísticamente significativos. El valor de C-LDL fue significativamente más bajo en T1 respecto de T0 [media T0 vs. T1 (mg/dL), p: 93 vs. 91, 0,036]. Por el contrario, los niveles de TG fueron significativamente más altos que los valores basales en T1 ([media T0 vs. T1 (mg/dL), p: 93 vs. 112, 0,001]. En T2 la concentración promedio de TG fue estadísticamente más baja que en T1 ([media T1 vs. T2 (mg/dL), p: 112 vs. 98, 0,006]. La comparación de DM% con VRC mostró que no se produjeron cambios clínicamente relevantes en los lípidos estudiados. Las representaciones gráficas de las DM% se muestran en la Figura 1.

Figura 1. Variación de la concentración plasmática de los lípidos una hora después del desayuno y una hora luego del almuerzo respecto del valor basal.
Discusión y Conclusiones
En este estudio, en el que se incluyeron 33 mujeres jóvenes aparentemente sanas que ingirieron un desayuno y un almuerzo estandarizado se demostró que, una hora después de haber realizado la ingesta, ninguno de los parámetros lipídicos estudiados fue afectado por las comidas. Existe evidencia de que una hora pos ingesta es un período de tiempo en el que se presentan los cambios máximos de estos analitos. En el estudio efectuado por Langsted et al. los cambios máximos en los valores medios de los lípidos ocurrieron entre las 0 y 2 h posteriores a la comida en CT y C-LDL, entre 0 y 5 h en C-HDL, y entre 1 y 4 h en TG (7).
Los resultados del presente estudio coinciden con los de Plumelle et al. (12), quienes tampoco encontraron diferencias posprandiales en los niveles de CT después de la ingesta de un desayuno y un almuerzo estandarizado. Estos autores también observaron una variación estadística pero no clínicamente significativa de C-HDL entre la condición de ayuno y no ayuno. Sin embargo, es conveniente aclarar que el porcentaje de cambio posprandial en el trabajo de Plumelle et al. fue comparado con el límite total del cambio y no con el VRC (12). El cambio posprandial más importante que se registró en el presente estudio correspondió a los TG después del desayuno (22,5%); sin embargo, no superó el VRC, por lo que no representó un cambio clínicamente significativo. En el trabajo publicado por Lima-Oliveira G. et al, TG fue el único parámetro del perfil lipídico afectado por la ingesta de una comida ligera y estandarizada. El cambio fue considerado clínicamente significativo al comparar las variaciones posprandiales con las especificaciones de calidad deseables para el sesgo derivado de la variabilidad biológica (6). Plummell et al. también evidenciaron diferencias clínicamente significativas en los niveles de TG al comparar el cambio posprandial respecto del límite total del cambio (12).
A la hora de la ingesta de alimentos se observó una disminución de 3 mg/dL en C-HDL, 2 mg/dL en el nivel de C-LDL y un incremento de 19 mg/dL de TG. Estos hallazgos fueron similares a los de Langsted et al. quienes informaron que los cambios máximos luego de una comida e ingesta normal de líquidos respecto del ayuno fueron de -4 mg/dL para C-HDL entre las 0 y 5 h, -8 mg/dL para C-LDL entre las 0 y 2 h y 26 mg/dL para TG entre 1 y 4 h posteriores a la comida (7). Sin embargo, es conveniente tener presente que el protocolo detrabajo que se realizó en este estudio es diferente al de Langsted et al., pues estos autores realizaron estudios poblacionales de cohorte prospectivos tendientes a evaluar a los TG medidos sin ayuno como marcador de evento cardiovascular. Por esta razón no realizaron la evaluación de los lípidos en cada uno de los individuos con y sin ayuno en forma individual, sino que se les extrajo sangre y se los interrogó respecto de la hora de su última ingesta para luego comparar los diferentes intervalos de tiempo de ayuno respecto de aquellos con ayuno mayor de 8 h. Otra diferencia importante respecto del estudio de Langsted et al. es que los individuos no tuvieron una comida estandarizada, ya que cada uno realizó su comida habitual (7) (8). Estos autores consideraron que los cambios observados fueron mínimos y atribuyeron la reducción en los niveles de C-LDL a la hemodilución resultante de la ingesta de líquidos junto con la comida, sin embargo, este argumento fue cuestionado por Lund y Jensen (23) y recientemente se demostró que a la hora de la ingesta de un vaso de agua (300 mL) no había cambios significativos en el nivel de C-LDL (11).
Tal como sostienen Langsted et al (7) si bien el incremento de TG puede atribuirse a la ingesta de grasas en las comidas, es probable que la reducción simultánea de C-HDL pueda estar vinculada con el intercambio bidireccional de transferencia de TG desde las lipoproteínas ricas en TG a las partículas de C-HDL, y de ésteres de colesterol desde C-HDL a las lipoproteínas ricas en TG. Mora et al. también demostraron en el estudio Women´s Health Study en el que se evaluaron los cambios en el nivel de lípidos luego de una comida habitual, la disminución de C-LDL de 8 mg/dL y el incremento de TG de 18 mg/dL (8), mientras que Langsted y Nordestgaard publicaron el hallazgo de una disminución de 12 mg/dL en la concentración de C-LDL y un incremento de 18 mg/dL de TG, tras el consumo de una dieta habitual (24). Por su parte, Sidhu y Naugler hallaron que los niveles de C-LDL disminuyeron 4 mg/dL mientras que los TG aumentaron 26 mg/dL después del consumo de alimentos habituales (25).
Otro aspecto a considerar en este trabajo es el hecho de que se ofrecieron dos comidas, un desayuno con un contenido graso de 12,8 g y un almuerzo con un contenido graso de 35,8 g, ninguna de las cuales produjo cambios clínicamente significativos en los parámetros analizados del perfil lipídico. Estudios previos demostraron que una comida con un contenido menor de 30 g de grasa tenía un efecto posprandial muy pequeño en la lipemia o directamente no tenía ninguna influencia (26-29). Según Stone, en individuos normotrigliceridémicos (ej: TG en ayunas <150 mg/dL), no es esperable que el consumo de un desayuno con bajo contenido graso (<15 g) produzca un aumento del nivel de TG posprandial mayor de 200 mg/dL (30).
Varios factores podrían afectar a las concentraciones posprandiales de los lípidos, ya que la ingesta del desayuno, con menor contenido graso respecto de la comida del almuerzo, produjo mayor variación en la concentración de TG (22,5% vs. 8,5%), un dato con rigor estadístico. Esto podría atribuirse al ritmo circadiano de los mismos, que ocasiona un descenso en los niveles entre las 8 y las 16 h (31) ya que, en este trabajo, la recolección de las muestras de sangre pos-almuerzo se tomaron entre las 13 y las 14 h. Si bien es cierto que la turbiedad de las muestras lipémicas puede producir interferencias con las técnicas espectrofotométricas (32), en este estudio no se observó dicha interferencia al ser evaluada a través de los índices séricos. Los estudios publicados respecto de la influencia de la comida sobre parámetros lipídicos difieren en sus diseños y estrategias para definir los cambios clínicamente significativos (6) (7) (12). En este estudio se consideró importante detectar los cambios de relevancia clínica en los lípidos analizados empleando la estimación del VRC, que incluye la variabilidad biológica y analítica. Este es considerado un parámetro más objetivo que las diferencias estadísticamente significativas para evaluar la significación clínica, con el fin de no conducir a conclusiones erróneas respecto de los efectos preanalíticos en los lípidos analizados (33-35).
Es necesario un conocimiento preciso basado en la evidencia respecto de la influencia que las variables preanalíticas pueden tener en los resultados de laboratorio (36). Algunos autores sostienen que las solicitudes médicas de perfil lipídico suelen estar acompañadas de otras determinaciones bioquímicas, tales como glucosa (37), por lo cual la instrucción de ayuno para todas ellas ayuda en la estandarización y armonización. Otros concluyen que para un gran número de pruebas bioquímicas el ayuno no es necesario (12), excepto para unas pocas y ante esta disyuntiva nos encontramos hoy, ayuno versus no ayuno, ¿deberán reverse las indicaciones actuales? ¿el tiempo de ayuno? ¿los valores de referencia? En virtud de la heterogeneidad de las respuestas posprandiales a los alimentos y las diferencias culturales, étnicas y genéticas es imperiosa la necesidad de conocer la aplicabilidad de la condición de no ayuno en otras poblaciones (9) (10). En este sentido, éste es el primer estudio en Sudamérica que evalúa la influencia de dos comidas estandarizadas típicas de Argentina en los niveles de CT, C-HDL, C-LDL y TG.
Ciertas limitaciones del presene estudio deberán abordarse en futuras investigaciones, como el bajo número de participantes, el sesgo de género y edad, etnia y el hecho de que las muestras analizadas se obtuvieron exclusivamente de voluntarios sanos. Por lo tanto, y teniendo en cuenta que los presentes resultados se limitan a los analitos estudiados y se han recopilado en condiciones específicas, es obligatorio realizar más investigaciones sobre una población más grande e incluir individuos con diferentes patologías. Otro aspecto que se debe contemplar es el hecho de que solo se evaluaron los cambios en el perfil lipídico a la hora de la ingesta y sería importante analizar las variaciones que se pudieran producir en diferentes tiempos posprandiales como así también lo que se refiere a los ritmos circadianos y su posible influencia en la evaluación bioquímica de los lípidos. Son necesarios más estudios y evidencias para poder asegurar que es tiempo de cambio respecto de las condiciones y período de ayuno. Pero es claro que no se puede perder de vista la importancia de la estandarización y armonización en los requerimientos de ayuno en pos de la calidad en la etapa preanalítica.
Si bien el consenso general es que tanto la estandarización como la armonización son requisitos cruciales para minimizar los errores en el proceso bioquímico, también es una verdad general que los protocolos de fase preanalítica para la determinación del perfil de lípidos exponen a los pacientes “tal vez innecesariamente” a la situación inusual de ayunar durante 12 h antes de la flebotomía. Por lo tanto, aunque este estudio muestra que el ayuno no habría sido necesario para la determinación del perfil de lípidos, también es evidente la necesidad de profundizar la investigación, no solo de las dietas sino también de los requisitos para la recolección de muestras de sangre, para eventualmente reformular las condiciones actuales de ayuno.
1. Giavarina D, Lippi G. Blood venous sample collection: recommendations overview and a checklist to improve quality. Clin Biochem 2017; 50: 568–73.
2. Green SF. The cost of poor blood specimen quality and errors in preanalytical processes. Clin Biochem 2013; 46: 1175–9.
3. Simundic AM, Cornes M, Grankvist K, Lippi G, Nybo M. Standardization of collection requirements for fasting samples: for the Working Group on Preanalytical Phase (WG-PA) of the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). Clin Chim Acta 2014; 432: 33–7.
4. Plebani M. Harmonization of clinical laboratory information – current and future strategies. eJIFCC 2016; 27: 15-22.
5. Lippi G, Lima-Oliveira G, Salvagno GL, Montagnana M, Gelati M, Picheth G, et al. Influence of a light meal on routine haematological tests. Blood Transfus 2010; 8: 94-9. [ Links ]
6. Lima-Oliveira G, Salvagno GL, Lippi G, Gelati M, Montagnana M, Danese E, et al. Influence of a regular, standardized meal on clinical chemistry analytes. Ann Lab Med 2012; 32: 250-6. [ Links ]
7. Langsted A, Freiberg JJ, Nordestgaard BG. Fasting and nonfasting lipid levels: influence of normal food intake on lipids, lipoproteins, apolipoproteins, and cardiovascular risk prediction. Circulation 2008; 118: 2047-56. [ Links ]
8. Langsted A, Nordestgaard BG. Nonfasting lipids, lipoproteins, and apolipoproteins in individuals with and without diabetes: 58-434 individuals from the Copenhagen General Population Study. Clin Chem 2011; 57: 482-9. [ Links ]
9. Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, et al. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cutpoints – a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem 2016; 62: 930–46.
10. Lorenzo Lozano MC, Cosmen Sanchez A, Belinchon Torres PM, Prieto Menchero S, Pineda-Tenor D. Is fasting necessary for lipid profile determinations? Some considerations from the perspective of the clinical laboratory Clin Chem Lab Med 2017; 55: e187-e188. [ Links ]
11. Benozzi SF, Unger G, Campion A, Pennacchiotti GL. Fasting conditions: influence of water intake on clinical chemistry analytes. Biochem Med (Zagreb) 2018; 28: 1–8.
12. Plumelle D, Lombard E, Nicolay A, Portugal H. Influence of diet and sample collection time on 77 laboratory tests on healthy adults. Clin Biochem 2014; 47: 31-7. [ Links ]
13. Clinical Laboratory Standards Institute, Procedures for the collection of diagnostic blood specimens by venipuncture, Approved Standard- Sixth Edition. CLSI document H3-A6, Clinical Laboratory Standards Institute, Wayne, Pennsylvania, USA, 2007. [ Links ]
14. Lima-Oliveira G, Lippi G, Salvagno GL, Montagnana M, Picheth G, Guidi GC. Impact of the phlebotomy training based on CLSI/NCCLS H03-A6 – procedures for the collection of diagnostic blood specimens by venipuncture. Biochem Med 2012; 22: 342-51.
15. Fraser CG. Reference change values. Clin Chem Lab Med 2011; 50: 807-12. [ Links ]
16. Ricos C, Cava F, Garcia Lario JV, Hernández A, Iglesias N, Jiménez CV, et al. The reference change value: a proposal to interpret laboratory reports in serial testing based on biological variation. Scand J Clin Lab Invest 2004; 64: 175-84. [ Links ]
17. Minchinela J, Ricos C, Perich C, Fernandez-Calle P, Alvarez V, Domenech M, et al. Biological variation database, and quality specifications for imprecision, bias and total error (desirable and minimum). The 2014 update. Disponible en: https://www.westgard.com/biodatabase- 2014-update.htm (Fecha de acceso: 25 de agosto de 2018). [ Links ]
18. Ariel-Quiroga Rodríguez A, Martinez-Indart L, Granada Ybernc ML, Arza Ruesga A, Múgica Garay J, López-Urrutia Fernández A. Estudio de estabilidad de las concentraciones de cortisol, 25-hidroxivitamina D y corticotropina (ACTH). Rev Lab Clin 2012; 5: 68-74. [ Links ]
19. Alcaraz Quiles J, Rico Santana N, Bedini Chesa JL. Estabilidad de 27 magnitudes bioquímicas en muestras de suero conservadas en refrigeración. Rev Lab Clin 2014; 7: 9-16. [ Links ]
20. Oddoze C, Lombard E, Portugal H. Stability study of 81 analytes in human whole blood, in serum and in plasma. Clin Biochem 2012; 45: 464-9. [ Links ]
21. Cuhadar S, Atay A, Koseoglu M, Dirican A, Hur A. Stability studies of common biochemical analytes in serum separator tubes with or without gel barrier subjected to various storage conditions. Biochem Med (Zagreb) 2012; 22: 202-14. [ Links ]
22. Cuhadar S, Koseoglu M, Atay A, Dirican A. The effect of storage time and freeze-thaw cycles on the stability of serum samples. Biochem Med (Zagreb) 2013; 23: 70-7. [ Links ]
23. Lund SS, Jensen T. Using nonfasting lipids – hemodilution or convenience? Clin Chem 2011; 57: 1336–8.
24. Mora S, Rifai N, Buring JE, Ridker PM. Fasting compared with nonfasting lipids and apolipoproteins for predicting incident cardiovascular events. Circulation 2008; 118: 993–1001.
25. Sidhu D, Naugler C. Fasting time and lipid levels in a community-based population: a cross-sectional study. Arch Intern Med 2012; 172: 1707–10.
26. Dubois C, Beaumier G, Juhel C, Armand M, Portugal H, Pauli AM, et al. Effects of graded amounts (0–50 g) of dietary fat on postprandial lipemia and lipoproteins in normolipidemic adults. Am J Clin Nutr 1998; 67: 31–8.
27. Patsch JR, Miesenbock G, Hopferwieser T, Muhlberger V, Knapp E, Dunn JK, et al. Relation of triglyceride metabolism and coronary artery disease: studies in the postprandial state. Arterioscler Thromb 1992; 12: 1336–45.
28. Murphy MC, Isherwood SG, Sethi S, Gould BJ, Wright JW, Knapper JA, Williams CM. Postprandial lipid and hormone responses to meals of varying fat contents: modulatory role of lipoprotein lipase? Eur J Clin Nutr 1995; 49: 578–88.
29. Jeppesen J, Chen YD, Zhou MY, Wang T, Reaven GM. Effect of variations in oral fat and carbohydrate load on postprandial lipemia. Am J Clin Nutr 1995; 62: 1201–5.
30. Rifai N, Young IS, Nordestgaard BG, Wierzbicki AS, Vesper H, Mora S, et al. Non fasting sample for the determination of routine lipid profile: is it an idea whose time has come? Clin Chem 2016; 62: 3.428–35.
31. Chern-Pin Chuaa E, Shuib G, Tian-Guang Leea I, Laua P, Tana LC, Sing-Chen Yeoa, et al. Extensive diversity in circadian regulation of plasma lipids and evidence for different circadian metabolic phenotypes in humans. Proc Natl Acad Sci USA 2013; 110: 14.468–73.
32. Calmarza P, Cordero J. Lipemia interferences in routine clinical biochemical tests. Biochem Med 2011; 21: 160-6. [ Links ]
33. Ialongo C, Bernardini S. Preanalytical investigations of phlebotomy: methodological aspects, pitfalls and recommendations. Biochem Med (Zagreb) 2017; 27: 177-91. [ Links ]
34. Middlemis Maher J, Markey JC, Ebert-May D. The other half of the story: effect size analysis in quantitative research. CBE—Life Sci Educ 2013; 12: 345-51.
35. Sullivan GM, Feinn R. Using effect size-or why the p value is not enough. J Grad Med Educ 2012; 4: 279-82. [ Links ]
36. Cornes MP, Church S, van Dongen-Lases E, Grankvist K, Guimarães JT, Ibarz M, et al. Working Group for Preanalytical Phase (WG-PRE) and European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). The role of European Federation of Clinical Chemistry and Laboratory Medicine Working Group for Preanalytical Phase in standardization and harmonization of the preanalytical phase in Europe. Ann Clin Biochem 2016; 53: 539-47. [ Links ]
37. Lima-Oliveira G, Valentim CD, Guidi GC. Lipid profile, changes in laboratory prescriptions are necessary. J Clin Lipidol 2017; 11: 768–9.
Recibido: 27 de mayo de 2019
Aceptado: 3 de septiembre de 2019














