Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.4 La Plata dic. 2019
BIOQUÍMICA CLÍNICA
Tomar mate previo a la flebotomía no interfiere en las pruebas bioquímicas de rutina
Silvia Fabiana Benozzi1a, Gisela Unger2a, Pablo Gustavo Milano2a, Amparo Campion2b, Graciela Laura Pennacchiotti3a,b*
1 Magister en Bioquímica.
2 Bioquímico/a.
3 Doctora en Bioquímica.
a Bioquímica Clínica I. Departamento de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur, San Juan 670, (8000) Bahía Blanca, Provincia de Buenos Aires, Argentina.
b Hospital Municipal de Agudos ‘‘Dr. Leónidas Lucero’’, Estomba 968, (8000) Bahía Blanca, Provincia de Buenos Aires, Argentina.
* Autor para correspondencia.
Correspondencia Dra. GRACIELA LAURA PENNACCHIOTTI Universidad Nacional del Sur San Juan 670. 8000 BAHÍA BLANCA. Argentina. Correo electrónico: grapen@uns.edu.ar
Resumen
En este estudio se evaluó el efecto de tomar mate en las pruebas bioquímicas de rutina. Se extrajo sangre a 32 mujeres voluntarias luego de 12 horas de ayuno y a la hora (T1), dos horas (T2) y tres horas (T3) posteriores a la toma de 5 mates. Se estudiaron parámetros hematológicos y analitos de química clínica. Los resultados se analizaron empleando pruebas estadísticas para muestras relacionadas. Se calculó la diferencia porcentual media (DM%) de cada analito en cada hora respecto del valor basal y se comparó con el valor de referencia del cambio (VRC). Una DM% mayor que el VRC se consideró clínicamente significativa. En T1, T2 y T3 los recuentos de neutrófilos, eosinófilos y linfocitos fueron más bajos que en T0, también los niveles de glucosa, urea, creatinina y cistatina C fueron más bajos que en T0, mientras que los valores de proteínas totales, colesterol transportado por lipoproteínas de baja densidad y la actividad enzimática de lactato deshidrogenasa fueron más altos que en T0. En todos los casos los cambios fueron estadísticamente significativos, aunque no lo fueron desde el punto de vista clínico. Tomar 5 mates antes de la flebotomía no interfiere en los resultados de las pruebas bioquímicas de rutina.
Palabras clave: Ayuno; Recolección; Sangre; Variabilidad preanalítica; Mate.
Abstract
Intake mate prior to phlebotomy does not interfere in the test parameters
In the present study the effect of drinking mate in routine biochemical tests was evaluated. Blood was collected from 32 female volunteers after a 12 h fasting period. In addition, 1 hour (T1), 2 hours (T2), and 3 hours (T3) after drinking 5 mates, blood was collected again. Hematological parameters and clinical chemistry analytes were studied. The results were analyzed using statistical tests for related samples. Mean difference % (MD%) was calculated for each analyte and was further compared with reference change value (RCV). The MDs% higher than RCV were considered clinically significant. At T1, T2, and T3 the count neutrophils, eosinophils and lymphocytes were lower than at T0. Also glucose, urea, creatinine, and cystatin C values were lower than at T0 whereas total proteins, LDL-C, and LD enzymatic activity values were higher than at T0. In all cases, variability was statistically significant but not clinically significant. Drinking 5 mates prior to phlebotomy does not interfere with the results of routine biochemical tests.
Keywords: Fasting; Blood; Collection; Pre-analytical variability; Mate.
Resumo
Beber mate antes da flebotomia não interfere nos testes bioquímicos de rotinas
Neste trabalho, o efeito de beber chimarrão foi avaliado em testes bioquímicos de rotina. O sangue foi extraído de 32 mulheres voluntárias após 12 horas de jejum, e uma hora (T1), duas horas (T2) e três horas (T3) após a tomada de 5 chimarrões. Parâmetros hematológicos e analitos de química clínica foram estudados. Os resultados foram analisados utilizando testes estatísticos para amostras relacionadas. A diferença percentual média% (DM%) de cada analito em cada hora foi calculada em relação ao valor basal e comparada com o valor de referência da modificação (VRM). Uma DM% maior que o VRM foi considerada clinicamente significativa. Em T1, T2 e T3 as contagens de neutrófilos, eosinófilos e linfócitos foram mais baixas que em T0, Também os níveis de glicose, ureia, creatinina e cistatina C foram mais baixos que em T0, ao passo que os valores de proteínas totais, colesterol transportado por lipoproteínas de baixa densidade e a atividade enzimática de lactato desidrogenase foram mais altos que em T0. Em todos os casos as alterações foram estatisticamente significativas, embora do ponto de vista clínico não o tenham sido. Tomar 5 chimarrões antes da flebotomia não interfere nos resultados dos testes bioquímicos de rotina.
Palavras-chave: Jejum; Coleta; Sangue; Variabilidade pré-analítica; Chimarrão.
Introducción
Las pruebas de laboratorio le proporcionan al médico información esencial para la toma de decisiones, por ello, los errores que se producen en los exámenes de laboratorio impactan en la seguridad del paciente (1). Dentro de la totalidad del proceso bioquímico la etapa preanalítica es la más propensa a errores, con un porcentaje que oscila entre 46 y 71% (2) (3). La preparación del paciente es un aspecto crítico de la etapa preanalítica en la que se ha observado una elevada variabilidad entre los distintos países. Un gran número de variables preanalíticas asociadas a la preparación del paciente tales como: la dieta, los medicamentos, las drogas de abuso, las medicinas en base a hierbas, las vitaminas, la actividad física, el hábito de fumar, el alcohol y otras, pueden afectar a las pruebas de laboratorio (4). Para mitigar el impacto de la variabilidad preanalítica, es esencial estandarizar y armonizar las recomendaciones y la información que se le brinda a los pacientes en base a la evidencia científica (4) (5).
Las recomendaciones publicadas en 2014 por el Working Group on Preanalytical Phase (WG-PRE) of the European Federation of Clinical Chemistry and Laboratory Medicine con el fin de estandarizar y armonizar la preparación del paciente contemplan varios aspectos: ayuno de 12 h durante el cual se puede beber agua, no tomar alcohol 24 h antes de la extracción; no fumar ni tomar bebidas que contengan cafeína durante la mañana en la que se realiza la extracción (6). Sin embargo, es necesario considerar que existen hábitos culturales y costumbristas arraigados en algunos países, que pueden afectar a las pruebas de laboratorio. En Sudamérica es frecuente que los pacientes concurran al laboratorio habiendo “tomado mate” previamente. El mate es una bebida popular, tradicional en países como la Argentina, Brasil, Paraguay y Uruguay (7).
Consiste en una infusión que se prepara en un recipiente denominado mate, en el que se coloca la yerba mate (Ilex paraguariensis St. Hill.). Se vierte agua sobre la yerba mate varias veces para hacer una infusión parcial que se bebe utilizando una varilla hueca de metal llamada “bombilla”. El mate se toma en infusiones sucesivas (8). La yerba mate tiene actividades biológicas que se atribuyen a sus constituyentes: nutrientes, minerales y vitaminas solubles en agua, polifenoles (ácido fenólico, flavonoides), alcaloides (metilxantinas, incluidas cafeína, teobromina, teofilina) y terpenos (carotenoides, saponinas) (7). A la yerba mate se le atribuyen propiedades antioxidantes y protectoras para la diabetes, la hipertensión, la aterosclerosis y la dislipemia (7) (8). Sin embargo, no existe evidencia científica respecto del efecto del hábito de “tomar mate”, como variable preanalítica, en las pruebas de laboratorio.
Por lo expuesto, el objetivo del trabajo fue analizar si “desayunar mate”, antes de la flebotomía, interfiere en las pruebas bioquímicas de rutina del laboratorio clínico.
Materiales y Métodos
Diseño del estudio
El presente es un estudio consecutivo realizado en un laboratorio no acreditado (según las normas IRAM ISO 15189) del Hospital Municipal de Agudos “Dr. Leónidas Lucero” de la ciudad de Bahía Blanca, Provincia de Buenos Aires, República Argentina. El trabajo se realizó en 2018 y se llevó a cabo siguiendo las pautas metodológicas publicadas previamente (9) (10).
Población
La población incluida en el trabajo estuvo constituida por 32 mujeres que voluntariamente accedieron a participar en este estudio. La edad media de las voluntarias fue de 24 (mínimo: 22, máximo: 50) años. Las participantes fueron informadas respecto del propósito del estudio, el procedimiento del mismo y expresaron su consentimiento informado por escrito. El estudio contó con la aprobación del Comité de Bioética del hospital en el que se llevó a cabo el trabajo. Criterio de inclusión: mujeres adultas sin patología crónica o aguda. Criterio de exclusión: embarazo, tratamiento con medicación o haber realizado actividad física dentro de las 24 h previas a la flebotomía. El tamaño de la población estudiada se definió en base a publicaciones previas en las que se evaluaron variables preanalíticas relacionadas con la preparación del paciente, particularmente asociadas con el requerimiento de ayuno (9) (10).
Muestras
Las muestras de sangre para las pruebas bioquímicas fueron obtenidas luego del reposo nocturno con 12 h de ayuno. Las participantes permanecieron en reposo y sentadas durante 15 min antes de la punción venosa. Todas las muestras fueron obtenidas por un flebotomista con experiencia en el procedimiento y siguiendo las pautas publicadas (11). La primera muestra de sangre (basal: T0) se obtuvo entre las 7 y las 9 de la mañana de acuerdo a las recomendaciones del WG-PRE (6).
Inmediatamente después de la flebotomía basal las mujeres tomaron cinco mates preparados en forma estandarizada (40 g de yerba mate y 300 mL de agua a 70 °C en cinco infusiones consecutivas). Con posterioridad a la toma de mate se repitieron las extracciones de sangre a la hora (T1), dos horas (T2) y tres horas (T3). De cada individuo se obtuvieron cuatro muestras de sangre de 5 mL cada una. Las participantes permanecieron sentadas, en reposo, en el sitio de extracción, durante todo el procedimiento. Para realizar la punción de la vena antecubital se emplearon agujas 21Gx1 (NEOJET, Zhejiang Ougian Medical Apparatus Co, Wenzhou, China) y jeringas de 10 mL (Hongda, Jiangxi Hongda Medical Equipment Group Ltd., Nanchang, China).
Luego de la extracción sanguínea las muestras se distribuyeron en tubos plásticos de 1,3 mL con EDTA K3 como aditivo (TECNON, Laboratorios Argentinos, Berisso, Argentina) para su posterior análisis y en tubos plásticos de 2,5 mL con heparina de litio como aditivo (TECNON, Laboratorios Argentinos, Berisso, Argentina). Estos últimos se centrifugaron a 1.500xg durante 15 min a temperatura ambiente. El plasma se separó del paquete globular inmediatamente al terminar la centrifugación y se alicuotó en dos tubos de polipropileno sin aditivos (TECNON, Laboratorios Argentinos, Berisso, Argentina) para realizar, posteriormente, los análisis en los diferentes analizadores. Los índices séricos evaluados en Vitros® 4600 (Ortho Clinical Diagnostics, New Jersey, EE.UU.) demostraron que las muestras estaban libres de hemólisis, lipemia o ictericia.
Material utilizado en la preparación de la infusión
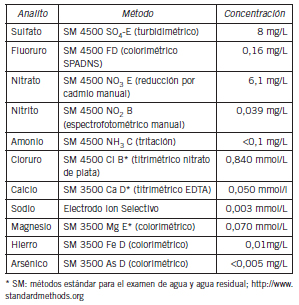
La yerba mate fue adquirida en un supermercado local. La composición de la infusión informada por el fabricante se muestra en la Tabla I. El agua utilizada para preparar la infusión fue agua envasada por una compañía local (Aristu Hnos, Bahía Blanca, Argentina) y estuvo previamente sujeta a tratamiento de ósmosis reversa, filtrada, ionizada y osonizada para garantizar su calidad física, química y biológica para el consumo humano. La Tabla II muestra la composición química del agua informada por el fabricante (12).
Tabla I. Información nutricional de la infusión obtenida a partir de 50 g de yerba y 500 mL de agua a 70 ºC. Composición provista por el fabricante.
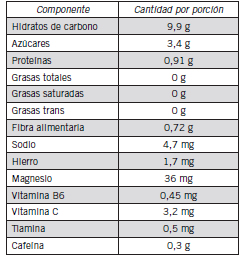
Tabla II. Composición química de agua provista por el fabricante.
Parámetros hematológicos
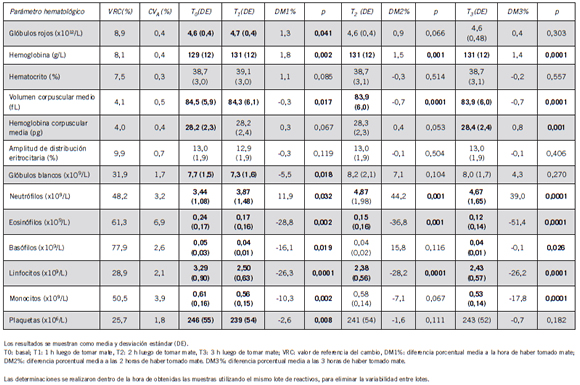
Las determinaciones hematológicas se realizaron en un analizador hematológico automatizado (Sysmex XN1000, Sysmex, Kobe, Japón), con reactivos, calibradores y controles provistos por el fabricante. Los parámetros estudiados fueron: recuento de glóbulos blancos, neutrófilos, eosinófilos, basófilos, linfocitos, monocitos, recuento de glóbulos rojos, hematocrito, hemoglobina, volumen corpuscular medio, hemoglobina corpuscular media, amplitud de distribución eritrocitaria y recuento de plaquetas. El coeficiente de variación analítico (CVA) para cada parámetro hematológico fue obtenido del control de calidad interno del laboratorio (Tabla III). Los resultados se muestran como media y desviación estándar (DE). Las determinaciones se realizaron dentro de la hora de obtenidas las muestras utilizando el mismo lote de reactivos, para eliminar la variabilidad entre lotes.
Tabla III. Variación de los parámetros hematológicos en las tres horas posteriores a tomar mate.
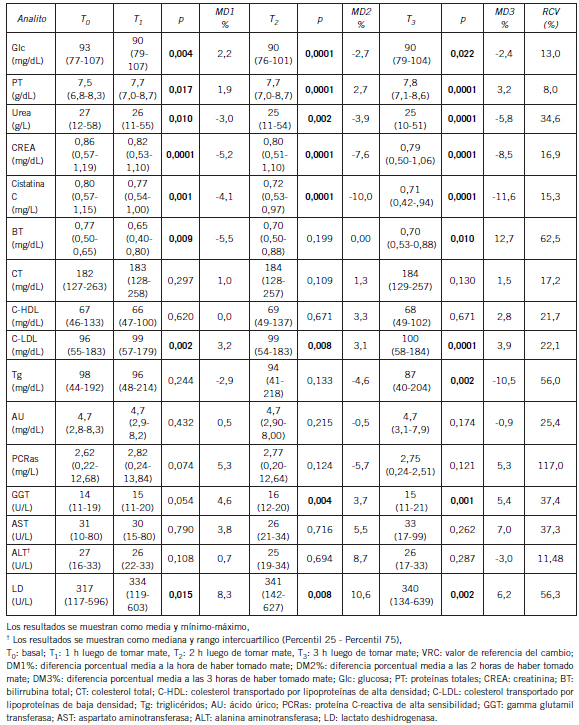
Analitos de química clínica
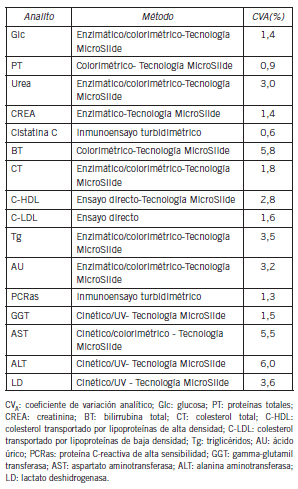
La mayoría de las determinaciones de química clínica se realizaron en un autoanalizador Vitros® 4600 (Ortho Clinical Diagnostics, New Jersey, EE.UU.) con reactivos y calibradores del mismo fabricante. Los controles de calidad internos y externos fueron incluidos en el procedimiento de medición de los analitos. La medición de cistatina C, proteína C reactiva de alta sensibilidad (PCRas) y el colesterol transportado por las lipoproteínas de baja densidad (C-LDL) se realizó en un autoanalizador Modular P800® (Roche Diagnostics, Mannheim, Alemania) siguiendo las especificaciones de calidad mencionadas con anterioridad. Los métodos empleados para la medición de los analitos se muestran en la Tabla IV. Todas las determinaciones se realizaron al mismo tiempo, con el mismo lote de reactivos, para disminuir la variabilidad entre lotes. El CVA de cada analito se obtuvo usando material de control de tercera opinión (BIORAD, Irvine, EE.UU.) (Tabla IV).
Tabla IV. Pruebas de laboratorio realizadas, métodos empleados y sus respectivos coeficientes de variación analítico.
Análisis estadístico
La normalidad de los parámetros estudiados fue evaluada con la prueba de Kolgomorov- Smirnov. Las diferencias entre T0 y Tx se analizaron usando la prueba t de student para muestras relacionadas (13) cuando los analitos tuvieron distribución normal [parámetros hematológicos, glucosa (Glc), proteínas totales (PT), creatinina (CREA), cistatina C, colesterol total (CT), colesterol transportado por lipoproteínas de alta densidad (C-HDL), C-LDL, triglicéridos (Tg), ácido úrico (AU), PCRas, aspartato aminotransferasa (AST), lactato deshidrogenasa (LD)]. La comparación de medianas entre T0 y Tx se realizó con la prueba no paramétrica Wilcoxon Signed Rank para muestras pareadas, en los analitos que tuvieron una distribución no paramétrica [bilirrubina total (BT), gamma-glutamil transferasa (GGT), alanina aminotransferasa (ALT)] (13).
El valor p<0,05 fue considerado estadísticamente significativo. El análisis estadístico se realizó con el programa estadístico Statistical Package for Social Science for Windows (SPSS) software (Versión 15,0. Chicago, IL, EE.UU.). Para cada analito se calculó el cambio clínicamente significativo usando el valor de referencia del cambio (VRC) según la siguiente fórmula (14) (15):
![]()
donde Z es una constante para el nivel de confianza estadística (1,96 para á =0,05), CVI es la variabilidad biológica intraindividual obtenida de la base de datos de Westgard (18), y CVA es el coeficiente de variación analítico obtenido del control de calidad interno del laboratorio (Tabla III y IV).
Para cada prueba bioquímica y en cada tiempo estudiado, se calculó la diferencia porcentual media (DM%), según la siguiente fórmula (10) (16) (17):
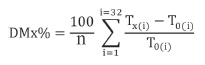
donde: n = 32 (número total de participantes incluidas en el estudio); x: 1 h, 2 h, 3 h después de tomar mate; i: individuo; Tx(i): valor de la medición del parámetro hematológico o analito en la muestra Tx de cada individuo; T0(i): valor de la medición del parámetro hematológico o analito en la muestra T0 (basal) de cada individuo. Estos datos se muestran en las Tablas III y V.
Tabla V. Variación de los analitos de química clínica en las tres horas posteriores a tomar mate
Se consideró que el cambio detectado en el parámetro bioquímico medido fue clínicamente significativo cuando la DM% superó el respectivo VRC.
Resultados
Los resultados de los parámetros hematológicos estudiados se muestran en la Tabla III. A las tres horas posteriores a la toma de mate se observó un aumento en la concentración de hemoglobina y en el recuento de neutrófilos, y contrariamente, se produjo una disminución en el volumen corpuscular medio, en el recuento de eosinófilos y en el de linfocitos. Todos estos cambios respecto del valor basal fueron estadísticamente significativos. En algunos parámetros se observaron cambios en uno o dos de los tiempos estudiados, pero no en todos ellos, así, un valor significativamente más alto respecto de T0 se registró en el recuento de glóbulos rojos a la hora de haber tomado mate y a las tres horas en el valor de la hemoglobina corpuscular media.
En cambio, se obtuvo un valor significativamente más bajo respecto de T0 en el recuento de glóbulos blancos y de plaquetas a la hora de tomar mate; y a la hora y tres horas en el recuento de basófilos y de monocitos. A pesar de ello, ninguna de las variaciones resultó clínicamente significativa. Las Figuras 1 y 2 muestran las variaciones porcentuales de los parámetros hematológicos de las series blanca y roja. En la Tabla V se puede observar que, a la hora, a las dos horas y a las tres horas de tomar mate se registraron incrementos en los niveles de PT, C-LDL, y LD.
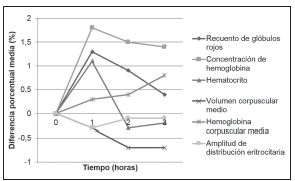
Figura 1. Diferencia porcentual media de la serie roja en las tres horas posteriores a la toma de mate.
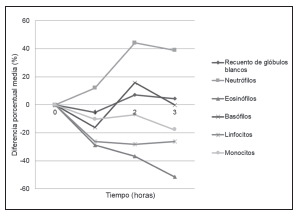
Figura 2. Diferencia porcentual media de la serie blanca en las tres horas posteriores a la toma de mate.
En cambio, se produjeron disminuciones en los valores de Glc, urea, CREA, cistatina C, BT. Todos estos cambios fueron estadísticamente significativos. Los niveles de Tg disminuyeron a las 3 horas de la toma de mate y la enzima GGT aumentó sus niveles significativamente a las dos y tres horas de tomar mate. Sin embargo, de la comparación de la DM% con VRC, se evidencia que los cambios en los analitos estudiados no resultaron de relevancia clínica. La representación gráfica de las DM% se muestran en las Figuras 3, 4 y 5.
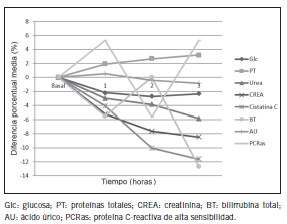
Figura 3. Diferencia porcentual media de analitos de química clínica en las tres horas posteriores a la toma de mate.
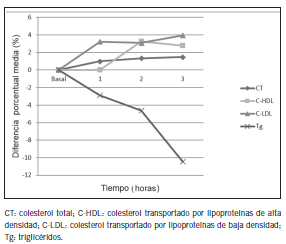
Figura 4. Diferencia porcentual media de los lípidos en las tres horas posteriores a la toma de mate.
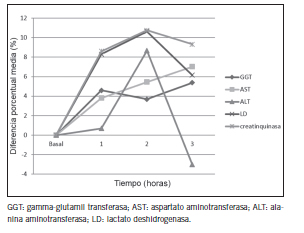
Figura 5. Diferencia porcentual media de las enzimas en las tres horas posteriores a la toma de mate.
Discusión y Conclusiones
Si bien se han publicado numerosos artículos respecto del efecto de “tomar mate” sobre diversos parámetros que se miden en el laboratorio a largo plazo (7) (8), este es el primer trabajo que estudia y analiza el impacto de “tomar mate”, como variable preanalítica, en las pruebas de rutina del laboratorio bioquímico. En este estudio, ninguna de las pruebas bioquímicas estudiadas fue afectada por “tomar mate” en las tres horas posteriores a la toma de la infusión. Sin embargo, se observaron variaciones cercanas al VRC en algunos parámetros hematológicos como el recuento de neutrófilos, linfocitos y eosinófilos.
La explicación de esas variaciones no es simple.
El aumento estadísticamente significativo en el recuento de neutrófilos (12%-44%) luego de tomar mate puede atribuirse a las variaciones diurnas en el recuento de neutrófilos más que a la toma de mate, tal como se ha documentado en la bibliografía (18-20). Asimismo, la disminución observada en el recuento de linfocitos coincide con los hallazgos de otros autores tales como Bishop et al. (21-26) y Yang et al. (20), quienes atribuyeron esta variación al ritmo circadiano regulado por el cortisol que se presenta en ciertas subpoblaciones de linfocitos T en el rango horario en que las muestras sanguíneas fueron obtenidas. Por ello, las variaciones estadísticamente significativas observadas en neutrófilos y linfocitos podrían atribuirse al horario de muestreo más que al efecto de la toma de mate per se. Esto coincide con el hecho de que la DM% obtenida en ningún caso superó el respectivo VRC.
En consecuencia, el horario de la toma de muestra para los recuentos de neutrófilos y linfocitos es un aspecto a considerar con el fin de evitar el efecto de las variaciones circadianas en los resultados de estos parámetros hematológicos (25). Por otro lado, la disminución observada en el recuento de eosinófilos, cuyos cambios fueron considerables (29%-51%) pese a no superar el VRC, son de difícil explicación. Algunos autores sostienen la hipótesis de que la comida induce un incremento en el cortisol y ello promueve la migración de los eosinófilos hacia el bazo, nódulos linfoides y timo (27). En este sentido sería de interés investigar si alguno de los componentes de la yerba mate tiene un efecto inductor de cortisol. En cuanto a los parámetros de química clínica estudiados, se observó que todos ellos se mantuvieron dentro de los intervalos de referencia y ninguna de las variaciones observadas resultaron clínicamente relevantes.
La disminución significativa en los niveles de glucosa que se observó en este trabajo es coincidente con los hallazgos de Troisi et al. (28) quienes informaron una disminución constante en la glucosa plasmática en ayunas a lo largo de la mañana e incluso plantearon que las diferencias entre los valores de glucosa de 8 a 10 de la mañana pueden ser significativas. Los cambios observados en los niveles de Tg podrían atribuirse al ritmo circadiano descripto por Chern-Pin Chuaa et al. quienes demostraron un descenso en los niveles de este analito entre las 8 y las 16 h (29).
De esta manera el horario de toma de muestra resulta de relevancia a fin de disminuir la variabilidad relacionada con los ritmos circadianos que afecta a los analitos de química clínica. En este estudio se consideró que el mejor parámetro disponible para evaluar la relevancia clínica de los cambios observados es el VRC, ya que incluye la variabilidad biológica y analítica. La sola interpretación del valor de p puede conducir a conclusiones erróneas, máxime cuando éstas tienen por objetivo armonizar y estandarizar la preparación del paciente para las pruebas de laboratorio (30-32).
La aplicación de políticas de calidad en la totalidad del procedimiento bioquímico es el desafío al que se enfrentan en la actualidad todos los laboratorios bioquímicos, fundamentalmente en lo que se refiere a la etapa preanalítica, pues en ella se registra el mayor porcentaje de errores del laboratorio (33) (34). La armonización entre los laboratorios es imprescindible (4), puesto que los valores que emite el laboratorio tienen implicancia directa en la toma de decisiones y procedimientos médicos (1). La obtención de una muestra de calidad analítica implica la correcta preparación del paciente lo que permite la emisión de resultados confiables que garanticen la seguridad del mismo. Para ello es indispensable contar con evidencia científica que avale las recomendaciones con el fin de estandarizar y armonizar este proceso crítico de la fase preanalítica. Los hábitos costumbristas, tradicionales, culturales, considerados inocuos por la población, deben ser analizados y evaluados en sus potenciales efectos preanalíticos, por lo que este trabajo resulta relevante en ese sentido. Una limitación de este estudio fue el género, la edad, la etnia y que las muestras procedieron únicamente de voluntarios sanos. Sería interesante ampliar el tamaño muestral pero es una limitación en este tipo de trabajos por la complejidad de la logística que implica, para evitar variables confusoras, el hecho de conseguir voluntarios para pruebas sostenidas en el tiempo. No obstante se siguieron las pautas metodológicas previamente publicadas en muchos trabajos de esa índole en donde el tamaño muestral era similar (9) (10). Asimismo, podría resultar de interés, realizar estudios con una población más amplia e incluyendo individuos que cursen con condiciones patológicas de diversa índole. Se debe considerar que estos resultados solo son válidos para los analitos estudiados y bajo las condiciones expuestas en el presente trabajo.
En virtud de los resultados obtenidos se puede concluir que tomar cinco mates hasta una hora antes de la flebotomía no interfiere en los resultados de los parámetros de rutina del laboratorio que fueron analizados.
Potencial conflicto de interés
No declarado
1. Da Rin G. Pre-analytical workstations: a tool for reducing laboratory errors. Clin Chim Acta 2009; 404: 68-74. [ Links ]
2. Plebani M. Errors in clinical laboratories or errors in laboratory medicine? Clin Chem Lab Med 2006; 44: 750-9. [ Links ]
3. Astion ML, Shojania KG, Hamill TR, Kim S, Ng VL. Classifying laboratory incident reports to identify problems that jeopardize patient safety. Am J Clin Pathol 2003; 120: 18-26. [ Links ]
4. Cornes MP, Church S, van Dongen-Lases E, Grankvist K, Guimarães JT, Ibarz M, et al. Working Group for Preanalytical Phase (WG-PRE) and European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). The role of European Federation of Clinical Chemistry and Laboratory Medicine Working Group for Preanalytical Phase in standardization and harmonization of the pre analytical phase in Europe. Ann Clin Biochem 2016; 53: 539-47. [ Links ]
5. Giavarina D, Lippi G. Blood venous sample collection: Recommendations overview and a checklist to improve quality. Clin Biochem 2017; 50: 568–73.
6. Simundic AM, Cornes M, Grankvist K, Lippi G, Nybo M. Standardization of collection requirements for fasting samples: for the Working Group on Preanalytical Phase (WG-PA) of the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). Clin Chim Acta 2014; 432: 33-7. [ Links ]
7. Cardozo Junior EA, Morand C. Interest of mate (Ilex paraguariensis A. St.-Hil.) as a new natural functional food to preserve human cardiovascular health – A review. J Funct Foods 2016; 21: 440-54.
8. Bracesco N, Sanchez AG, Contreras V, Menini T, Gugliucci A. Recent advances on Ilex paraguariensis research: minireview. J Ethnopharmacol 2011; 136 (3): 378-84. [ Links ]
9. Lippi G, Lima-Oliveira G, Salvagno GL, Montagnana M, Gelati M, Picheth G, et al. Influence of a light meal on routine haematological tests. Blood Transfus 2010; 8: 94-9. [ Links ]
10. Lima-Oliveira G, Salvagno GL, Lippi G, Danese E, Gelati M, Montagnana M, et al. Could light meal jeopardize laboratory coagulation tests? Biochem Med (Zagreb) 2014; 24: 343-9. [ Links ]
11. Lima-Oliveira G, Lippi G, Salvagno GL, Montagnana M, Picheth G, Guidi GC. Impact of the phlebotomy training based on CLSI/NCCLS H03-A6 – procedures for the collection of diagnostic blood specimens by venipuncture. Biochem Med 2012; 22: 342-51.
12. Standard methods for the examination of water & wastewater. Disponible en: http://www.standardmethods.org (Fecha de acceso: 25 de agosto de 2017). [ Links ]
13. Simundic AM. Practical recommendations for statistical analysis and data presentation in Biochemia Medica Journal. Biochem Med (Zagreb) 2012; 22: 15-23. [ Links ]
14. Fraser CG. Reference change values. Clin Chem Lab Med 2011; 50: 807-12. [ Links ]
15. Ricos C, Cava F, Garcia Lario JV, Hernandez A, Iglesias N, Jimenez CV, et al. The reference change value: a proposal to interpret laboratory reports in serial testing based on biological variation. Scand J Clin Lab Invest 2004; 64: 175-84. [ Links ]
16. Minchinela J, Ricos C, Perich C, Fernandez-Calle P, Alvarez V, Domenech M, et al. Biological variation database, and quality specifications for imprecision, bias and total error (desirable and minimum). The 2014 update. Disponible en: https://www.westgard.com/biodatabase-2014-update.htm (Fecha de acceso: 25 de agosto de 2017). [ Links ]
17. Aniel-Quiroga Rodríguez A, Martinez-Indart L, Granada Ybernc ML, Arza Ruesga A, Múgica Garay J, López-Urrutia Fernández A. Estudio de estabilidad de las concentraciones de cortisol, 25-hidroxivitamina D y corticotropina (ACTH). Rev Lab Clin 2012; 5: 68-74. [ Links ]
18. Sennels HP, Jørgensen HL, Hansen AL, Goetze JP, Fahrenkrug J. Diurnal variation of hematology parameters in healthy young males: the Bispebjerg study of diurnal variations. Scand J Clin Lab Invest 2011; 71: 532-41. [ Links ]
19. Plumelle D, Lombard E, Nicolay A, Portugal H. Influence of diet and sample collection time on 77 laboratory tests on healthy adults. Clin Biochem 2014; 47: 31-7. [ Links ]
20. Yang Y, Zhou C, Yang D. Daytime biological variation of hematological parameters in a healthy Chinese population. Int Jnl Lab Hem 2017;39: e37-e40. [ Links ]
21. Bishop NC, Fitzgerald C, Porter PJ, Scanlon GA, Smith AC. Effect of caffeine ingestion on lymphocyte counts and subset activation in vivo following strenuous cycling. Eur J Appl Physiol 2005; 93: 606-13. [ Links ]
22. Fu L, Lee CC. The circadian clock: pacemaker and tumour suppressor. Nat Rev Cancer 2003; 3: 350-61. [ Links ]
23. Dimitrov S, Benedict C, Heutling D, Westermann J, Born J, Lange T. Cortisol and epinephrine control opposing circadian rhythms in T cell subsets. Blood 2009; 113: 5134-43. [ Links ]
24. Trifonova ST, Zimmer J, Turner JD, Muller CP. Diurnal redistribution of human lymphocytes and their temporal associations with salivary cortisol. Chronobiol Int 2013; 30: 669-81. [ Links ]
25. Besedovsky L, Born J, Lange T. Endogenous glucocorticoid receptor signaling drives rhythmic changes in human T-cell subset numbers and the expression of the chemokine receptor CXCR4. FASEB J 2014; 28: 67-75. [ Links ]
26. Labrecque N, Cermakian N. Circadian clocks in the immune system. J Biol Rhythms 2015; 30: 277-90. [ Links ]
27. Sabag N, Castrillón MA, Tchernitchin A. Cortisol induced migration of eosinophil leukocytes to lymphoid organs. Experientia 1978; 34: 666-7. [ Links ]
28. Troisi RJ, Cowie CC, Harris MI. Diurnal variation in fasting plasma glucose: implications for diagnosis of diabetes in patients examined in the afternoon. JAMA 2000; 284: 3.157-9. [ Links ]
29. Chern-Pin Chuaa E, Shuib G, Tian-Guang Leea I, Laua P, Tana LC, Sing-Chen Yeoa, et al. Extensive diversity in circadian regulation of plasma lipids and evidence for different circadian metabolic phenotypes in humans. Proc Natl Acad Sci 2013; 110: 14.468-73. [ Links ]
30. Ialongo C, Bernardini S. Preanalytical investigations of phlebotomy: methodological aspects, pitfalls and recommendations. Biochem Med (Zagreb) 2017; 27 (1): 177-91. [ Links ]
31. Middlemis Maher J, Markey JC, Ebert-May D. The other half of the story: effect size analysis in quantitative research. CBE—Life Sci Educ 2013; 12: 345-51.
32. Sullivan GM, Feinn R. Using effect size-or why the p value is not enough. J Grad Med Educ 2012; 4: 279-82. [ Links ]
33. Plebani M. Errors in clinical laboratories or errors in laboratory medicine? Clin Chem Lab Med 2006; 44: 750–9.
34. Astion ML, Shojania KG, Hamill TR, Kim S, Ng VL. Classifying laboratory incident reports to identify problems that jeopardize patient safety. Am J Clin Pathol 2003; 120 (1): 18-26. [ Links ]
Recibido: 22 de julio de 2019
Aceptado: 3 de septiembre de 2019














