Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.4 La Plata dic. 2019
CONTROL DE CALIDAD
Programa de Evaluación Externa de la Calidad “Prof. Dr. Daniel Mazziotta”: una nueva etapa asegurando la mejora continua de la calidad
María Cecilia Etchegoyen1a*, María Marta Prevoo1a, Raúl Héctor Girardi2a
1 Bioquímica.
2 Bioquímico.
a Fundación Bioquímica Argentina.
* Autor para correspondencia.
Correspondencia Bioq. CECILIA ETCHEGOYEN Correo electrónico: cecilia.etchegoyen@fba.org.ar
Resumen
Las determinaciones de los laboratorios clínicos tienen un papel muy importante en la evaluación, diagnóstico, tratamiento y evolución del estado de salud de las personas. La confiabilidad de sus resultados se logra a través del aseguramiento de la calidad y mejora continua. El Programa de Evaluación Externa de la Calidad “Prof. Dr. Daniel Mazziotta” acompaña a los laboratorios de análisis clínicos desde hace 31 años brindando distintas herramientas para garantizar la calidad analítica. Ofrece los servicios de evaluación externa de la calidad, suministro de material para control de calidad interno para determinaciones en Química Clínica y soluciones para control de instrumental y pruebas de suficiencia. Desde la creación del programa se establecieron objetivos estratégicos a desarrollarse en tres etapas: establecimiento, consolidación y apoyo a la gestión de la calidad. Se genera ahora una nueva etapa, cuyo objetivo final es la acreditación. Como primer paso de este ciclo, se implementó un sistema de gestión de la calidad (SGC) de acuerdo a los requisitos establecidos en la norma argentina IRAM-ISO 9001:2015. En agosto de 2019, el Instituto Argentino de Normalización y Certificación (IRAM), representante en Argentina de la International Organization for Standarization (ISO), certificó que el SGC del programa cumple lo establecido en dicha norma. Su aplicación tiene como objetivo asegurar que los servicios ofrecidos satisfagan las necesidades de los laboratorios clínicos cumpliendo los requisitos legales requeridos y asegurando la mejora continua. El objetivo de este trabajo fue describir las acciones realizadas en la implementación del SGC y la posterior certificación de IRAM-ISO 9001:2015, por el IRAM.
Palabras clave: Evaluación externa de la calidad; Mejora continua; IRAMISO 9001:2015.
Abstract
Quality Assessment Program Prof. Dr. Daniel Mazziotta: a new stage ensuring continuous quality improvement
Clinical laboratory determinations have a very important role in the evaluation, diagnosis, treatment and evolution of the health status of people. The reliability of their results is achieved through quality assurance and continuous improvement. The External Quality Assessment Programme Prof. Dr. Daniel Mazziotta has been accompanying clinical analysis laboratories for 31 years offering different tools to ensure analytical quality. It provides the services of external quality assessment, supply of material for internal quality control for determinations in Clinical Chemistry and solutions for instrumental control and sufficiency tests. Since the creation of the program, strategic objectives have been established to be developed in three stages: establishment, consolidation and support for quality management. A new stage is now being generated, whose final objective is accreditation. As a first step of this cycle, a quality management system (QMS) was implemented according to the requirements established in the IRAM Argentina standard-ISO 9001:2015. In August 2019, the Argentine Institute for Standardization and Certification (IRAM), representative in Argentina of the International Organization for Standardization (ISO), certified that the Programme’s QMS complies with the provisions of said standard. Its application aims to ensure that the services offered meet the needs of clinical laboratories by fulfilling the legal requirements and ensuring continuous improvement. The objective of this work is to describe the actions carried out in the implementation of the QMS and the subsequent IRAM-ISO 9001: 2015 certification by the IRAM.
Keywords: External quality assessment; Continuous improvement; IRAM-ISO 9001:2015.
Resumo
Programa de Avaliação Externa de Qualidade Prof. Dr. Daniel Mazziotta: um novo estágio garante a melhoria contínua da qualidade
As determinações laboratoriais clínicas têm um papel muito importante na avaliação, diagnóstico, tratamento e evolução do estado de saúde das pessoas. A confiabilidade de seus resultados é alcançada através da garantia de qualidade e melhoria contínua. O Programa de Avaliação da Qualidade Externa “Prof. Dr. Daniel Mazziotta” apoia os laboratórios de análises clínicas há 31 anos, oferecendo diferentes ferramentas para garantir a qualidade analítica. Oferece os serviços de: avaliação externa de qualidade, fornecimento de material de controle interno de qualidade para determinações em Química Clínica e soluções para controle instrumental e testes de suficiência. Desde a criação do programa, os objetivos estratégicos foram estabelecidos para serem desenvolvidos em três etapas: estabelecimento, consolidação e suporte para a gestão da qualidade. Uma nova etapa é agora gerada, cujo objetivo final é a Acreditação. Como primeira etapa desse ciclo, um sistema de gestão da qualidade (SGQ) foi implementado de acordo com os requisitos estabelecidos na norma IRAM Argentina - ISO 9001:2015. Em agosto de 2019, o Instituto Argentino de Normalização e Certificação (IRAM), representante na Argentina da Organização Internacional de Normalização (ISO), certificou que o SGC do programa está em conformidade com as disposições da referida norma. Sua aplicação visa garantir que os serviços oferecidos satisfaçam as necessidades dos laboratórios clínicos, atendendo aos requisitos legais exigidos e garantindo a melhoria contínua. O objetivo deste trabalho é descrever as ações realizadas na implementação do SGQ e a subsequente certificação da IRAM-ISO 9001:2015, pela IRAM.
Palavras-chave: Avaliação externa de qualidade; Melhoria contínua; IRAM-ISO 9001:2015.
Introducción
El laboratorio de análisis clínicos es un partícipe primordial en el sistema de salud. Los resultados de las determinaciones bioquímicas cumplen un rol importante en las decisiones médicas. Es necesario asegurar su confiabilidad garantizando su calidad y promoviendo la mejora continua. Con el fin de acompañar al bioquímico en esta responsabilidad, en 1987 se creó el Programa de Evaluación Externa de la Calidad (PEEC), en un principio soportado por la estructura de la Federación Bioquímica de la Provincia de Buenos Aires y a partir de 1993 como parte de la Fundación Bioquímica Argentina (FBA). En el año 2016 tomó el nombre de Programa de Evaluación Externa de la Calidad “Prof. Dr. Daniel Mazziotta”, en homenaje a su mentor. El programa se inició con 198 laboratorios y con la evaluación de sólo 3 mensurandos de Química Clínica. Luego de 31 años de trayectoria, participan más de 3.000 laboratorios de todo el país del sector público, privado, ambulatorios y de alta complejidad. Cuenta con 30 subprogramas, y cubre un alto porcentaje de las áreas de la Bioquímica Clínica (1) .
El PEEC ofrece a los laboratorios clínicos los siguientes servicios:
a) Evaluación Externa de la Calidad: constituye uno de los pilares necesarios para garantizar la calidad analítica en los laboratorios clínicos. Básicamente una misma muestra, la cual se asimila a un paciente, es analizada por los laboratorios clínicos cada cual con su estructura analítica. La evaluación de los resultados permite estudiar las distintas condiciones analíticas para un determinado sistema, comparar su desempeño con el resto de los participantes y con especificaciones de calidad predefinidas (2)(3).
b) Suministro de material para control de calidad interno para determinaciones en Química Clínica y soluciones para control de instrumental: es el otro pilar de la calidad analítica. Permite monitorear la imprecisión en el proceso de medición, detectar errores, controlar la estabilidad y el desempeño del sistema de medición. La evaluación retrospectiva permite comparar el grado de concordancia con el grupo par correspondiente (4).
c) Pruebas de suficiencia: evalúa el desempeño del laboratorio en los subprogramas requeridos. Es solicitado, para casos particulares, por la Secretaría de FBA.
Desde sus orígenes se plantearon objetivos estratégicos a cumplirse en tres etapas:
• Primera etapa: establecimiento del PEEC. Inicialmente se planteó la continuidad del programa para lo cual se necesitaba garantizar el suministro de material a los laboratorios con un arancel mínimo para asegurar la permanencia en la participación.
• Segunda etapa: consolidación del programa. Se planteó la expansión a otras áreas del laboratorio. Se establecieron los criterios de aceptabilidad. Se promovió la implementación del CCI como técnica complementaria al control externo.
• Tercera etapa: apoyo a la gestión de la calidad. El PEEC evolucionó a un programa de apoyo suministrando a los laboratorios herramientas para poder garantizar la calidad analítica de sus servicios.
Se creó el Laboratorio de Referencia y Estandarización en Bioquímica Clínica (LARESBIC). Centrados en ofrecer servicios que cumplan con las expectativas de los laboratorios como herramienta en garantía y mejora continua de la calidad, se plantea hoy una nueva etapa cuyo objetivo estratégico es la Acreditación del programa. Para iniciar este proceso, se comenzó a trabajar en la implementación de un sistema de gestión de la calidad (SGC) que cumpliera con los requisitos establecidos en la Norma IRAM-ISO 9001:2015, Sistemas de Gestión de la Calidad (5). Esta propuesta fue acompañada activamente por el Cuerpo Directivo y Gerencia de FBA, quienes apoyaron todo el proceso y decidieron solicitar la certificación del Programa al IRAM (Instituto Argentino de Normalización y Certificación), representante en Argentina de la International Organization for Standarization (ISO).
IRAM-ISO 9001:2015 se centra en la eficacia del sistema de gestión de calidad para satisfacer los requisitos del cliente y se aplica a cualquier organización incluido un programa de evaluación externa. Permite obtener mejoras en el desempeño y bases firmes para las nuevas oportunidades que se desarrollen en forma efectiva y, a su vez, se mantengan en el tiempo. Esta norma emplea el enfoque en procesos, incorpora el ciclo planificar-hacer-verificar-actuar (PHVA) y el pensamiento basado en riesgos. El enfoque en procesos permite controlar las interrelaciones entre los procesos del sistema de forma tal que se pueda mejorar el desempeño global de la organización. La aplicación del ciclo PHVA a los procesos y al SGC como un todo, permite asegurar que estos se gestionen adecuadamente y así también las oportunidades de mejora. Por otro lado, el pensamiento basado en riesgos permite determinar factores que podrían desviar a los procesos y al SGC de los resultados planificados originando controles preventivos para minimizar los efectos negativos y maximizar las oportunidades de mejora. El objetivo de este trabajo fue describir las acciones realizadas desde el PEEC para implementar un SGC que cumpla con los requisitos establecidos en la IRAMISO 9001:2015 y lograr posteriormente la certificación del mismo por el IRAM.
Materiales y Métodos
El alcance del SGC del PEEC, según la norma IRAMISO 9001:2015, comprende los siguientes procesos:
a) Evaluación externa de la calidad de los laboratorios de análisis clínicos.
b) Suministro de material para control de calidad interno para determinaciones en Química Clínica y soluciones para control de Instrumental.
c) Prueba de Suficiencia de Laboratorios de Análisis Clínicos.
Se estableció la interrelación entre ellos mediante un mapa de procesos (Fig. 1). Se identificaron los clientes del PEEC y los procesos principales, de gestión y de soporte.

Figura 1. Mapa de procesos.
Procesos de gestión
Se realizó un análisis situacional para conocer los factores que podían afectar a la organización. Se evaluaron factores internos y externos que pudieran incidir en las operaciones y en el futuro de la organización. Las herramientas utilizadas fueron las matrices PEST y FODA. La matriz PEST es un instrumento que permite conocer el entorno analizando una serie de factores: políticos (P), económicos (E), sociales (S) y tecnológicos (T). Fue realizada por la Gerencia de FBA y la Dirección del PEEC. La matriz FODA permite definir la capacidad competitiva de la organización. Se evalúan las fortalezas (F), oportunidades (O), debilidades (D) y amenazas (A). Las fortalezas y debilidades surgen del análisis interno de la organización y las oportunidades y amenazas son resultado del análisis externo, tomando en cuenta la competencia, los clientes potenciales y el mercado. Formaron parte de este análisis la Dirección, Coordinación General, administrativos, personal operativo y personal del LARESBIC.
Se evaluó el grado de satisfacción tanto de clientes externos (laboratorios de análisis clínicos) como internos (personal del PEEC) por medio de encuestas. Para los clientes externos se midieron los tres procesos:
• Evaluación Externa de la Calidad. Se publicó la encuesta con la planilla de carga de resultados del Subprograma Química Clínica. Se evaluó la conformidad con la participación en el PEEC, materiales de control, ingreso y entrega de resultados y la comunicación con el programa.
• Suministro de materiales para el CCI. Se envió por correo electrónico a aquellos laboratorios que solicitaron el servicio durante 2018-2019. Se evaluó la satisfacción con el material suministrado y el tiempo de gestión.
• Prueba de suficiencia. Se envió por correo electrónico a los laboratorios que solicitaron la prueba durante 2018. Se evaluaron los mismos puntos que en CCI. Para el personal del PEEC se realizó una encuesta de clima organizacional.
Con la información lograda del FODA, del PEST y las medidas de satisfacción, se realizó el mapa estratégico de la organización (Fig. 2) de acuerdo a las cuatro perspectivas del cuadro de mando integral: económicofinanciera, de los clientes, de los procesos y competencias estratégicas. Se establecieron objetivos de calidad en cada una de las perspectivas y se definieron indicadores para su seguimiento.
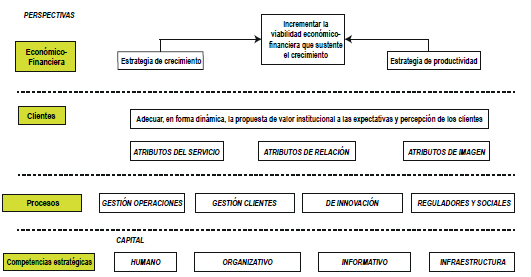
Figura 2. Mapa estratégico.
Cumpliendo con los requisitos establecidos en la Norma respecto a las oportunidades de mejora y al tratamiento de las no conformidades y observaciones, se realizó un registro de las mismas. Las no conformidades y las observaciones se producen por incumplimiento de diferentes requisitos: legales, de la norma IRAM-ISO 9001, interno del propio SGC o expresado por los laboratorios. Las oportunidades de mejora son producidas internamente por el PEEC o expresadas por los laboratorios. Todas las no conformidades fueron tratadas analizando las causas, realizando la corrección en aquellos casos que hubiera sido necesario, aplicando diferentes acciones correctivas tendientes a controlar, corregir y enfrentar las consecuencias del incumplimiento de los requisitos. Se identificaron medidas de control para asegurar la eficacia de estas acciones.
Procesos principales
Se realizó el flujograma de cada uno de los procesos y se abordaron los riesgos y oportunidades a través de un análisis en modo de fallo y sus efectos potenciales (AMFE)(6). Este es un análisis cuantitativo donde se cruzan las variables de probabilidad de ocurrencia (PO), gravedad del daño (S) y la detectabilidad (D). Se asigna una puntuación a cada una de las variables y se obtiene el risk priority number (RPN o número de prioridades de riesgo) como el producto de PO x S x D. Según el puntaje obtenido, se determina el riesgo donde se debe intervenir. Se analizaron cada uno de los pasos de los procesos y se ordenaron según la probabilidad de que ocurriera. A aquellos tres pasos que tenían mayor puntaje, se les realizó un análisis de causa, se planificaron acciones para disminuir su riesgo y se estableció un cronograma de seguimiento y evaluación.
Se escribieron los procedimientos correspondientes a cada uno de los procesos y se definieron las actividades a realizar y responsabilidades, de manera de asegurar la confiabilidad del servicio.
Procesos soporte
Se definieron los perfiles de cargo para la Dirección, Coordinadores Generales, Coordinadores de Subprogramas, Secretarios, Supervisor de Operadores y Operadores. La Dirección evaluó al personal del PEEC, y éste a su vez, fue evaluado por el Presidente y el Gerente de FBA. Se realizó un plan de capacitación acorde a las características de cada perfil. Se evaluaron los proveedores de materiales de control, de logística e insumos, teniendo en cuenta la calidad, el cumplimiento y el precio.
Resultados
Se llevó a cabo un plan de auditorías internas cuyo objetivo fue obtener información sobre el SGC, el cumplimiento de los requisitos establecidos por esta norma y los tres procesos del PEEC. Fueron realizadas por consultores externos, un representante del Consejo de Administración, el Director y los Coordinadores Generales del PEEC. Durante las mismas, se capacitó al personal del PEEC para realizar posteriores auditorías internas. Posteriormente se realizó la Revisión por la Dirección. La documentación tenida en cuenta para esto fue:
1. Norma IRAM-ISO 9001:2015
2. Análisis FODA y PEST
3. Mapa estratégico
4. Retroalimentación del cliente externo: encuestas de satisfacción
5. Retroalimentación del cliente interno: encuesta de clima organizacional
6. Objetivos de calidad: cuadro de indicadores
7. Datos sobre el desempeño de los procesos y conformidad del producto
8. Estado de oportunidades de mejora, no conformidades y acciones correctivas
9. Informes de auditorías internas
10. Evaluación de proveedores
11. Presupuesto de gastos para asegurar que se dispone de los recursos necesarios
12. Evaluación de riesgo, análisis de causa-raíz y acciones emprendidas para disminuir los mismos.
Se tomaron decisiones respecto a: oportunidades de mejora, necesidades de cambio del SGC, necesidades de recursos (económicos, de infraestructura, tecnológicos y humanos) a evaluarse durante 2019. Se verificó desde la Dirección que el PEEC cumplía con los requisitos de la Norma, y en consecuencia se solicitó la evaluación para la Certificación IRAM del Sistema de Gestión. El IRAM inició el proceso de certificación a través de un programa de auditoría inicial de dos etapas:
• Etapa I: con un enfoque sobre el diseño del sistema de gestión y su adecuación a las necesidades de la organización.
• Etapa II: con un mayor enfoque sobre los procesos identificados por el solicitante, que soportan las actividades descritas en el alcance de la certificación, así se evaluó la implementación de su sistema de gestión. Durante esta etapa, además, se verificó la implementación y la eficacia de las acciones correctivas derivadas de los hallazgos de la auditoría de la etapa I.
Como resultado de estas auditorías en agosto de 2019, el IRAM certificó que el Programa de Evaluación Externa de la Calidad de la Fundación Bioquímica Argentina “Prof. Dr. Daniel Mazziotta”, posee un sistema de gestión de la calidad que cumple con los requisitos de la Norma IRAM-ISO 9001:2015, cuyo alcance es:
a) Evaluación externa de la calidad de los laboratorios de análisis clínicos
b) Suministro de material para control de calidad interno para determinaciones en Química Clínica y soluciones para control de instrumental
c) Prueba de suficiencia de laboratorios de análisis clínicos.
Discusión y Conclusiones
Las ventajas para el PEEC de implementar un SGC basado en esta norma son:
• proporcionar a los laboratorios participantes servicios que satisfagan sus necesidades mediante el cumplimiento de los requisitos legales requeridos
• facilitar la detección de oportunidades para aumentar la satisfacción de los laboratorios
• mejorar la imagen del PEEC
• poder demostrar la conformidad con los requisitos del SGC
• aumentar la competitividad
• mejorar la eficiencia
• evaluar los riesgos y oportunidades de mejora de los procesos internos • facilitar la toma de decisiones.
A partir de esta certificación, se inicia una nueva etapa cuyo objetivo final es la acreditación tanto del PEEC, por IRAM-ISO/IEC 17043:2014 (Evaluación de la conformidad. Requisitos generales para los ensayos de aptitud), como del LARESBIC, por IRAM-ISO/IEC 17025:2017 (Requisitos generales para la competencia de los laboratorios de ensayo y calibración).
Lograr el reconocimiento de nuestro programa por un organismo competente, fue la motivación que comprometía a todos los sectores del programa. La tarea no fue sencilla, pero pudo alcanzarse por contar con una estructura organizada y sólida creada por un profesional de excelencia, el Prof. Dr. Daniel Mazziotta. Él supo mostrar cuál era el camino y cómo obtener el mejor de los desempeños.
Agradecimientos
Los autores agradecen por su participación en este proyecto a: Liliana Genua, Marcelo Calógero, desde la secretaria del Programa; a Víctor Ganganelli y su grupo de operadores: Alejandro Carlomagno, Marta Perrier y Gabriela Bilbao. Al Dr. Jorge Bongiovani que confió en este grupo de trabajo y acompañó durante todo el proceso. A Daniel Bermann y Celina Beckford con el gran aporte directriz y al Cuerpo Directivo y Gerencia de Fundación Bioquímica Argentina por la posibilidad y las herramientas para lograr esta certificación.
1. Girardi RH, Prevoo MM, Etchegoyen MC. Programa de Evaluación Externa de la Calidad de la Fundación Bioquímica Argentina, 30 años de evolución. Diagnóstico in vitro 2018; 8: 33-43. [ Links ]
2. Uldall A. EQAnews 1998; 9; 55-8.
3. Norma IRAM-ISO/IEC 17043:2010, Evaluación de la conformidad - Requisitos generales para los ensayos de aptitud. [ Links ]
4. Clinical and Laboratory Standards Institute: Statistical quality control for quantitative measurement procedures: principles and definitions. CLSI C24-A4, 4th ed. CLSI, Wayne, PA, EE.UU., 2016. [ Links ]
5. Norma IRAM-ISO 9001:2015, Sistema de Gestión de la Calidad. [ Links ]
6. Figueroa-Montes LE. Gestión de riesgos en los laboratorios clínicos. Acta Med Per 2015: 32: 241-50. [ Links ]
Recibido: 18 de julio de 2019
Aceptado: 19 de septiembre de 2019














