Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.4 La Plata dic. 2019
GESTIÓN DE LA CALIDAD Y ACREDITACIÓN
Aplicación de Seis Sigma en el Laboratorio Clínico
Stella Maris Carchio1a, Ana Carolina Cappella2a, Carolina Goedelmann3b, Marcela Pandolfo4cd, Daniel Bustos5cd*
1 Bioquímica. Especialista en Administración Hospitalaria. Especialista en Gestión de Servicios de Salud. Diplomada en Seguridad del Paciente.
2 Bioquímica. Diplomada en Seguridad del Paciente.
3 Bioquímica. Especialista en Hematología.
4 Bioquímica.
5 Dr. de la Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Laboratorio Central Hospital de Clínicas “José de San Martín”, Buenos Aires, Argentina.
a Laboratorio Hospital de Pediatría “Dr. J. P. Garrahan”, Buenos Aires, Argentina.
b Laboratorio de Hematología y Hemostasia Hospital de Pediatría “Dr. J. P. Garrahan”, Buenos Aires, Argentina.
c Facultad de Farmacia y Bioquímica.
d Laboratorio Central Hospital de Clínicas “José de San Martín”, Buenos Aires, Argentina.
* Autor para correspondencia.
Correspondencia Dr. DANIEL BUSTOS Hospital de Clínicas José de San Martín. Laboratorio Central. Avda. Córdoba 2351 – CABA-Buenos Aires, Argentina. Correo electrónico: dbustos@ffyb.uba.ar
Resumen
Seis Sigma es un método de mejora de procesos que se focaliza en disminuir la variabilidad de los mismos. El enfoque más común es contar los defectos, determinar el porcentaje, convertirlos a una tasa de defectos por millón y luego usar una tabla para buscar la métrica sigma apropiada. El segundo enfoque consiste en utilizar la medida de la variación del proceso para estimar la métrica sigma. En el laboratorio clínico se pueden aplicar ambos conceptos según la etapa del laboratorio en la cual se pretenda usar la métrica sigma. Para ambos enfoques un proceso de 6 sigmas es considerado un proceso eficiente, de alta calidad. En este trabajo se planteó para la etapa preanalítica una meta mínima de 4 sigmas. Algunos procesos muestran un buen desempeño con indicadores de calidad con sigmas mayores de 4. Sin embargo, varios de ellos tienen sigmas menores que la meta propuesta demostrando ser los más vulnerables. En Química Clínica y Hematología, la elección del requisito de calidad es el punto clave para armonizar la métrica sigma junto a la estrategia para la obtención del error sistemático y aleatorio. En este trabajo se muestran las diferentes estrategias para relacionar el desempeño basado en el sigma del proceso analítico con las reglas de validación de las corridas analíticas.
Palabras clave: Seis Sigma; Laboratorio Clínico; Indicadores de calidad; Métricas.
Abstract
Application of Six Sigma in the Clinical Laboratory
Six Sigma is a method for improvement of processes that focuses on reducing their variability. The most common approach is to count the defects, determine the percentage, convert them to a defect rate per million and then use a table to find the appropriate sigma metric. The second approach consists of using the process variation measure to estimate the sigma metric. In the clinical laboratory, both concepts can be applied according to the stage of the laboratory in which the sigma metric is intended to be used. For both approaches, a 6 sigma process is considered an efficient, high quality process. In this work, a minimum goal of 4 sigma was raised for the preanalytical stage. Some processes show good performance with quality indicators with sigma greater than 4. However, several of them have sigma lower than the proposed goal proving to be the most vulnerable. In Clinical Chemistry and Hematology, the choice of the quality requirement is the key point to harmonize the Sigma metric together with the strategy to obtain systematic and random error. This paper shows the different strategies to relate the performance based on the sigma of the analytical process with the validation rules of the analytical runs.
Keywords: Six Sigma; Clinical Laboratory; Quality indicators; Metrics.
Resumo
Aplicação do Seis Sigma no Laboratório Clínico
Seis Sigma é um método de melhoria de processos focado na redução da sua variabilidade. A abordagem mais comum é contar os defeitos, determinar a porcentagem, convertê-los numa taxa de defeitos por milhão e, depois disso, usar uma tabela para procurar a métrica sigma apropriada. A segunda abordagem consiste em usar a medida da variação do processo para estimar a métrica sigma. No laboratório clínico, podem ser aplicados os dois conceitos de acordo com a fase do laboratório em que se pretenda usar a métrica sigma. Para ambas as abordagens, um processo de 6-sigmas é considerado um processo eficiente e de alta qualidade. Neste trabalho, uma meta mínima de 4 sigmas foi definida para o estágio pré-analítico. Alguns processos mostram bom desempenho com indicadores de qualidade com sigmas maiores que 4. No entanto, vários deles têm sigmas menores que a meta proposta provando ser os mais vulneráveis. Em Química Clínica e Hematologia, a escolha do requisito de qualidade é o ponto chave para harmonizar a métrica sigma juntamente com a estratégia para obter o erro sistemático e aleatório. Este artigo mostra as diferentes estratégias para relacionar o desempenho baseado no sigma do processo analítico com as regras de validação das execuções analíticas.
Palavras-chave: Seis Sigma; Laboratório Clínico; Indicadores de Qualidade; Métricas.
Introducción
Seis Sigma es un método de mejora de procesos que se focaliza en disminuir la variabilidad de los mismos. El modelo “Seis sigma” fue desarrollado por Motorola en el año 1986 y reportó un ahorro de 17 billones de dólares debido a una mejora de procesos mediante su implementación (1).
El enfoque más común es contar defectos, determinar el porcentaje, convertirlos a una tasa de defectos por millón y luego usar una tabla para buscar la sigma- métrica apropiada. El segundo enfoque es utilizar la medida de la variación del proceso para estimar la métrica sigma. En el laboratorio clínico se pueden aplicar ambos conceptos según la etapa del laboratorio en la cual se quiera aplicar la métrica sigma. En la etapa preanalítica se pueden contar los defectos de diferentes indicadores de calidad elegidos como puntos clave de medición de un proceso, tales como errores de transcripción o errores de identificación, obtener el porcentaje de defectos y luego usando una tabla apropiada, transformarlos a un valor de sigma del proceso(2-4).
En la etapa analítica el modelo se basa en el número de desvíos estándar o sigmas (variación del proceso) que pueden entrar dentro de las especificaciones de calidad predeterminadas del proceso. En el laboratorio clínico la especificación de calidad está definida por el error máximo permitido. Mientras más desviaciones estándar del proceso entran dentro del error permitido más alto será el valor de sigma y el proceso será más robusto (5).
Sigma se calcula con la siguiente ecuación (6):
Sigma = (%error total permitido-% desvío) / %coeficiente de variación (CV)
Del análisis de esta fórmula se puede concluir que una correcta calibración puede hacer que el desvío o error sistemático sea cero o cercano a cero, entonces mientras el CV sea más pequeño, el valor de sigma será mayor. Para ambos enfoques un proceso de seis sigmas es considerado un proceso eficiente, de alta calidad. La variación del proceso está asociada a los errores del mismo y un proceso que alcanza seis sigmas solo admitirá 3,4 defectos/errores por millón de oportunidades. El punto clave de la implementación de la métrica sigma no es el sigma obtenido en sí mismo sino identificar la causa raíz de los errores y establecer un plan de mejora que trate de disminuirlos o eliminarlos, mejorando de esta manera el proceso.
En el caso de la etapa analítica la disminución del error sistemático y el CV será sólo posible hasta lo que el estado del arte del instrumental lo permita y por otra parte la obtención de la métrica sigma se verá afectada por el error máximo tolerable elegido, por la forma de obtener el error sistemático y por el nivel de concentración del analito al cual se tome el CV. No hay una especificación de calidad universalmente aceptada para las pruebas de laboratorio, ni siquiera un consenso global sobre los objetivos analíticos que deben alcanzarse. Los objetivos de calidad analítica pueden ser diferentes de un país a otro y esta falta de consenso significa que no se puede asumir qué objetivos están utilizando los proveedores cuando presentan sus sistemas de medición y si los mismos coinciden con los del laboratorio que los utiliza. Por ejemplo, en los EE.UU. lo más común es que las métricas se calculen utilizando los objetivos de Clinical Laboratory Improvement Amendments (CLIA) y del College of American Pathologists (CAP) mientras que en Europa se usan los objetivos de variabilidad biológica o de Rilibak (lineamientos alemanes para la calidad) (7). Otro de los aspectos relevantes de la métrica sigma para el proceso analítico es la concentración del analito en la cual se toma el CV para aplicar la métrica. La mayoría de los métodos presentan heterocedasticidad (8). Esto significa que el CV puede variar con la concentración del analito medido; en general se observa un CV mayor a bajas concentraciones y uno menor a altas concentraciones. Esto significa que para 3 niveles de controles es probable que se obtengan 3 valores de CV diferentes, lo que podría llevar a tener 3 sigmas diferentes según el CV que se aplique en la fórmula. Lo aconsejado en estos casos es elegir el CV que esté más cerca del nivel de decisión clínica de la prueba de laboratorio. Esto último también puede ser conflictivo cuando se trata de una prueba de laboratorio que tiene más de un nivel de decisión clínica. En esta última situación lo más aconsejable es definir el valor de decisión clínica más relevante, es decir el más crítico para la toma de decisiones médicas basado en las consecuencias de esta toma de decisiones.
La obtención del valor del error sistemático también puede ser conflictiva puesto que por un lado podría asumirse que una correcta calibración lleva a un error sistemático de cero o cercano a cero y esto podría permitir que se asuma el desvío como cero en la métrica sigma. Otra de las opciones es obtener el error sistemático del control externo de calidad y en este caso el valor obtenido se verá afectado por el grupo par tomado para realizar el cálculo (9). En este trabajo se muestran los dos enfoques aplicados al laboratorio clínico, el primero de ellos a la etapa preanalítica y el segundo de ellos aplicado a la etapa analítica, en Química Clínica y Hematología.
Seis Sigma en la etapa preanalítica
Aproximadamente el 70% de las decisiones médicas se basan en resultados de laboratorio (10), es por ello que se debe asegurar la calidad en todas las etapas del proceso del análisis (preanalítica, analítica y posanalítica), para garantizar resultados confiables. Se debe tener en cuenta, además, la calidad en los procesos de apoyo que tienen implicancia en la información brindada por el laboratorio, como son el sistema informático, la bioseguridad, las condiciones ambientales, los insumos, la capacitación del recurso humano, entre otros (11).
De acuerdo con distintos estudios, la etapa preanalítica ha demostrado ser la más vulnerable, con una tasa de error de hasta un 70% del total de los errores de laboratorio. Esto se debe a la complejidad de los subprocesos que la componen ya que abarca desde la planificación de la solicitud de análisis hasta que la muestra se encuentra disponible en el laboratorio efector, lista para ser procesada. La mayoría de estos procesos son manuales, llevados a cabo por personal externo al laboratorio (enfermeros y médicos) y dependen de la comunicación, motivo por el cual la probabilidad de cometer errores es alta. La ausencia de normas, sumada a la dificultad en la difusión y cumplimiento de las existentes, constituye una de las causas más frecuentes de error en esta etapa (12) (13). En este contexto y con el fin de obtener muestras de calidad analítica, representativas de la condición de salud-enfermedad del paciente y que garanticen resultados confiables, se necesita controlar y monitorear esta etapa. Se desarrolló entonces un panel de indicadores de calidad que facilita la identificación de los procesos más vulnerables y la intervención en forma oportuna, para minimizar el impacto del error y brindar una atención segura. Se utilizó la métrica Sigma (ó) que permite estimar la variabilidad de los procesos analizados y presenta correlación con el número de errores o defectos por millón de oportunidades (DPMO) que definen la eficiencia de un proceso (14-17) (Tabla I).
Tabla I. Modelo Seis Sigma

La fórmula utilizada para el cálculo es la siguiente:
DPMO = N° de defectos x 1.000.000/N° de oportunidades x N° de unidades
Se consideró vulnerable al proceso con ó<4.
Como ejemplo se presenta un panel de indicadores de calidad expresados con la métrica sigma con el fin de demostrar su utilidad. Se incluyeron indicadores armonizados con los propuestos por Working Group “Laboratory Errors and Patient Safety” of International Federation of Clinical Chemistry and Laboratory Medicine (IFCC), con el objetivo de comparar el desempeño de los procesos del laboratorio con otros que participan en dicho proyecto internacional. Se sumaron indicadores propios para completar la información acerca del desempeño de procesos específicos del laboratorio (18). Los resultados se muestran en las Tablas II y III. En color rojo, los resultados de procesos más vulnerables; en verde, resultados que alcanzaron o superaron la meta (sigma >4).
Tabla II. Indicadores armonizados: Datos del Hospital de Pediatría Dr. J. P. Garrahan, año 2017
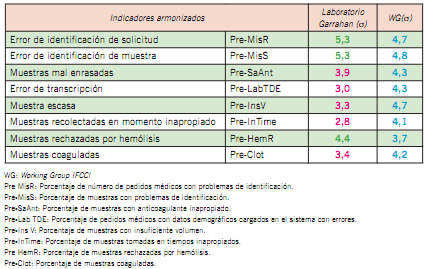
Tabla III. Indicadores del Hospital Garrahan. Datos del Hospital de Pediatría Dr. J. P. Garrahan, año 2017

La expresión en sigmas de los indicadores de calidad facilita el análisis de los resultados lo cual resulta de gran utilidad para establecer prioridades y desarrollar estrategias de mejora. Posibilita, además, la comparación de los desempeños entre laboratorios de manera objetiva, independientemente de las particularidades de cómo se lleven a cabo los procesos. La inclusión del modelo Seis Sigma pone en evidencia rápidamente a aquellos procesos que requieren un cambio sustancial, ponderando su vulnerabilidad y facilitando la elección de los que deben ser atendidos en forma inmediata, de modo de generar mejoras con impacto positivo en la calidad asistencial y la seguridad del paciente.
Seis Sigma en Química Clínica
El modelo Seis Sigma es la herramienta utilizada en Química Clínica para evaluar el desempeño del sistema de medición, definir las reglas operativas de control de calidad interno e implementar medidas correctivas para la mejora continua. En este trabajo se presenta la evaluación del desempeño analítico de los siguientes analitos: glucosa, urea, colesterol total, creatinina, ácido úrico, proteínas totales, sodio, potasio, cloro, albúmina, calcio, fósforo, triglicéridos, colesterol HDL, magnesio, hierro.
Seis Sigma en la fase analítica de Química Clínica fue calculado a través de los siguientes pasos:
• Definir criterio de calidad: error máximo aceptable TEa%
• Calcular variabilidad aleatoria: coeficiente de variación (CV%)
• Calcular variabilidad sistemática (desvío%)
• Determinar el error total analítico (ET)
• Calcular la métrica sigma
Error total admitido (ETa): es la especificación de calidad acerca de la tasa de error que puede ser permitida en un método analítico para que pueda proporcionar resultados útiles para el paciente. Los modelos acordados por la EFLM (European Federation of Clinical Chemistry and Laboratory Medicine) en la Conferencia de Milán de 2014 fueron tres; el primer modelo está basado en el efecto de la prestación analítica sobre los resultados clínicos, el segundo está basado en componentes de variabilidad biológica y el tercero en el estado del arte, pero sin consenso respecto a qué analitos debieran alcanzar una u otra especificación (19). En la Argentina, la selección de las especificaciones de calidad se realiza sin la exigencia de un desempeño mínimo establecido por algún ente regulatorio y no se dispone de consensos nacionales. La norma ISO 15189 atribuye a la dirección del laboratorio la responsabilidad de definir, implementar y realizar el seguimiento de las metas de desempeño seleccionadas (20). En la experiencia del Laboratorio del Hospital de Clínicas la métrica sigma para cada analito se calculó a partir del error máximo admitido considerando las tolerancias analíticas publicadas por CLIA (21), y variabilidad biológica (VB) (22)(23).
Variabilidad analítica aleatoria, coeficiente de variación (CV%)
Diariamente se procesan los controles de calidad internos. En este caso estos son de primera mano provistos por el proveedor del sistema de medición Roche (PPC1 y PPC2), equivalentes a valores normales y patológicos respectivamente. En forma mensual se calcula el CV de cada nivel de control para cada determinación y se verifica que el CV obtenido sea menor o igual que el CV especificado por el fabricante y verificado en la calificación del desempeño inicial y menor o igual que 50% de la variabilidad biológica intraindividual. En la mayoría de los analitos evaluados se cumplen las dos consignas anteriores, pero en el caso de analitos con variabilidad biológica muy baja, como el calcio, cloro, sodio y albúmina no se llegan a cumplir las especificaciones respecto a variabilidad biológica nivel deseable y los mismos deben ser evaluados por un requisito de calidad analítico más amplio como CLIA 88.
CV utilizado para el cálculo del sigma
En este punto es importante considerar que, al tener mensualmente dos CV para cada analito, uno que corresponde al control de nivel normal y otro que corresponde al control de nivel patológico, es posible calcular un valor de sigma para cada nivel de concentración para cada analito o bien definir el CV con el que se calculará el sigma. En nuestro laboratorio en forma general se utilizó el promedio de los CV para la mayoría de los analitos estudiados, ya que se observó que el desempeño de la métrica sigma obtenido era similar, ya sea utilizando el CV correspondiente al control normal, el patológico o al CV promedio de ambos, excepto para la creatinina, para la que se consideró el CV de mayor imprecisión que correspondía al control normal cuya concentración se correspondía aproximadamente al nivel de decisión médica.
Variabilidad sistemática (desvío, sesgo)
En forma mensual se procesó un control de calidad externo (PEEC-Fundación Bioquímica Argentina- FBA). El valor del desvío % o desvío relativo porcentual (DRP) es aportado a partir del reporte mensual remitido por la FBA. Los mismos fueron obtenidos mediante el cálculo:
Desvío %: (valor obtenido del laboratorio- valor medio del grupo par/ valor medio del grupo par) X 100
Para la medida del sigma en forma mensual se calculó la media cuadrática del sesgo de las últimas 12 encuestas.
Error total analítico (ET)
Se calcula sumando el desvío % + 1,65 x CV %. Se utilizó un factor de 1,65 para el CV, para especificar que una corrida analítica debería ser rechazada cuando la tasa de defectos alcanzaba el 5%. El error total analítico debe ser menor o igual que el Eta.
Cálculo de sigma
Sigma = (TEa% ‐ desvío %) / CV%
Planilla Excel sigma mensual
Una forma de seguimiento constante es registrar en forma mensual en una planilla Excel los valores obtenidos de CV%, desvío%. Se calcula el ET, y habiendo establecido los valores del ETa por CLIA 88 y VB nivel deseable, se obtiene el valor del sigma (Tabla IV).
Tabla IV. Seguimiento mensual de seis sigmas en química clínica. Hospital de Clínicas “José de San Martín”

Evaluación del desempeño
Se compara el ET con el ETa, de acuerdo a especificaciones de CLIA 88 y VB nivel deseable. Se considera desempeño aceptable cuando el ET medido es menor o igual que el ETa, y el valor sigma (ó) es mayor o igual a 3. Se estratifican los métodos en inaceptables (ó menores de 2), marginales (ó entre 2 y 3), pobres (ó entre 3 y 4), buenos (ó entre 4 y 5), muy buenos (ó entre 5 y 6) y el estándar de oro (ó mayor de 6). Puede verse que conforme al requisito de calidad seleccionado el desempeño para algunos analitos muestra mucha disimilitud. Los analitos con alta regulación homeostática (baja variabilidad biológica intraindividual) como el sodio, cloro, calcio, albúmina, proteínas totales, creatinina, magnesio no llegan a alcanzar las especificaciones biológicas a nivel deseable, por lo que deben ser monitoreados por especificaciones de calidad más permisivas como CLIA o variabilidad biológica mínima y para analitos como hierro y triglicéridos (con alta VB) se plantea la reasignación de ETa a metas de calidad más exigentes como por ejemplo la VB óptima. En el caso particular de magnesio y proteínas totales se evaluó el desempeño Sigma según la VB mínima ya que los valores obtenidos con CLIA 88 arrojan resultados mayores de 6 sigmas (Tabla V).
Tabla V. Reglas de validación de corridas analíticas según desempeño metodológico usando métrica sigma

De acuerdo a los resultados obtenidos, se establece el requisito de calidad con el que se va a evaluar el desempeño seis sigma en los distintos analitos:
• Variabilidad biológica nivel deseable: glucosa, urea, colesterol, ácido úrico, potasio, fosforo, colesterol HDL.
• Variabilidad biológica nivel mínima: proteínas totales, magnesio
• Variabilidad biológica nivel óptima: triglicéridos, hierro
• CLIA 88: creatinina, sodio, cloro, albúmina, calcio
La evaluación del desempeño de los analitos en el presente trabajo fue realizada en base a las especificaciones de calidad de CLIA 88. Es importante considerar que CLIA ha propuesto hacer una actualización (febrero de 2019), incorporando nuevos analitos y ajustando los valores de otros ya existentes. Esta actualización tiene como base los resultados de los programas de EQA de calidad. El modelo Seis Sigma es de suma utilidad para planificar el control interno de calidad y basado en el desempeño de los métodos, facilita la definición de las reglas operativas para el control interno y permite optimizar la calidad de los procesos (Tabla V).
Es imprescindible seleccionar en forma adecuada el requisito de calidad. La elección de una u otra fuente de ETa puede cambiar la aceptabilidad del desempeño de un método, como así también, la forma de monitorear el CCI. Si se asignan especificaciones muy permisivas el valor sigma obtenido va a ser aceptable, y se puede delimitar la calidad analítica. Sobre la base de nuestros resultados después de varios años de estudio podemos indicar que un modelo de control de calidad adecuado en Química Clínica podría incluir inicialmente el establecimiento de metas analíticas utilizando el modelo de CLIA 88 para aquellos analitos con baja variabilidad biológica y el modelo de variabilidad biológica en metas deseables para el resto de los analitos. Para los analitos con desempeño menor de 4 sigma, el control debe ser mejor y más estricto y requerirá de un diagnóstico de las posibles fuentes de error, el estudio de los períodos óptimos de calibración, aumentar el número de muestras de control, redefinir la corrida analítica y ajustar las reglas de control. Asimismo, es importante monitorear el seguimiento del sigma para cada analito y establecer límites de aceptabilidad (24)(25).
Seis Sigma en Hematología
El lineamiento CLSI C24 Statistical Quality Control for Quantitative Measurements Procedures: Principles and Definitions contempla los lineamientos para la planificación del control interno de calidad (CCI) en métodos cuantitativos que se aplican a hematología (26). Para diseñar la estrategia de CCI se deben seguir los pasos descriptos en la Figura 1:
• Definir la calidad requerida para los ensayos individuales: error total aceptable (ETa).
• Seleccionar el material de control y definir los límites.
• Determinar la calidad analítica que el ensayo puede proporcionar: precisión y sesgo (desvío/error sistemático).
• Definir una corrida analítica apropiada para el procedimiento de medición que funciona en un laboratorio individual.
• Implementar la estrategia de control de calidad y responder adecuadamente a las situaciones fuera de control.

Figura 1. Algoritmo de planificación de una estrategia de CCI (Adaptado de CLSI C24)
El sistema de CCI apropiado será diferente dependiendo del analito y del ensayo. Los sistemas de CCI deben verificar que los ensayos alcancen la calidad deseada de los resultados. Por lo tanto, antes de diseñar una adecuada estrategia de CCI, el laboratorio debe definir la calidad requerida y la calidad que el ensayo puede proporcionar. La primera es informada por el ETa, mientras que la segunda, por la precisión y el sesgo del ensayo. Los analitos tienen diferentes niveles de variación biológica (BV) y los ensayos tendrán diferentes niveles de precisión y exactitud, por lo tanto, el sistema de CCI apropiado será diferente dependiendo del analito y el ensayo (19).
Para la selección de requisitos el desempeño mínimo o limitante se debe tomar el desempeño declarado por el fabricante del equipo, que en general se informa en términos de imprecisión como coeficiente de variación porcentual (CV%). El mínimo ETa puede estimarse como 3*CV. En la Tabla VI se muestran los ETa obtenidos a partir de diferentes fuentes para los principales analitos del hemograma, los datos reportados por el fabricante para la tecnología Sysmex y el estado del arte estimado a partir del desempeño de los grupos pares de comparación del CCI (Sysmex Insight) y control externo de calidad RIQAS (Randox International Quality Assessment Scheme, Randox Laboratories, UK). Para algunos parámetros como hematocrito, volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM)/concentración de hemoglobina corpuscular media (CHCM) y recuento de plaquetas con la tecnología actual es difícil alcanzar las especificaciones de VB. Por otro lado, el recuento de leucocitos tiene un desempeño que está por encima de lo que se exigiría según la variación biológica. Esto posiblemente indica que el estado del arte es más que adecuado para proporcionar la calidad requerida por esas pruebas.
Tabla VI. Requisitos de calidad para el hemograma

Se asume que cualquier error será evidente en el análisis de muestras de control interno de calidad en la misma extensión que en las muestras de los pacientes. Por definición esto no es completamente verdad debido a los errores aleatorios (DE: desvío estándar). De todos modos, el sistema de CCI puede maximizarse si se utiliza el material de control apropiado. Según los lineamientos de CLSI C24 idealmente la matriz del material de control debe ser la misma que la de las muestras de los pacientes. El laboratorio debe obtener suficiente cantidad de control homogéneo y estable que dure por un período de tiempo extendido, si es posible 1-2 años. Los más apropiados son los materiales de control fabricados por una tercera parte independiente que no tiene relación con el fabricante del procedimiento de medida o el calibrador utilizado. El número de concentraciones de material de control debe ser suficiente para determinar el desempeño aceptable del método en el intervalo de medida de interés. Se recomienda un mínimo de 2 niveles. Para el control de calidad del hemograma la utilización de pools de muestras de pacientes es dificultosa por una cuestión de estabilidad de las muestras. Los materiales de control más utilizados para contadores hematológicos son de primera opinión, fabricados por el proveedor del procedimiento de medida. Existe alguno de tercera opinión, aunque su uso está menos difundido, su aplicación a nuevos parámetros del hemograma es limitada. En general los lotes están conformados por tres niveles de control, aunque no cubren completamente el rango de medición de los analitos. El material de control posee baja conmutabilidad con las muestras de los pacientes por las condiciones de pretratamiento: contienen sangre entera humana y animal estabilizada (eritrocitos humanos, leucocitos y plaquetas de mamíferos, resuspendidos en un fluido similar al plasma). El tiempo de estabilidad varía de acuerdo a la plataforma, pero en general no supera las ocho semanas por lote, y los viales abiertos permanecen estables en algunos casos hasta 7 días si se almacenan entre 2 y 8 °C. Los valores asignados están determinados en autoanalizadores que son calibrados con sangre fresca contra los procedimientos de medida convencionales.
El laboratorio debería calcular el valor de media y DE de trabajo que refleje el desempeño del procedimiento de medida en su entorno. La media de trabajo debe ser la propia del laboratorio. Si no hay un valor asignado como target histórico, idealmente debe ser calculada con 10 determinaciones de 10 días por separado. Si esto no fuera posible se podría en menos días, pero no más de 4 determinaciones por día. Para el DE lo mejor es usar el histórico del sistema de medición. Si no hay histórico establecer el inicial en 20 días por separado. Como los lotes de control del hemograma tienen una estabilidad no mayor a los 2 meses se sugiere trabajar con el CV% ponderado de al menos 6 meses para obtener la imprecisión histórica.
La comparación del error esperado (ETa) asociado con un comportamiento estable del procedimiento de medida puede realizarse separadamente para cada componente o en combinación. La medida del error del procedimiento, en el contexto del control estadístico de la calidad ha sido típicamente considerada conformada por 2 componentes:
• Error sistemático, estimado con el sesgo
• Error aleatorio, estimado con la imprecisión (CV%/DE)
Existen 4 estrategias para acceder al sesgo que se pueden aplicar a hematología:
1. El método óptimo es comparar el método con el de referencia a través de lineamientos CSLI EP9 (27), el problema es que los laboratorios no tienen acceso a procedimientos de referencia.
2. Realizar experimentos de comparación de métodos con el método saliente si éste estuvo verificado y monitoreado, generalmente no provee una buena estimación, ya que el sesgo del procedimiento de comparación generalmente no se conoce exactamente.
3. Comparar con los resultados del grupo par de comparación basados en los datos interlaboratorios del CCI o del control de calidad externo (CCE). De esta manera se evalúa la aparente diferencia relativa con otros laboratorios usuarios del mismo procedimiento de medida pero no se tiene en cuenta ningún aporte al sesgo inherente a ese procedimiento.
4. La última opción es asumir que el sesgo es cero. Esta aproximación reconoce que el acceso actual a los cálculos del sesgo no es práctico y el uso de un sesgo estimado relativo daría una percepción errada del sesgo y no sería útil para la planificación del CCI. Cuando el sesgo se asume como cero el plan del CCI estaría destinado a identificar desvíos de condiciones operativas estables. La aproximación a un sesgo apropiado depende de las limitaciones técnicas de acceso al sesgo y fuentes disponibles para laboratorios individuales.
Generalmente la estimación de la precisión interensayo o intra laboratorio es clínicamente más relevante y refleja más la variabilidad a lo largo de intervalos de tiempo que la precisión en condiciones de repetibilidad. La estimación de la imprecisión intra laboratorio (DE o CV%), para ser utilizada en una estrategia de CCI, debería basarse en resultados a largo plazo adecuados, como para representar los diferentes tipos de influencias que pueden contribuir al procedimiento de medida en un largo plazo con la precisión bajo control. Cuando no existe un histórico estimado, el DE inicial puede ser obtenido realizando al menos 20 mediciones en 20 días separados y utilizar este valor hasta obtener el histórico. Alternativamente se puede utilizar también la imprecisión obtenida con CLSI EP15 (28) u otro procedimiento de estimación de la varianza. Se espera que los CV basados en mediciones obtenidas en un período menor a un mes subestimen los CV que representen un desempeño estable, a largo plazo en control. Computar el DE/CV% acumulado de varios meses de operación da una mejor estimación porque se tienen en cuenta componentes adicionales que puedan afectar la precisión como calibraciones, cambios de reactivos o lotes, mantenimientos preventivos, reemplazo de componentes y factores del entorno.
La métrica sigma define en qué medida un ensayo se desvía de la perfección y se puede utilizar para planificar la estrategia del CCI:
• Definir número niveles de materiales de control para una medición.
• Determinar las reglas de control estadísticas óptimas a ser aplicadas para cada evento.
• Proporcionar orientación sobre la frecuencia de eventos requerida.
El cálculo del sigma depende el valor de ETa elegido y del método empleado para cálculo del sesgo. El resultado del cálculo puede cambiar significativamente de un desempeño inaceptable a uno aceptable simplemente por el ETa seleccionado o el método utilizado para estimar el sesgo. No existe un sigma que caracterice al procedimiento de medida en todo el intervalo y para diferentes usos médicos. En consecuencia, puede existir un diferente sigma para cada nivel de control.
La ecuación para el cálculo de la métrica sigma para Hematología es la usual que se aplica para otras pruebas de laboratorio:
Métrica sigma= (ETa%-sesgo%)/CV%.
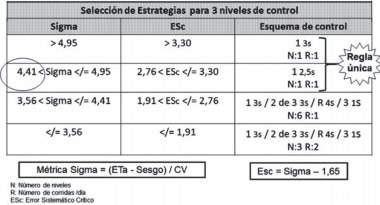
El procedimiento de control de calidad apropiado es aquel que tiene una probabilidad de detección (Pde) de errores clínicamente importantes mayor del 90% y una probabilidad de falso rechazo (Pfr) menor del 5% (preferiblemente menor del 1). Con el valor de sigma calculado, una Pfr< 0,05 y una Pde>0,09 se define la estrategia de control utilizando el gráfico para la planificación de CCI para 3 niveles de control (Figura 2). Esta herramienta es un gráfico de función de potencia que muestra la probabilidad de rechazo frente al tamaño del error para diferentes reglas de CCI y números de mediciones de control. La clave de esta herramienta es el error sistemático crítico (ESc) que necesita ser detectado por el procedimiento de control de calidad. El tamaño de este error depende de la calidad requerida para la prueba y de la precisión y exactitud observadas para el procedimiento de medición. En general, debe eliminarse el uso de la regla 1 2s a causa de su alto falso rechazo y considerar alternativas como 1 2,5s, 13s, y 13,5s que poseen bajas probabilidades de falso rechazo. Es muy difícil de manejar una estrategia de regla múltiple en los contadores hematológicos, y la forma de elegir una estrategia de regla única muchas veces implica disminuir la Pde por debajo del 90%, lo que es en teoría también inaceptable. Para trabajar con regla única es necesario un sigma mínimo de 4 (Tabla VII).

Figura 2. Identificación las estrategias de control
Tabla VII. Selección de estrategias para tres niveles de control. Estrategia II
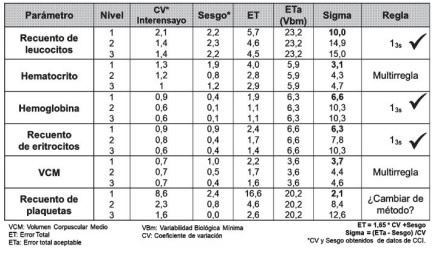
La planificación se realiza utilizando el nivel con el peor sigma. A modo de ejemplo en la Tabla VIII se muestra la planificación para algunos parámetros del hemograma, utilizando como ETa el requerimiento menos exigente de VB (VBm). Como puede observarse se puede llegar a planificar una estrategia de regla única para eritrocitos, hemoglobina y recuento de leucocitos, y es posible incluso poner un criterio más exigente para este último parámetro. En cambio, para hematocrito y VCM el resultado es de multirreglas si se planifica con este ETa. Pero si se observan los ETa que se comparan en la Tabla VI, se puede deducir que el ETa por VBm es demasiado cercano a lo que el fabricante declara. Por lo tanto, se debería recurrir a un ETa obtenido desde el estado del arte.
Tabla VIII. Ejemplo de planificación de CCI en hematología. Estrategia I
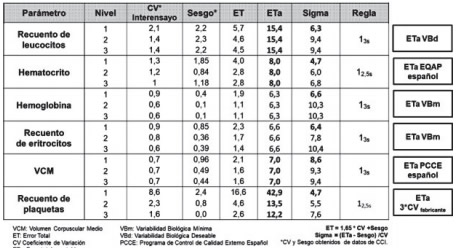
En cuanto al recuento plaquetario, si bien el ETa de 20,2% es superior al 12% declarado por el fabricante, un sigma cercano a 2 es difícilmente mejorable y útil a los fines del monitoreo del grupo. Se analizó el desempeño del grupo en este parámetro y se determinó que existía un problema con ese nivel de control en particular, el CV del grupo par de comparación había aumentado sensiblemente en esos lotes. El desempeño del laboratorio acompañaba al del grupo (Figura 3). Se contactó al fabricante que reportó un CV para ese nivel mucho mayor que el establecido en las especificaciones del manual. Por lo tanto, una opción es planificar con ese nuevo CV declarado por el fabricante, para que el sigma sea aceptable (Tabla IX).

Figura 3. Desempeño del laboratorio y del grupo par de comparación para el recuento de plaquetas (2017-2018).
Tabla IX. Ejemplo de planificación de CCI en hematología. Estrategia II
Una vez seleccionada la estrategia a seguir se deben aplicar las reglas y responder apropiadamente las situaciones fuera de control, calcular el ET/sigma y compararlo con los requisitos establecidos para certificar la estabilidad del sistema. Evaluar y documentar acciones correctivas tomadas en base a los resultados de ese análisis.
1. Prabhushankar GV, Devadasan S, Shalij P. Thirunavukkarasu V. The origin, history and definition of Six Sigma: a literature review. IJSSCA 2008; 4 (2). [ Links ]
2. Inal TC, Goruroglu Ozturk O, Kibar F, Cetiner S, Matyar S, Daglioglu G, et al. Lean six sigma methodologies improve clinical laboratory efficiency and reduce turnaround times. J Clin Lab Anal 2018; 32 (1): e22161. [ Links ]
3. Elbireer A, Le Chasseur J, Jackson B. Improving laboratory data entry quality using Six Sigma. Int J Health Care Qual Assur 2013; 26 (6): 496-509. [ Links ]
4. Charuruks N. Sigma metrics across the total testing process. Clin Lab Med 2017; 37 (1): 97-117. [ Links ]
5. Guo X, Zhang T, Gao X, Li P, You T, Wu Q, et al. Sigma metrics for assessing the analytical quality of clinical chemistry assays: a comparison of two approaches: Biochem Med (Zagreb) 2018; 28 (2). [ Links ]
6. Bais R. Use of capability index to improve laboratory analytical performance. Clin Biochem Rev 2008; 29(Suppl 1): S27–S31.
7. Hens K, Berth M, Armbruster D, Westgard S. Sigma metrics used to assess analytical quality of clinical chemistry assays: importance of the allowable total error (TEa) target. Clin Chem Lab Med 2014; 52 (7): 973-80. [ Links ]
8. Fuentes Arderiu X, Castiñeiras Lacamba MJ, Queraltó Compaño JM. Bioquímica clínica y patología molecular. 2a ed. Barcelona: Reverté, c1998. 2 v. ISBN 9788429118568. [ Links ]
9. Kumar BV, Mohan T. Sigma metrics as a tool for evaluating the performance of internal quality control in a clinical chemistry laboratory. J Lab Physicians 2018; 10 (2): 194-9. [ Links ]
10. Tony Badrick. Evidence-based laboratory medicine. Clin Biochem Rev 2013; 34 (2): 43–6.
11. Sciacovelli L, Lippi G, Sumarac Z, West J, García del Pino Castro I, Furtado Vieira K, et al. On behalf of the Working Group “Laboratory Errors and Patient Safety” of International Federation of Clinical Chemistry and Laboratory Medicine (IFCC). Quality Indicators in Laboratory Medicine: the status of the progress of IFCC Working Group “Laboratory Errors and Patient Safety” project. Clin Chem Lab Med. 2017; 55 (3): 348-57.
12. Plebani M, Sciacovelli L, Aita A. Indicators for the total testing process. Lab Med 2017; 37: 187–205.
13. Plebani M, Laposata M, Lundberg GD. The brain-tobrain loop concept for laboratory testing 40 years after its introduction. Am J Clin Pathol 2011; 136: 829–33.
14. Pineda Tenor D, Cabezas Martínez A. Aplicación del modelo Seis Sigma en el laboratorio clínico. En: Asociación Española de Biopatología Médica, Taller del Laboratorio Clínico I.S.S.N.-1988-7469; 2013. [ Links ]
15. Plebani M, Astion ML, Barth JH, Chen W, de Oliveira Galoro CA, Escuer MI, et al. Harmonization of quality indicators in laboratory medicine. A preliminary consensus. Clin Chem Lab Med 2014; 52 (7): 951-8. [ Links ]
16. Plebani M. Towards a new paradigm in laboratory medicine: the five rights. Clin Chem Lab Med 2016; 54: 1881–91.
17. Sciacovelli L, Aita A, Plebani M. Extra-analytical quality indicators and laboratory performance. Clin Biochem 2017; 50 (10–11): 632-7.
18. Carraro P, Plebani M. Errors in a stat laboratory: types and frequencies 10 years later. Clin Chem 2007; 53 (7): 1338-42. [ Links ]
19. Sandberg S, Fraser CG, Horvath AR, Jansen R, Jones G, Oosterhuis W, et al. Defining analytical performance specifications: Consensus Statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem Lab Med 2015; 53 (6): 833-5. [ Links ]
20. IRAM-ISO 15189 Norma Argentina. Laboratorio de análisis clínicos. Requisitos para la calidad y competencia (ISO 15189:2012.IDT). [ Links ]
21. CLIA Final Rules for Quality System. Federal Register February 28, 1992; 57 (40): 7002-186. [ Links ]
22. Ricos C, Alvarez V, Cava F, Garcia-Lario JV, Hernandez A, Jimenez CV et al. Desirable analytical quality specifications for imprecision, bias and total error upon biological variation. Current databases on biologic variation: pros, cons and progress. Scand J Clin Lab Invest 1999; 59: 491-500. [ Links ]
23. Desirable specifications for total error, imprecision, and bias, derived from intra- and inter-individual biologic variation. Disponible en: https://www.westgard.com/biodatabase1.htm (Fecha de acceso: 2 de agosto de 2019). [ Links ]
24. Westgard J. Statistical quality control procedures. Clinics in Laboratory Medicine 2013; 33: 111-24. [ Links ]
25. Clinical Laboratory Improvement Amendments of 1988 (CLIA) Proficiency Testing Regulations Related to Analytes and Acceptable Performance. Centers for Medicare & Medicaid Services (CMS), HHS; Centers for Disease Control and Prevention (CDC), HHS. Federal Register/ Vol. 84, No. 23 / Monday, February 4, 2019. [ Links ]
26. CLSI. Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions 4th ed. CLSI guideline C24 Wayne, PA: Clinical and Laboratory Standards Institute; 2016. [ Links ]
27. CLSI. Measurement Procedure Comparison and Bias Estimation using Patient Samples. 3rded. CLSI guideline EP09c. Wayne PA: Clinical and Laboratory Standard Institute; 2018. [ Links ]
28. CLSI. User Verification of Precision and Estimation of Bias; Approved Guideline. Third Edition. CLSI document EP15-A3 Wayne, PA: Clinical and Laboratory Standards Institute; 2014. [ Links ]
Recibido: 23 de agosto de 2019
Aceptado: 22 de noviembre de 2019














