Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.1 La Plata Mar. 2020
TOXICOLOGÍA
Bisfenol-A: cuantificacion en orina de mujeres embarazadas por cromatografia gaseosa-espectrometria de masa
Gabriel Guillermo Cases1a*, Raul Eduardo Uicich1, Paula Kandel Gambarte2, Marcela Liliam Vazquez3, Claudio Fernando Moix3, Analia Ferloni4b, Flavia Alejandra Vidal4b, Lucas Otano4b, Silvana Figar4b, Soledad Aragone4b, Maria Isabel Gimenez1b
1 Bioquimico.
2 Licenciada en Ciencias Biologicas.
3 Tecnico Quimico.
4 Medico.
a Profesional Principal. CPA. CONICET.
b Integrante del Programa de Investigacion en Salud y Ambiente (PISA).
Seccion Cromatografia y Espectrometria de Masa, Laboratorio Central, Hospital Italiano de Buenos Aires, Peron 4190, C1181ACH, Ciudad Autonoma de Buenos Aires, Argentina.
* Autor para correspondencia.
Correspondencia Dr. GABRIEL CASES Perón 4190, Planta Baja (C1181ACH) CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina Tel. (54) (11) 4959-0200 ext. 4900 / Tel. (54) (11) 15-4039-2791 Correo electrónico: gabriel.cases@hospitalitaliano.org.ar; ggcases@hotmail.com
Resumen
El uso de bisfenol-A (BPA) a nivel de la industria global se ha venido incrementando en los ultimos anos, y fueron los mercados emergentes los impulsores de esta demanda creciente. Las aplicaciones de BPA en la industria de los alimentos y bebidas representan solo del 3 al 4% del consumo global de policarbonato, pero su uso esta siendo reexaminado debido a que se conocieron varios trabajos cientificos que indican la existencia de una relacion directa entre el BPA y los efectos adversos para la salud. La contaminacion de los alimentos y bebidas se produce por migracion del BPA desde los envases que los contienen (alimentos enlatados, vinos, etc.), y es la principal fuente de exposicion en el humano. Para evaluar dicha exposicion se desarrollo y valido un metodo analitico por cromatografia gaseosa acoplada a espectrometria de masa para la cuantificacion de BPA total en orina de mujeres embarazadas atendidas en el Hospital Italiano de Buenos Aires en el ano 2013, con un limite de cuantificacion de 2,0 ng/mL y un limite de deteccion de 0,8 ng/mL. De las 149 muestras de orina analizadas, el 66,4% fueron cuantificables, con la mediana de BPA total de 4,8 ng/mL (4,3 ng/mg de creatinina) y la media geometrica de 4,8 ng/mL (4,7 ng/mg de creatinina).
Palabras clave: Bisfenol-A; Orina; Embarazo; Disruptor endócrino; Cromatografía gaseosa-espectrometría de masa.
Abstract
Bisfenol-A: quantification in urine of pregnant women by gas chromatography-mass spectrometry
The use of bisphenol-A (BPA) at the level of the global industry has been increasing in recent years, with emerging markets being the drivers of this growing demand. BPA applications in the food and beverage industry represent only 3 to 4% of the global consumption of polycarbonate, but its use is being reexamined because several scientific works were reported indicating the existence of a direct relationship between BPA and adverse effects on health. The contamination of food and beverages is produced by the migration of BPA from the containers that hold them (canned foods, wines, etc.) and it is the main source of exposure in humans. To evaluate this exposure, an analytical method was developed by gas chromatography coupled to mass spectrometry for the quantification of total BPA in urine of pregnant women treated at the Hospital Italiano de Buenos Aires in 2013, with a limit of quantification of 2.0 ng/mL and of detection of 0.8 ng/mL. Of the 149 urine samples analyzed, 66.4% were quantifiable, with a median total BPA of 4.8 ng/mL (4.3 ng/mg creatinine) and a geometric mean of 4.8 ng/mL (4.7 ng/mg creatinine).
Keywords: Bisphenol-A; Urine; Pregnancy; Endocrine disruptor; Gas chromatography-mass spectrometry.
Resumo
Bisfenol-A: quantificacao em urina de gestantes por cromatografia gasosa-espectrometria de massa
O uso de bisfenol-A (BPA) ao nivel da industria global foi aumentando nos ultimos anos, e foram os mercados emergentes que deram impulso a essa demanda crescente. As aplicacoes de BPA na industria de alimentos e bebidas representam apenas 3 a 4% do consumo global de policarbonato, mas seu uso esta sendo reexaminado visto que varios trabalhos cientificos indicando a existencia de uma relacao direta entre o BPA e os efeitos adversos na saude foram conhecidos. A contaminacao dos alimentos e bebidas e produzida pela migracao de BPA das embalagens que os contem (alimentos enlatados, vinhos, etc.) e e a principal fonte de exposicao em humanos. Para avaliar esta exposicao, foi desenvolvido e avaliado um metodo analitico por cromatografia gasosa acoplada a espectrometria de massas para a quantificacao do BPA total na urina de gestantes atendidas no Hospital Italiano de Buenos Aires em 2013, com um limite de quantificacao de 2,0 ng/mL e um limite de deteccao de 0,8 ng/mL. Das 149 amostras de urina analisadas, 66,4% foram quantificaveis, com uma mediana de BPA total de 4,8 ng/mL (4,3 ng/mg de creatinina) e a media geometrica de 4,8 ng/mL (4,7 ng/mg de creatinina).
Palavras-chave: Bisfenol-A; Urina; Gravidez; Disruptor endócrino; Cromatografia gasosa-espectrometria de massa.
Introduccion
El Bisfenol-A (bisphenol-A; BPA, por sus siglas en inglés) es un compuesto orgánico a partir del cual se produce policarbonato, un plástico ampliamente utilizado en la fabricación de recipientes para alimentos y bebidas. Las resinas epoxi también son elaboradas en su mayoría a partir de BPA y son utilizadas como revestimiento de los contenedores de alimentos y bebidas (latas, cubas para almacenamiento de vinos, etc.), formando una película entre los alimentos y la superficie interna del recipiente metálico, que evita su corrosión e impide la migración de metal hacia los alimentos. Pero lo que no se puede evitar es la migración del BPA, aunque sea mínima, desde el revestimiento hacia los alimentos o bebidas. Por lo tanto, las personas están expuestas a pequeñas cantidades de BPA por el solo hecho de alimentarse. Diversos estudios científicos le asignaron al BPA un rol biológicamente activo a muy bajas dosis (1), ya que posee la capacidad de unirse a receptores de estrógenos (disruptor endócrino). Dichos trabajos indican una correlación estrecha entre el BPA y los efectos nocivos para la salud humana.
Por consiguiente, su uso en la industria alimenticia está siendo reexaminado, impulsado principalmente por la opinión pública, los medios de comunicación y los activistas medioambientales. Tanto la autoridad europea de seguridad alimentaria así como también el servicio de salud pública estadounidense están revisando toda la información recolectada en los últimos años sobre el BPA (2) (3). Para ello se ha establecido un período de uno a dos años durante el cual no se tomarán medidas correctivas extremas, sino que adoptarán una postura más laxa, para darle tiempo a la industria de materiales de embalaje de alimentos a que desarrollen propuestas alternativas al BPA que ayuden a la solución del problema.
El BPA se absorbe rápidamente en el tracto gastrointestinal y en una alta proporción luego de la ingesta oral a dosis bajas comparables con la exposición humana ambiental promedio. Prácticamente no sufre una biotransformación de fase I y es metabolizado en el hígado casi completamente por conjugación en una biotransformación de fase II con glucurónido (en mayor proporción) y sulfato, los que le agregan hidrofilicidad al BPA y permiten su rápida excreción urinaria.
La eficiente conjugación hepática del BPA libera al compartimiento plasmático niveles muy bajos de BPA libre (BPA-L) capaz de unirse al receptor estrogénico. Por lo tanto, a la formación de BPA-glucurónido (BPA-G) y BPA-sulfato (BPA-S) se las considera como reacciones de desactivación o detoxificación, aunque existen recientes trabajos científicos que indican que el BPA-G puede también ser biológicamente activo (4) (5). En la orina existen niveles muy bajos de BPA-L y el principal metabolito presente es el BPA-G, por lo que se considera a la orina como el fluido corporal de elección para evaluar la exposición humana al BPA a través de la cuantificación del biomarcador más apropiado de exposición, el BPA total (BPA-T) (6). Para lograr resultados confiables y robustos, los métodos analíticos basados en espectrometría de masa son los más adecuados por su alta selectividad, sensibilidad y precisión (4) (6-10). El objetivo del presente trabajo es el desarrollo de un método analítico por cromatografía gaseosa acoplada a un detector de espectrometría de masa (GC/MS) para la detección y cuantificación de BPA-T en orina de mujeres embarazadas, a partir de un procedimiento que incluye: hidrólisis enzimática, extracción con solvente orgánico del compuesto y su posterior derivatización.
Materiales y Metodos
Materiales
El estándar de bisfenol-A (99%), la enzima betaglucuronidasa/ sulfatasa (Tipo H-1 de Helix pomatia) y el derivatizante N,O-bis(trimetilsilil)trifluoroacetamida (BSTFA) + 1% de trimetilclorosilano (TMCS) fueron adquiridos a Sigma-Aldrich (Argentina). El acetato de etilo (grado LC/MS) era de marca Carlo Erba, el acetato de amonio de Fluka y el ácido clorhídrico de Merck. Se utilizó el sistema de agua ultrapura Sartorius Arium Pro y frascos para recolección de orina de 150 mL, libres de ftalatos y de BPA, certificados por el Laboratorio Deltalab. El material de vidrio era nuevo y fue enjuagado con agua ultrapura.
Preparacion de Estandares de Calibración
El estándar de BPA fue disuelto en acetato de etilo y se preparó una solución stock de 1,1 mg/mL. Se prepararon las soluciones de trabajo por diluciones seriadas en acetato de etilo de la solución stock de BPA. Estas fueron utilizadas para realizar la curva de calibración de cinco niveles de concentración, en un rango de 2,0 a 20,0 ng/mL. Las soluciones stock fueron almacenadas a 4 ºC. Las soluciones de trabajo fueron almacenadas a 4 ºC y al abrigo de la luz por no más de una semana.
Recoleccion y preparacion de muestras
Las muestras de orina por micción espontánea fueron recolectadas en el ámbito hospitalario en un frasco de polipropileno (libre de BPA), con tres horas de retención como mínimo y sin ayuno previo, luego fueron alicuotadas en tubos de polipropileno y conservadas en freezer a -80 ºC hasta el momento de su análisis en el laboratorio. Se analizaron en total 149 muestras de orina de mujeres embarazadas (de 11 a 16 semanas), mayores de edad, atendidas en el Hospital Italiano entre agosto y septiembre de 2013. Se les explicaron los objetivos del estudio, se les garantizó la confidencialidad y se obtuvieron sus consentimientos informados por escrito. Las muestras se recolectaron con la aprobación del Comité de Ética de Protocolos de Investigación del Hospital Italiano de Buenos Aires (CEPI, N° de Protocolo: 1592).
Procesamiento de las muestras
Para la cuantificación de BPA se utilizó un procedimiento descripto anteriormente (7) (8) (10) con ligeras modificaciones. Se seleccionaron las muestras de orina cuya concentración de creatinina estaba comprendida entre 25 mg/dLy 360 mg/dL. Se colocó 1 mL de orina en un tubo de vidrio, se agregaron 50 μL de la solución buffer de acetato de amonio 1 M (pH: 5,0) y 50 μL de â-glucuronidasa, se incubó por 24 horas en baño de agua termostatizado a 37 ºC. Luego se agregaron 150 μL de ácido clorhídrico 4 N y 2 mL de acetato de etilo para realizar la extracción del BPA-T (BPA-L+ BPA-G). Para favorecer la misma se agitó la muestra en un vortex durante 4 minutos, luego fue centrifugada a 2.500 rpm y a 4 ºC por 5 minutos. Se obtuvo un sobrenadante que fue transferido a un vial de vidrio y evaporado a sequedad bajo corriente de nitrógeno. Para la derivatización se agregaron 100 μL de la mezcla BSTFA + 1% TMCS (reactivo sililante) al extracto seco y se incubó 30 minutos a 60 ºC en un bloque calefactor (calor seco). Se inyectaron 2 μL de la muestra derivatizada en el GC/MS a través del inyector automático. La determinación de creatinina se realizó por el método de Jaffé en un autoanalizador AU5800 de Beckman- Coulter.
Separacion y cuantificacion
Todos los análisis de BPA se realizaron utilizando un equipo de cromatografía gaseosa marca Agilent Technologies modelo 7890A acoplado a un detector selectivo de masas de la misma marca, modelo 5975C TAD (GC/ MSD), y un automuestreador modelo 7693. Para la adquisición de datos y procesado de espectros se utilizó el programa de control de instrumentos Agilent GC/ MSD ChemStation. Para la separación cromatografía se utilizó una columna capilar Agilent J &W DB-5MS + DuraGuard (30 m x 0,250 mm ID, 0,25 μm film thickness). Se programó la temperatura de la columna de la siguiente manera: la inicial fue de 150 ºC por 2 minutos y se incrementó a 30 ºC/minuto hasta 270 ºC, se mantuvo dicha temperatura final por 8 minutos. Se enjuagó (back flush) a 300 ºC por 8 minutos. Se aplicó un tiempo de espera del solvente (solvent delay) de 3 minutos, antes del inicio del escaneo de masas, para proteger al multiplicador de iones del detector de una saturación. El tiempo total de corrida fue de 14 minutos. Se utilizó helio de alta pureza como gas portador, a un flujo constante de 1 mL/min. La temperatura del inyector se fijó en 250 ºC, y el volumen de inyección fue de 2 μL en modo splitless. Las temperaturas tanto de la interfase GC/MSD como la de la fuente de iones fueron de 300 ºC, y la del cuadrupolo, de 180 ºC. La energía de ionización por impacto electrónico (EI) fue de 70 eV. La adquisición de iones se realizó por el modo de monitoreo selectivo (SIM). Los iones monitoreados fueron el de m/z 357 para cuantificación, correspondiente al bis (trimetilsilil)-BPA desmetilado (M-15)+, y los de m/z 358, 360 y 372 para confirmación, este último correspondiente al bis (trimetilsilil)-BPA (ion M+) (Fig. 1). Para la identificación y confirmación del BPA de las muestras, se utilizó el tiempo de retención (Tr) y la relación de áreas de pico de los iones de confirmación respecto del ion de cuantificación, parámetros obtenidos del estándar de BPA. Como dato adicional de identificación se realizó la búsqueda del espectro de BPA de la muestra en la biblioteca comercial NIST (Fig. 2). Se midió la concentración de BPA en cada muestra por interpolación del área de pico del analito en la curva de calibración.
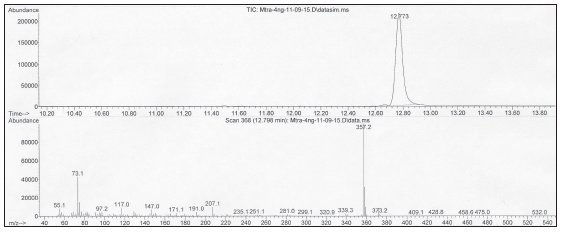
Figura 1. Cromatograma SIM y espectro de masa de BPA.
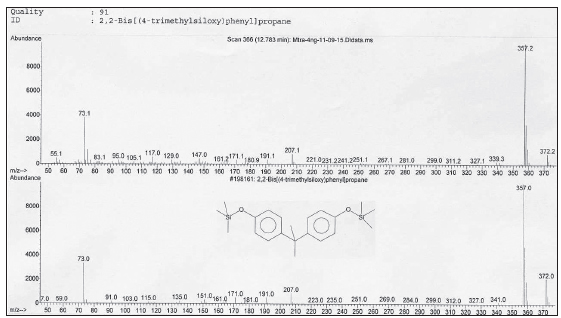
Figura 2. BPA: busqueda y comparacion con espectro de biblioteca.
Evaluacion de la contaminacion por BPA
Se analizaron diversos blancos de todos los materiales utilizados desde la obtención de la muestra, su almacenamiento y posterior análisis. Se evaluaron los frascos contenedores de muestra, los tubos de vidrio, las puntas para pipetas, viales para automuestreador, solventes y reactivos, etc. Además, se analizó el aporte de BPA proveniente del sistema GC/MSD. No se ha detectado la presencia de BPA por encima del límite de detección (LD) en ninguna de las pruebas realizadas.
Validacion del metodo
Se utilizó un procedimiento basado en los criterios de validación publicados por la EMA (11). El método de GC/MS fue validado para selectividad, linealidad, límite de detección (LD), límite inferior de cuantificación (LIC), exactitud y precisión. La selectividad fue evaluada por comparación del área del pico cromatográfico entre el blanco de muestra y la muestra del estándar de calibración. El área del pico en el tiempo de retención esperado para cada analito en las muestras blanco debe ser menor al 20% del promedio de áreas de pico en las muestras del LIC. La curva de calibración fue construida trazando el área de pico del analito medido en el eje de ordenadas (eje Y) con respecto a la concentración nominal del analito en el eje de abscisas (eje X), para cada uno de los calibradores. Se realizó un análisis de regresión lineal por cuadrados mínimos, y fueron calculadas la pendiente, la ordenada al origen y el coeficiente de determinación (R2) de la curva de calibración.
El LIC del ensayo fue definido como la menor concentración de la curva de calibración que se podía cuantificar (LIC, relación señal/ruido (S/N) ≥5). El LD fue definido como la menor concentración que se podía detectar (LD, S/N ≥3).
Analisis de datos y estadistica
Se utilizó el software ChemStation para generar la curva de calibración que contiene: tiempo de retención (Tr), valores del área de la señal, y concentración para el analito en cada muestra. Los cálculos de la relación lineal entre áreas de señal y concentraciones se obtuvieron mediante regresión de mínimos cuadrados con factor de ponderación de 1/x2. Para el análisis de datos se utilizó el programa Excel de Microsoft Office. Se calculó la media con su desviación estándar (DE), la media geométrica (MG), la desviación estándar geométrica (DEG) y la mediana, para el BPA-T ajustado y no ajustado por creatinina.
Resultados
Selectividad
El método analítico permitió diferenciar al BPA de otros componentes de la orina.
Linealidad, limites de deteccion y cuantificacion
La curva de calibración resultó ser lineal entre 2,0 y 20,0 ng/mL, con un coeficiente de determinación (R2) mayor de 0,99. El límite de detección fue de 0,8 ng/mL y el límite de cuantificación fue de 2,0 ng/mL (ambos límites fueron analizados para BPA en 1 mL de orina).Todas las concentraciones de BPA de cada muestra se ajustaron por la concentración de creatinina en las mismas y se expresaron como ng/mg de creatinina para controlar las variables diluciones de la orina.
Precision y exactitud
Estos parámetros se evaluaron sobre una muestra de control de calidad de 10 ng/mL, por quintuplicado de preparación e inyectadas por simplificado en una misma corrida. Se obtuvieron los siguientes valores: precisión: 12,8% (expresado como coeficiente de variación porcentual CV%), exactitud: 10,3% (expresado como error relativo porcentual ER%).
Valores de BPA total hallados en orina
Se detectó la presencia de BPA-T en un 87,2% (130/149) del total de muestras analizadas. La media obtenida del total de muestras cuantificadas fue de 5,7 ng/mL (Desviación estándar: 4,3 ng/mL), y de 5,7 ng/mg (DE: 5,0 ng/mg) (valores ajustados por creatinina). Sólo tres muestras resultaron por encima del límite superior de cuantificación (LSC). En la Tabla I están resumidos los valores obtenidos con el método validado.
Tabla I. Resumen de los resultados obtenidos de BPA total en orina de mujeres embarazadas.

Discusion y Conclusiones
Se utilizó un método analítico de alta sensibilidad y especificidad para la detección y cuantificación de trazas de BPA-T presente en la orina de mujeres embarazadas en su primer trimestre de gestación. El principal metabolito de BPA en orina es el BPA-G (alrededor del 70% del BPA-T), le sigue en proporción el BPA-S (15%) y el resto es BPA sin conjugar (BPA-L) (4). Para liberar al BPA conjugado y obtener BPA-L se utilizó la enzima beta-glucuronidasa, que además de hidrolizar al BPA-G posee acción de sulfatasa. A pesar de que el pH utilizado en la hidrólisis era óptimo para la acción de glucuronidasa, es posible que se haya hidrolizado algo del BPA-S. Por lo tanto, el BPA-L obtenido luego de la hidrólisis enzimática representaría al total de BPA que ingresó en el organismo y se lo debe considerar como el único biomarcador de exposición suficientemente confiable en los estudios basados en la población (6). Además, en el caso particular de mujeres embarazadas, serviría como marcador indirecto de exposición fetal.
Se detectó la presencia de BPA en el 87,2% de las muestras de orina analizadas. Esto demuestra la omnipresencia de este compuesto en la vida cotidiana y la dificultad de hallar muestras que sirvan de control de no exposición para la comparación de resultados. En lo estrictamente analítico, se deben extremar las medidas tendientes a minimizar la contaminación de BPA en los materiales utilizados en todo el proceso, desde la toma de muestra hasta el análisis cuantitativo. Se cuantificó el 66,4% de las muestras analizadas, y se obtuvo para la concentración de BPA-T una mediana de 4,3 ng/mg de creatinina y de 4,8 ng/mL (sin ajuste). La MG (ajustada por creatinina) fue de 4,7 ng/mg, y de 4,8 ng/mL (sin ajuste), y la DEG para ambas fue de 1,7 (Tabla II). Las concentraciones de creatinina fueron utilizadas también para determinar si la muestra urinaria de micción espontánea era válida.
Tabla II. Valores de BPA total urinario en mujeres embarazadas (menos de 12 semanas de gestación).

En la Tabla III se comparan los valores obtenidos en este estudio con los publicados en la bibliografía. En su mayoría existe un alto porcentaje de detección de BPA (mayor del 80%) en las muestras de orina de mujeres embarazadas. En cuanto a los valores de MG y mediana, los autores creen que resulta inadecuada su comparación con otros trabajos, debido a la variabilidad existente entre las técnicas de procesamiento de muestras (el uso o no de hidrólisis enzimática, derivatización, etc.), en el análisis cromatográfico (cromatografía líquida o gaseosa) y en los diferentes tiempos de gestación en los cuales se recolectaron las muestras. Además, existe evidencia científica que demuestra una baja correlación entre las mediciones seriadas de BPA urinario de una misma persona durante el embarazo (12). Esto es debido a la naturaleza de la exposición al BPA (consumo episódico de alimentos y uso de productos), y a la corta vida media biológica del mismo (13). Por lo tanto, resulta imprecisa la estimación de exposición a largo plazo al BPA con el solo uso de una muestra puntual de orina (14).
Tabla III. Valores publicados de BPA total en orina de mujeres embarazadas (2013-2019).

Los resultados de este trabajo son los primeros datos obtenidos de BPA-T urinario en una población de mujeres embarazadas de la Argentina, y deben ser tomados como el punto de partida para futuros ensayos toxicológicos y ambientales que evalúen la exposición a largo plazo al BPA, y a muy bajas concentraciones, tanto en niños recién nacidos como en la población en general de la Argentina.
Fuentes de financiacion
El presente trabajo de investigación fue realizado con el apoyo del programa de becas “Ramón Carrillo-Arturo Oñativia”, categoría individual, otorgada por el Ministerio de Salud de la Nación Argentina, a través de la Comisión Nacional Salud Investiga. Año 2013.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses respecto del presente trabajo.
1. VomSaal FS, Hughes C. An extensive new literature concerning low-dose effects of bisphenol A shows the need for a new risk assessment. Environ Health Perspect 2005; 113 (8): 926-33. [ Links ]
2. Gundert-Remy U, Bodin J, Bosetti C, FitzGerald R, Hanberg A, Hass U, et al. Bisphenol A (BPA) hazard assessment protocol. EFSA supporting publication 2017: EN-1354 (14), 1-76. [ Links ]
3. NTP Research report on the CLARITY-BPA core study: A perinatal and chronic extended-dose-range study of Bisphenol A in rats. NTP RR 9. Research Triangle Park, NC. NTP2018; (9): 1-221. [ Links ]
4. Gerona RR, Pan J, Zota AR, Schwartz JM, Friesen M, Taylor JA, et al. Direct measurement of bisphenol A (BPA), BPA glucuronide and BPA sulfate in a diverse and low-income population of pregnant women reveals high exposure, with potential implications for previous exposure estimates: a cross-sectional study. Environ Health 2016; 1-14. [ Links ]
5. Boucher JG, Boudreau A, Ahmed S, Atlas E. In vitro effects of Bisphenol A â-D-glucuronide (BPA-G) on adipogenesis in human and murine preadipocytes. Environ Health Perspect 2015; 123 (12): 1.287-93. [ Links ]
6. Koch HM, Kolossa-Gehring M, Schroter-Kermani C, Angerer J, Bruning T. Bisphenol A in 24 h urine and plasma samples of the German Environmental Specimen Bank from 1995 to 2009: A retrospective exposure evaluation. J Expo Sci Environ Epidemiol 2012; 22 (6): 610-6. [ Links ]
7. Arakawa C, Fujimaki K, Yoshinaga J, Imai H, Serizawa S, Shiraishi H. Daily urinary excretion of bisphenol A. Environ Health Prev Med 2004; 9: 22-6. [ Links ]
8. Tsukioka T, Terasawa J, Sato S, Hatayama Y, Makino T, Nakazawa H. Development of analytical method for determining trace amounts of BPA in urine samples and estimation of exposure to BPA. J Environ Chem 2004; 14 (1): 57–63.
9. Moors S, Blaszkewicz M, Bolt HM, Degen GH. Simultaneous determination of daidzein, equol, genistein and bisphenol A in human urine by a fast and simple method using SPE and GC-MS. Mol Nutr Food Res 2007; 51: 787-98. [ Links ]
10. Kuklenyik Z, Ekong J, Cutchins CD, Needham LL, Calafat AM. Simultaneous measurement of urinary bisphenol A and alkylphenols by automated solid-phase extractive derivatization gas chromatography/mass spectrometry. Anal Chem 2003; 75: 6.820-5. [ Links ]
11. European Medicines Agency (EMA). Guideline on bioanalytical method validation. EMEA/CHMP/EWP/ 192217/2009 Rev.1 Corr. 2**. [Accessed september 2nd]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf. [ Links ]
12. Casas M, Valvi D, Luque N, Ballesteros-Gomez A, Carsin A, Fernandez MF, et al. Dietary and sociodemographic determinants of bisphenol A urine concentrations in pregnant women and children. Environ Intern 2013; 56: 10-8. [ Links ]
13. Teeguarden JG, Calafat AM, Ye X, Doerge DR, Churchwell MI, Gunawan R, et al. Twenty-four hour human urine and serum profiles of bisphenol A during high-dietary exposure. Toxicol Sci 2011; 123: 48–57.
14. Braun JM, Kalkbrenner AE, Calafat AM, Bernert JT, Ye X, Silva MJ, et al. Variability and predictors of urinary bisphenol A concentrations during pregnancy. Environ Health Perspect 2011; 119: 131-7. [ Links ]
15. Giesbrecht GF, Ejaredar M, Liu J, Thomas J, Letourneau N, Campbell T, et al. Prenatal bisphenol A exposure and dysregulation of infant hypothalamic-pituitary-adrenal axis function: findings from the APrON cohort study. Environ Health 2017; 16 (47): 1-11. [ Links ]
16. Chiu YH, Minguez-Alarcon L, Ford JB, Keller M, Seely EW, Messerlian C, et al. Trimester-specific urinary bisphenol A concentrations and boodglucose levels among pregnant women from a fertility clinic. J Clin Endocrinol Metab 2017; 102 (4): 1.350-7. [ Links ]
17. Johns LE, Ferguson KK, Cantonwine DE, McElrath TF, Mukherjee B, Meeker JD. Urinary BPA and phthalate metabolite concentrations and plasma vitamin D levels in pregnant women: arepeated measures analysis. Environ Health Perspect 2017; 125 (8): 1-9. [ Links ]
18. Huo W, Xia W, Wan Y, Zhang B, Zhou A, Zhang Y, et al. Maternal urinary bisphenol A levels and infant low birth weight: a nested case-control study of the Health Baby Cohort in China. Environ Int 2015; 85: 96-103. [ Links ]
19. Myridakis A, Fthenou E, Balaska E, Vakinti M, Kogevinas M, Stephanou EG. Phthalate esters, parabens and bisphenol-A exposure among mothers and their children in Greece (Rhea cohort). Environ Int 2015; 83: 1-10. [ Links ]
20. Arbuckle TE, Davis K, Marro L, Fisher M, Legrand M, LeBlanc A, et al. Phthalate and bisphenol A exposure among pregnant women in Canada -Results from the MIREC study. Environ Int 2014; 68: 55-65. [ Links ]
21. Lee BE, Park H, Hong YC, Ha M, Kim Y, Chang N, et al. Prenatal bisphenol A and birth outcomes: MOCEH (Mothers and Children’s Environmental Health) study. Int J Hyg Environ Health 2014; 217: 328-34.
22. Hoepner LA, Whyatt RM, Just AC, Calafat AM, Perera FP, Rundle AG. Urinary concentrations of bisphenol A in an urban minority birth cohort in New York City, prenatal through age 7 years. Environ Res 2013; 122: 38-44. [ Links ]
Recibido: 9 de julio de 2019
Aceptado: 4 de octubre de 2019














