Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.1 La Plata Mar. 2020
TRADUCCIONES SELECCIONADAS DEL CLINICAL CHEMISTRY
Los biomarcadores cardiacos e inflamatorios se asocian con un empeoramiento en los outcomes renales en pacientes con diabetes mellitus tipo 2: observaciones del estudio SAVOR-TIMI 53
Cardiac and inflammatory biomarkers are associated with worsening renal outcomes in patients with type 2 diabetes mellitus: observations from SAVOR-TIMI 53
Thomas A. Zelniker1, David A. Morrow1, Ofri Mosenzon2, Yared Gurmu1, Kyungah Im1, Avivit Cahn2, Itamar Raz2, Philippe Gabriel Steg3,4,5, Lawrence A. Leiter6, Eugene Braunwald1, Deepak L. Bhatt1, Benjamin M. Scirica1*
1 Grupo de Estudio TIMI, Division de Medicina Cardiovascular, Hospital Brigham and Women y Harvard Medical School, Boston, MA.
2 Unidad de Diabetes, Departamento de Medicina Interna, Hospital Universitario Hebreo Hadassah, Jerusalen, Israel.
3 Departamento de Cardiologia, Hospital Bichat, AP-HP, Paris, Francia.
4 FACT, DHU FIRE, Inserm U1148, LVTS, Universidad Paris-Diderot, Paris, Francia.
5 Imperial College, Royal Brompton Hospital, Londres, Reino Unido.
6 Instituto de Conocimiento Li Ka Shing, Hospital St. Michael, Universidad de Toronto, Toronto, ON, Canada.
* La correspondencia debe ser dirigida a este autor en: TIMI Study Office, 60 Fenwood Rd., Suite 7022–7024W, Boston, MA 02115. Correo electronico: bscirica@bwh.harvard.edu
Traducción: Dr. Diego Lucero. Seccion de Metabolismo de Lipoproteinas. National Heart, Lung, Blood Institute. National Institutes of Health. Bethesda, Maryland, Estados Unidos.
Este articulo ha sido traducido con el permiso de la AACC. La AACC no es responsable de la exactitud de la traduccion. Las opiniones expresadas son las de los autores y no necesariamente de la AACC o de la Revista. Tomado de Clin Chem 2019; 65 (6):781-90, con el permiso del editor. Derechos de autor original c Asociacion Americana de Quimica Clinica, Inc, 2019. Al citar este articulo, por favor recurra a la fuente original de publicacion en la revista Clinical Chemistry.
Resumen
Antecedentes: Las enfermedades cardiaca y renal se manifiestan comunmente con interacciones bidireccionales. Nuestra hipotesis es que los biomarcadores cardiacos e inflamatorios pueden ser utiles en la identificacion de pacientes con diabetes mellitus tipo 2 (DM2) de alto riesgo de deterioro de la funcion renal.
Métodos: En el presente analisis exploratorio del estudio SAVOR-TIMI 53, las concentraciones de troponina T cardiaca de alta sensibilidad (TnT-us), propeptido natriuretico cerebral N-terminal (NT-proBNP) y proteina C-reactiva de alta sensibilidad (PCR-us) fueron medidas en muestras basales de suero de 12.310 pacientes. El punto final primario para este analisis fue una disminucion mayor al 40% en la tasa de filtracion glomerular estimada (TFGe) al final del tratamiento (FdT) en una mediana de seguimiento de 2,1 anos. Las relaciones entre los biomarcadores y el punto final se modelaron utilizando regresion logistica ajustada y regresion de Cox.
Resultados: Despues de la regresion logistica ajustada, incluyendo la funcion renal basal, cada biomarcador se asocio independientemente con mayor riesgo de una disminucion mayor o igual al 40% en la TFGe al FdT [Cuartil (Q) Q4 vs Q1: cociente de probabilidades (CP) ajustado de TnT-us fue 5,63 (IC 95%, 3,49–9,10); para NTproBNP CP ajustado, 3,53 (IC 95%, 2,29–5,45); OR ajustado para PCR-us, 1,84 (IC 95%, 1,27–2,68); todos los valores con p≤0,001]. Ademas, cada biomarcador se asocio de manera independiente con mayor riesgo de empeoramiento en la categoria de la relacion albumina/ creatinina urinaria (RACu) (p≤0,002 en todos los casos). Los analisis de sensibilidad en pacientes sin insuficiencia cardiaca y TFGe >60 mL/min demostraron resultados similares. En un modelo ajustado de marcadores multiples (multi-marcador), TnT-us y NT-proBNP se mantuvieron significativamente asociados con ambos puntos finales renales (p<0,01 en todos los casos).
Conclusiones: TnT-us, NT-proBNP y PCR-us se asociaron con el empeoramiento de la funcion renal [reduccion de la TFGe (≥40%) y deterioro en la categoria de RACu] en pacientes con DM2 de alto riesgo. Los pacientes con biomarcadores cardiacos o inflamatorios elevados deben ser tratados no solo por su riesgo de resultados cardiovasculares, sino tambien monitoreados en cuanto a su deterioro renal.
Abstract
Background: Cardiac and renal diseases commonly occur with bidirectional interactions. We hypothesized that cardiac and inflammatory biomarkers may assist in identification of patients with type 2 diabetes mellitus (T2DM) at high risk of worsening renal function.
Methods: In this exploratory analysis from SAVOR-TIMI 53, concentrations of high-sensitivity cardiac troponin T (hs-TnT), N-terminal pro–B-type natriuretic peptide (NT-proBNP), and high-sensitivity C-reactive protein (hs-CRP) were measured in baseline serum samples of 12310 patients. The primary end point for this analysis was a ≥40% decrease in estimated glomerular filtration rate (eGFR) at end of treatment (EOT) at a median of 2.1 years. The relationships between biomarkers and the end point were modeled using adjusted logistic and Cox regression.
Results: After multivariable adjustment including baseline renal function, each biomarker was independently associated with an increased risk of ≥40% decrease in eGFR at EOT [Quartile (Q) Q4 vs Q1: hs-TnT adjusted odds ratio (OR), 5.63 (3.49–9.10); NT-proBNP adjusted OR, 3.53 (2.29–5.45); hs-CRP adjusted OR, 1.84 (95% CI, 1.27–2.68); all P values ≤0.001]. Furthermore, each biomarker was independently associated with higher risk of worsening of urinary albumin-to-creatinine ratio (UACR) category (all P values ≤0.002). Sensitivity analyses in patients without heart failure and eGFR >60 mL/min provided similar results. In an adjusted multimarker model, hs- TnT and NT-proBNP remained significantly associated with both renal outcomes (all P values <0.01).
Conclusions: hs-TnT, NT-proBNP, and hs-CRP were each associated with worsening of renal function [reduction in eGFR (≥40%) and deterioration in UACR class] in high-risk patients with T2DM. Patients with high cardiac or inflammatory biomarkers should be treated not only for their risk of cardiovascular outcomes but also followed for renal deterioration.
Abreviaturas no estandar
DM2, diabetes mellitus tipo 2;
NT-proBNP, propéptido natriurético cerebral N-terminal;
TnT-us, Troponina T ultra-sensible;
PCR-us, Proteína C ultra-sensible;
TFGe, Tasa de filtración glomerular estimada;
RACu, Relación albúmina/creatinina urinaria;
MDI, mejora en la discriminación integrada;
NRI, mejora neta de reclasificación;
RIQ, rango intercuartílico;
OR, odds ratio;
IR, índice de riesgo;
AUC, área debajo de la curva.
Introduccion
Si bien la mortalidad cardiovascular es la principal causa de muerte en pacientes con diabetes mellitus tipo 2 (DM2), los eventos microvasculares son complicaciones a largo plazo de la DM2, y la nefropatía diabética representa la causa principal de enfermedad renal en etapa terminal que requiere terapia de reemplazo renal (1). El empeoramiento de la función renal tiene un gran impacto en la morbilidad de los pacientes y a menudo se asocia con un grave deterioro de la salud y un mayor riesgo de muerte; también requiere un ajuste de dosis en la selección de medicación concomitante e influye en la selección de medicación hipoglucemiante, desafiando así el tratamiento óptimo de esta población de alto riesgo.
La nefropatía diabética es una enfermedad heterogénea, en la cual están involucrados múltiples mecanismos patobiológicos, incluidos los productos finales de glicación avanzada, la hipertensión, inflamación y estrés oxidativo (2)(3). La enfermedad cardiovascular y la nefropatía diabética comparten varios factores de riesgo y están estrechamente entrelazadas dado que una enfermedad aumenta el riesgo de la otra. Esta relación puede explicarse por las numerosas interacciones bidireccionales entre la enfermedad cardíaca y renal (3–7), ya que la disfunción aguda o crónica del corazón o los riñones puede exacerbar la función del otro órgano (5). Las concentraciones aumentadas de biomarcadores cardíacos son indicadores bien reconocidos de mayor riesgo cardiovascular en una amplia población de pacientes con DM2 (8)(9). La evidencia sobre el papel de los biomarcadores cardiovasculares en los resultados renales en pacientes con DM2 es escasa y proviene principalmente de un estudio de caso de cohorte anidado [n=3.385, con 439 casos (283 nefropatía, 183 retinopatía)] de la Acción en Diabetes y Enfermedad
Vascular: ensayo de evaluación controlada de liberación modificada de Preterax y Diamicron (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation, ADVANCE) (10). Este estudio encontró que el propéptido natriurético cerebral Nterminal( NT-proBNP) y la troponina T cardíaca de alta sensibilidad (TnT-us; ensayo Gen 5 en los EE.UU.) se asocian significativamente con eventos microvasculares como retinopatía diabética y nefropatía. El presente estudio de cohorte fue diseñado para determinar si los biomarcadores cardíacos e inflamatorios tradicionales, tales como TnT-us, NT-proBNP y la proteína C reactiva de alta sensibilidad (PCR-us) también pueden mejorar la identificación de pacientes con DM2 en alto riesgo de desarrollar insuficiencia renal determinada por la tasa de filtración glomerular estimada (TFGe) y la relación albúmina/creatinina urinaria (RACu).
Materiales y Metodos
Poblacion de estudio
Este estudio fue un análisis exploratorio de una cohorte de biomarcadores anidado en el estudio SAVORTIMI 53. El diseño y los resultados de SAVOR-TIMI 53 han sido publicados previamente (11)(12). Brevemente, SAVOR-TIMI 53 fue un ensayo aleatorizado, a doble ciego, controlado con placebo que examinó la eficacia cardiovascular y la seguridad de saxagliptina en 16.492 pacientes con DM2. Los pacientes elegibles tenían ≥40 años, HbA1c documentada ≥6,5% en los 6 meses previos, y tenían un alto riesgo de un evento cardiovascular con enfermedad cardiovascular establecida o factores de riesgo múltiples. Los pacientes fueron excluidos si en ese momento estaban recibiendo o habían recibido terapia con incretinas en los 6 meses anteriores, si presentaban enfermedad renal en etapa terminal y se encontraban sometidos a diálisis a largo plazo, se habían sometido a un trasplante renal o habían tenido una creatinina sérica >6,0 mg/dL. Todos los participantes dieron su consentimiento informado por escrito, y el protocolo del estudio fue aprobado por todos los comités de revisión institucional relevantes. Durante un período medio de seguimiento de 2,1 años, la saxagliptina no alteró el riesgo global de infarto de miocardio, accidente cerebrovascular y muerte cardiovascular (12), aunque hubo un aumento del 27% en el riesgo relativo de hospitalización por insuficiencia cardíaca en pacientes que recibieron saxagliptina (13). Además, la saxagliptina mejoró la RACu en comparación con el placebo (14).
Objetivos y puntos finales
El outcome primario fue la disminución en el IFGe ≥40% al final del tratamiento en comparación con el valor inicial, el cual es un punto final comúnmente utilizado en estudios recientes en DM2 (15)(16). Los outcomes adicionales incluyeron el empeoramiento en la categoría de RACu (normoalbuminuria, <30 mg/g; microalbuminuria, ≥30 mg/g a <300 mg/g y macroalbuminuria, ≥300 mg/g) al final del tratamiento y el tiempo transcurrido hasta el desarrollo del punto final compuesto, que incluye requerimiento de diálisis, trasplante renal, o una creatinina sérica >6,0 mg/dL.
Analisis de laboratorio
La evaluación de la función renal se realizó por protocolo en muestras de sangre y orina enviadas al laboratorio central (QuintilesIMS) y analizadas en la visita de selección y aleatorización y al final de tratamiento. El IFGe se calculó de acuerdo con la fórmula Modification of Diet in Renal Disease (MDRD), como se especifica en el protocolo del estudio principal. Se definió a microalbuminuria como una concentración entre 30 y 300 mg de albúmina por gramo de creatinina y a macroalbuminuria como una concentración de albúmina >300 mg por gramo de creatinina.
Se tomaron muestras de sangre por punción venosa y luego de permitir su coagulación (aproximadamente 20-30 min), se centrifugaron para obtener el suero claro (por ejemplo, 2.000 g durante 15 min). Luego, las muestras se fraccionaron en alícuotas y se congelaron a −20 °C a −80 °C dentro de los 60 min en el sitio de obtención hasta que fueron enviadas, congeladas, al Laboratorio de Ensayos Clínicos Biomarker Research/TIMI en Boston, Massachusetts, donde fueron mantenidas a una temperatura de −80 °C o inferior. Las concentraciones de TnT-us, NT-proBNP y PCR-us se midieron en muestras recogidas al azar. TnT-us se determinó mediante inmunoensayo electroquimioluminiscente de alta sensibilidad en el analizador Cobas® 6000-Roche (Roche Diagnostics). En el momento de la prueba, este ensayo se encontraba aprobado ya en la Unión Europea, pero estaba aún en fase de investigación en los EE.UU. Los límites de blanco y detección del ensayo fueron 3 ng/L y 5 ng/L, respectivamente. Los coeficientes de variación (CV) observados a 26,9 ng/L y 2.231 ng/L fueron 2,1% y 1,3%, respectivamente. Los puntos de corte de diagnóstico utilizados fueron ≥15 ng/L en hombres y ≥10 ng/L en mujeres. Estos valores representan el percentil 99 en individuos sanos; los CV en estos puntos de corte fueron <10% (17). Las concentraciones séricas de NT-proBNP se midieron en el primer descongelamiento de muestra, utilizando un inmunoensayo tipo sandwich en un analizador Cobas e601 (proBNP II, Roche Diagnostics). El rango analítico se encuentra entre 5 y 35.000 ng/L. Los CV observados a 136 ng/L y 4.513 ng/L fueron 2,8% y 2,8%, respectivamente. Los puntos de corte para determinar aumento en las concentraciones de NT-proBNP se establecieron a priori como ≥450 ng/L para aquellos sujetos menores de 50 años de edad, ≥900 ng/L para aquellos sujetos entre 50 y 75 años y ≥1.800 ng/L para aquellos sujetos mayores de 75 años de edad (18). Las concentraciones de PCR-us se determinaron con un ensayo inmunoturbidimétrico mejorado en el analizador Cobas c501 (CRP hs, Roche Diagnostics). Los CV observados a 3,8 mg/L y 10,4 mg/L fueron 3,0% y 2,3%, respectivamente. El punto de corte para determinar un aumento de la concentración se definió como >3 mg/L según las pautas para la estratificación del riesgo cardiovascular (19).
Analisis estadistico
Las características basales se resumieron utilizando medias (y DE) o medianas (y cuartiles) según correspondiese. Todas las concentraciones de biomarcadores se analizaron utilizando cuartiles (Q1-Q4). Se realizaron análisis de sensibilidad en una cohorte de pacientes sin antecedentes de insuficiencia cardíaca y TFGe>60 mL/min/1,73 m2 al inicio del estudio. Los antecedentes de insuficiencia cardíaca se evaluaron mediante un cuestionario de casillas de verificación en el formulario al inicio del estudio. Se evaluaron las correlaciones de Spearman entre todos los biomarcadores, TFGe basal, RACu, índice de masa corporal, glucosa plasmática en ayunas y HbA1c. Las tasas de eventos acumulados se calcularon en FdT por el complemento de los estimadores de supervivencia de Kaplan-Meier. Las asociaciones entre las concentraciones basales de biomarcadores y los outcomes posteriores se examinaron utilizando modelos multivariados de regresión logística y Cox. Los modelos multivariados se ajustaron por edad (variable continua), sexo, tabaquismo, raza, duración de la DM2 (<5, 5–9, 10–14, 15–19, ≥20 años), HbA1c, TFGe basal (<30, 30–60, 60–90, ≥90 mL/min/1,73 m2, y como variable continua en el análisis de sensibilidad), RACu basal (como variable continua), presión arterial sistólica (continua), infarto de miocardio previo, antecedentes de insuficiencia cardíaca, hipertensión, dislipidemia, presencia de enfermedad cardiovascular y ramas de tratamiento (saxagliptina versus placebo). Los biomarcadores se analizaron como variables continuas, clasificadas por cuartiles y por los puntos de corte preespecificados (9), los cuales fueron mencionados anteriormente.
Las mejoras pronósticas en la discriminación y la reclasificación de cada biomarcador se evaluaron mediante el estadístico C, la mejora de discriminación integrada (MDI) y la mejora de la reclasificación neta (MRN) para la tasa de eventos para cada biomarcador (20). La calibración se aseguró mediante la inspección visual de los gráficos de calibración y la prueba de Hosmer- Lemeshow. El MDI representa la diferencia en las probabilidades promedio pronosticadas entre casos y controles en un modelo clínico en comparación con el otro, mientras que el MRN en la tasa de eventos mide la probabilidad de que los pacientes se reclasifiquen apropiadamente para aumentar o disminuir el riesgo desde el umbral al agregar biomarcadores para el modelo (20).
Todos los análisis estadísticos se realizaron utilizando SAS (versión 9.4, SAS Institute) o R (versión 3.4.1, R Core Team) y el paquete R “PredictABEL” (versión 1.2–2) (21). Se consideró que los valores de p (2 colas) <0,05 indicaban significación estadística. No se realizó ningún ajuste para pruebas múltiples. Los autores tuvieron pleno acceso y asumieron toda la responsabilidad por la integridad de los datos. Todos los análisis estadísticos fueron realizados por el Grupo de Estudio TIMI.
Resultados
Poblacion estudiada
Las características basales de la cohorte de biomarcadores se muestran en la Tabla 1 del Suplemento de datos que acompaña a la versión online de este artículo en http://www.clinchem.org/content/vol65/issue6. De los 12.310 pacientes incluidos en este análisis, 8.200 (66,6%) eran hombres. La edad media fue de 65,1 (8,5) años. Un total de 7.738 (62,9%) pacientes no tenían antecedentes de insuficiencia cardíaca y presentaban una TFGe >60 mL/min/1,73 m2 al inicio del estudio. En general, 293 (2,4%) pacientes experimentaron un deterioro de ≥40% en TFGe, y 1.346 (10,9%) pacientes empeoraron en la categoría RACu. El punto final compuesto por diálisis renal, trasplante renal o creatinina sérica >6,0 mg/dL ocurrió en 79 (0,6%) pacientes. Mientras que entre los pacientes sin antecedentes de insuficiencia cardíaca y TFGe >60 mL/min/1,73 m2, 159 (2,46%) pacientes experimentaron un deterioro de ≥40% en TFGe, 799 (13,1%) pacientes empeoraron en la categoría RACu y el punto final renal compuesto ocurrió en 13 (0,17%) pacientes.
Niveles basales de biomarcadores en suero
Al inicio del estudio, las medianas y los rangos intercuartílicos (RIQ) fueron para TnT-us, 12,0 ng/L (RIQ, 8,1-18,4 ng/L); NT-proBNP, 140,8 ng/L (RIQ, 64,1–332,1 ng/L); y PCR-us, 2,4 mg/dL (RIQ, 1,1– 5,0 mg/dL). Los pacientes con concentraciones séricas de biomarcadores más altas tenían más probabilidades de tener una TFGe más baja y categorías iniciales de RACu más altas. Además, los pacientes con concentraciones séricas de PCR-us en el cuartil superior (Q4) tenían mayor peso y concentraciones de HbA1c más elevadas (ver Tablas 2-4 en el Suplemento de datos online). NT-proBNP y TnT-us correlacionaron moderada y positivamente entre sí (r=0,50; p<0,001) y mostraron una relación inversa con TFGe (r=−0,37 y r=−0,38 para NT-proBNP y TnT-us, respectivamente; ambos valores de p<0,001). Además, NT-proBNP y TnT-us correlacionaron ligera y positivamente con RACu (consultar la Tabla 5 en el Suplemento de datos online). PCR-us se correlacionó débilmente con HbA1c (r=0,15; p <0,001) pero no mostró otras correlaciones relevantes.
Concentraciones basales de biomarcadores en suero y outcomes renales
Los niveles séricos de todos los biomarcadores en el cuartil superior (Q4) se asociaron con tasas más altas de disminución ≥40% en TFGe al fin del tratamiento (Q4 vs Q1: TnT-us, 6,1% vs 1,2%; NT-proBNP, 6,4% vs 1,5%; PCR-us, 4,3% vs 2,0%; todos los valores de p para la tendencia <0,001) (Fig. 1). Luego del ajuste multivariado, las concentraciones séricas de todos los biomarcadores en Q4 se asociaron con un riesgo significativamente mayor de deterioro en TFGe [Q4 vs Q1: odds ratio (OR) ajustado TnT-us, 5,63 (3,49-9,10); NT-proBNP OR ajustado, 3,53 (2,29–5,45); OR ajustado a PCR-us, 1,84 (IC 95%, 1,27–2,68)] (Fig. 2). Se obtuvieron resultados similares en los análisis de sensibilidad cuando los análisis fueron aplicados en pacientes sin antecedentes de insuficiencia cardíaca y TFGe >60 mL/min/1,73 m2 (Fig. 2).
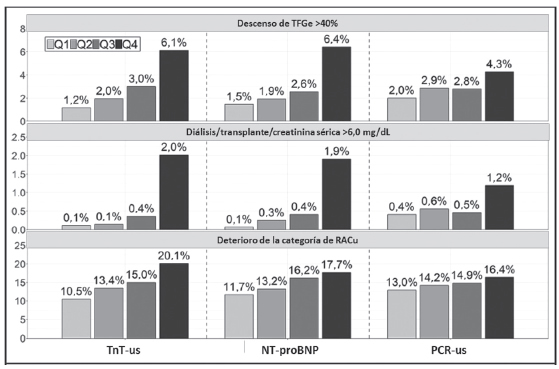
Fig. 1. Tasas de eventos de Kaplan-Meier al final del tratamiento por cuartiles de PCR-us, NT-proBNP y TnT-us para el empeoramiento de RACu, disminucion de TFGe ≥40% y el conjunto de dialisis, trasplante renal o aumento de creatinina serica >6,0 mg/dL.

Fig. 2. Odds ratio/Indice de riesgo ajustados (OR ajust / IR ajust) para las concentraciones sericas de biomarcadores en el cuartil superior vs cuartil inferior para una disminucion de la TFGe ≥40%, el conjunto de dialisis, trasplante renal o aumento de creatinina serica >6,0 mg/dL, y empeoramiento de la RACu para la cohorte total (izquierda) y en pacientes sin insuficiencia cardiaca (IC) y TFGe >60 mL/min/1,73 m2 (derecha).
De manera similar, hubo una relación en forma de gradiente de todos los biomarcadores con el punto final renal compuesto de diálisis, trasplante renal o creatinina sérica >6,0 mg/dL (Q4 vs Q1: TnT-us, 2,0% vs 0,1%; NT-proBNP, 1,9% vs 0,1%; PCR-us, 1,2% vs 0,4%; todos los valores de p para tendencia <0,001) (Fig.1). El bajo número de eventos (n=79) condujo a IC amplios para los índices de riesgo (IR) ajustados, pero se observó una asociación significativa para TnT-us [IR ajustado, 4,40 (1,24–15,55)] y NT-proBNP [IR ajustado, 7,59 (1,72–33,54)] (Fig. 2). Además, las tasas de empeoramiento de la categoría de RACu al final del tratamiento aumentaron de manera gradual con el aumento de los cuartiles de todos los biomarcadores (Q4 vs Q1: TnT-us, 20,1% vs 10,5%; NT-proBNP, 17,7% vs 11,7%; PCR-us, 16,4% vs 13,0%; todos los valores de p para la tendencia <0,001), y los niveles séricos en el cuartil superior siguieron estando significativamente asociados aún después del ajuste multivariado [Q4 vs Q1: OR ajustado para TnT-us, 2,72 (2,22–3,33); OR ajustado para NT-proBNP, 1,88 (1,55–2,29); OR ajustado para PCR-us, 1,31 (IC 95%, 1,10–1,56)] (Figs. 1 y 2).
Los OR y IR ajustados, incluyendo el IC del 95%, para cada cuartil de biomarcadores y todos los outcomes, tanto para la cohorte total como en pacientes sin antecedentes de insuficiencia cardíaca y TFGe >60 mL/ min/1,73 m2, se presentan en las Tablas 6 y 7 del Suplemento de datos online. Además, no observamos ningún efecto estadísticamente significativo por parte de la rama de tratamiento sobre las concentraciones de biomarcadores y los outcomes renales. Los resultados aparecen en las Figs. 1 a 3 del Suplemento de datos online.
Rendimiento para la diferenciacion de riesgo, analisis de reclasificacion y estratificacion de riesgo multimarcador
El rendimiento diagnóstico fue evaluado mediante una curva ROC que demostró un rendimiento de moderado a bueno de TnT-us y NT-proBNP para un deterioro ≥40% de la TFGe al fin de tratamiento [área bajo la curva (AUC): TnT-us, 0,69 (0,66–0,72); NT-proBNP, 0,68 (0,65-0,71); PCR-us, 0,58 (0,54-0,61)], y un muy buen rendimiento para el outcome compuesto que incluyó diálisis, trasplante renal o creatinina sérica >6,0 mg/dL [AUC: TnT-us, 0,83 (0,77-0,90); NT-proBNP, 0,82 (0,76-0,88); PCR-us, 0,62 (0,55–0,68)], mientras que PCR-us demostró tener poca eficacia diagnóstica para estos outcomes clínicos (Tabla 1).
Tabla 1. Estadistico C (IC del 95%) con las respectivas areas debajo de la curva (AUC) para TnT-us, NT-proBNP, PCR-us, solo covariables clinicas, y un modelo combinado de marcadores multiples / covariables clinicas con el ΔAUC (entre covariables clinicas/marcadores multiples combinadas y el modelo de solo covariables clinicas).

En un modelo multimarcador ajustado de forma robusta (que incluye los 3 biomarcadores en el modelo), TnT-us [IR ajustado por el incremento en una desviación estándar (DE) del biomarcador transformado logarítmicamente, 1,62 (1,42–1,86)] y NT-proBNP [IR ajustado por el incremento en 1-DE del biomarcador transformado logarítmicamente, 1,50 (1,28-1,76)] se asociaron independientemente con un empeoramiento ≥40% de la TFGe; además, los 3 biomarcadores se asociaron significativamente con un deterioro en la categoría de RACu (p<0,01 en todos los casos) (Fig. 3). Además, hubo mayor riesgo a mayor número de biomarcadores aumentados según los valores de corte especificados previamente (Fig. 4).

Fig. 3. Modelo de marcadores multiples ajustado.
OR e IR se informan por aumento de 1 U en biomarcadores estandarizados y transformados logaritmicamente. OR ajustado/IR ajustado, OR/IR ajustado.

Fig. 4. Score de biomarcadores ajustado.
Numeros crecientes de biomarcadores aumentados segun los puntos de corte preestablecidos (TnT-us: hombre, >15; mujer, >10 ng/L; NT-proBNP: <50 anos, ≥450; 50-75 anos, ≥900; ≥75 anos, ≥1.800 ng/L; PCR-us: >3 mg/dL) se asociaron con un mayor riesgo.
La adición de los 3 biomarcadores a las covariables clínicas utilizadas para el ajuste resultó en una mejora significativa del AUC para la discriminación de un empeoramiento ≥40% en la TFGe (Ä = 0,04; p <0,001) y para deterioro de la categoría de RACu (Ä=0,04; p<0,001). En un análisis de sensibilidad que examinó solo pacientes sin antecedentes de insuficiencia cardíaca y TFGe>60 mL/min/1,73 m2, se encontraron estadísticos C consistentes (Tabla 8 del Suplemento de datos online). Los estadísticos C univariados para las covariables clínicas que se sabe que son marcadores de riesgo tradicionales, se muestran en la Tabla 9 del Suplemento de datos online. Además, los análisis de reclasificación muestran una mejora en la discriminación de riesgo para una disminución en la TFGe ≥40% [tasa de eventos MRN, 0,0712 (0,0213–0,1211); MDI, 0,0078 (0,0033–0,0124)] y deterioro de RACu [tasa de eventos MRN, 0,0537 (0,0269– 0,0806); MDI, 0,0118 (0,0092-0,0143)] cuando se agregó TnT-us al mismo modelo clínico (Tabla 9 del Suplemento de datos online).
Además, el MRN en la tasa de eventos y el MDI mostraron una discriminación de riesgo mayor para de disminución en TFGe ≥40% al final del tratamiento cuando se agregó a NT-proBNP al mismo modelo [MRN, 0,0492 (0,0004-0,098); MDI, 0,0053 (0,0012– 0,0093)] (Tabla 10 del Suplemento de datos online).
Discusion
El hallazgo más importante de este estudio fue que concentraciones más elevadas de TnT-us, NT-proBNP y PCR-us en suero al comienzo del estudio se asociaron significativamente con una peor función renal al inicio del estudio y con un mayor deterioro en pacientes con DM2 y antecedentes de enfermedad cardiovascular o con alto riesgo de enfermedad cardiovascular. Los biomarcadores de la necrosis miocárdica (TnT-us) y el estrés hemodinámico (NT-proBNP) mostraron un rendimiento considerablemente superior al de PCR-us, lo que sugiere que la evidencia de lesión miocárdica y estrés hemodinámico proporciona un mejor enfoque para identificar pacientes con riesgo de deterioro renal, que los procesos inflamatorios evaluados por PCR. Los 3 biomarcadores se asociaron más fuertemente con determinantes más severos de la función renal (como una caída de la TFGe, o el conglomerado de terapia de reemplazo renal, o un incremento de la creatinina sérica >6,0 mg/dL) que con el simple empeoramiento de RACu. Además, los eventos que componen el conglomerado de terapia de reemplazo renal ocurrieron casi exclusivamente en pacientes con concentraciones de biomarcadores en el cuartil superior. Esta relación persistió aún después de ajustar por las principales variables confundidoras o cuando se testeó en pacientes sin antecedentes de insuficiencia cardíaca y un TFGe >60 mL/min/1,73 m2, lo que indica que estos biomarcadores proporcionan información pronóstica incremental.
Con los avances recientes en el tratamiento farmacológico de pacientes con DM2, como los agonistas del receptor del péptido similar al glucagón-1 (GLP-1, glucagon-like peptide 1 receptor) (22)(23) o los inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT2, sodium-glucose cotransporter-2) (15)(24), se ha logrado un éxito sustancial en la prevención de eventos cardiovasculares adversos y en la prolongación de la vida. Al mismo tiempo, los pacientes están expuestos a una mayor duración de la hiperglucemia que conduce a complicaciones microvasculares a largo plazo a nivel cardíaco y renal (1)(6). Ronco y colaboradores sugirieron que esta interacción es bidireccional (5). Las vías fisiopatológicas son multifactoriales, complejas e incluyen deterioro hemodinámico, activación neurohormonal, disfunción endotelial e inflamación sistémica (3)(6).
Se han encontrado pocos marcadores clínicos y de laboratorio para el pronóstico de eventos microvasculares de disfunción renal de real utilidad clínica (25) (26) más allá de la determinación de creatinina sérica o albúmina urinaria (27). Por el contrario, los biomarcadores cardíacos e inflamatorios son herramientas bien reconocidas para mejorar la estratificación de riesgo de eventos cardiovasculares en pacientes con DM2 (8)(9). Estos resultados amplían la utilidad de la medición de biomarcadores cardíacos tradicionales en pacientes con DM2, ya que mejorarán la estratificación del riesgo macro y microvascular. Se necesitan estudios prospectivos para determinar si la utilización de biomarcadores para conducir a decisiones terapéuticas específicas podría mejorar los outcomes renales. Sin embargo, los reportes sobre protección renal mediante la reducción de la progresión de albuminuria con agonistas del receptor del péptido similar al glucagón-1 como liraglutida (28) y semaglutida (22), así como outcomes renales “duros” como el conjunto compuesto por reducción de la TFGe ≥40%, terapia de reemplazo renal o muerte renal con inhibidores del cotransportador de sodio-glucosa tipo 2, como la empagliflozina (29) y la canagliflozina (15), brindan la oportunidad de identificar si existen interacciones específicas de tratamiento entre los biomarcadores y la terapia (16).
Los estudios previos sobre biomarcadores cardiovasculares y outcomes renales son escasos y se limitan a estudios de tipo caso-control y de cohorte. Nuestros resultados en más de 12.000 pacientes corroboran los resultados de un estudio de cohorte de casos del ensayo ADVANCE (n = 3.385) que estudia NT-proBNP y TnT-us (10). En ese importante estudio, Welsh y sus colegas encontraron una asociación significativa entre los biomarcadores cardíacos y la retinopatía y nefropatía diabética. Los efectos precisos son difíciles de comparar directamente con nuestros resultados debido a que los puntos finales son ligeramente diferentes, el diseño de cohorte de casos, el riesgo cardiovascular sustancialmente mayor en la cohorte de biomarcadores SAVOR-TIMI 53, de mayor número de pacientes, y luego de la utilización de métodos estadísticos contemporáneos como MRN a la tasa de eventos e MDI. Un pequeño estudio caso-control que incluyó 33 pares de pacientes en la cohorte hipertensa del estudio de Prevención de Enfermedades Renales y Vasculares en Etapa Final (PREVEND, Prevention of Renal and Vascular End-stage Disease) sugirió que TnT-us se asocia de forma independiente con la incidencia de microalbuminuria (30). Sin embargo, su asociación fue más débil con puntos finales renales duros. La microalbuminuria es una manifestación clínica temprana de la nefropatía diabética y a menudo es considerada como un signo de lesión glomerular. Sin embargo, la llamada “hipótesis de Steno” propuso que la albuminuria también puede ser un signo de daño vascular que conduce a un aumento de la filtración permeable a la albúmina (31)(32), apoyando así la relación entre los biomarcadores cardiovasculares y la enfermedad renal. De hecho, se ha demostrado que la microalbuminuria se asocia con una mayor permeabilidad a las macromoléculas del lecho vascular periférico (33).
Este estudio se beneficia de una cohorte de estudio grande y bien caracterizada, no obstante se deben abordar varias limitaciones. Primero, los biomarcadores, particularmente la troponina y los péptidos natriuréticos, aumentan con la disminución de la función renal. Sin embargo, observamos resultados similares en los análisis de sensibilidad en pacientes sin antecedentes de insuficiencia cardíaca y una TFGe>60 mL/min/1,73 m2. En segundo lugar, por razones de factibilidad y practicidad, la RACu se determinó utilizando una sola muestra de orina en lugar de mediciones repetidas o, idealmente, recolecciones de orina de 24 h; por lo tanto, los resultados obtenidos pueden reflejar una variación diaria intraindividual la cual no pudo tenerse en cuenta. Además, en el estudio SAVOR-TIMI 53, la información clínica sobre pacientes con insuficiencia cardíaca es limitada, lo que impide una mayor caracterización de estos pacientes. Otra limitación significativa es la duración relativamente corta del estudio en términos de outcomes renales. Un estudio de mayor duración permitiría una mayor acumulación de eventos. Por último, aunque pueden existir posibles factores confundidores residuales en nuestros hallazgos, la solidez de nuestros resultados está respaldada por una asociación cualitativa entre biomarcadores cardíacos y outcomes microvasculares publicados en la literatura. También se debe enfatizar que el diseño del presente estudio fue de carácter exploratorio; por lo tanto, no se realizaron ajustes para pruebas múltiples.
En conclusión, en 12.310 pacientes con DM2 y antecedentes de enfermedad cardiovascular, o en riesgo de enfermedad cardiovascular, el aumento de los niveles basales de TnT-us, NT-proBNP y PCR-us se asociaron con un posterior deterioro de la función renal y albuminuria. Por lo tanto, la evaluación de biomarcadores cardíacos e inflamatorios puede proporcionar una mejor evaluación del riesgo de complicaciones microvasculares, tal como el deterioro renal, además de los outcomes cardiovasculares. Se requieren estudios adicionales para identificar potenciales interacciones de tratamiento entre las terapias renoprotectoras y los niveles basales de estos biomarcadores cardiovasculares.
Contribuciones de los autores
Todos los autores confirmaron que han contribuido al contenido intelectual de este trabajo y que han cumplido los siguientes cuatro requisitos: (a) contribuciones significativas a la concepción y diseño, adquisición, análisis e interpretación de datos; (b) redactar o revisar el artículo en cuanto al contenido intelectual; (c) aprobación final del artículo publicado; y (d) aceptar ser responsable de todos los aspectos del artículo, asegurando así que las preguntas relacionadas con la precisión o integridad de cualquier parte del artículo se investiguen y resuelvan adecuadamente. T.A. Zelniker contribuyó al diseño del estudio, la interpretación de los datos y la redacción del manuscrito. D.A. Morrow contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. O. Mosenzon contribuyó al diseño del estudio, la recopilación e interpretación de los datos y la revisión crítica del manuscrito. Y. Gurmu contribuyó al diseño del estudio, el análisis estadístico y la revisión crítica del manuscrito. K. Im contribuyó al diseño del estudio, análisis estadístico y revisión crítica del manuscrito. A. Cahn contribuyó al diseño del estudio, la recopilación e interpretación de los datos y la revisión crítica del manuscrito. I. Raz contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. P.G. Steg contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. L.A.Liter contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. E. Braunwald contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. D.L. Bhatt contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. B.M. Scirica contribuyó al diseño del estudio, la recopilación de datos, la interpretación de los datos y la revisión crítica del manuscrito. B.M. Scirica es el garante de este trabajo y, como tal, tuvo acceso total a todos los datos del estudio y se responsabiliza por la integridad de los datos y la precisión del análisis de los datos.
Declaraciones o posibles conflictos de intereses de los autores: Tras la presentación del manuscrito, todos los autores completaron el formulario de declaraciones del autor. Declaraciones y/o posibles conflictos de intereses:
Empleo o liderazgo: ninguno declarado.
Rol consultor o asesor: D.A. Morrow, Laboratorios Abbott, Aralez, AstraZeneca, Bayer Pharma, Peloton, Roche Diagnostics, Verseon; O. Mosenzon, AstraZeneca, Bristol Myers Squibb; A. Cahn, Sanofi, Novonordisk, MSD, Elli Lilly, AstraZeneca, BI; I. Raz, AstraZeneca, Bristol Myers Squibb; P.G. Steg, Amgen, Amarin, Novartis, Sanofi, BMS, Novo Nordisk; L.A. Leiter, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Janssen, Merck, Novo Nordisk, Sanofi, Servier; B.M. Scirica, AstraZeneca, Biogen, Boehringer Ingelheim, Convance, Dr. Reddy’ Laboratory, Eisai, Elsevier Practice Update, GlaxoSmithKline, Lexicon, Merck, NovoNordisk, Sanofi, St. Jude’s Medical.
Propiedad de acciones: Ninguna declarada.
Honorarios: A. Cahn, Sanofi, Novonordisk, MSD, Elli Lilly, AstraZeneca, BI; I. Raz, AstraZeneca, Bristol Myers Squibb; P.G. Steg, Pfizer; L. Leiter, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Janssen, Merck, Novo Nordisk, Sanofi, Servier; D.L. Bhatt, Baim Clinical Research Institute - investigación financiada por Boehringer Ingelheim.
Financiación de la investigación: Roche Diagnostics proporcionó soporte para reactivos. El estudio SAVOR-TIMI 53 fue financiado por AstraZeneca y Bristol-Myers Squibb. T.A. Zelniker, Deutsche Forschungsgemeinschaft (ZE 1109 / 1-1); D.L. Bhatt, AstraZeneca, Bristol-Myers Squibb.
Testimonio de expertos: B.M. Scirica, AbbVie.
Patentes: ninguna declarada.
Otra remuneración: T.A. Zelniker, becas de la Fundación Alemana de Investigación (Deutsche Forschungsgemeinschaft, ZE 1109 / 1-1), becas de investigación de Astra Zeneca a su institución durante la realización del estudio. D.A. Morrow, subvenciones de AstraZeneca, durante la realización del estudio; subvenciones y honorarios personales de Abbott Laboratories, subvenciones de Amgen, subvenciones y honorarios personales de AstraZeneca, subvenciones de Eisai, subvenciones y honorarios personales de GlaxoSmithKline, subvenciones y honorarios personales de Merck, subvenciones de Novartis, subvenciones y honorarios personales de Roche Diagnostics, personal honorarios de Peloton, honorarios personales de Verseon, honorarios personales de Bayer Pharma, honorarios personales de InCarda, honorarios personales de Aralez, subvenciones de Medicines Company, fuera del trabajo presentado. O. Mosenzon, subsidios y honorarios personales de AstraZeneca, subsidios y honorarios personales de Bristol-Myers Squibb, durante la realización del estudio; honorarios personales de NovoNordisk, honorarios personales de Eli Lilly, honorarios personales de Sanofi, honorarios personales de Merck Sharp & Dohme, honorarios personales de Boehringer Ingelheim, honorarios personales de Jansen y Jansen, honorarios personales de Novartis, fuera del trabajo presentado. Y. Gurmu, becas de Astra Zeneca, durante la realización del estudio. Dr. Im, becas de Astra Zeneca, durante la realización del estudio. A. Cahn, subvenciones y honorarios personales de Astra Zeneca, honorarios personales de Elli Lilly, honorarios personales de NovoNordisk, honorarios personales de Sanofi, honorarios personales de MSD, honorarios personales de Boehringher Ingelheim, honorarios personales y otras de Glucome, honorarios personales de Medial Earlysign, fuera del trabajo presentado. I. Raz, honorarios personales de AstraZeneca, honorarios personales de Bristol-Myers Squibb, durante la realización del estudio; honorarios personales de Boehringer Ingelheim, honorarios personales de Concenter BioPharma / Silkim LTd, honorarios personales de Eli Lilly and Company, honorarios personales de Merck Sharp & Dohme Limited, honorarios personales de Novo Nordisk, Inc., honorarios personales y otros de Orgenesis, honorarios personales de Pfizer, honorarios personales de Sanofi, honorarios personales de SmartZyme Innovation Ltd, honorarios personales de Panaxia, honorarios personales de FuturRx Ltd, honorarios personales de Insuline Medical, honorarios personales de Medial EarlySign Ltd, honorarios personales de CamerEyes, honorarios personales de Exscopia, Dermal Biomics Inc. y Johnson & Johnson, honorarios personales de Novartis Pharma AG, honorarios personales de Teva, honorarios personales de Glucome Ltd, honorarios personales de DarioHealth, fuera del trabajo presentado, gastos de viaje y viajes a reuniones para SAVOR. P.G. Steg, honorarios personales y apoyo no financiero de AstraZeneca, durante la realización del estudio; subvenciones y honorarios personales de Bayer / Janssen, subvenciones y honorarios personales de Merck, subvenciones y honorarios personales de Sanofi, subvenciones y honorarios personales de Amarin, honorarios personales de Amgen, honorarios personales de Bristol Myers Squibb, honorarios personales de Boehringer-Ingelheim, personal honorarios de Pfizer, honorarios personales de Novartis, honorarios personales de Regeneron, honorarios personales de Lilly, honorarios personales de AstraZeneca, subsidios y honorarios personales de Servier, fuera del trabajo presentado. L. Leiter, subvenciones y honorarios personales de AstraZeneca, durante la realización del estudio; subsidios y honorarios personales de AstraZeneca, subsidios y honorarios personales de Boehringer Ingelheim, subsidios y honorarios personales de Eli Lilly, subsidios y honorarios personales de Janssen, subsidios y honorarios personales de Merck, subsidios y honorarios personales de NovoNordisk, subsidios y honorarios personales de Sanofi, honorarios personales de Servier, subvenciones de GSK, fuera del trabajo presentado. E. Braunwald, becas de Astra Zeneca, durante la realización del estudio; subvenciones de Daiichi Sankyo, subvenciones de GlaxoSmithKline, subvenciones de Merck, subvenciones de Novartis, honorarios personales de Theravance, honorarios personales de Cardurion, honorarios personales de MyoKardia, otras de Novartis, otras de Medicines Company, otras de Merck, honorarios personales de Medscape, fuera del trabajo presentado. D.L. Bhatt, subvenciones de Astra- Zeneca, subvenciones de Bristol-Myers Squibb, durante la realización del estudio; becas de Amarin, becas de AstraZeneca, becas de Bristol-Myers Squibb, becas de Eisai, becas de Ethicon, becas de Medtronic, becas de Sanofi Aventis, becas de The Medicines Company, otras de FlowCo, otras de PLx Pharma, otras de Takeda, honorarios personales del Duke Clinical Research Institute, honorarios personales de Mayo Clinic, honorarios personales del Instituto de Investigación de Salud de la Población, honorarios personales y apoyo no financiero del American College of Cardiology, honorarios personales de Belvoir Publications, honorarios personales de Slack Publications, honorarios personales de WebMD, honorarios personales de Elsevier, otros de Medscape Cardiology, otros de Regado Biosciences, otros del Boston VA Research Institute, honorarios personales y apoyo no financiero de la Society of Cardiovascular Patient Care, apoyo no financiero de la American Heart Association, honorarios personales de HMP Global, subsidios de Roche, honorarios personales del Harvard Clinical Research Institute (ahora Baim Institute for Clinical R esearch), otro de Clinical Cardiology, honorarios personales del Journal of the American College of Cardiology, otro de VA, subsidios de Pfizer, subsidios de Forest Laboratories / AstraZeneca, subsidios de Ischemix, otros de St. Jude Medical (ahora Abbott), otros de Biotronik, otro de Cardax, otro de American College of Cardiology, otro de Boston Scientific, subsidios de Amgen, subsidios de Lilly, subsidios de Chiesi, subsidios de Ironwood, honorarios personales de la Clínica Cleveland, honorarios personales de la Escuela de Medicina Mount Sinai, otro de Merck, subsidios de Abbott, subsidios de Regeneron, otros de Svelte, subsidios de PhaseBio, subsidios de Idorsia, subsidios de Synaptic, honorarios personales de TobeSoft, honorarios personales y otros de Boehringer Ingelheim, honorarios personales de Bayer, fuera del trabajo presentado. B.M. Scirica, becas de Astra Zeneca, durante la realización del estudio; becas de Eisai, becas de Novartis, becas de Merck Consulting, honorarios personales de Astra Zeneca, honorarios personales de Biogen Idec, honorarios personales de Boehringer Ingelheim, honorarios personales del Dr. Reddy’s Laboratory, honorarios personales de Eisai, honorarios personales de Elsevier Practice Update Cardiología, honorarios personales de NovoNordisk, honorarios personales de Sanofi, honorarios personales de St. Jude’s Medical, honorarios personales y otros de Health [at] Scale, fuera del trabajo presentado.
Rol del patrocinador: Las organizaciones financiadoras jugaron un rol directo en el diseño del estudio. Las organizaciones de financiación no desempeñaron ningún papel en la elección de los pacientes inscriptos, la revisión e interpretación de los datos, la preparación del manuscrito o la aprobación final del manuscrito.
Comité ejecutivo: Eugene Braunwald (presidente del estudio), Deepak L. Bhatt (co-investigador principal), Itamar Raz (co-investigador principal), Jaime A. Davidson, Robert Frederich (sin voto), Boaz Hirshberg (sin voto), Ph. Gabriel Steg.
© 2019 American Association for Clinical Chemistry.
1. Gregg EW, Li Y, Wang J, Burrows NR, Ali MK, Rolka D, et al. Changes in diabetes-related complications in the United States, 1990–2010. N Engl J Med 2014; 370: 1.514–23.
2. Porrini E, Ruggenenti P, Mogensen CE, Barlovic DP, Praga M, Cruzado JM, et al. Non-proteinuric pathways in loss of renal function in patients with type 2 diabetes. Lancet Diabetes Endocrinol 2015; 3: 382–91.
3. Braam B, Joles JA, Danishwar AH, Gaillard CA. Cardiorenal syndrome—current understanding and future perspectives. Nat Rev Nephrol 2014; 10: 48–55.
4. Bock JS, Gottlieb SS. Cardiorenal syndrome: new perspectives. Circulation 2010; 121: 2.592–600.
5. Ronco C, McCullough P, Anker SD, Anand I, Aspromonte N, Bagshaw SM, et al. Cardio-renal syndromes: report from the consensus conference of the acute dialysis quality initiative. Eur Heart J 2010; 31: 703–11.
6. Hatamizadeh P, Fonarow GC, Budoff MJ, Darabian S, Kovesdy CP, Kalantar-Zadeh K. Cardiorenal syndrome: pathophysiology and potential targets for clinical management. Nat Rev Nephrol 2013; 9: 99–111.
7. Scirica BM, Mosenzon O, Bhatt DL, Udell JA, Steg PG, McGuire DK, et al. Cardiovascular outcomes according to urinary albumin and kidney disease in patients with type 2 diabetes at high cardiovascular risk: observations from the SAVOR-TIMI53 trial. JAMA Cardiol 2018; 3: 155–63.
8. Everett BM, Brooks MM, Vlachos HE, Chaitman BR, Frye RL, Bhatt DL, Group BDS. Troponin and cardiac events in stable ischemic heart disease and diabetes. N Engl J Med 2015; 373: 610–20.
9. Scirica BM, Bhatt DL, Braunwald E, Raz I, Cavender MA, Im K, et al. Prognostic implications of biomarker assessments in patients with type 2 diabetes at high cardiovascular risk: a secondary analysis of a randomized clinical trial. JAMA Cardiol 2016; 1: 989–98.
10. Welsh P, Woodward M, Hillis GS, Li Q, Marre M, Williams B, et al. Do cardiac biomarkers NT-proBNP and hsTnT predict microvascular events in patients with type 2 diabetes? Results from the ADVANCE trial. Diabetes Care 2014; 37: 2202–10.
11. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al. The design and rationale of the saxagliptin assessment of vascular outcomes recorded in patients with diabetes mellitus-thrombolysis in myocardial infarction (SAVOR-TIMI) 53 study. Am Heart J 2011; 162: 818–25.e6.
12. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1.317–26.
13. Scirica BM, Braunwald E, Raz I, Cavender MA, Morrow DA, Jarolim P, et al. Heart failure, saxagliptin, and diabetes mellitus: observations from the SAVOR-TIMI 53 randomized trial. Circulation 2014; 130: 1.579–88.
14. Mosenzon O, Leibowitz G, Bhatt DL, Cahn A, Hirshberg B, Wei C, et al. Effect of saxagliptin on renal outcomes in the SAVOR-TIMI 53 trial. Diabetes Care 2017; 40: 69–76.
15. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377: 644–57.
16. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, et al. The design and rationale for the dapagliflozin effect on cardiovascular events (DECLARE)–TIMI 58 trial. Am Heart J 2018; 200: 83–9.
17. Gore MO, Seliger SL, Defilippi CR, Nambi V, Christenson RH, Hashim IA, et al. Age- and sex-dependent upper reference limits for the high-sensitivity cardiac troponin T assay. J Am Coll Cardiol 2014; 63: 1.441–8.
18. ProBNP II [package insert]. Indianapolis (IN): Roche Diagnostics; 2010.Google Scholar. [ Links ]
19. Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd., Criqui M, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107: 499–511.
20. Pencina MJ, Steyerberg EW, D’Agostino RB Sr. Net reclassification index at event rate: properties and relationships. Stat Med 2017; 36: 4.455–67.
21. Kundu S, Aulchenko YS, van Duijn CM, Janssens AC. Predictabel: An R package for the assessment of risk prediction models. Eur J Epidemiol 2011; 26: 261–4.
22. Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jodar E, Leiter LA, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375: 1.834–44.
23. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375: 311–22.
24. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2.117–28.
25. Titan SM, Zatz R, Graciolli FG, dos Reis LM, Barros RT, Jorgetti V, Moyses RM. FGF-23 as a predictor of renal outcome in diabetic nephropathy. Clin J Am Soc Nephrol 2011; 6: 241–7.
26. Krolewski AS, Warram JH, Forsblom C, Smiles AM, Thorn L, Skupien J, et al. Serum concentration of cystatin C and risk of end-stage renal disease in diabetes. Diabetes Care 2012; 35: 2.311–6.
27. Ninomiya T, Perkovic V, de Galan BE, Zoungas S, Pillai A, Jardine M, et al. Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes. J Am Soc Nephrol 2009; 20: 1.813–21.
28. Mann JFE, Orsted DD, Brown-Frandsen K, Marso SP, Poulter NR, Rasmussen S, et al. Liraglutide and renal outcomes in type 2 diabetes. N Engl J Med 2017; 377: 839–48.
29. Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016; 375: 323–34.
30. Hellemons ME, Lambers Heerspink HJ, Gansevoort RT, de Zeeuw D, Bakker SJ. High-sensitivity troponin T predicts worsening of albuminuria in hypertension; results of a nested case-control study with confirmation in diabetes. J Hypertens 2013; 31: 805–12.
31. Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects widespread vascular damage. The Steno hypothesis. Diabetologia 1989; 32: 219–26.
32. de Zeeuw D, Parving HH, Henning RH. Microalbuminuria as an early marker for cardiovascular disease. J Am Soc Nephrol 2006; 17: 2.100–5.
33. Feldt-Rasmussen B. Increased transcapillary escape rate of albumin in type 1 (insulin-dependent) diabetic patients with microalbuminuria. Diabetologia 1986; 29: 282–6.














