Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.2 La Plata jun. 2020
BIOQUÍMICA CLÍNICA
Comparación de dos tipos de recipientes para analizar gases en sangre y otras mediciones relacionadas contra jeringas con heparinato de litio liofilizado
Cleo Irene Bocio1*, Johana Aylen García1, Gladys Dotto1, Florencia Graciela Roch2, Viviana Noelia Neme Mazzuchi1, Carolina Jachuf1, María Lía Torres2
1 Bioquímica Especialista en Química Clínica.
2 Bioquímica Especialista en Química Clínica con orientación en Nefrología y Medio Interno.
Servicio de Bioquímica. Hospital Córdoba, Libertad 2051 esq. Avenida Patria, 5000 Córdoba, Argentina.
* Autor para correspondencia.
Correspondencia Bioq. CLEO IRENE BOCIO Agustín Patiño 288 5008 Lomas de San Martin, Córdoba, Argentina. Correo electrónico: cleo_bociocba@hotmail.com
Resumen
El estudio de gases en sangre involucra pruebas relacionadas con el equilibrio ácido-base y estado de oxigenación (pH, pO2, SO2, pCO2, HCO3 -). Además, en los equipos multiparamétricos se realizan otras determinaciones (mediciones relacionadas) como: Na+, K+, Cl-, Ca2+, glucosa y lactato. El objetivo de este trabajo fue comparar los resultados de medición de dos tipos de recipientes (tipo 2: jeringa preparada en el laboratorio con heparinato de Na+ líquido diluido y tipo 3: microtubo con heparinato de Li líquido) contra el recipiente recomendado por el CLSI en su guía 46-A2 (tipo 1: jeringa con heparinato de Li liofilizado balanceado con zinc). El análisis se hizo desde un punto de vista estadístico y clínico para establecer la posibilidad de usar indistintamente estos tres tipos de recipientes. Se analizaron un total de 254 muestras. Para evaluar la aceptación clínica de los resultados se tomó como estándar de calidad la variabilidad biológica. No se encontraron diferencias clínicamente significativas en los analitos del recipiente tipo 2 respecto del tipo 1, excepto para Ca2+. Se rechazaron desde el punto de vista clínico varios analitos del recipiente tipo 3. En conclusión, el uso del recipiente tipo 3 fue inapropiado. Sin embargo, el recipiente tipo 2 sería apto para el análisis de este tipo de muestras.
Palabras clave: Gases en sangre; Calidad preanalítica; Heparinato de litio liofilizado; Heparinato de Na+ líquido; Calcio iónico.
Abstract
Comparison of two types of containers to analyze blood gases and other related measurements against syringes with lyophilized lithium heparinate
Blood gas analysis involves tests related to the acid-base balance and oxygenation state (pH, pO2, SO2, pCO2, HCO3 -). In multiparametric equipment, some ion and metabolite (related measurements) are performed: Na+, K+, Cl-, Ca²+, glucose and lactate. The objective of this study was to compare two types of containers (type 2: syringe prepared in the laboratory with diluted liquid sodium heparinate and type 3: microtube with liquid lithium heparinate) against the container recommended by CLSI in its guide 46-A2 (type 1: syringe with lyophilized lithium heparinate balanced with inc). The analysis was made from a statistical and clinical point of view to establish the possibility of indiscriminately using these three types of containers. A total of 254 samples were analyzed. To establish the clinical acceptance of the results, the biological variability quality standard was used. No clinically significant differences were found in the analytes of the type 2 container compared to type 1, except for Ca+. Several analytes of the type 3 container were rejected from the clinical point of view. In conclusion, the use of the type 3 container is inappropriate; however, the type 2 container would be suitable for the analysis of this type of samples.
Keywords: Blood gas analysis; Pre-analytical quality; Lyophilized lithium heparinate; Liquid Na+ heparinate; Ionic calcium.
Resumo
Comparação de dois tipos de recipientes para analisar gases em sangue e outras medições relacionadas contra seringas com heparinato de lítio liofilizado
O estudo de gases em sangue envolve testes relacionados com o equilíbrio ácido-base e estado de oxigenação (pH, pO2, SO2, pCO2, HCO3 -). Além disso, nos equipamentos multiparâmetros, outras determinações (medições relacionadas) como: Na+ , K+, Cl-, Ca2+, glicose e lactato são realizadas. O objetivo deste trabalho foi comparar os resultados de medição de dois tipos de recipientes (tipo 2: seringa preparada no laboratório com heparinato de Na+ líquido diluído e tipo 3: microtubo com heparinato de Li líquido) contra o recipiente recomendado pelo CLSI em seu guia 46-A2 (tipo 1: seringa com heparinato de Li liofilizado equilibrado com zinco). A análise foi feita do ponto de vista estatístico e clínico, para estabelecer a possibilidade de utilização indiscriminada desses três tipos de recipientes. Um total de 254 amostras foram analisadas. Para avaliar a aceitação clínica dos resultados, a variabilidade biológica foi tomada como padrão de qualidade. Não foram encontradas diferenças clinicamente significativas nos analitos do recipiente tipo 2 em relação ao tipo 1, exceto para Ca²+. Vários analitos do recipiente tipo 3 foram rejeitados do ponto de vista clínico. Em conclusão, o uso do contêiner tipo 3 foi inadequado. No entanto, o recipiente tipo 2 seria apto para a análise deste tipo de amostras.
Palavras-chave: Gases em sangue; Qualidade pré-analítica; Heparinato de lítio liofilizado; Heparinato de Na+ líquido; Cálcio iônico.
Introducción
El estudio de gases en sangre (GS) es una de las herramientas más utilizadas por los médicos tanto para la evaluación del estado clínico, como para el manejo del paciente crítico en emergencias y unidades de cuidados intensivos. El estudio de GS comprende pH, pO₂ (presión parcial de oxígeno), SO₂ (saturación de oxígeno), pCO₂ (presión parcial de anhídrido carbónico), HCO₃⁻ (bicarbonato); además, en los equipos multiparamétricos actuales se pueden medir otros analitos (mediciones relacionadas): Na⁺, K⁺, Cl⁻, Ca2⁺, glucosa y lactato, con la ventaja de que se informan al mismo tiempo que los GS. Esto agrega valor a la hora de interpretar el medio interno en situaciones de urgencia. Dentro de las etapas que comprende el proceso del laboratorio, la fase preanalítica es donde se produce el mayor número de errores, aproximadamente el 70% del total que afectan a un resultado. Los aspectos que más impactan a la medición de GS y las mediciones relacionadas son: el tipo de recipiente y anticoagulante utilizado, las condiciones de almacenamiento, el tiempo de procesamiento, la homogeneización y la presencia de burbujas o cámara de aire en la muestra (1-3).
Históricamente el anticoagulante de elección para la determinación de GS fue el heparinato de Na+ líquido (4). Debido a los posibles efectos de dilución, quelación y adición de iones producidos por éste, que impactan en el resultado de GS y en especial en las mediciones relacionadas, el Clinical & Laboratory Standards Institute (CLSI) en su guía 46-A2 Blood Gas and pH Analysis and Related Measurements recomienda el uso de jeringas comerciales con heparinato de Li liofilizado balanceado con iones (5). Sin embargo, por cuestiones económicas aún se utilizan en nuestro medio jeringas preparadas con heparinato de Na+ líquido puro o diluido. Además, en algunos laboratorios de nuestra región se emplean tubos comerciales que contienen heparinato de Li líquido, diseñados para la medición de analitos de química básica. En el presente estudio se evaluaron dos tipos de recipientes respecto a la jeringa recomendada. Las otras variables preanalíticas fueron estandarizadas para evitar su impacto en los resultados.
El objetivo del presente trabajo fue comparar desde un punto de vista estadístico y clínico, dos tipos de recipientes de muestras usadas en nuestro medio para medición de GS y mediciones relacionadas: jeringas de 5 mL con heparinato de Na líquido diluido 1/7, y microtubos comerciales con heparinato de Li líquido, contra jeringas comerciales con heparinato de Li liofilizado, recipiente recomendado por el CLSI.
Materiales y Métodos
Se realizó un estudio observacional prospectivo y transversal, en el que se tomaron muestras a pacientes mayores de 18 años de edad, de ambos sexos, internados en el Hospital Córdoba a los que se les solicitó el estudio de GS y mediciones relacionadas en el mes de enero de 2018. Se obtuvieron consentimientos informados de los pacientes y el estudio fue aprobado por el Comité de Capacitación, Docencia y Ética de la Investigación del Hospital.
Para la recolección de las muestras se utilizaron tres tipos de recipientes. El tipo 1 fueron jeringas comerciales de 1 mL con heparinato de Li liofilizado balanceado con zinc (marca comercial Nipro), a volumen completo. El tipo 2 fueron jeringas preparadas en el laboratorio, de 5 mL, con el agregado de heparinato de Na+ líquido de 5.000 UI/mL diluido 1/7 (una parte de heparinato de Na+, 3 partes de agua desionizada y 3 partes de solución fisiológica); se obtuvo una concentración final de 15-20 UI de heparinato por mL de sangre, según recomienda el CLSI en la guía 46-A2. Se dispensó una gota de heparinato diluido en la jeringas de 5 mL antes de su uso y se retiró el excedente para que solo quedara en el espacio muerto de la misma (el cual, por mediciones, fue aproximadamente 25 μL). La jeringa se llenó en todos los casos con un volumen de 2,5 mL, según recomendación del trabajo realizado por el Capítulo Bioquímico de la Sociedad Argentina de Terapia Intensiva SATI (6). El tipo 3 fueron microtubos comerciales de 1 mL (VITIS) con heparinato de Li líquido con tapa troquelada, a volumen completo. Se extrajo sangre arterial o venosa a 84 pacientes según la solicitud médica para determinación de GS y mediciones relacionadas, utilizando los tres tipos de recipientes. Fueron analizadas un total de 254 muestras.
Para el llenado de los tres recipientes se procedió a realizarlo de manera aleatoria a partir de una jeringa de extracción única, de la siguiente manera: se efectuó la punción al paciente con una “jeringa madre” de 10 mL sin anticoagulante. Para el llenado de los recipientes tipo 1 y tipo 2 se aspiró la sangre desde la jeringa madre, con aguja 21Gx1. El de tipo 1 se llenó a volumen completo y el de tipo 2 hasta el 50% de la capacidad total (2,5 mL). Para el tipo 3 se dispensó la sangre a través de la tapa troquelada, hasta completar el volumen, en todos sin dejar cámara de aire. Las muestras se midieron antes de los 15 minutos, en un equipo Cobas b221 (con co-oximetría) Roche (Mannheim Alemania), previamente homogeneizadas. Para el recipiente tipo 3 se usó un adaptador de ampollas (Ampoule Adapter) para analizar la muestra sin destapar el tubo. Se midió: pH, pO2, SO2, pCO2, HCO3 -, Na+, K+, Cl-, Ca2+, glucosa y lactato.
Análisis estadístico
Los parámetros de GS y mediciones relacionadas fueron expresados como mediana y rango intercuartílico (RIC). Se eliminaron outliers con el test de Tukey. Se compararon los resultados obtenidos de cada uno de los analitos de los recipientes tipo 2 y tipo 3 contra los resultados obtenidos con el recipiente tipo 1. Para el análisis desde el punto de vista estadístico se utilizó el test de Wilcoxon para muestras apareadas. Se consideró significativo un p<0,05. Para el análisis desde el punto de vista clínico se utilizó el método de Bland- Altman; los sesgos obtenidos fueron comparados contra el sesgo permitido que se corresponde con el error sistemático permitido (ESp=50% del error total aceptable o ETa). Las especificaciones de calidad adoptadas fueron variabilidad biológica deseable, (www.westgard. com/biodatabase1.htm) para todas las determinaciones excepto para pO₂ que se tomó de The Royal College of Pathologists of Australasia and the Australasian Clinical Biochemist Association Quality Assurance Program (RCPA) por no estar disponible en variabilidad biológica, y para K⁺ que se adoptó variabilidad biológica mínima. Para SO₂ no se encontraron requerimientos de calidad disponibles.
El error total aceptable (ETa) es el máximo error permitido sin invalidar la utilidad clínica del resultado. En los casos en que el sesgo obtenido fue aceptable se consideró que los recipientes eran equivalentes y los resultados intercambiables desde el punto de vista clínico. Para el análisis de los datos se utilizó el programa estadístico MedCalc Versión 18.9 demo.
Resultados
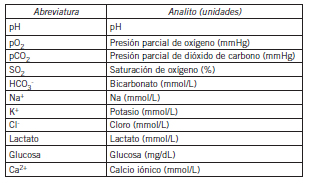
Los resultados fueron expresados en: mediana, RIC, valores de p obtenidos por el test de Wilcoxon para muestras apareadas, sesgos obtenidos por el método de Bland-Altman y Eta, los cuales se muestran en la Tabla I para recipiente tipo 2 vs. tipo 1 y en la Tabla II para recipiente tipo 3 vs. tipo 1. En la Tabla III se consignan las abreviaturas y unidades empleadas para cada analito.
Tabla I. Comparación de recipiente tipo 1 vs. tipo 2. Mediana, RIC y valores de p obtenidos por el test de Wilcoxon para muestras apareadas, sesgos obtenidos por el método de Bland-Altman y ETa variabilidad biológica deseable para todos los analitos.
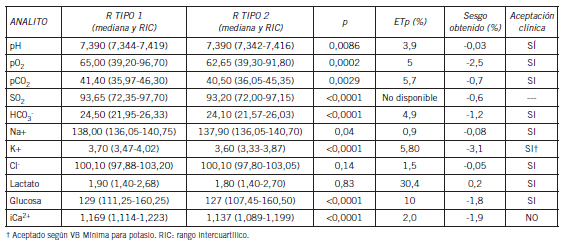
Tabla II. Comparación de recipiente tipo 1 vs. tipo 3. Mediana, RIC y valores de p obtenidos por el test de Wilcoxon para muestras apareadas, sesgos obtenidos por el método de Bland-Altman.
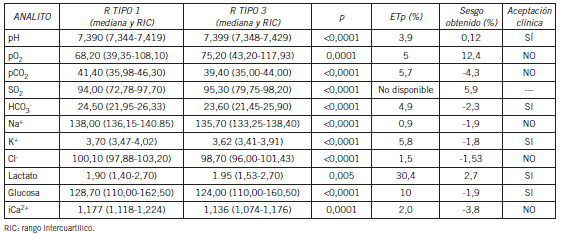
Tabla III. Analitos (abreviaturas y unidades)
A continuación se muestran los gráficos obtenidos por el método de Bland-Altman para pH, pCO₂, Ca2⁺, y pO₂ del recipiente tipo 2 vs. tipo 1 (Fig. 1) (Fig. 2) (Fig. 3)(Fig. 4) y recipiente tipo 3 vs. tipo 1 (Fig. 5) (Fig. 6) (Fig. 7) (Fig. 8) respectivamente. En ellos se observan los sesgos obtenidos.

Figura 1. Gráfico de Bland-Altman: media, sesgo para pH del recipiente tipo 2 vs. tipo 1.

Figura 2. Gráfico de Bland-Altman: media, sesgo para pCO₂ del recipiente tipo 2 vs. tipo 1.

Figura 3. Gráfico de Bland-Altman: media, sesgo para Ca2⁺ del recipiente tipo 2 vs. tipo 1.
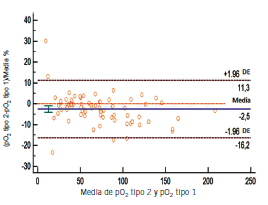
Figura 4. Gráfico de Bland-Altman: media, sesgo para pO₂ del recipiente tipo 2 vs. tipo 1.

Figura 5. Gráfico de Bland-Altman: media, sesgo para pH del recipiente tipo 3 vs. tipo 1.
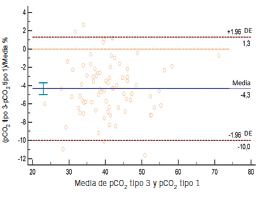
Figura 6. Gráfico de Bland-Altman: media, sesgo para pCO₂ del recipiente tipo 3 vs. tipo 1.
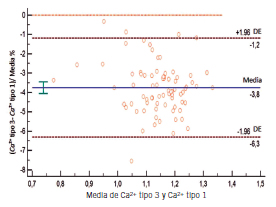
Figura 7. Gráfico de Bland-Altman: media, sesgo para Ca2⁺ del recipiente tipo 3 vs. tipo 1.
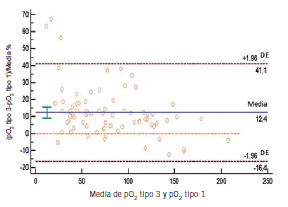
Figura 8. Gráfico de Bland-Altman: media, sesgo para pO₂ del recipiente tipo 3 vs. tipo 1.
Se encontraron diferencias estadísticamente significativas en todos los analitos medidos excepto Cl⁻ y lactato en el recipiente tipo 2 respecto del tipo 1. Sin embargo, la diferencia no resultó clínicamente significativa, excepto para el Ca2⁺ en el cual el sesgo encontrado fue mayor al permitido. Se encontraron diferencias estadísticamente significativas en todos los parámetros del recipiente tipo 3 respecto del tipo 1. Desde el punto de vista clínico se rechazaron pCO2, pO₂, Cl⁻, Na⁺ y Ca2⁺ debido a que los sesgos obtenidos superaron el sesgo permitido.
Discusión y Conclusiones
Está ampliamente documentado que la utilización de sales de heparinato como anticoagulante y su concentración, afectan a los parámetros de GS y mediciones relacionadas (5-8); sin embargo, sigue siendo el anticoagulante de elección para la recolección de este tipo de muestras. Los resultados pueden verse afectados por efectos como dilución, quelación y adición de iones; es por ello que se han desarrollado estrategias para reducir al mínimo estos efectos no deseados. La utilización de heparinato de Li liofilizado balanceado con iones, en jeringas comerciales llenas con el volumen indicado por el fabricante, previene los tres efectos mencionados anteriormente y por eso es la recomendada por el CLSI (9). A pesar de ello, algunos grupos de trabajo proponen o comparan diferentes formulaciones de heparinato y su uso en jeringas para el muestreo de gases (7)(10).
En el presente trabajo se seleccionaron dos tipos de recipientes para efectuar un análisis o comparación con los parámetros medidos en jeringas comerciales. El recipiente tipo 2 está ampliamente difundido entre los laboratorios de la región, basado en la experiencia desarrollada por el Capítulo Bioquímico de la SATI, para armonizar la manera de extraer las muestras de calcio iónico. En dicha experiencia se efectuó una dilución del heparinato de Na+ 1/7, y se recomendó el llenado de las jeringas según su volumen total y el volumen muerto de éstas (6). El recipiente tipo 3 también es empleado por algunos laboratorios de la región, aunque el uso de tubos en lugar de jeringas para gases en sangre no es recomendado en la bibliografía mundial.
Al analizar los resultados de GS de la comparación del recipiente tipo 2 respecto del tipo 1, se puede observar que el recipiente tipo 2 tuvo un buen desempeño, demostrado por la aceptación clínica de los sesgos. Esto avala la hipótesis de que podrían intercambiarse los recipientes (tipo 2 y tipo 1) sin afectar la utilidad clínica del resultado. No se obtuvieron cambios significativos en el pH del recipiente tipo 2 respecto del tipo 1. En otros estudios, por ejemplo los de Ordog et al. (11) y Hutchison et al. (12), se utilizaron cantidades crecientes de heparinato de Na+ líquido puro y se demostró que el pH no se modificaba hasta una dilución del 40-50% de la sangre. Respecto a la pCO₂ se obtuvo un sesgo negativo en el recipiente tipo 2 respecto del tipo 1, que si bien fue despreciable para fines clínicos, puede explicarse por ser éste uno de los parámetros más afectados por la dilución (10). Además, es conocido que el CO₂ difunde parcialmente a través de la pared de las jeringas de polipropileno de baja densidad (recipiente tipo 2), y cuanto mayor sea la diferencia de la pCO₂ entre la sangre y el aire ambiental, más rápidamente se producirá el intercambio entre ambos (13). Este efecto es mínimo en el recipiente tipo 1 por estar fabricado con polipropileno de alta densidad. Esto también explicaría el sesgo obtenido para bicarbonato, por ser un parámetro calculado a partir de la pCO₂.
En la bibliografía se recomienda para obtención de sangre en jeringas para GS y mediciones relacionadas, que la dilución que provoca el heparinato líquido no sea superior del 5% (3)(4). Es por ello que se adoptó el procedimiento explicado en Materiales y Métodos en cuanto a dilución, cantidad de heparinato y volumen de sangre en la jeringa, para el recipiente tipo 2, para minimizar el efecto de dilución de los analitos. Los iones (Na⁺, K⁺, Ca²⁺) mostraron sesgos negativos, al igual que los resultados obtenidos por Sandler et al. (7); los más significativos fueron el de K⁺ y Ca²⁺ (14). El Ca²⁺ no sería aceptable clínicamente según el requerimiento de calidad de variabilidad biológica. Este mal desempeño podría ser atribuible al efecto de quelación de Ca2+ por la molécula de heparinato (polianión) (15)(16) que podría seguir atrapando Ca²⁺ a pesar de la dilución utilizada en la preparación del recipiente tipo 2. Este hallazgo difiere de los resultados obtenidos por la Sociedad Argentina de Terapia Intensiva (6) en sus experiencias publicadas en el Capítulo Bioquímico. Cuando compararon diferentes proporciones sangre-anticoagulante, se observó que la dilución 1/7 no afectaba la medición de Ca²⁺. Para el caso de K⁺, si se emplea el requerimiento de calidad de variabilidad biológica mínima podría considerarse comparable el recipiente tipo 2 con el tipo 1. En el caso del anión Na⁺ y del anión Cl⁻ las diferencias no fueron clínicamente significativas.
Los sesgos obtenidos para lactato y glucosa no fueron significativos desde el punto de vista clínico. En general, los errores preanalíticos de mayor importancia para la determinación de éstos se relacionan con demoras en el procesamiento y conservación incorrecta de las muestras y no con el tipo de heparinato empleado. Al analizar los resultados de la comparación del recipiente tipo 3 respecto del tipo 1 para GS, se obtuvieron sesgos importantes para pCO₂ y pO₂, lo cual invalidaría su uso en la clínica. Esto podría deberse a que el recipiente no estaba cerrado al vacío, lo que dificultaba mantener la anaerobiosis. También cabe destacar el impedimento para eliminar burbujas y la alta permeabilidad de la tapa troquelada; todo esto permitiría un mayor intercambio de gases con el ambiente (17). Es importante destacar que en ninguna bibliografía consultada sobre la extracción de gases en sangre, se recomienda el uso de tubos llenos sin cámara de aire, como el caso del recipiente tipo 3. El objetivo de compararlo con el recipiente tipo 1 fue porque en algunos laboratorios del medio en donde se realizó el estudio este reservorio es utilizado de rutina para la extracción de GS.
Al igual que en el recipiente tipo 2, en el tipo 3 podría haber efectos de quelación y dilución sobre los iones porque contenían como anticoagulante heparinato de Li líquido puro no balanceado en calcio. Estos efectos se vieron también reflejados en el Na⁺ y el Cl⁻ y Ca²⁺ del recipiente tipo 3. En conclusión, según los resultados obtenidos a partir del análisis desde el punto de vista estadístico y clínico, se puede concluir que el uso del recipiente tipo 3 es inapropiado tanto para el análisis de GS como para las mediciones relacionadas. Sin embargo, el recipiente tipo 2, a excepción del Ca²⁺, sería apto para el análisis de este tipo de muestras, ya que los resultados obtenidos fueron comparables con el recipiente recomendado por el CLSI.
Por lo tanto, sería factible implementar el uso de jeringas de 5 mL adicionadas con la cantidad de anticoagulante que ocupe sólo el espacio muerto de la jeringa. El anticoagulante debe ser preparado con heparinato de Na+ (5.000 UI/mL) diluido 1/7, como se describe en Materiales y Métodos, y completando hasta 2,5 mL de sangre en anaerobiosis; es decir, se debe utilizar el anticoagulante en la composición, proporción y dilución propuesta en el recipiente tipo 2, para el caso en que por razones económicas no se pueda acceder a la jeringa con heparinato de Li liofilizado balanceado con iones. Es importante remarcar que si se empleasen recipientes descriptos como tipo 2 (con heparinato de Na+ diluido 1/7), se debería buscar una opción para la medición de Ca²⁺ por separado, en jeringas comerciales (tipo 1) o mediante el uso, por ejemplo, de tubos de suero sellados al vacío (6)(18)(19). Si se utiliza suero, el tubo de extracción debe llenarse completamente y no destaparse hasta el momento del análisis para mantener la anaerobiosis. Si en la muestra se realizan otras determinaciones, la medida de calcio libre será siempre la primera en realizarse. Si el suero se expone al aire más de 10 minutos, se produce un aumento progresivo en el pH de la muestra debido a la pérdida de CO2 que ocasionará un descenso progresivo en la concentración de calcio libre (18).
1. Holod SA, Pengue C, Campos M del C, Pittaluga SG, Raimondi RA. Calidad en el laboratorio de urgencias: determinación del estado ácido-base. Acta Bioquím Clín Latinoam 2011; 45 (3): 447-54. [ Links ]
2. Knowles TP, Mullin RA, Hunter JA, Douce FH. Effects of syringe material, sample storage time, and temperature on blood gases and oxygen saturation in arterialized human blood samples. Respir Care 2006; 51: 732-6. [ Links ]
3. Higgins C. Useful tips to avoid preanalytical errors in blood gas testing: pH, pCO2 and pO2. Disponible en: http://www.acutecaretesting.org (Fecha de acceso: 1 de noviembre de 2018). [ Links ]
4. Higgins C. The use of heparin in preparing samples for blood gas analysis. Disponible en: http://www.acutecaretesting.org (Fecha de acceso: 1 de noviembre de 2018). [ Links ]
5. Dukić L, Kopčinović LM, Dorotić A, Baršić I. Blood gas testing and related measurements: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Croatian Society of Medical Biochemistry and Laboratory Medicine. Biochem Med (Zagreb) 2016; 26 (3): 318-36.
6. Capitulo-Bioquímico-Subcomisión de normalización. Calcio iónico. Disponible en: http://www.sati.org.ar/images/Capitulo-Bioquimico-Subcomision-de-normalizacion-Calcio-Ionico.pdf (Fecha de acceso: 1 de noviembre de 2018). [ Links ]
7. Sandler P, Goldstein LN. The effect of different forms of heparin on point-of-care blood gas analysis. S Afr Med J 2018; 108 (3): 224-9. [ Links ]
8. Chhapola V, Kumar S, Goyal P. Is liquid heparin comparable to dry balanced heparin for blood gas sampling in intensive care unit? Indian J Crit Care Med 2014; 18: 14-20. [ Links ]
9. Clinical and Laboratory Standards Institute (CLSI) C46-A2. Blood gas and pH analysis and related measurements; approved guideline, Second Edition. CLSI, Wayne, PA, 2009. [ Links ]
10. Karendal B. Effect of heparin or saline dilution of blood on pCO2 and pH. Ups J Med Sci 1975; 80 (3): 175-7. [ Links ]
11. Ordog GJ, Wasserberger J, Balasubramaniam S. Effect of heparin on arterial blood gases. Ann Emerg Med 1985; 14 (3): 233-8. [ Links ]
12. Hutchison AS, Ralston SH, Dryburgh FJ, Small M, Fogelman I. Too much heparin: possible source of error in blood gas analysis. Br Med J (Clin Res Ed) 1983; 287 (6399): 1.131–2.
13. Baird G. Preanalytical considerations in blood gas analysis. Biochem Med (Zagreb) 2013; 23 (1): 19–27.
14. Van Berkel M, Scharnhorst V. Electrolyte-balanced heparin in blood gas syringescan introduce a significant sesgo in the measurement of positively charged electrolytes. Clin Chem Lab Med 2011; 49 (2): 249–52.
15. Sachs C, Rabouine P, Chaneac M, Kindermans C, Dechaux M, Falch-Christiansen T. Preanalytical errors in ionized calcium measurements induced by the use of liquid heparin. Ann of Clin Biochem 1991; 28 (2): 167–73.
16. Toffaletti JG, Wildermann RF. The effects of heparin anticoagulants and fill volume in blood gas syringes on ionized calcium and magnesium measurements. Clin Chim Acta 2001; 304 (1-2): 147-51. [ Links ]
17. Biswas CK, Ramos JM, Agroyannis B, Kerr DN. Blood gas analysis: effect of air bubbles in syringe and delay in estimation. Br Med J (Clin Res Ed) 1982; 284 (6320): 923–7.
18. Muñoz Pérez M, Buño Soto A, Díaz García R, Galán Ortega A, Guevara Ramírez P, Guillén Campuzano E, et al. Recomendaciones para la medida de calcio ionizado. Documentos de la SEQC 2010. [ Links ]
19. Clinical and Laboratory Standards Institute C31-A2. D´Orazio P, Toffaletti JP, Wandrup J. Ionized calcium determinations: precollection variables, specimen choice, collection and handling; approved guideline. Second Edition. Clinical and Laboratory Standards Institute 2001; 21(10). [ Links ]
Recibido: 29 de noviembre de 2018
Aceptado: 26 de noviembre de 2019














