Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.2 La Plata jun. 2020
BIOQUÍMICA CLÍNICA
Importancia clínica y diagnóstica de la relación receptor de tirosin-quinasa tipo 1 en su forma soluble y el factor de crecimiento placentario
Ricardo Guglielmone¹*, Rafael De Elías¹, Oscar Kiener¹, Rafael De Elías² (h), Gisel Kiener², Virginia Maldonado²
¹ Bioquímico Especialista en Química Clínica.
² Bioquímico.
Laboratorio Central, Sanatorio Allende, Obispo Oro 38. Córdoba (CP 5000), Argentina.
* Autor para correspondencia.
Correspondencia Bioq. RICARDO GUGLIELMONE Laboratorio Central Sanatorio Allende, Obispo Oro 38 5000 - CÓRDOBA, Argentina. Correo electrónico: rguglielmone@hotmail.com; vir_maldonado88@hotmail.com.ar
Resumen
El objetivo del trabajo fue evaluar la utilidad clínica de la relación factor de crecimiento placentario/receptor de tirosin-quinasa tipo 1 soluble (sFlt-1/ PlGF) para el diagnóstico de preeclampsia (PE) en embarazadas de alto riesgo y con diagnóstico clínico de PE en un centro de salud de Córdoba, Argentina. Se procesaron 135 muestras de embarazadas: 39 con diagnóstico clínico de PE (Grupo I), 72 con riesgo de PE (Grupo II), y 24 de grupo control (Grupo III). Se utilizó una técnica automatizada de electroquimioluminiscencia (Roche). Valores <38 se consideraron sin riesgo de PE, entre 38 y 85 (< semana 34) o 38 y 110 (> semana 34) con riesgo moderado o alto riesgo dentro de las 4 semanas posteriores a la realización de dichos marcadores y >85 en embarazadas con síntomas de aparición temprana o >110 en embarazadas con síntomas de aparición tardía, PE confirmada. En el Grupo I, 33 muestras dieron relación >38 y 6 fueron menores. De 72 muestras del Grupo II 69 dieron <38 y 3 >38. Todas las muestras del Grupo III dieron relación <38. La razón de verosimilitud positiva (LR+) fue de 20,31 y la razón negativa (LR-) fue de 0,16. La relación fue >38 en la mayoría de las embarazadas con diagnóstico de PE. La determinación es útil en aquellas mujeres embarazadas que son de alto riesgo, ya sea porque tienen hipertensión o proteinuria o algún antecedente previo, en las cuales puede ser fundamental para decidir el correcto diagnóstico.
Palabras clave: Preeclampsia; Hipertensión; Factor de crecimiento placentario; Receptor de tirosin-quinasa tipo 1.
Abstract
Clinical and diagnostic importance of the type 1 receptor tyrosine-kinase ratio in its soluble form and placental growth factor
The objective of this work was to evaluate the clinical usefulness of the relation placental growth factor/soluble tyrosine-kinase type 1 receptor (sFlt-1/PlGF) for the diagnosis of PE (preeclampsia) in pregnant women at high risk and with clinical diagnosis of PE in a health center of Córdoba, Argentina. A total of 135 samples of pregnant women were processed: 39 with clinical diagnosis of PE (Group I), 72 with risk of PE (Group II), and 24 of control group (Group III). An automated electrochemiluminescence technique (Roche) was used. Ratio sFlt-1/PlGF <38 was considered without risk of PE. Between 38 and 85 (< week 34) or 38 and 110 (> week 34), with moderate risk or high risk within 4 weeks after performing these markers. To confirm diagnosis, relationships >85 in pregnant women were considered with symptoms of early onset and >110 in pregnant women with symptoms of late onset. In Group I, 33 samples reported >38 and 6 were lower. Of 72 samples from Group II, 69 gave <38 and 3, >38. All samples from Group III gave a ratio <38. The positive likelihood ratio (LR+) was 20.31 and the negative likelihood ratio (LR-), 0.16. The ratio was >38 in the majority of women already diagnosed as PE. The test is useful in those pregnant women who are at high risk of PE, either because they have hypertension or proteinuria or a previous history. In those cases it can be fundamental to decide the correct diagnosis.
Keywords: Preeclampsia; Hypertension; Placental growth factor; Type 1 tyrosine-kinase receptor.
Resumo
Importância clínica e diagnóstica da relação receptor de tirosina-quinase tipo 1 em sua forma solúvel e o fator de crescimento placentário
O objetivo do estudo é avaliar a utilidade clínica da relação fator de crescimento placentário/receptor de tirosina-quinase tipo 1 solúvel (sFlt-1/PIGF) para o diagnóstico de pré-eclâmpsia (PE) em grávidas de alto risco e com diagnóstico clínico de PE em um centro de saúde de Córdoba, Argentina. Foram processadas 135 amostras de gestantes, sendo 39 com diagnóstico clínico de PE (Grupo I), 72 com risco de PE (Grupo II) e 24 de grupo controle (Grupo III). Foi utilizada uma técnica automatizada de eletroquimioluminescência (Roche). Valores <38 foram considerados sem risco de PE, entre 38 e 85 (<semana 34) ou 38 e 110 (> semana 34), risco moderado ou alto risco dentro das 4 semanas após a realização desses marcadores e >85 em mulheres grávidas com sintomas de início precoce ou >110 em mulheres grávidas com sintomas de início tardio, PE confirmada. No Grupo I, 33 amostras deram relação >38 e 6 foram menores. Das 72 amostras do Grupo II, 69 deram <38 e 3 >38. Todas as amostras do Grupo III apresentaram uma relação <38. A relação de verossimilhança positiva (LR+) foi de 20,31 e a relação de verossimilhança negativa (LR-), 0,16. A relação foi >38 na maioria das pacientes com diagnóstico clínico de PE. A determinação é de utilidade em mulheres grávidas que são de alto risco, seja porque têm hipertensão ou proteinúria ou algum antecedente prévio, nas quais pode ser fundamental para decidir o diagnóstico certo.
Palavras-chave: Pré-eclâmpsia; Hipertensão; Fator de crescimento placentário; Receptor de tirosinaquinase tipo 1.
Introducción
La definición de preeclampsia (PE) dada por el Colegio Americano de Obstetras y Ginecólogos especifica la aparición de hipertensión (HTA) (mayor de 140/90 mmHg) y proteinuria (mayor de 0,3 g/24 h) después de la semana 20 de gestación (1). La HTA del embarazo puede manifestarse de cuatro formas: una HTA crónica previa a un embarazo, preeclampsia-eclampsia, HTA crónica con preeclampsia superpuesta y una HTA gestacional no proteinúrica (2).
Estudios clínicos y experimentales sugieren que la disfunción endotelial es el principal mecanismo de HTA en el embarazo (3). La PE puede desarrollarse en forma temprana, antes de la semana 34 (entre la semana 20 y 33+6 días) de gestación o en forma tardía, después de la semana 34 de gestación (4). La PE temprana generalmente está asociada a una invasión de trofoblastos, hipoxia placentaria y liberación de factores bioactivos que podrían estar dirigidos al endotelio y la PE tardía está asociada a condiciones maternas preexistentes que podrían afectar la integridad del endotelio (5).
Los factores de riesgo para la PE son variados y únicos para esta condición. Factores genéticos, como así también la historia familiar materna y paterna predisponen a la PE. El riesgo es 7 veces mayor si ya hubo PE en un embarazo previo. Una gestación múltiple es un factor de riesgo adicional y una gestación triple tiene mayor riesgo que una doble, sugiriendo esto que un incremento en la masa placentaria puede tener un rol importante. Es de notar que los factores de riesgo cardiovascular están asociados con la PE, edad mayor de 40 años, resistencia a la insulina, obesidad, inflamación sistémica e HTA preexistente, diabetes o enfermedad renal. Consistente con esto, las mujeres con historia previa de PE tienen un riesgo elevado de enfermedad cardiovascular en su vida posterior (6). El estilo de vida materno, la dieta y el sobrepeso pre-embarazo u obesidad podrían incrementar el riesgo de PE (7). Las condiciones médicas preexistentes como el lupus eritematoso sistémico, el estrés mental, la macrosomía neonatal previa, la historia de cirugía del tracto reproductivo, la hemorragia preparto y las condiciones respiratorias crónicas pueden también estar asociados a PE (8).
El factor de crecimiento placentario (PlGF) es un factor pro-angiogénico que se une al receptor del factor de crecimiento endotelial vascular-1 (VEGFR-1) y aumenta los efectos angiogénicos del factor de crecimiento endotelial vascular (VEGF). El PlGF tiene sólo un décimo de la afinidad por el VEGFR-1 comparado con el VEGF, pero los niveles son 40 veces más altos que el VEGF durante el embarazo normal. El PlGF dilata los vasos uterinos y promueve el crecimiento de las células endoteliales, la vasculogénesis y el desarrollo de la placenta. Los niveles en plasma del PlGF son bajos en las mujeres no embarazadas (aproximadamente 44 pg/mL), pero son sustancialmente altos en mujeres embarazadas (9). Durante las semanas 21 y 22 de gestación, los niveles de PlGF son aproximadamente de 353 pg/mL, y aumentan progresivamente durante la gestación hasta alcanzar un nivel medio de 574 pg/mL después de la semana 29-30 de gestación (10).
Durante la PE, el PlGF circulante disminuye y esto es más evidente en la PE temprana que en la PE tardía (11). El receptor de tirosin-quinasa tipo 1 en su forma soluble o receptor del factor de crecimiento endotelial vascular soluble (sFlt-1 o sVEGFR-1) es un factor anti-angiogénico expresado en una variante splice alternativa del VEGFR-1 donde pierde los dominios transmembrana y citoplasmático. El sFlt-1 se une al VEGF y al PlGF en la circulación e inhibe su acción sobre los receptores en la superficie celular. El sFlt-1 puede también formar un heterodímero con los receptores de superficie e inhibir cualquier acción de señalización que ellos puedan promover (12).
Las células trofoblásticas son las que expresan el ARNm del sFlt-1 y los niveles de éstos son aproximadamente 1.500 pg/mL en mujeres normales embarazadas comparados con los 150 pg/mL en mujeres no embarazadas (13). Los niveles de sFlt-1 son estables en las mujeres embarazadas normales y muestran un incremento después de la semana 36 de gestación. Durante el tercer trimestre, el incremento del sFlt-1 persiste y hay una reducción en el VEGF y el PlGF. En la PE, el incremento de sFlt-1 y la disminución de PlGF ocurren de una forma más pronunciada que en mujeres con embarazos normales (4). Los niveles circulantes de sFlt-1 y la relación de sFlt-1/PlGF son más altos en embarazos dobles que en los simples, posiblemente debido a la gran masa placentaria (14), hecho que apoya que la placenta sea probablemente la fuente de estos factores.
La medición en plasma de VEGF, PlGF, sFlt-1 y endoglinas (sEng) puede ayudar a una detección temprana en mujeres embarazadas asintomáticas, especialmente aquellas con alto riesgo de tener PE (2). El disbalance angiogénico/anti-angiogénico es una importante característica de la PE. Los niveles circulantes de sFlt-1 están incrementados más de un mes antes de la aparición de los síntomas clínicos y el PlGF está disminuido en mujeres que desarrollan PE desde el final del primer trimestre (15). La relación sFlt-1/PlGF está aumentada en la PE comparada con las mujeres con embarazo normal tanto en la PE temprana como en la tardía (16). Un metaanálisis de 20 diferentes estudios revela que la exactitud diagnóstica de la relación sFlt-1/PlGF en la PE es relativamente alta, pero sugiere que esta relación tiene una mayor eficiencia diagnóstica en la PE temprana comparada con la PE tardía, la cual puede ser debida a las diferencias en la patogénesis de las distintas formas de PE (17). La isquemia placentaria causa alta producción de proteínas anti-angiogénicas como la sFlt-1 y sEng que tienen serios efectos sobre el sistema cardiovascular. La liberación de estos factores antiangiogénicos dentro de la circulación materna lleva a un daño del endotelio materno y a las manifestaciones clínicas de la PE tal como la HTA. Un trabajo de Verlohren et al. demostró que en pacientes embarazadas sanas, las concentraciones medias de sFlt-1 aumentaban continuamente desde aproximadamente 1.445 pg/mL en las semanas 10-14 de gestación hasta 4.400 pg/mL después de la semana 37 (18). Al parecer la deficiencia de PlGF y el exceso de sFlt-1 pueden resultar de una hipoxia placentaria asociada con un remodelado incompleto de la arteria espiral materna. Este remodelado incompleto de las arterias ofrece persistentemente alta resistencia al flujo sanguíneo arterial uterino y puede predisponer a una ruptura vascular en la placenta especialmente después de la aparición de la HTA (19). El incremento en suero del sFlt-1 es detectable 5 semanas antes de la aparición clínica de los síntomas (20). Por otra parte, un importante ensayo clínico prospectivo validó un valor de corte de la relación sFlt-1/PlGF para el manejo de PE en el estudio Prognosis el cual claramente demostró que una relación sFlt-1/PlGF de 38 puede ser usada para descartar la PE dentro de una semana posterior a la medición de esta relación independientemente de la edad gestacional. El valor predictivo negativo fue de 99,3%. Luego, una relación sFlt-1/PlGF mayor de 85, medida antes de la semana 34 de gestación o de 110 medida después de la semana 34 de gestación, es indicativa de un alto riesgo de diagnóstico de PE o un desorden relacionado a la placenta que requiera un cuidado clínico y monitoreo biológico. Para las mujeres con una relación sFlt-1/PlGF entre 38 y 85, si es antes de la semana 33+6 días o entre 38 y 110 si es después de la semana 34, la PE puede ser descartada; sin embargo, esas mujeres tienen un alto riesgo de desarrollar PE dentro de las siguientes 4 semanas (21).
El objetivo de este trabajo fue validar la utilidad clínica del PlGF, sFlt-1 y la relación entre ambos para el diagnóstico de PE en mujeres embarazadas con diagnóstico clínico o con alto riesgo de desarrollar PE en un centro de salud en Córdoba, Argentina.
Materiales y Métodos
Se tomaron muestras de sangre de mujeres embarazadas durante el control del segundo y tercer trimestre desde enero de 2017 hasta julio de 2018 para medir PlGF, sFlt-1 y calcular su relación. Las muestras utilizadas fueron las mismas obtenidas para hacer el control de embarazo habitual; no se realizaron extracciones de muestras adicionales. Del total de muestras se seleccionaron aquellas que tenían diagnóstico clínico de PE, otras con HTA o con alto riesgo de tener PE debido a antecedentes de embarazos previos con PE y muestras controles. De las historias clínicas se tomaron los siguientes datos: presión arterial (PA), semana de embarazo, proteinuria, peso del recién nacido y diagnóstico clínico informado por el médico.
El protocolo de estudio fue aprobado por el Comité de Ética del Sanatorio Allende de Córdoba, Argentina. Los resultados fueron obtenidos después de que todas las mujeres finalizaron su embarazo, fijando como valores de corte de la relación sFlt-1/PlGF menor de 38 para descartar PE, entre 38 y 85 (PE temprana) o 38 y 110 (PE tardía) riesgo moderado o alto riesgo dentro de las 4 semanas posteriores a la realización de dichos marcadores y mayor de 85 en aquellas mujeres embarazas que tuvieron síntomas con aparición temprana (entre las semanas 20 y 33+6 días) o mayor a 110 en aquellas embarazadas que tuvieron síntomas con aparición tardía (después de la semana 34), PE confirmada (21).
Las muestras se obtuvieron por punción venosa en tubos Vacutainer®, se dejaron reposar por 30 minutos y se centrifugaron para la separación del suero. Luego se realizaron los análisis correspondientes al control de embarazo y el suero restante fue almacenado a -20 °C hasta el día de la realización de los marcadores. Todas las mediciones fueron hechas después del parto de las mujeres embarazadas para no tener ninguna incidencia sobre la toma de decisión médica. Las determinaciones fueron realizadas con los reactivos de Roche Diagnóstico (Alemania) en una plataforma Cobas 8000 módulo e602 (Roche Diagnostic GmbH Mannheim, Alemania).
Para el análisis de los datos se utilizó el programa InStat (versión demo). Para calcular sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo y también la razón de verosimilitud se utilizaron los métodos convencionales utilizando una tabla de contingencia de dos filas y dos columnas. Las variables continuas se compararon con un análisis de varianza (ANOVA), para variables sesgadas se utilizó el test de Kruskal-Wallis con el test de Dunn como post-test. Los datos fueron informados como media ± desviación estándar para los datos continuos con distribución gaussiana y mediana (mínimo y máximo) para los datos con distribución sesgada, las variables categóricas se expresaron con porcentaje. Se consideró estadísticamente significativo un p<0,05.
Resultados
De 694 muestras recolectadas se realizaron las mediciones de sFlt-1 y PlGF a 24 mujeres embarazadas; saludables (Grupo III control) a 111 mujeres embarazadas, 39 fueron muestras correspondientes a mujeres embarazadas con diagnóstico clínico de PE (Grupo I), 15 con PE temprana y 24 con PE tardía. De las 15 mujeres embarazadas con PE temprana, 11 (73%) tuvieron PA de 140/90 o más y en 4 mujeres (27%) la PA fue menor y la mediana de la proteinuria fue de 0,13 g/L. De las 24 mujeres embarazadas con PE tardía, 16 tuvieron PA superior o igual a 140/90 (67%) y en 8 fue menor (33%). La mediana de la proteinuria fue de 0,47 g/L para este grupo. De las 72 muestras de mujeres embarazadas con riesgo de PE (Grupo II), 44 fueron muestras tomadas antes de la semana 33+6 días y 28 fueron tomadas después de la semana 34. De las 44 muestras que se tomaron antes de la semana 33+6 días, 16 tuvieron PA de 140/90 o superior (36%) y en 28 la PA fue más baja (64%); de estas últimas la mayoría tuvieron como mínimo 130/80 y la mediana de la proteinuria fue de 0,42 g/L. De las 28 muestras de mujeres embarazadas con alto riesgo y cuyas muestras fueron tomadas después de la semana 34, 4 tuvieron PA igual o por encima de 140/90 (14%) y en 24 fue menor (86%), la mayoría con PA de 130/80 como mínimo y la mediana de la proteinuria fue de 0,33 g/L con la excepción que no se le pudo realizar a todo el grupo sino sólo a 17 de las 25. De las 24 mujeres embarazadas saludables (Grupo III), 7 (29%) fueron después de la semana 34 y el promedio de la presión arterial fue de 107,1/67,1 y 17 (71%) fueron antes de la semana 33+6 días cuyo promedio de la PA fue de 115,4/72,2 (Tabla I).
Tabla I. Comparación de la PA y la proteinuria en los distintos grupos de embarazadas y semanas de gestación.

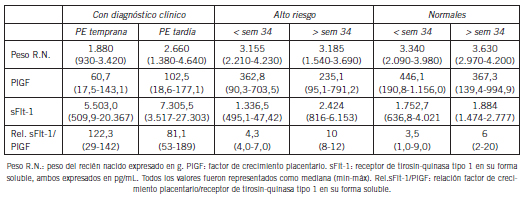
En el Grupo I, la mediana del peso del recién nacido fue 2.660 g y la mediana de la relación de sFlt-1/PlGF fue de 81,1 para el grupo de mujeres embarazadas con PE tardía y de 1.880 g el peso de los recién nacidos y la mediana de la relación fue de sFlt-1/PlGF fue de 122,3 para el grupo de mujeres embarazadas con PE temprana. La mediana de PlGF y sFlt-1 fue de 60,7 pg/mL y 5.503 pg/mL respectivamente para el grupo de embarazadas con diagnóstico de PE temprana y de 102,5 pg/mL y 7.305,5 pg/mL para el grupo de embarazadas con diagnóstico de PE tardía.
La mediana de la relación sFlt-1/PlGF del Grupo II, cuyas muestras fueron tomadas después de la semana 34 fue de 10, la mediana del sFlt-1 fue de 2.424 pg/mL y el de PlGF fue de 235,1 pg/mL, mientras que la mediana del peso de los recién nacidos fue de 3.185 g. Para las embarazadas cuyas muestras fueron tomadas antes de la semana 33+6 días la mediana de la relación sFlt-1/PlGF, sFlt-1, PlGF y el peso del recién nacido fueron de 4,3, 1.336,5 pg/mL, 362,8 pg/mL y 3.155 g, respectivamente. Para el Grupo III, donde las muestras fueron tomadas antes de la semana 34 los valores de relación sFlt-1/ PlGF, sFlt-1, PlGF y el peso del recién nacido fueron 3,5, 1.752,7 pg/mL, 446,1 pg/mL y 3.340 g, respectivamente y para las embarazadas donde la muestra fue tomada después de la semana 34 los valores fueron de 6, 1.884 pg/ mL, 367,3 pg/mL y 3.630 g, respectivamente (Tabla II).
Tabla II. Comparación del peso del recién nacido, factor de crecimiento placentario (PlGF), receptor de la tirosin-quinasa tipo 1 en su forma soluble (sFlt-1) y su relación entre los distintos grupos de embarazadas.
También se hizo una comparación de los resultados entre PlGF, sFlt-1 y la relación entre ambos marcadores entre los tres grupos: Grupo III vs. Grupo I, Grupo III vs. Grupo II y Grupo I vs. Grupo II tanto antes de la semana 33+6 días como después de la semana 34. Para el caso del PlGF antes de la semana 33+6 días y después de la semana 34 la comparación entre las embarazadas del Grupo III y las embarazadas del Grupo I y las del Grupo II con las embarazadas del Grupo I, las diferencias fueron estadísticamente significativas p<0,001. La diferencia entre las embarazadas del Grupo I y las embarazadas del Grupo II tanto antes de la semana 33+6 días como después de la semana 34, no fue significativa, p<0,05 (Fig.1) (Fig. 2).
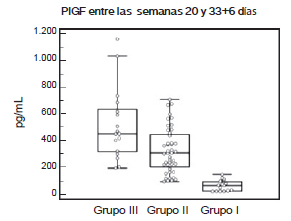
Figura 1. Valores de PlGF de mujeres embarazadas entre las semanas 20 a 33+6 días del Grupo III (grupo control), del Grupo II (de alto riesgo) y del Grupo I (Dx+).
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,001 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.
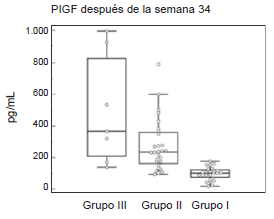
Figura 2. Valores de PlGF de mujeres embarazadas después de la semana 34 del Grupo III (grupo control), del Grupo II (de alto riesgo) y del Grupo I (Dx+).
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,001 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.
En la comparación del sFlt-1 entre las embarazadas del Grupo I y las embarazadas del Grupo II, las diferencias fueron significativas, p<0,001 tanto antes como después de la semana 34. En las embarazadas del Grupo III y las embarazadas del Grupo I, antes de la semana 33+6 días la diferencia también fue significativa, p<0,01 y después de la semana 34 la diferencia fue muy significativa, p<0,001. En la comparación entre las embarazadas del Grupo III con las embarazadas del Grupo II, tanto antes de la semana 33+6 días como después de la semana 34, no hubo diferencias estadísticamente significativas, p>0,05 (Fig. 3) (Fig. 4).

Figura 3. Valores de sFlt-1 de mujeres embarazadas entre las semanas 20 a 33+6 días del Grupo III (normales) del Grupo II (de alto riesgo) y del Grupo I (Dx+).
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,01 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.

Figura 4. Valores de sFlt-1 de mujeres embarazadas después de la semana 34 del Grupo III (normales) del Grupo II (de alto riesgo) y del Grupo I (Dx+)
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,001 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.
En el caso de la relación sFlt-1/PlGF tanto antes de la semana 33+6 días como después de la semana 34, en las mujeres embarazadas del Grupo I vs. las del Grupo II y vs. las del Grupo III, las diferencias fueron significativas, p<0,001 y entre las mujeres embarazadas del Grupo II y las del Grupo III la diferencia no fue significativa con una p>0,05 (Fig. 5) (Fig. 6).
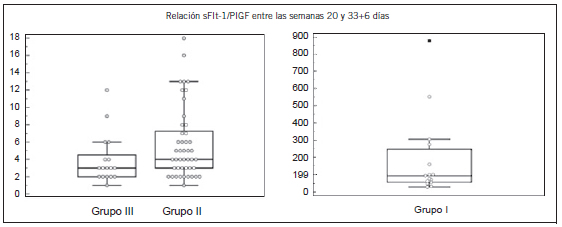
Figura 5. Valores de la relación sFlt-1/PlGF entre las semanas 20 y 33+6 días del Grupo III (normales), del Grupo II (de alto riesgo) y del Grupo I (Dx+).
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,001 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.
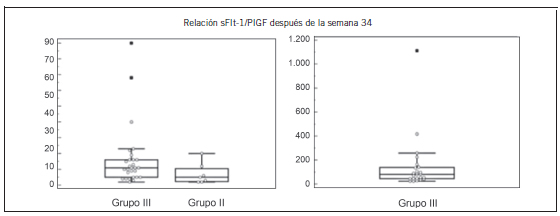
Figura 6. Valores de la relación sFlt-1/PlGF después de la semana 34 del Grupo III (normales), del Grupo II (de alto riesgo) y del Grupo I (Dx+).
Grupo III vs. Grupo II p>0,05 - Grupo III vs. Grupo I p<0,001 - Grupo II vs. Grupo I p<0,001. Dx+: con diagnóstico clínico de PE.
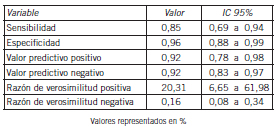
Las tres pacientes del Grupo II que dieron una relación por encima de 38, desarrollaron PE tardía pero ya estaban al final del embarazo y fueron monitoreadas de cerca por el personal médico hasta el final del embarazo. El resto de las mujeres embarazadas tuvieron relaciones normales. Dentro de este grupo hubo 3 mujeres embarazadas en quienes las muestras fueron tomadas antes de la semana 33+6 días y 3 mujeres embarazadas cuyas muestras fueron tomadas después de la semana 34, que tuvieron PE previa pero la relación dio normal. También hubo 7 mujeres embarazadas que tenían proteinuria e HTA pero la relación fue normal y llegaron al parto sin inconvenientes. Por último, se realizó la estadística para calcular el valor predictivo positivo (VPP), valor predictivo negativo (VPN), sensibilidad (S), especificidad (E) y LH+, LH- de los resultados de la relación sFlt-1/PlGF. Los resultados fueron VPP 91,67%, VPN 92%, S 84,6%, E 95,8%, LR+ 20,3 y LR- 0,16 como lo muestra la Tabla III.
Tabla III. Valores predictivos positivos y negativos, sensibilidad, especificidad y razón de verosimilitud.
Discusión y Conclusiones
Lo que se puede obtener de este estudio es que la relación entre sFlt-1/PlGF fue significativa entre el grupo de embarazadas con diagnóstico clínico vs. el grupo de embarazadas con riesgo de PE y vs. un grupo de embarazadas normales. Esto significa que con estos valores se puede descartar o confirmar la PE y que el médico, a partir de estos resultados, podría tomar una decisión sobre si prolongar el embarazo o adelantar el parto en caso de ser confirmado el diagnóstico. En otros trabajos se ha demostrado la importancia de mediciones repetidas de la relación para predecir los resultados de embarazos patológicos, incluyendo PE y una restricción en el crecimiento intrauterino. En particular, en un trabajo realizado por Schoofs et al. se encontró que los resultados obtenidos en mediciones repetidas eran predictivos de la continuidad del embarazo durante las 4 semanas posteriores. Para promover mediciones repetidas de la relación sFlt-1/PlGF se necesita un estudio a gran escala para definir un valor de corte (22).
También puede observarse que los valores de PlGF en el grupo de mujeres embarazadas con diagnóstico clínico de PE (tanto tardía como temprana) eran muy inferiores comparados con el grupo de mujeres embarazadas de alto riesgo y con el grupo de mujeres embarazas normales y esto tiene una relación directa con el desarrollo del feto. Como fue descripto recientemente, una baja concentración de PlGF está asociada con un bajo peso del R.N. y por lo tanto puede ser una información valiosa para identificar embarazos con potenciales resultados adversos para el feto y donde se necesita un parto urgente (22). Cabe destacar que, en el 20% de los casos, la eclampsia puede presentarse sin hipertensión o proteinuria precedente, sugiriendo que los criterios diagnósticos empleados corrientemente no son tan eficientes (6). Es por este motivo que dentro del grupo de mujeres embarazadas consideradas de alto riesgo se incluyeron aquellas que tenían presión alta pero sin llegar a ser de 140/90.
Este trabajo tuvo algunas limitaciones. Fue realizado en un solo centro de salud y la cantidad de muestras tomadas fue limitada. Además, se realizó una sola medición, cuando lo ideal es hacer mediciones repetidas, tanto para los casos en que la relación sea superior al valor de corte como en el caso en que dicha relación esté por debajo, estudio que queda pendiente para realizar en el futuro. En un metaanálisis se incluyeron 15 estudios donde se investigó la posibilidad de que la relación predecía PE de alto o bajo riesgo en mujeres embarazadas. El análisis de los datos demostró una alta sensibilidad y especificidad de la relación sFlt-1/PlGF en predecir PE en todos los embarazos. Cabe destacar que esta relación tiene una baja tasa de verosimilitud y un alto valor predictivo negativo para descartar la enfermedad. Sobre las bases de las mediciones, este análisis sugiere que la relación sFlt-1/PlGF es una poderosa herramienta en la valoración clínica de mujeres embarazadas. Estas determinaciones ayudan al diagnóstico temprano de PE y también contribuyen a disminuir los costos relacionados al seguimiento y a las internaciones innecesarias de aquellas mujeres embarazadas que menos probablemente desarrollen PE (23).
Finalmente, como conclusión se podría decir que es importante medir la relación sFlt-1/PlGF en pacientes que ya tienen el diagnóstico clínico de PE y en mujeres embarazadas de alto riesgo (por HTA o proteinuria o algún otro antecedente) para decidir el correcto diagnóstico. El desarrollo de estudios prospectivos y longitudinales con determinaciones seriadas de estos factores a lo largo del embarazo es necesario para una mejor valoración de estos marcadores, para entender la etiología, para prevención, diagnóstico, pronóstico y tratamiento de esta desafiante enfermedad (4).
Agradecimientos
Los autores agradecen muy especialmente a Roche Diagnóstico (Argentina) por proveer los reactivos para medir PlGF y sFlt-1 en la plataforma Cobas 8000 y al Dr. Sergio Grutadauria y a la Dra. Silvia Barzón por los aportes realizados.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses respecto del presente trabajo.
1. Davey DA, MacGillivray I. The classification and definition of the hypertensive disorders of pregnancy. Am J Obstet Gynecol 1988; 158: 892–8.
2. Sajjad MJ, Khalil RA. Genetic, immune, and vasoactive factors in the vascular dysfunction associated with hypertension in pregnancy. Expert Opin Ther Targets 2015; 19 (11): 1.495–515.
3. Sánchez-Aranguren LC, Prada CE, Riaño-Medina CE, Lopez M. Endothelial dysfunction and preeclampsia: role of oxidative stress. Front Physiol 2014; 5 (372): 1-11. [ Links ]
4. Jardim LL, Rios DR, Perucci LO, de Sousa LP, Gomes KB, Dusse LM. Is the imbalance between pro-angiogenic and anti-angiogenic factors associated with preeclampsia? Clin Chim Acta 2015; 447: 34–8.
5. Brandao AH, Felix LR, Patricio Edo C, Leite HV, Cabral AC. Difference of endothelial function during pregnancies as a method to predict preeclampsia. Arch Gynecol Obstet 2014; 290: 471–7.
6. Powe CE, Levine RJ, Karumanchi SA. Preeclampsia, a disease of the maternal endothelium: the role of anti- angiogenic factors and implications for later cardiovascular disease. Circulation 2011 June 21; 123 (24): 2.856-69. [ Links ]
7. Spradley FT, Palei AC, Granger JP. Increased risk for the development of preeclampsia in obese pregnancies: weighing in on the mechanisms. Am J Physiol Regul Integr Comp Physiol 2015; 309: R1326–43.
8. Tanbe AF, Khalil RA. Circulating and vascular bioactive factors during hypertension in pregnancy. Curr Bioact Compd 2010; 6: 60–75.
9. Romero R, Nien JK, Espinoza J, Todem D, Fu W, Chung H, et al. A longitudinal study of angiogenic (placental growth factor) and anti-angiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor- 1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate. J Matern Fetal Neonatal Med 2008; 21: 9–23.
10. Krauss T, Pauer HU, Augustin HG. Prospective analysis of placenta growth factor (PlGF) concentrations in the plasma of women with normal pregnancy and pregnancies complicated by preeclampsia. Hypertens Pregnancy 2004; 23: 101–11.
11. Tsatsaris V, Goffin F, Munaut C, Brichant JF, Pignon MR, Noel A, et al. Overexpression of the soluble vascular endothelial growth factor receptor in preeclamptic patients: pathophysiological consequences. J Clin Endocrinol Metab 2003; 88: 5.555–63.
12. Charnock-Jones DS. Placental hypoxia, endoplasmic reticulum stress and maternal endothelial sensitisation by sFLT1 in pre-eclampsia. J Reprod Immunol 2016; 114: 81–5.
13. Shah DA, Khalil RA. Bioactive factors in uteroplacental and systemic circulation link placental ischemia to generalized vascular dysfunction in hypertensive pregnancy and preeclampsia. Biochem Pharmacol 2015; 95: 211–26.
14. Faupel-Badger JM, McElrath TF, Lauria M, Houghton LC, Lim KH, Parry S, et al. Maternal circulating angiogenic factors in twin and singleton pregnancies. Am J Obstet Gynecol 2015; 212 (5): 636.e1-8. [ Links ]
15. Herraiz I, Simon E, Gomez-Arriaga PI, Martinez-Moratalla JM, Garcia-Burguillo A, Jimenez EA, et al. Angiogenesis- related biomarkers (sFlt-1/PLGF) in the prediction and diagnosis of placental dysfunction: an approach for clinical integration. Int J Mol Sci 2015; 16 (8): 19.009-26. [ Links ]
16. March MI, Geahchan C, Wenger J, Raghuraman N, Berg A, Haddow H, et al. Circulating angiogenic factors and the risk of adverse outcomes among haitian women with preeclampsia. PLoS One 2015 May 12; 10 (5): e0126815. [ Links ]
17. Liu Y, Zhao Y, Yu A, Zhao B, Gao Y, Niu H. Diagnostic accuracy of the soluble Fms-like tyrosine kinase-1/ placental growth factor ratio for preeclampsia: a meta- analysis based on 20 studies. Arch Gynecol Obstet 2015; 992 (3): 507-18. [ Links ]
18. Verlohren S, Galindo A, Schlembach D; Zeisler H; Herraiz I, Moerti MG; et al. An automated method for the determination of the sFlt-1/PlGF ratio in yhe assessment of preeclampsia. Am J Obstet Gynecol 2010; 202 (2); 161 e1-161 e11. [ Links ]
19. Holmes VA, Young IS, Patterson CC, Maresh MJA, Pearson WM, Walker JD, et al. For the diabetes and preeclampsia intervention trial (DAPIT) Study Group. The role of angiogenic and antiangiogenic factors in the second trimester in the prediction of preeclampsia in pregnant women with type 1 diabetes. Diabetes Care 2013; 36: 3.671–7.
20. Levine RJ, Maynard SE, Qian C, Kee-Hak L, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med 2004; 350: 672-83. [ Links ]
21. Zeisler H, Llurba E, Chantraine F, Vatish M, Staff AC, Sennströn M, et al. Predictive value of the sFlt-1:PlGF ratio in women with suspected preeclampsia. N Engl J Med 2016; 374: 13-22. [ Links ]
22. Saleh L, Verdonk K, Danser AHJ, Steegers EAP, Russcher H, van den Meiracker AH, et al. The sFlt-1/PlGF ratio associates with prolongation and adverse outcome of pregnancy in women with (suspected) preeclampsia: analysis of a high-risk cohort. Eur J 122 of Obstetrics & Gynecol Reprod Biol 2016; 199: 121–6.
23. Agrawal S, Cerdeira AS, Redman C, Vatish M. Meta- analysis and systematic review to assess the role of soluble FMS-like tyrosine kinase-1 and placenta growth factor ratio in prediction of preeclampsia: The SaPPPhirE Study. Hypertension 2018; 71 (2): 306-16. [ Links ]
Recibido: 2 de julio de 2019
Aceptado: 18 de octubre de 2019














