Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.2 La Plata jun. 2020
HEMOSTASIA Y TROMBOSIS
Validación del ensayo FVIII:C cromogénico en una plataforma automatizada
Emanuel Sueldo1a*, Cristina Duboscq2b, Mirta Arias3a
1 Licenciado en Bioquímica Clínica, Especialista en Hematología.
2 Dra. en Química.
3 Bioquímica Especialista en Hematología.
a Hospital César Milstein, Buenos Aires, Argentina.
b Hospital Británico, Buenos Aires, Argentina.
* Autor para correspondencia.
Correspondencia Lic. EMANUEL SUELDO La Rioja 951, 1221 Ciudad Autónoma de Buenos Aires, Buenos Aires, Argentina Correo electrónico: hematologiamilstein@gmail.com
Resumen
El objetivo de este trabajo fue realizar la validación analítica del método cromogénico (FVIII:Ccro) en la plataforma ACL TOP y correlacionarlo con el método coagulable en una etapa (FVIII:Ccoag). El estudio de validación (EP5-A2, EP6-A2 y comparación de métodos por EP-9) se realizó para la curva de rango normal-bajo (CRNB): aproximadamente entre 10-150 UI/dL de FVIII y de rango muy bajo (CRMB): aproximadamente entre 0-10 UI/dL. Los resultados de repetitividad (CVr) y precisión intermedia (CVi) fueron menores del 6% y comparables a los informados por el fabricante para otras plataformas. El rango de medición analítica fue de 11-129 UI/dL con CRNB, y se extrapoló a 0,3 UI/dL al utilizar la CRMB. Para la CRNB FVIII:Ccro mostró buena correlación con FVIII:Ccoag: r: 0,98, pendiente: 0,982 (0,961–1,003), ordenada al origen: -0,3 (-1,1–0,5), sesgo: -2,0%. Para CRMB se obtuvo un r de 0,96, pendiente: 0,921 (0,855–0,988), ordenada al origen: -0,07 (-0,35–0,20), sesgo: -10,2%. Sólo 4 pacientes presentaron niveles discrepantes entre ambos métodos. La determinación de FVIII:C por el método cromogénico automatizado en la familia ACL TOP fue comparable con FVIII coagulable en una etapa en el rango analítico evaluado. El FVIII:Ccro automatizado puede utilizarse para el diagnóstico y seguimiento del tratamiento de los pacientes hemofílicos.
Palabras clave: FVIII:C cromogénico automatizado; Validación de métodos; Hemofilia A.
Abstract
Validation of the chromogenic FVIII:C assay in an automated platform
The objective of this work was to perform the analytical validation of the chromogenic method (FVIII:Ccro) on the ACL TOP platform correlating with one stage assay (FVIII:Ccoag). The validation study (EP5-A2, EP6-A2 and comparison of methods by EP-9) was performed for the low-normal range curve (CRNB): approximately between 10-150 IU/dL of FVIII and very low range (CRMB): approximately between 0-10 IU/dL. The results of CVr (repeatability) and CVi (intermediate precision) were lower than 6% and comparable to those reported by the manufacturer for other platforms. The analytical measurement range was 11-129 IU/dL, extrapolated to 0.3 IU/dL using the CRMB. For CRNB FVIII:Ccro showed good correlation with FVIII:Ccoag: r: 0.98, slope: 0.982 (0.961-1.003), intercept: -0.3 (-1.1-0.5), bias: -2.0%. For CRMB: r: 0.96 was obtained, pending: 0.921 (0.855-0.988), intercept: -0.07 (-0.35-0.20), bias: -10.2%. Only 4 patients presented discrepant levels between both methods. The automated chromogenic FVIII assay in the ACL TOP family is comparable with one stage coagulable FVIII in the analytical range studied. The FVIII:Ccro automated can be used for the diagnosis and monitoring of the treatment of hemophilic patients.
Keywords: Chromogenic FVIII:C assay; Analytical validation methods; Haemophilia A.
Resumo
Validação do ensaio FVIII:C cromogênico em plataforma automatizada
O objetivo deste trabalho foi a validação analítica do método cromogênico (FVIII:Ccro) na plataforma ACL TOP correlacionando-se com o método coagulável numa etapa (FVIII:Ccoag). O estudo de validação (EP5-A2, EP6-A2 e comparação de métodos por EP-9) foi realizado para a curva de faixa normal-baixa (CRNB) aproximadamente entre 10 e 150 Ul/dL de FVIII e de faixa muito baixa (CRMB): aproximadamente entre 0 e 10 UI/dL. Os resultados de Repetitividade (CVr) e precisão intermediária (CVi) foram inferiores a 6% e comparáveis aos descritos pelo fabricante para outras plataformas. A faixa de medição analítica foi de 11-129 UI/dL com CRNB extrapolando-se para 0,3 UI/dL utilizando a CRMB. Para a CRNB FVIII:Ccro houve boa correlação com o FVIII: Ccoag: r: 0,98, inclinação: 0,982 (0,961-1,003), ordenada na origem: -0,3 (-1,1-0,5), Viés: -2,0%. Para CRMB: foi obtido um r: 0,96, pendente: 0,921 (0,855-0,988), ordenado na origem: -0,07 (-0,35-0,20), Viés: -10,2%. Apenas quatro pacientes apresentaram níveis discrepantes entre os dois métodos. A determinação de FVIII:C pelo método cromogênico automatizado na família ACL TOP foi comparável ao FVIII coagulável em um estágio na faixa analítica avaliada. FVIII: O FVIII:Ccro automatizado pode ser utilizado para o diagnóstico e seguimento do tratamento dos pacientes hemofílicos.
Palavras-chave: FVIII:C cromogênico automatizado; Validação de métodos; Hemofilia A.
Introducción
La determinación de la actividad del Factor VIII (FVIII:C) se utiliza en el diagnóstico y monitoreo del tratamiento de la hemofilia A (HA). Categorizar correctamente al paciente en hemofilia severa, moderada o leve es importante para seleccionar el tratamiento adecuado. La determinación puede realizarse por el método coagulable en una etapa (FVIII:Ccoag) o por el método cromogénico (FVIII:Ccro). En 1995 se desarrolló el método cromogénico que se basa en la capacidad del FVIII de actuar como cofactor al promover la activación del FX por el FIX activado (FIXa) (1). La actividad del FX activado (FXa) generado es evaluada mediante la hidrólisis de un sustrato cromogénico específico del FXa. La tasa de liberación inicial de la p-nitroanilina medida a 405 nm es proporcional a la actividad del FXa y, por ende, a la actividad del FVIII en la muestra (2). Dado que todos los reactivos están en exceso, en este método la absorbancia obtenida depende solamente de la concentración de FVIIII en la muestra. Años atrás esta metodología se realizaba en forma manual pero actualmente hay algunas plataformas automatizadas que poseen la metódica adaptada aunque no validada para estos sistemas reactivo-instrumento. Los programas de evaluación externa de la calidad han demostrado que el método cromogénico para la determinación de la actividad de FVIII tiene menor variabilidad en el diagnóstico de pacientes con HA leve. Sin embargo, tanto el método coagulable como el cromogénico presentan altos coeficientes de variación porcentual (CV%) cuando los niveles de FVIII:C son menores a 5 UI/dL. El ensayo cromogénico no es interferido por heparina, inhibidores directos de trombina o por la presencia de anticoagulante lúpico en la muestra del paciente; pero sí es afectado por la presencia de inhibidores de FXa (3). Es el método recomendado para medir FVIII en concentrados por la Farmacopea Europea. En aproximadamente un tercio de los pacientes con HA leve hay discrepancias entre los resultados del método coagulable en una etapa y el método cromogénico y también se han informado discrepancias en pacientes con HA moderada (4) (5). En 1976 se comunicaron por primera vez valores más bajos por el método en dos etapas en comparación con los obtenidos por el método coagulable en una etapa. Estos pacientes presentaban síntomas de sangrado consistentes con los valores obtenidos por el método en dos etapas o por el método cromogénico. Se identificaron mutaciones que afectaban al dominio de interfase A1-A2-A3 que causa una disminución en la estabilidad del heterotrímero del FVIII activado (FVIIIa). Se han descripto pacientes en los cuales se observó una mayor actividad con el método cromogénico que con el coagulable y no tenían manifestaciones clínicas de sangrado. En ellos se han identificado 7 mutaciones que afectan al sitio de clivaje por trombina y al sitio de unión al FIXa (6). No se han encontrado discrepancias importantes en pacientes con HA severa. Si bien hay discusión respecto a cuál es el ensayo que refleja mejor la gravedad clínica de los pacientes, las distintas guías internacionales sugieren utilizar ambos ensayos en los centros de hemofilia, ya que como se ha mencionado hay pacientes con determinadas mutaciones que muestran discrepancias entre ambos métodos.
El método cromogénico ha tomado mayor relevancia con el advenimiento de nuevos tratamientos con la denominada terapia de no reemplazo para la HA, donde el monitoreo de los pacientes debería realizarse utilizando el ensayo cromogénico, en muchos casos no validado por los fabricantes en equipos automatizados. El objetivo de este trabajo fue validar la determinación de la actividad de FVIII medida por el método cromogénico en la plataforma ACL TOP Family.
Materiales y Métodos
Plataformas utilizadas
Se utilizaron dos coagulómetros de detección óptica de ACL TOP Family (Instrumentation Laboratory, Milán, Italia): ACL TOP 300 y ACL TOP 500.
Rango de validación
Aproximadamente entre 0 y 150 UI/dL de FVIII:C (curva de rango normal-bajo (CRNB): 10–150 UI/dL de FVIII:C, curva de rango muy bajo (CRMB): entre 0 y 10 UI/dL de FVIII:C).
Población
Ensayo de comparación de métodos
Se estudiaron 83 pacientes con diagnóstico de HA y 77 donantes de sangre sanos. Los 83 pacientes con HA se correspondían con: 20 HA severa (FVIII:C: 0,1-0,9 UI/dL), 10 con HA moderada (FVIII:C: 1,1-4,7 UI/dL), 5 con HA leve (FVIII:C: 6,0-23,8 UI/dL), 48 con HA severa en tratamiento con concentrados de FVIII (80% de los pacientes estaban en tratamiento con productos recombinantes de cadena completa). Para establecer el rango de referencia se estudiaron 120 donantes de sangre, 58% hombres, de 18 a 65 años de edad que firmaron el consentimiento informado para la realización del estudio; 42 donantes fueron de grupo sanguíneo “cero”.
Metodología
Determinación del FVIII:C coagulable en una etapa
Se realizó con reactivo de tiempo de tromboplastina parcial activado (APTT) SynthASiL [APTT-SS, Instrumentation Laboratory (IL)] y plasma deficiente en FVIII (HemosIL deficient plasma, IL) el cual contiene niveles normales de von Willebrand y niveles de FVIII:C <1 UI/dL. El ensayo de FVIII:C se realizó en tres diluciones (100%, 50% y 25%) utilizando la prueba de paralelismo, acorde a la metódica del coagulómetro. La curva de calibración se realizó utilizando un plasma calibrador (HemosIL Cal Plasma, IL) que contenía un nivel de FVIII medido contra un estándar internacional y los resultados se informaron en UI/dL.
La plataforma ACL TOP realiza una curva de calibración de 8 puntos (aproximadamente de 0-150 UI/dL), cada punto por triplicado y utiliza un modelo matemático distinto para cada segmento de la curva (segmento alto 133-44 UI/dL y segmento bajo (44-0 UI/dL). El desempeño del ensayo coagulable en una etapa fue monitoreado con dos niveles de control de calidad interno: control normal (Normal control assayed, IL), control patológico especial 2 (Special Test 2, IL) y la participación en el programa de control de calidad externo: Riqas y ECAT Foundation.
Determinación de FVIII:C cromogénico
Se utilizó el ensayo Electrachrome FVIII (IL), que contiene: reactivo factor (enzima: volumen de reconstitución: 3 mL, cuya composición es: FIXa bovino 0,3 U/vial, FX en exceso 2,7 IU/vial, y trombina 1 UNIH/vial, CaCl2 40 μmol/vial y fosfolípidos 0,2 μmol/vial), sustrato cromogénico (volumen de reconstitución: 6 mL, composición: sustrato cromogénico liofilizado S-2765 7,7 mg/vial, inhibidor sintético de trombina I-2581 0,2 mg/vial y manitol como estabilizante) y solución reguladora (24 mL de tampón Tris 0,025 mol/L, solución concentrada de pH 7,9). La solución tampón de trabajo se obtiene al diluir 1:10 con agua destilada la solución concentrada. Condiciones de reacción: predilución de la muestra con solución tampón de trabajo, para el rango normalbajo: 1:80, para el rango muy bajo: 1:16. Se toman 50 μL de la muestra prediluida y se incuba a 37 ºC durante 180- 240 segundos, para luego añadir la enzima, e incubar nuevamente por 120-130 segundos. A continuación se añaden 50 μL del sustrato, y a partir de este momento se monitorea la mAbs/min hasta los 120 segundos. El valor de mAbs/min final se extrapola en la curva de calibración correspondiente para obtener la concentración de FVIII por el método cromogénico. La curva de calibración se realizó con plasma calibrador (HemosIL Cal Plasma, IL) que contiene nivel de FVIII calibrado contra un estándar internacional (WHO).
Para esta determinación se realizaron dos curvas de calibración: una curva de rango normal-bajo aproximadamente entre 10–100 UI/dL de actividad de FVIII, para lo cual el equipo realizó 4 puntos de calibración cada uno por duplicado, y una curva de rango muy bajo: 0–10 UI/dL de FVIII:C, para la cual el equipo realizó 5 puntos de calibración y cada uno por duplicado. Control de calidad interno. Se utilizaron 2 niveles de control, normal y patológico especial 2 (Normal Control Assayed y Special Test 2, respectivamente. IL), Control de calidad externo: ECAT Foundation. Las medias de los niveles de FVIII cromogénicos de ambos controles internos se determinaron localmente con 20 mediciones durante tres días consecutivos ya que el fabricante no informaba el valor para esta metodología para la familia ACL TOP.
Ensayos de validación
Para los distintos ensayos de validación se utilizaron los siguientes controles:
• Para la curva de rango normal-bajo: control normal: Normal Control Assayed (CN: 91 UI/dL), control patológico especial 2: Special Test 2 (CP2: 30 UI/dL), IL.
• Para la curva de rango muy bajo: control normal y patológico especial: Normal Control Assayed y Special Test 2 diluidos 1:20 y 1:10 en plasma deficiente en FVIII (CNd, CP2d respectivamente, IL).
• Niveles de decisión médica: *límite superior del rango de referencia: 150 UI/dL, *límite inferior del rango de referencia: 50 UI/dL, *categorización HA leve: 5-40 UI/dL, *categorización HA moderada: 1-5 UI/dL, *categorización HA severa: <1 UI/dL (7).
• Ensayo de precisión: según el protocolo EP5-A2 del Clinical and Laboratory Standards Institute (CLSI) (8).
• Estimación preliminar (Sdp): se procesaron los 4 niveles de control 20 veces en una misma corrida analítica. Outliers: 5.5*Sdp.
• Repetitividad (CVr) y precisión intermedia (CVi): cada nivel de control fue medido por duplicado durante 20 días.
• Rango de medición analítico (RMA): se utilizó el protocolo EP6-A2 del CLSI (9): 12 niveles por triplicado, utilizando un pool de donantes (FVIII:C 130 UI/dL), Control Patológico especial 1 (Special Test 1, CP1, FVIII:C 59 UI/dL), CP2 (FVIII:C 30 UI/dL), plasma deficiente en FVIII (FVIII:C 0,1 UI/dL).
• Comparación de métodos: Se realizó conforme al protocolo EP9-A2 del CLSI (10). Para la curva de rango normal-bajo se utilizaron 120 muestras (FVIII:Ccoag entre 11-203 UI/dL), y para la curva de medición muy baja: 34 muestras (FVIII:Ccoag <10 UI/dL).
• Se consideró un error total aceptable (ETa) según criterios de variabilidad biológica mínima: 13,3%. El ETa fijado por el estado del arte actual es de 29,8% para la determinación coagulable en una etapa (fuente RIQAS para el mismo plasma deficitario de APTT utilizado en este estudio) y 34% (ECAT Foundation).
• Intervalos de referencia: se utilizó el protocolo EP28-A2 del CLSI (11) calculado en 120 donantes de sangre.
Resultados
La metodología automatizada en la plataforma ACL TOP Family permite realizar dos curvas de calibración para la medición de la actividad de FVIII cromogénico (Fig. 1) (Fig. 2).

Figura 1. Curva de calibración rango normal-bajo del método cromogénico.
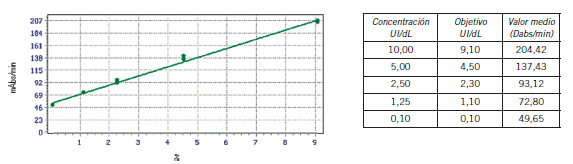
Figura 2. Curva de calibración rango muy bajo del método cromogénico.
Ensayo de precisión
La Tabla I muestra los resultados obtenidos para el ensayo de precisión preliminar, y los resultados obtenidos en el ensayo de repetitividad y precisión intermedia se muestran en la Tabla II.
Tabla I. Resultados de precisión preliminar.
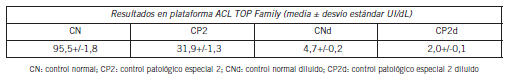
Tabla II. Resultados de repetitividad y precisión intermedia.

Los resultados de CVr y CVi son menores de 6% y comparables a los informados por el fabricante para este método cromogénico en la plataforma ACL Futura/ ACL Advance (Tabla II).
Linealidad
El método mostró comportamiento lineal en el rango de medición: 0,3-129 UI/dL, pendiente: 0,99 (0,98- 1,00); ordenada al origen: 0,44 (-0,06-0,94) (Fig. 3). Límite de cuantificación: 0,3 UI/dL.

Figura 3. Rango de medición analítica para el método cromogénico.
Comparación de métodos
Al aplicar el protocolo EP9 para la curva de rango normal-bajo se obtuvieron los siguientes resultados: FVIII:Ccoag vs. FVIII:Ccro r: 0,98, pendiente: 0,982 (0,961–1,003), ordenada al origen: -0,3 (-1,1–0,5), sesgo: -2,0%. Para CRMB: se obtuvo un coeficiente de correlación de 0,96, pendiente: 0,921 (0,855–0,988), ordenada al origen: -0,07 (-0,35–0,20), sesgo: -10,2%. En la Figura 4 se muestra la correlación entre ambas metodologías. Se observa que en la curva de rango normal-bajo los métodos tuvieron mejor correlación que en los niveles muy bajos. Para niveles por encima de 129% de FVIII:C, las muestras tuvieron que ser diluidas debido a que se encontraban por encima del rango de medición analítica. En la comparación clínica entre ambas metodologías se encontraron discrepancias en 4 muestras de pacientes, lo que cambió su categorización inicial de severidad de la enfermedad. Los niveles más bajos medidos por FVIII:C cromogénico correlacionaron con su fenotipo clínico de sangrado (Fig. 5).
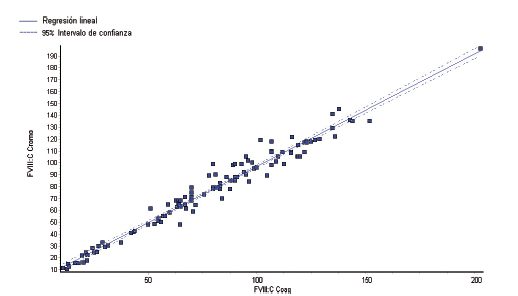
Figura 4. Correlación de métodos en el rango de la curva normal baja (11-203 UI/dL).
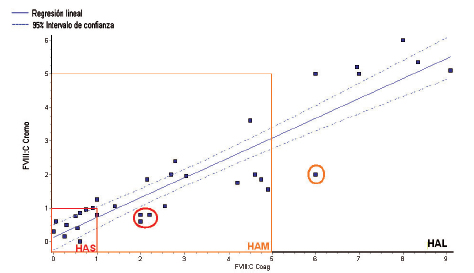
Figura 5. Correlación de métodos en el rango de la curva muy baja (<10 UI/dL).
Error Total (ET)
Los requerimientos de calidad en términos de imprecisión establecidos por Variabilidad Biológica (VB) mínima y por ECAT considerando un sesgo despreciable se calcularon según la siguiente fórmula: (ETa): (1,65CV%+ES). VB mínimo: 8,0%, ECAT: 20,6%. El error total obtenido con un 90% de confianza se obtuvo de la siguiente fórmula: EA+ES=1,65*CV%+ES. Para la curva de rango normal-bajo fue de 9,8%, mientras que para los niveles muy bajos medidos con la CRMB fue de 19,1%, en ambos casos menores al ETa calculado por el estado del arte.
Rango de referencia
El valor de referencia para esta metodología fue establecido tras estudiar 120 donantes de sangre, 58% hombres, de 18 a 65 años de edad que firmaron el consentimiento para la realización del estudio, en donde 42 donantes pertenecían al grupo sanguíneo “cero”. El valor de referencia obtenido para los 120 individuos fue de 40-155 UI/dL. Cuando se tuvo en cuenta el grupo sanguíneo, el rango obtenido fue: FVIII:C 55-155 UI/dL para el grupo “no cero” y de 40-130 UI/dL para el grupo “cero”, similares a los obtenidos por el método coagulable en una etapa en la misma plataforma y con los mismos reactivos.
Discusión y Conclusiones
El dosaje de FVIII:C por el método cromogénico se basa en un principio similar al del ensayo de dos etapas coagulable, excepto que la medición del punto final es cromogénica, lo que elimina las dificultades que implica la detección del coágulo en los distintos sistemas de medición. Como principales ventajas, el ensayo cromogénico no está afectado por la activación de la muestra en una extracción dificultosa (presencia de FVIIIa), por la presencia de heparina o inhibidores directos de la trombina, según los niveles presentes en la muestra, o por la presencia de anticoagulante lúpico (2). El número de ensayos disponibles en el mercado minimiza la variabilidad del ensayo cromogénico en comparación con el ensayo coagulable en una etapa.
Diversos autores han informado que el fenotipo clínico se corresponde mejor con el ensayo cromogénico en dos etapas que con el ensayo de una etapa. Sin embargo, otros autores cuestionan al ensayo cromogénico por su alto costo y por no ser un método totalmente fisiológico. A pesar de las ventajas señaladas más arriba, el uso del ensayo cromogénico en los laboratorios clínicos es limitado, quizás debido a la percepción de mayores costos de reactivos en comparación con el método coagulable en una etapa y a la falta de ensayos cromogénicos automatizables validados. Se ha estimado que con el fraccionamiento y conservación de los reactivos a -70 °C los costos podrían reducirse hasta en un 50-75%, lo que potencialmente anularía este problema. Cada laboratorio debería corroborar que los reactivos que utiliza presenten la estabilidad informada por el fabricante y probar la estabilidad de cada reactivo durante los procesos de congelamiento y descongelamiento (12).
Según las guías internacionales, todos los laboratorios de coagulación de centros de hemofilia deberían utilizar ambos métodos para la determinación de la actividad del FVIII, sobre todo porque el 10-15% de los pacientes con HA leve (genéticamente confirmados), muestran valores más bajos por el método cromogénico. Esto se correlaciona con su fenotipo clínico, lo cual podría deberse a que la inestabilidad de la molécula mutada es puesta de manifiesto en el mayor tiempo de incubación del método cromogénico (13-15).
Actualmente en el tratamiento de la hemofilia, la introducción de nuevas moléculas recombinantes modificadas de FVIII y nuevos enfoques alternativos como anticuerpos miméticos (Emicizumab ACE910), aumentan la necesidad de que los laboratorios introduzcan el ensayo cromogénico como un ensayo de rutina. Si bien el método cromogénico está basado en el mismo principio que el método coagulométrico en dos etapas, y puede ser automatizado totalmente, no hay informes de una metódica universal o de que las técnicas estén validadas en la mayoría de las plataformas automatizadas. En este trabajo se muestran los resultados obtenidos de la validación del método cromogénico en la plataforma ACL TOP Family. Según los resultados obtenidos, esta plataforma muestra adaptabilidad de la metódica cromogénica para el dosaje de actividad de FVIII y es de fácil utilización por el usuario en cuanto a la preparación de reactivos, procesamiento de las muestras y evaluación del desempeño del mismo. El desempeño del método fue aceptable en términos de imprecisión. Respecto a lo informado por el fabricante acerca del uso del mismo ensayo en otra plataforma, el método mostró valores de imprecisión inferiores en la curva de rango normal-bajo y ligeramente mayores en la curva de rango muy bajo, pero en ambos casos se cumplió con los requerimientos de calidad establecidos.
En el análisis de la comparación de métodos (FVIII:Ccro vs. FVIII:Ccoag) se observó que las muestras procesadas utilizando la curva de rango normal bajo tuvieron la mejor correlación al ser comparadas con los niveles muy bajos, probablemente por el alto CV del método coagulable en una etapa para este nivel de concentración de FVIII. Cuando las muestras tenían niveles de FVIII:C medidos por método coagulable en una etapa por encima de 129 UI/dL las muestras tuvieron que ser diluidas debido a que se encontraban por encima del rango de medición analítica, mejorando la correlación.
El bajo límite de cuantificación de la metodología (0,3 UI/dL) mejora la performance analítica respecto a algunos métodos en una etapa en determinados sistemas reactivo-instrumento que no tienen la capacidad de medir niveles <10 UI/dL con una incertidumbre aceptable, lo cual dificulta el diagnóstico y tratamiento de los pacientes con HA (métodos semiautomáticos, manuales, sin posibilidad de realizar una curva baja de medición). En la población estudiada con ambas metodologías se encontraron discrepancias en 4 muestras de pacientes, lo que cambió su categorización inicial de severidad de la enfermedad, correlacionando los niveles más bajos medidos por FVIII:C cromogénico con su fenotipo clínico de sangrado (FVIII:Ccoag/FVIII:Ccro: Paciente 1= 6/2; Paciente 2= 2/0,8; Paciente 3= 2/0,6; Paciente 4= 2,2/0,8). En estos pacientes se encuentra pendiente el estudio genético para confirmar que se correspondan con mutaciones frecuentemente asociadas a discrepancias entre los métodos. Las mutaciones más frecuentes incluyen mutaciones missense (con sentido equivocado) donde la relación FVIII:Ccoag/FVIII:Ccro es mayor de 1,5 o 2,0. Según la bibliografía, éstas se corresponderían a mutaciones localizadas en el dominio de interfase A1-A2-A3, lo que causa un FVIIIa inestable, mejor detectado por el método cromogénico. Otras mutaciones que generan discrepancias, pero ahora la relación FVIII:Ccoag/FVIII:Ccro sería <0,5, son mutaciones localizadas en los sitios de clivaje por trombina o sitios de unión al FIXa, lo cual debido al uso de concentraciones fisiológicas de FIX y trombina en el método en una etapa lo hace más sensible a la detección de la misma, a diferencia del método cromogénico (16-18).
Sin embargo en una publicación, Trossaert et al. señalaron que todavía existen dos cuestiones pendientes de resolución: no existe una definición clara para la denominada “discrepancia entre los ensayos” y son pocos los estudios que correlacionan los niveles de FVIII con el fenotipo de sangrado (19). De acuerdo a los resultados obtenidos en este trabajo, la determinación de FVIII cromogénico es automatizable en las plataformas ACL TOP 500 y ACL TOP 300 con un desempeño analítico global aceptable por lo que permite ser utilizada para el diagnóstico y monitoreo de los pacientes hemofílicos.
1. Kitchen S, Olson J, Preston E. Quality in Laboratory Hemostasis and Thrombosis. Second Edition. West Sussex, UK: Wiley-Blackwell; 2013. p.111-2. [ Links ]
2. Kitchen S, McCraw A, Echenagucia M. Diagnóstico de hemofilia y otros trastornos de la coagulación. Second edition; Montreal: FMH; 2010. p. 76-8. [ Links ]
3. Blanco A, Kordich L (eds.). Fundamentos para el manejo práctico en el laboratorio de Hemostasia. Segunda Edición. Buenos Aires: Grupo CAHT; 2018. p. 302-5. [ Links ]
4. Parquet-Gernez A, Mazurier C, Goudemand M. Functional and immunological assays of FVIII in 133 haemophiliacs-- characterization of a subgroup of patients with mild haemophilia A and discrepancy in 1- and 2-stage assays. Thromb Haemost 1988; 59: 202-6. [ Links ]
5. Duncan EM, Duncan BM, Tunbridge LJ, Lloyd JV. Familial discrepancy between one stage and two stage FVIII assay methods in a subgroup of patients with haemophilia A. Br J Haematol 1994; 87: 846-8. [ Links ]
6. Potgieter J, Damgaard M, Hillarp A. One-stage vs. chromogenic assays in haemophilian A. European J Haematol 2015; 94 Suppl 77: 38–44.
7. White GC 2nd, Rosendaal F, Aledort LM, Lusher JM, Rothschild C, Ingerslev J. Definitions in hemophilia. Recommendation of the scientific subcommittee on factor VIII and factor IX of the scientific and standardization committee of the International Society on Thrombosis and Haemostasis. Thromb Haemost 2001; 85 (3): 560. [ Links ]
8. Tholen D, Kallner A, Kennedy J (deceased), Krouwer J, Meier K. Evaluation of precision performance of quantitative measurement methods; Document EP05-A2 second edition approved guideline 2004. Clinical and Laboratory Standards Institute (CLSI). USA. ISBN 1-56238-542-9. [ Links ]
9. Tholen D, Kroll M, Astles R, Caffo A, Happe T, Krouwer J, et al. Document EP06 Evaluation of the linearity of quantitative measurement procedures: A Statistical Approach; Approved Guideline 2003. Clinical and Laboratory Standards Institute (CLSI). USA. ISBN 1-56238-498-8. [ Links ]
10. Krouwer J, Tholen D, Garber C, Goldschmidt H, Kroll M, Linnet K et al. Method comparison and bias estimation using patient samples; Document EP9-A2 approved guideline 2002 - second edition. Clinical and Laboratory Standards Institute (CLSI). USA. ISBN 1-56238-472-4. [ Links ]
11. Horowitz G, Altaie C, Boyd J, Ceriotti F, Garg U, Horn P, et al. Defining, stablishing, and verifying reference intervals in the clinical laboratory; Document EP28- A3c approved guideline 2010 - third edition. Clinical and Laboratory Standards Institute (CLSI). USA. ISBN 1-56238-682-4. [ Links ]
12. Bowyer A, Duncan E, Antovic J. Bowyer. Role of chromogenic assays in haemophilia A and B diagnosis. Haemophilia 2018 Jul; 24 (4): 578-83. [ Links ]
13. Oldenburg J, Pavlova A. Discrepancy between one-stage and chromogenic factor VIII activity assay results can lead to misdiagnosis of haemophilia A phenotype. Hamostaseologie 2010; 30: 207–11.
14. Rodgers SE, Duncan EM, Barbulescu DM, Quinn DM and Lloyd, J.V. In vitro kinetics of factor VIII activity in patients with mild haemophilia A and a discrepancy between one-stage and two-stage factor VIII assay results. Br J Haematol 2007; 136: 138–45.
15. Duncan EM, Rodgers, SE, McRae SJ. Diagnostic testing for mild hemophilia A in patients with discrepant onestage, two-stage, and chromogenic factor VIII:C assays. Semin Thromb Hemost 2013; 39: 272–82.
16. Pavlova A, Delev D, Pezeshkpoor B, Muller J, Oldenburg J. Haemophilia A mutations in patients with non-severe phenotype associated with a discrepancy between one-stage and chromogenic factor VIII activity assays. Thromb Haemost 2014; 111: 851–61.
17. Cid AR, Calabuig M, Cortina V, Casana P, Haya S, Moret A, et al. One-stage and chromogenic FVIII:C assay discrepancy in mild haemophilia A and the relationship with the mutation and bleeding phenotype. Haemophilia 2008; 14: 1049–54.
18. Trossaert M, Boisseau P, Quemener A, Sigaud M, Fouassier M, Ternisien C, et al. Prevalence, biological phenotype and genotype in moderate/mild hemophilia A with discrepancy between one-stage and chromogenic factor VIII activity. J Thromb Haemost 2011; 9: 524–30.
19. Trossaert M, Lienhart A, Nougier C, Fretigny M, Sigaud M, Meunier S, et al. Diagnosis and management challenges in patients with mild haemophilia A and discrepant FVIII measurements. Haemophilia 2014 Jul; 20 (4): 550-8. [ Links ]
Recibido: 20 de mayo de 2019
Aceptado: 27 de junio de 2019














