Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.2 La Plata jun. 2020
MICROBIOLOGÍA
Contaminación ambiental por microorganismos multirresistentes y el efecto de la limpieza y desinfección en una unidad de cuidados intensivos
Marina Yiyela Masó1*, Ana Claudia Sesma2, Sandra Pintado3, Carolina Santolin4, Tomás Ignacio Luna5, Sandra Mariela Mangiaterra6
1 Bioquímica, área de Bacteriología, Servicio de Laboratorio.
2 Bioquímica Especialista en Bacteriología, área de Bacteriología, Servicio de Laboratorio.
3 Enfermera en Control de Infecciones (E.C.I.), Servicio de Enfermería.
4 Bioquímica Especialista en Bacteriología.
5 Médico, Unidad de Cuidados Intensivos de Adultos.
6 Bioquímica Especialista en Bacteriología, Jefa del área de Bacteriología, Servicio de Laboratorio. Hospital Italiano. Roma 550. Córdoba. Argentina.
* Autor para correspondencia.
Correspondencia Bioq. Marina Yiyela Masó Correo electrónico: marinamaso@hotmail.com
Resumen
Conocer el rol del medio ambiente es fundamental para evitar las infecciones intra-hospitalarias. Con ese objetivo, se planteó evaluar la prevalencia de contaminación ambiental por microorganismos multirresistentes (MMR) antes y después de la limpieza terminal de habitaciones de pacientes colonizados y establecer si la aparatología de uso común actuaba como reservorio de estos en la unidad de cuidados intensivos (UTI). Se obtuvieron muestras ambientales de las habitaciones, 48 h posteriores a la detección de colonización y luego de las limpiezas. Los resultados mostraron que luego de ambos procedimientos de limpieza se logró reducir de 28,2% a 2,6% la contaminación por Acinetobacter spp. multirresistente (AMR). También, se tomaron muestras de aparatología de uso común encontrándose entre 1,8 y 5,4% de contaminación por MMR. La limpieza y desinfección reducen significativamente la contaminación ambiental. Sin embargo, la colonización de equipos por MMR y el incumplimiento de precauciones universales representan una posibilidad de transmisión cruzada.
Palabras clave: Colonización por microorganismos multirresistentes; Contaminación de superficies hospitalarias; Limpieza y desinfección; Acinetobacter spp. multirresistente; Infecciones asociadas al cuidado de la salud.
Abstract
Environmental contamination by multi-resistant microorganisms and the effect of cleaning and disinfection in an intensive care unit
It is essential to understand the role of the environment in order to avoid intrahospital infections. To achieve this objective, this research proposes to assess the prevalence of the environmental contamination caused by multi-resistant microorganisms (MRM) before and after terminal disinfection in rooms with colonized patients, but also to establish whether the commonly used device acts as a reservoir of those micro-organisms in an intensive care unit (ICU). Environmental samples were obtained from the rooms, 48 hours after detecting colonization and also after the first and second final cleaning. The results showed that after both procedures, there was a reduction from 28.2% to 2.6% of contamination caused by multi-resistant Acinetobacter spp. (AMR). Samples from appliances and supplies were taken as well, in which case, between 1.8 and 5.4% of contamination levels induced by MMR were found. Cleaning and disinfecting significantly reduce environmental contamination. However, both MMR bacterial colonization and the lack of universal precautions enforcement represent a possibility of cross-transmission.
Keywords: Colonization by multi-resistant microorganisms; Contamination of hospital surfaces; Cleaning and disinfection; Multi-resistant Acinetobacter spp.; Health care-associated infections.
Resumo
Contaminação ambiental por micro-organismos multirresistentes e o efeito de limpeza e desinfecção em unidade de terapia intensiva
É essencial conhecer o papel do meio ambiente para evitar as infecções intra-hospitalares. Com esse objetivo, planejou-se avaliar a prevalência de contaminação ambiental por microorganismos multirresistentes (MMR) antes e depois da limpeza final dos quartos de pacientes colonizados e estabelecer se os aparelhos de uso comum atuavam como um reservatório deles na unidade de terapia intensiva (UTI). Obtiveram-se amostras ambientais dos quartos 48 horas após a detecção da colonização e logo após as limpezas finais. Os resultados mostraram que depois dos dois procedimentos de limpeza se obteve uma redução de 28,2% para 2,6% da contaminação por Acinetobacter spp. multirresistente (AMR). Foram obtidas também amostras de aparelhos de uso comum onde se encontraram entre 1,8% e 5,4% de contaminação por MMR. A limpeza e a desinfecção reduzem significativamente a contaminação ambiental. Contudo, a colonização de equipamentos por MMR e o não cumprimento de providências universais representam uma possibilidade de transmissão cruzada.
Palavras-chave: Colonização por micro-organismos multirresistentes; Contaminação de superfícies hospitalares; Limpeza e desinfecção; Acinetobacter spp. multirresistente; Infecções associadas aos cuidados com a saúde.
Introducción
Las infecciones asociadas al cuidado de la salud (IACS) constituyen el evento adverso más frecuente en la atención sanitaria, siendo una de las principales causas de aumento de morbilidad y mortalidad de los pacientes (1-3).
Generalmente son producidas por microorganismos multirresistentes (MMR), que son aquellos aislamientos bacterianos que presentan resistencia al menos a tres grupos de antibióticos. Suelen provenir de la microbiota endógena del paciente; sin embargo, se estima que entre el 20% y 40% de las IACS se originan por transmisión cruzada a través de las manos del personal de salud, quienes previamente hubieran tenido contacto directo con pacientes colonizados o infectados por estas bacterias o indirecto al tocar superficies ambientales contaminadas (3-6). Existe amplia evidencia de que el medio ambiente hospitalario actúa como reservorio de microorganismos patógenos, capaces de sobrevivir por períodos prolongados de tiempo en diversas condiciones (7).
Así también, está descripto que la desinfección de las áreas de alto contacto reduce la carga bacteriana de las superficies inanimadas, por lo que la aplicación de procedimientos de higiene hospitalaria adecuados constituye una medida efectiva y rentable para prevenir la diseminación de patógenos y, en consecuencia, disminuir las IACS (8).
Los objetivos de este trabajo fueron, por un lado, evaluar la prevalencia de contaminación ambiental por Acinetobacter spp. multirresistente (AMR) y enterobacterias productoras de carbapenemasas (EPC) antes y después de la limpieza terminal de las habitaciones de pacientes colonizados por dichas bacterias y, por otro lado, valorar la presencia de MMR en la aparatología de uso común en los pacientes.
Materiales y Métodos
En el período comprendido entre agosto de 2017 y agosto de 2018, a efectos de cumplir con los objetivos de este estudio, se obtuvieron 135 muestras ambientales de las habitaciones de pacientes colonizados por MMR de la UTI del Hospital Italiano de Córdoba. Las muestras fueron recolectadas en tres momentos pautados: 48 h posteriores a la detección de colonización y/o infección del paciente (pre-limpieza), luego de la primera y segunda limpieza terminal cuando dicho paciente recibía el alta de la habitación y previo a la admisión de un nuevo paciente (post-primera limpieza y post-segunda limpieza). Las mismas fueron obtenidas de sitios preestablecidos en cada habitación (monitor multiparamétrico, baranda de la cama, mesa de comer y el teclado de la bomba de infusión de medicamentos) por ser áreas de alto contacto. Además, se tomaron muestras semanales del botón disparador del aparato de rayos X y del botón del electrocardiógrafo utilizados en todos los pacientes internados en UTI, del tubo y teclado del teléfono y del teclado de la computadora portátil que son de uso común para el personal de salud.
Para su recolección se utilizaron hisopos estériles embebidos en solución fisiológica, los cuales se rotaron y deslizaron por las superficies indicadas y luego fueron colocados en caldo de enriquecimiento por 24 h a 35±2 °C. Posteriormente los caldos fueron subcultivados en medios de cultivo cromogénicos (CHROMagarmSuperCARBA ®) y se incubaron a 35±2 °C en atmósfera aeróbica con el objetivo de detectar colonias sospechosas de EPC y AMR. La primera lectura se realizó a las 24 h, y en ausencia de crecimiento se efectuó una nueva lectura a las 48 h. Ante el desarrollo de colonias con la pigmentación adecuada, según especificaciones del fabricante, se procedió a realizar la identificación bacteriana y el antibiograma utilizando pruebas manuales o automatizadas (Vitek ll; bioMérieux, Marcy l’Étoile, Francia).
Se realizó un análisis estadístico porcentual con los datos obtenidos.
Criterios de inclusión
Solo se incluyeron para el análisis de datos, las muestras de las habitaciones de pacientes colonizados por MMR (hisopado rectal positivo), en las que se logró cumplimentar con las tres etapas de toma de muestras ambientales. Debido a la amplia variabilidad de definiciones en la literatura médica, el término MMR a los fines de este trabajo, y en concordancia con varios autores, ha sido usado de manera genérica para denotar resistencia a tres o más clases de antimicrobianos considerados de utilidad para el tratamiento de las infecciones producidas por cada una de las especies bacterianas consideradas. Debido a la epidemiología local, en el caso de Enterobacterias y Acinetobacter spp., se utilizó como marcador principal la resistencia a carbapenemes (6) (9)(10).
Procedimiento operativo estandarizado (POE) de limpieza terminal en habitaciones de aislamiento por MMR utilizado en nuestra institución
Una vez desocupada la habitación de un paciente colonizado por MMR, el personal de limpieza, exclusivo de UTI, procedía a la limpieza y desinfección de la misma. Para ello se utilizaba un paño de microfibra para el mobiliario, uno para el baño, y un trapo de piso. Estos elementos eran propios de cada habitación y no debían ser compartidos. La limpieza se realizaba utilizando un limpiador desinfectante a base de monopersulfato de potasio al 20% (Viodex®), reconstituido según indicaciones del fabricante. Para su uso se rociaba la unidad con el desinfectante, se dejaba actuar 15 minutos y se comenzaba a secar desde las zonas menos sucias progresando a las más sucias, desde las zonas más altas hacia las más bajas, desde adentro hacia afuera, haciendo fricción con el paño embebido en el desinfectante y escurrido (post-primera limpieza). Luego de 20 minutos se repetía el procedimiento (post-segunda limpieza). Los monitores y respiradores (pantallas LED) solo se limpiaban con un paño humedecido con el desinfectante.
Resultados
Durante el período de estudio se recolectaron muestras ambientales de las 39 habitaciones de pacientes colonizados por AMR y EPC y que cumplieron con los criterios de inclusión mencionados previamente. El 87,5% de las cepas aisladas de los pacientes colonizados correspondieron a AMR, 10% a Klebsiella pneumoniae productora de carbapenemasa tipo KPC y 2,5% a Escherichia coli productora de carbapenemasa tipo KPC, dato que resulta importante al momento de comparar con los aislamientos ambientales. En los controles pre-limpieza de las habitaciones se encontraron 11 muestras positivas de un total de 135 muestras (8,1%); en la post-primera limpieza se obtuvieron 2 muestras positivas de 135 muestras totales (1,5%) y luego de la segunda limpieza, de las 135 muestras, solo una fue positiva (0,7%). En todos estos casos el MMR aislado fue AMR.
Los aislamientos de AMR en las muestras pre-limpieza se detectaron en 2 de 39 muestras del monitor multiparamétrico (5,1%), en 1 de 39 muestras de la mesa de comer (2,6%), en 6 de 39 muestras de la baranda de la cama (15,4%) y en 2 de 18 muestras del teclado de la bomba de infusión para medicamentos (11,1%). Cabe aclarar que en este último caso el número total de muestras fue de 18 debido a que este equipo era rápidamente removido de las habitaciones y no se pudieron completar las muestras post-limpieza en todos los casos. En los controles, luego de la primera limpieza, los aislamientos correspondientes a AMR se detectaron en 1 de 39 muestras en el monitor multiparamétrico (2,6%), en 1 de 39 muestras en la mesa de comer (2,6%) y no se obtuvo desarrollo en los hisopados de la baranda de la cama ni en el teclado de la bomba de infusión para medicamentos.
Después de la segunda limpieza, los aislamientos correspondientes a AMR se detectaron en 1 de 39 muestras en la baranda de la cama (2,6%) y no se obtuvieron aislamientos en los elementos restantes (Tabla I).
Tabla I. AMR en muestras pre y post-limpiezas terminales.

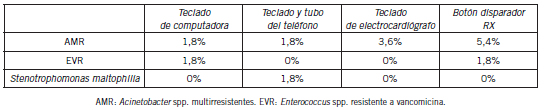
En el mismo período de tiempo se evaluaron semanalmente algunos de los elementos de uso común en UTI, que no se encuentran en forma permanente en el entorno del paciente pero sí toman contacto, de manera directa o indirecta, en algún momento de su estadía. Se incluyeron el botón disparador de rayos X, el teclado del electrocardiógrafo, el teclado de la computadora portátil y el teclado y el tubo del teléfono, de los que se obtuvieron 55 muestras de cada uno. Se detectaron 10 muestras positivas: AMR fue el microorganismo más prevalente (70,0% de las muestras positivas), seguido de Enterococcus spp. resistente a vancomicina (EVR) (20,0%) y por último, Stenotrophomonas maltophilia (10,0%).
El nivel más alto de contaminación por MMR se obtuvo en el botón disparador de rayos X con 7,3%, seguido del teclado del electrocardiógrafo, del teclado de la computadora portátil y del teclado y del tubo del teléfono, todos ellos con 3,6%. Dentro de los microorganismos aislados, AMR se detectó en 3 de 55 muestras de botón disparador de rayos X (5,4%), en 2 de 55 muestras en el teclado del electrocardiógrafo (3,6%), un aislamiento en el teclado de la computadora portátil (1,8%) y un aislamiento en el teclado y tubo del teléfono (1,8%). EVR se aisló en una de 55 muestras en el botón disparador de rayos X (1,8%), al igual que en el teclado de la computadora portátil. Stenotrophomonas maltophilia se aisló en una de 55 muestras del teclado y del tubo del teléfono (1,8%) (Tabla II).
Tabla II. Contaminación por MMR en aparatología de UTI.
Discusión y Conclusiones
La contaminación de las superficies del entorno del paciente constituye uno de los aspectos más controvertidos en el control de infecciones nosocomiales. Los pacientes colonizados son la principal fuente de contaminación, por lo que su rápida detección y aislamiento son medidas indispensables para evitar la diseminación de los patógenos. Pero hay otros puntos a tener en cuenta, como la dificultad de eliminación de estos patógenos, la capacidad de supervivencia de los MMR en áreas inanimadas y la falta de estándares de control de limpieza de las mismas (3)(11)(12).
Habitualmente no se recomienda el estudio de superficies de manera rutinaria. La mayoría de los controles microbiológicos ambientales se realizan en situación de brote y motivados por el comité de control de infecciones buscando un patógeno determinado. No obstante, diversas publicaciones sostienen que, debido a la reducción de opciones terapéuticas por la diseminación de MMR, ha cobrado especial importancia la monitorización y actuación preventiva para evitar la contaminación ambiental, y no solo la búsqueda de reservorios en situación de brote (11)(13).
En concordancia con lo expuesto, fue que se decidió evaluar, excepcionalmente y en el marco de este trabajo, la contaminación ambiental por MMR pre- y post-limpieza y así obtener una perspectiva real de la situación en la UTI de esta institución. Se pudo observar que luego de las limpiezas hubo una reducción importante en la contaminación ambiental. A pesar de eso, un bajo porcentaje de las habitaciones continuaron contaminadas por AMR luego de la primera limpieza y en un solo caso se detectó contaminación luego de la segunda limpieza, con hisopado previo negativo. Como explican Farrin et al., esto puede ser consecuencia de una variación en el tamaño de la superficie muestreada o de una recontaminación de la misma (14).
Dentro de los microorganismos investigados en este estudio, sólo se encontró contaminación ambiental por AMR en el entorno de los pacientes, EPC no fueron aisladas de las muestras recolectadas. Esto puede ser debido, no solo a la mayor prevalencia de pacientes colonizados por AMR por sobre EPC, sino además a que Acinetobacter sp. tiene la habilidad de persistir en superficies inanimadas secas por largos períodos de tiempo, mientras que las EPC, generalmente, no se transmiten a los pacientes a través de esta vía, ya que no suelen sobrevivir por más de 7 h en dichas condiciones. Por esto se estima que la transmisión de estos microorganismos se da por contaminación cruzada entre pacientes y manos del personal o por diseminación endógena (1)(8)(15-18).
Diversas publicaciones aseguran que las superficies tocadas frecuentemente por los pacientes y/o el personal de salud durante la atención habitual de los mismos, están usualmente contaminadas y se convierten en una fuente de transmisión nosocomial (4)(12)(19). En este estudio se decidió evaluar el monitor multiparamétrico, la mesa de comer, la baranda de la cama y el teclado de la bomba de infusión de medicamentos por ser áreas de alto contacto. En las muestras pre-limpieza, la superficie con mayor contaminación fue la baranda de la cama, seguida por el teclado de la bomba de infusión de medicamentos (se debe tener en cuenta que el número de muestras totales para este caso fue menor), el monitor multiparamétrico y la mesa de comer. Luego de ambos procedimientos de limpieza se observó una reducción significativa de contaminación por AMR (de 8,1% a 0,7%). Estos resultados permiten demostrar que la aplicación de procedimientos de limpieza estandarizados, en cada institución, es de gran utilidad para el control de la transmisión cruzada y altamente recomendada, al igual que el entrenamiento periódico del servicio de limpieza.
Otro de los aspectos que se analizó fue la contaminación de algunos de los elementos de uso común en UTI. Por un lado, se incluyó el botón disparador de rayos X y el botón del electrocardiógrafo que se utilizan para todos los pacientes internados en esa unidad, es decir, son elementos que ingresan a la zona del paciente (incluye al paciente y su entorno inmediato) por un período corto de tiempo por lo que pueden contaminarse rápidamente por el contacto directo con el paciente o indirectamente a través de las manos del personal de salud. Por otro lado, se incluyó el tubo y el teclado del teléfono y la computadora portátil que solo son utilizados por el personal de salud en el área sanitaria (elementos que se encuentran fuera de la zona del paciente y que no entran en contacto directo con ellos) debido a que pueden ser contaminados por el personal de salud posteriormente al contacto con pacientes si no se aplicaran las precauciones universales correctamente (20). La contaminación del teléfono y la computadora por gérmenes intrahospitalarios como EVR, Stenotrophomonas maltophilia y AMR corrobora la hipótesis de que las superficies que se tocan a menudo se contaminan más y además refuerza la idea de que en ocasiones, los profesionales no lavan sus manos luego de la atención al paciente y regresan a sus actividades sin tomar conciencia del riesgo de transmisión de MMR (20)(21).
En el caso de botón del aparato de rayos X y del botón del electrocardiógrafo y, en concordancia con el trabajo publicado por Russotto et al., las especies aisladas en más de una oportunidad en los equipos coincidirían con las aisladas en los pacientes incluidos en este estudio. Esto confirma que los equipos y el personal que los utiliza representan un reservorio de MMR y una posibilidad inminente de transmisión cruzada. Si bien en este trabajo no se realizaron estudios moleculares para confirmar la identidad entre cepas aisladas de pacientes y las ambientales, todos los aislamientos presentaron un antibiotipo similar. Según López-Cerero no hay recomendaciones específicas ni sistemas de verificación de limpieza estandarizados de los dispositivos móviles que se utilizan entre paciente y paciente (electrocardiógrafo, aparatos de rayos X, glucómetro, etc.) por lo que queda a criterio de cada unidad asistencial (11)(21)(22).
En conclusión, existe una vasta evidencia de la implicancia de las superficies contaminadas en la transmisión de patógenos nosocomiales, de manera directa o indirecta, que se encuentra en estrecha relación con la capacidad de estos microorganismos de permanecer viables por prolongados períodos de tiempo aún en condiciones desfavorables. Los procedimientos de limpieza tienen una gran relevancia dentro de los programas de control de IACS, ya que reducen significativamente la contaminación ambiental, para poder lograr una disminución de la colonización o infección por MMR. No obstante, es imprescindible aplicar programas que incluyan otros componentes esenciales como higiene de manos, medidas de aislamiento, uso adecuado de antibióticos y capacitación continua en estos aspectos.
Todas las recomendaciones propuestas anteriormente deberían ser aplicadas de manera conjunta, continua y en todos los pacientes. Todos los trabajadores de la salud deberían ser conscientes de ello y trabajar para garantizar niveles superiores de seguridad y calidad asistencial.
Agradecimientos
Los autores agradecen al servicio de limpieza de UTI, al Bioq. Esp. en Bacteriología Cristian Amieva y a la Técnica de Laboratorio Clínico e Histopatología Claudia Da Roit por la ayuda brindada durante la realización del trabajo. También agradecen a Patricia Ribas y a Ana Cecilia Luna por las traducciones en portugués e inglés respectivamente.
Fuentes de financiación
El presente trabajo fue realizado sin haberse recibido una financiación específica.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses respecto del presente trabajo.
1. Santolin C, Sesma AC, Llansa MA, Pintado S, Masso M, Mangiaterra SM. Colonización rectal por bacilos gram negativos multirresistentes: importancia de la detección precoz durante la hospitalización. Acta Bioquím Clín Latinoam 2017; 51: 675-80. [ Links ]
2. Gordon ZEJ, Masaquiza MDA, Gallegos MFA, Mayorga GER. La infección nosocomial. Un reto en las unidades de cuidados intensivos. Enferm Inv (Ambato) 2018; 3 (Sup.1): 28-33. [ Links ]
3. Gigante León A, Pavón Chocano MP, Hernández Martínez A, Patiño Patiño S, García Laguna RA. Incidencia de Acinetobacter baumannii en las superficies de contacto más habituales en una unidad de cuidados intensivos. NURE Inv 2015; 75: 1-12. [ Links ]
4. Weber DJ, Rutala WA, Miller MB, Huslage K, Sickbert- Bennett E. Role of hospital surfaces in the transmission of emerging health care-associated pathogens: Norovirus, Clostridium difficile, and Acinetobacter species. American J Infect Control 2010; 38: 25-33. [ Links ]
5. Zúñiga Carrasco IR, Caro Lozano J. Cultivos ambientales y de superficie: una estrategia de detección oportuna de infecciones nosocomiales. Rev Latin Infect Pediatr 2017; 30 (4): 147-50. [ Links ]
6. Jiménez Pearson MA, Galas M, Corso A, Hormazábal JC, Duarte Valderrama C, Salgado Marcano N, et al. Consenso latinoamericano para definir, categorizar y notificar patógenos multirresistentes, con resistencia extendida o panresistentes. Rev Panam Salud Publica 2019; 43: e65. [ Links ]
7. Alfa MJ, Lo E, Olson N, Mac Rae M, Buelow-Smith L. Use of a daily disinfectant cleaner instead of a daily cleaner reduced hospital-acquired infection rates. Am J Infect Control 2015; 43 (2): 141-6. [ Links ]
8. Strassle P, Thom KA, Johnsonm JK, Leekha S, Lissauer M, Zhu J, et al. The effect of terminal cleaning on environmental contamination rates of multidrug-resistant Acinetobacter baumannii. Am J Infect Control 2012; 40: 1.005-7. [ Links ]
9. Falagas ME, Karageorgopoulos DE. Pandrug resistance (PDR), extensive drug resistance (XDR), and multidrug resistance (MDR) among gram-negative bacilli: need for international harmonization in terminology. Clin Infect Dis 2008; 46: 1.121-2. [ Links ]
10. German GJ, Gilmour M, Tipples G, Adam HJ, Almohri H, Bullard J, et al. Canadian recommendations for laboratory interpretation of multiple or extensive drug resistance in clinical isolates of Enterobacteriaceae, Acinetobacter species and Pseudomonas aeruginosa. Can Commun Dis Rep 2018; 44 (1): 29-34. [ Links ]
11. López-Cerero L. Papel del ambiente hospitalario y los equipamientos en la transmisión de las infecciones nosocomiales. Enferm Infecc Microbiol Clin 2013:1-6. [ Links ]
12. Thom KA, Johnson JK, Lee MS, Harris AD. Environmental contamination because of multidrug-resistant Acinetobacter baumannii surrounding colonized or infected patients. Am J Infect Control 2011; 39 (9): 711-5. [ Links ]
13. National Center for Emerging and Zoonotic Infectious Diseases. Division of Healthcare Quality Promotion. Facility guidance for control of carbapenem-resistant Enterobacteriaceae (CRE). Atlanta. CDC 2015 Update. [ Links ]
14. Farrin A, Manian MD, Griesenauer S, Senkel D,Setzer JM, Doll SA, et al. Isolation of Acinetobacter baumannii complex and methicillin-resistant Staphylococcus aureus from hospital rooms following terminal cleaning and disinfection: can we do better? Infect Control Hosp Epidemiol 2011; 32: 667-72. [ Links ]
15. Hota B. Contamination, disinfection, and cross-colonization: are hospital surfaces reservoirs for nosocomial infection? Clin Infect Dis 2004; 39: 1.182–9.
16. Neely AN. Persistence of microorganisms on common hospital surfaces -Strategies to control their dissemination. Infect Control Resour 2007; 4: 1-8. [ Links ]
17. Sesma AC. Acinetobacter baumanii. Un desafío de la microbiología y la medicina moderna. [Monografía de la Especialidad en Bacteriología. Facultad de Ciencias Químicas, Universidad Nacional de Córdoba] 2011. [ Links ]
18. Ramírez Sandoval MLP, Aranza Aguilar JL, Varela Ramírez MA, García González A, Vélez Castro G, Salcedo Romero R, et al. Brote de infección nosocomial de vías respiratorias bajas por Acinetobacter baumannii en un servicio de Medicina Interna de un hospital general de la Ciudad de México. Med Int Mex 2013; 29: 250-6. [ Links ]
19. Rutala WA, Weber DJ, the Healthcare Infection Control Practices Advisory Committee. Guideline for Disinfection and Sterilization in Healthcare Facilities. Centers for Disease Control and Prevention (CDC) 2008. [ Links ]
20. Russotto V, Cortegiani A, Raineri SM, Giarratano A. Bacterial contamination of inanimate surfaces and equipment in the intensive care unit. J Intensive Care 2015; 3: 54. [ Links ]
21. Oliveira AC, Damasceno QS. Surfaces of the hospital environment as possible deposits of resistant bacteria: a review. Rev Esc Enferm USP 2010; 44: 1.112-7. [ Links ]
22. Rivera Jacinto MA. Betalactamasas de espectro extendido en cepas de Escherichia coli y Klebsiella sp. aisladas de reservorios inanimados en un hospital del norte del Perú. Rev Esp Quimioter 2012; 25: 161-3. [ Links ]
Recibido: 4 de julio de 2019
Aprobado: 14 de enero de 2020














