Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.3 La Plata set. 2020
VIROLOGÍA
Alteraciones de parámetros de laboratorio en pacientes con SARS-CoV-2
Luis Edgardo López1a*, María Daniela Mazzucco2a
1 Bioquímico. Especialista en Emergentología. Especialista en Química Clínica con orientación en Nefrología y Medio Interno.
2 Bioquímica.
a Laboratorio Central del Instituto Modelo de Cardiología Privado S.R.L., Ciudad de Córdoba, Argentina.
* Autor para correspondencia.
Correspondencia Bioq. Esp. LUIS EDGARDO LÓPEZ Jefe de servicio de Laboratorio Central Instituto Modelo de Cardiología Privado S.R.L. Sagrada Familia 359, (5000) Ciudad de Córdoba, Argentina. Tel.: 0351-4656565 Int.: 495 Correo electrónico: luisbioq@gmail.com
Resumen
La enfermedad por coronavirus 2019 o COVID-19 que causa neumonía viral y que puede llegar al síndrome de distrés respiratorio agudo, falla multiorgánica y muerte generó un problema de salud de gran relevancia a nivel mundial. Este nuevo agente etiológico de reciente aparición, ha ocasionado desconcierto en los equipos de salud. La heterogeneidad de la presentación clínica del COVID-19 genera nuevos desafíos para la medicina de laboratorio. Hasta el momento se han informado múltiples hallazgos bioquímicos que cambian según las características clínicas del individuo infectado. Los informes de casos son diversos y varían según el lugar y los datos recopilados. En este contexto es necesario poder relacionar dichos sucesos con el desarrollo y curso de la enfermedad. La injerencia del laboratorio no está restringida únicamente al diagnóstico etiológico inicial. Los parámetros bioquímicos juegan un rol fundamental tanto en el monitoreo como en la estadificación y en el pronóstico de la enfermedad. El objetivo de la presente revisión fue abordar las principales alteraciones de parámetros de laboratorio relacionadas a la infección por SARS-CoV-2.
Palabras clave: SARS-CoV-2; COVID-19; Laboratorio; Parámetros; Alteraciones.
Abstract
Laboratory parameters changes in patients with SARS-CoV-2
Coronavirus 2019 or COVID-19, a disease which causes viral pneumonia and can reach acute respiratory distress syndrome, multi-organ failure and death, has generated a major health problem, with worldwide relevance. This new etiological agent of recent appearance has caused great confusion among health teams. The heterogeneity of the clinical presentation of COVID-19 brings about new challenges for laboratory medicine. So far, various biochemical findings have been reported, varying according to the infected individual’s clinical characteristics as well as to the location and data collected. In this context, it is necessary to be able to relate these events to the development and course of the disease. The role of the laboratory is not restricted only to the initial etiological diagnosis; biochemical parameters play a fundamental role in monitoring and both staging and prognosis of the disease. The objective of this review is to provide an overview of the main laboratory parameter alterations related to SARS-CoV-2 infection.
Keywords: SARS-CoV-2; COVID-19; Laboratory; Parameters; Alterations.
Resumo
Alterações de parâmetros laboratoriais em pacientes com SARS-CoV-2
A doença por coronavírus 2019 ou COVID-19, que causa pneumonia viral podendo chegar à síndrome de angústia respiratória, falha de múltiplos órgãos e morte, provocou um problema de saúde de grande relevância em nível mundial. Esse novo agente etiológico de recente aparecimento causou grande perplexidade nas equipes de saúde. A heterogeneidade da apresentação clínica do COVID-19 cria novos desafios para a medicina laboratorial. Até agora foram relatadas várias descobertas bioquímicas que variam de acordo com as características clínicas da pessoa infectada. Os relatórios dos casos são diversos e variam de acordo ao lugar e dados coletados. Nesse contexto é necessário poder relacionar esses fatos com o desenvolvimento e andamento da doença. O papel do laboratório não é restrito apenas ao diagnóstico etiológico inicial. Os parâmetros bioquímicos desempenham um papel fundamental tanto no monitoramento quanto no estadiamento e prognóstico da doença. O objetivo da presente revisão foi abordar as principais alterações de parâmetros laboratoriais relacionadas com a infecção por SARS-CoV-2.
Palavras-chave: SARS-CoV-2; COVID-19; Laboratório; Parâmetros; Alterações.
Introducción
En diciembre de 2019 en la ciudad de Wuhan, capital de la provincia de Hubei, China, se registró una serie de casos de neumonía grave de origen desconocido (1). Días posteriores, el agente etiológico responsable de dichas afecciones respiratorias fue identificado como un nuevo beta-coronavirus ARN, distinto del coronavirus del síndrome respiratorio agudo grave “SARS-CoV” del 2002-2003 y del coronavirus del síndrome respiratorio de Medio Oriente “MERS-CoV” (2) (3). Este nuevo coronavirus, coronavirus 2, conocido hoy como SARSCoV- 2, por su similitud filogenética con el SARS-CoV, es el causante de los brotes de neumonía viral atípica y del síndrome de distrés respiratorio agudo que afecta a la población mundial (4). Con más de 3.200.000 personas infectadas en todo el mundo y más de 150 países afectados, la enfermedad por coronavirus 2019 (COVID-19) se ha vuelto una amenaza inminente (5-8). Como consecuencia de ello, en enero de 2020 la Organización Mundial de la Salud (OMS) declaró la emergencia de salud pública de interés internacional y estableció la epidemia a nivel global (9).
El diagnóstico de COVID-19 es un gran desafío. Aunque un buen historial de contacto, síntomas clínicos y cambios radiográficos compatibles con neumonía hacen probable la presencia del SARS-CoV-2, el diagnóstico molecular de laboratorio es la herramienta más confiable y la más recomendada hasta el momento. La detección del genoma viral a través de métodos de biología molecular, como lo es la reacción en cadena de la polimerasa en tiempo real (RT-qPCR) es la principal herramienta de confirmación de diagnóstico etiológico, más confiable y de referencia (7) (10)(11)(12)(13). Producto del análisis de estudios retrospectivos, hoy se puede describir el perfil epidemiológico del SARS-CoV-2 (1). En una reciente revisión se mostró que los pacientes infectados tenían edades entre 30 y 79 años, con una mediana de 54 años; pocos casos se informaron hasta el momento en personas menores de 15 años. Se encontró mayor prevalencia del sexo masculino y un incremento en la tasa de mortalidad en aquellos pacientes con dos o más comorbilidades tales como obesidad, hipertensión arterial (HTA), diabetes mellitus (DM) y enfermedad cardiovascular (ECV) (10). En los pacientes que contraen la enfermedad COVID-19, las comorbilidades preexistentes y la edad de los individuos son factores claves tanto para el desarrollo como para el pronóstico y para la presentación clínica de la patología. Los pacientes más añosos y que poseen mayor número de comorbilidades, sobre todo HTA y obesidad, han sido los que peor cuadro clínico y evolución tuvieron (1) (11) (12). En términos generales, la enfermedad por SARS-CoV-2 se manifiesta como una patología viral respiratoria de características leves; sin embargo, en los individuos de alto riesgo puede manifestarse como un cuadro clínico complejo (12). Hasta el momento se ha documentado que aproximadamente el 80% de los individuos infectados presentan la forma asintomática de la enfermedad o manifestaron una forma leve de la misma. Solo el 20% requiere internación (con pronóstico variable) y solo el 5% de los individuos hospitalizados llega a desarrollar insuficiencia respiratoria severa que puede terminar en falla multiorgánica, shock y muerte. Salvo algunas excepciones, la población que requiere internación y evoluciona a un cuadro clínico severo guarda una estrecha relación con los factores de riesgo preexistentes y con la edad del hospedador infectado (7) (11) (14). No todos los pacientes que manifestaron la forma severa de la enfermedad al comienzo evidenciaron alteraciones compatibles y/o características de neumonía por SARS-CoV-2 en la placa radiográfica o en la tomografía axial computada (TAC) de tórax (10) (15). Los principales síntomas clínicos informados hasta el momento incluyeron fiebre, como el más frecuente, que en muchos casos es auto-reportada, fatiga sostenida en el tiempo, tos seca, mialgias y disnea en los casos más severos. Dentro del grupo de síntomas llamados menos frecuentes se encuentran dolor de cabeza, secreciones, hemoptisis y diarrea; este último cada vez menos infrecuente. Las variables de laboratorio documentadas en estos pacientes son múltiples, desde pacientes que solo mostraron tener ligeras alteraciones en el hemograma hasta individuos que presentaron cambios en parámetros que reflejaron desbalances homeostáticos compatibles incluso con la falla multiorgánica (10) (16). En este complejo contexto surge un cuestionamiento obvio por parte de la medicina de laboratorio, y es cómo la misma puede contribuir para contrarrestar posibles complicaciones futuras en estos pacientes (16). El objetivo de esta revisión fue describir las alteraciones de parámetros de laboratorio informadas hasta el momento en pacientes con COVID-19.
Anomalías en variables de laboratorio en pacientes con SARS-CoV-2
Hallazgos hematológicos
Numerosos hallazgos de laboratorio han sido relacionados a la enfermedad por COVID-19 hasta la actualidad. La Tabla I, basada en dos excelentes revisiones, resume las alteraciones bioquímicas más importantes que se observan con mayor frecuencia en individuos con COVID-19 (16) (17). Las variables hematológicas fueron los primeros hallazgos informados en los pacientes con SARS-CoV-2 que presentaban alteraciones bioquímicas. La leucocitosis con neutrofilia y la linfopenia fueron los hallazgos más frecuentes en los pacientes que presentaban la forma severa de la infección. La linfopenia ha sido el trastorno más estudiado y el más predominante en este grupo de pacientes. Entre el 35% y el 90% de los enfermos graves cursaron con esta alteración (16). Además, los pacientes que manifiestan este estadio de la enfermedad presentan una desregulación de la respuesta inmune que es la responsable del desenlace de una respuesta inflamatoria sistémica de gran magnitud que va a ser lesiva para el hospedador (10) (16). En un estudio realizado con 452 pacientes se observó una disminución significativa en los recuentos de linfocitos B, células natural killer (CD56/CD16) y linfocitos T, particularmente aquellos que expresaban el marcador de superficie CD4 (CD4+) (18). En una serie de 12 casos informados, el 78% de los individuos presentaron un bajo recuento de linfocitos que expresaban el marcador CD8 (CD8+) y el 35% un bajo recuento de CD4 (19). La linfopenia mostró tener una asociación directa con el pronóstico de la enfermedad. Los pacientes que tuvieron mayor grado de severidad presentaron un menor recuento absoluto de linfocitos al ingreso, lo que a su vez se asoció con una mayor estadía hospitalaria y peor morbimortalidad (20) (21). Se postuló que la disminución de linfocitos circulantes observada en pacientes con COVID-19 de peor pronóstico podría ser producto de la propia desregulación de la respuesta inmune del hospedador. En los casos de neumonía complicada, la traslocación de linfocitos desde la sangre hacia el pulmón, como resultado de la reacción inflamatoria, podría contribuir a la linfopenia (22) (23). La leucopenia al ingreso de la hospitalizacion se observó entre el 9 y el 25% de los casos (7) (10) (12) (14) (16) (20) (24). Entre el 2 y el 30% de los pacientes presentaron leucocitosis al momento de la consulta y/o internación (16) (24) (25). En muchos casos, esta leucocitosis fue un indicador de una posible coinfección de origen bacteriano concomitante a la infección viral (16). La trombocitopenia se presentó en menor medida, entre el 5 y el 17% de los ingresos. Entre el 40 y el 50% de los pacientes infectados también presentaron disminución en los niveles de hemoglobina (1) (16) (24). Se estudió que los posibles mecanismos por los cuales los coronavirus en general pueden producir cambios en la hematopoyesis incluyen: (a) la infección directa de células del estroma de la médula ósea vía CD13 o CD66a y/o (b) la inducción de autoanticuerpos y formación de complejos inmunes contra estas células sanguíneas (22). Además, el daño pulmonar severo en pacientes con SARS puede desempeñar un papel clave en la inducción de la leucopenia, linfopenia y de la trombocitopenia. Los mecanismos a nivel medular así como el secuestro y/o consumo celular producido por la severa reacción inflamatoria a nivel pulmonar y la reducción de la producción de plaquetas a nivel de este órgano podrían llegar a ser las causas que originan estos trastornos en pacientes con COVID-19 (22). No se ha informado hasta el momento la trombocitosis como hallazgo inicial en pacientes con SARS-CoV-2, pero sí se observó esta alteración en pacientes internados que han desarrollado complicaciones durante su estadía hospitalaria, en la mayoría de los casos de origen infeccioso (1) (16) (24). Qu et al., en un análisis retrospectivo de 30 casos positivos para COVID-19, examinaron diariamente la relación entre el número de plaquetas y el número absoluto de linfocitos “relación plaquetas/ linfocitos” (PLR). Aquellos pacientes que desarrollaron neumonías más graves, que requirieron más hospitalización y que tuvieron peor pronóstico, tuvieron una PLR mayor que los enfermos sin complicaciones y con mejor pronóstico (p=0,001) (21). En los pacientes que evolucionan desfavorablemente y terminan desarrollando el síndrome de distrés respiratorio agudo (SDRA) como complicación de la neumonía por SARS-CoV-2, se desata una reacción inflamatoria sistémica severa de gran magnitud. Existe una relación entre las plaquetas, linfocitos y esta condición. Además del rol en la hemostasia, coagulación, mantenimiento de la integridad vascular y angiogénesis, las plaquetas son células importantes del sistema inmune, participan de la inmunidad innata y en gran medida en la respuesta inflamatoria (26). Los altos niveles de citoquinas proinflamatorias (IL-3, IL-6, IL-9, IL-11 y el factor de células madre), circulantes en pacientes con COVID-19, pueden promover la producción de megacariocitos y así aumentar el número y actividad de las plaquetas (26). Los cambios dinámicos observados en el recuento plaquetario han sido relacionados con el empeoramiento de la enfermedad. La PLR podría ser un parámetro utilizado para el seguimiento, monitoreo y pronóstico en pacientes con SARS-CoV-2 (21).
Tabla I. Parámetros de laboratorio en pacientes con COVID-19
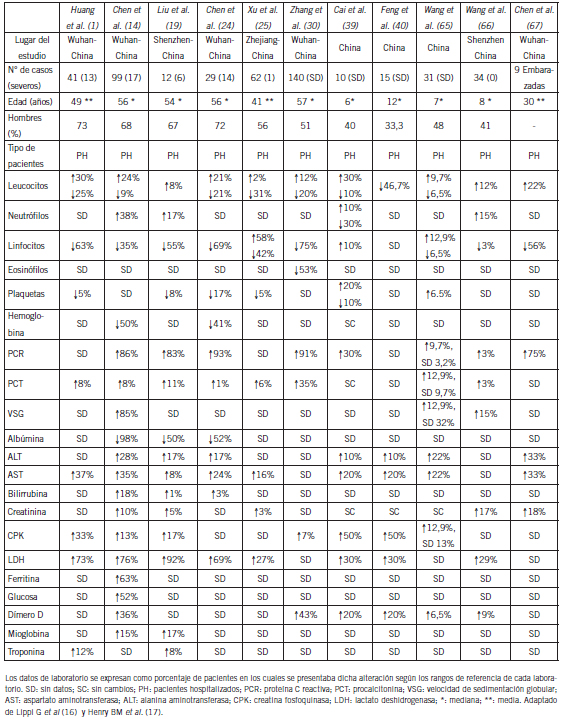
Respuesta inflamatoria y marcadores bioquímicos
La activación exacerbada de la respuesta inflamatoria observada en pacientes con COVID-19 parece ser el factor clave que da inicio a múltiples complicaciones futuras. Un estudio investigó detenidamente los cambios que se producen en los niveles de citoquinas en los pacientes con COVID-19. Las concentraciones de IL-6, IL-1B, IL- 1RA, IL7, IL8, IL9, IL10, IL-17, FGF básico, G-CSF, GMCSF, IFNã, IP10, MCP1, MIP1a, MIP1B, PDGF, VEGF y sobre todo TNFá fueron mayores en pacientes infectados que en adultos sanos. Estos hallazgos también sugirieron que, en los pacientes que manifiestan la forma severa de la enfermedad, la respuesta inmune frente a la infección podría provocar la hiperactivación macrofágica con la consiguiente producción de mediadores inflamatorios, que darían comienzo a la respuesta inflamatoria sistémica generando daño en órganos blancos como el pulmón normal del hospedador, entre otros (1). En los casos de infección severa, las elevadas concentraciones de citoquinas proinflamatorias encontradas, sugieren que esta “tormenta de citoquinas”, así descripta, está relacionada en forma directa con la gravedad de la enfermedad (1) (21). Los niveles incrementados de IL-6, proteína C reactiva y velocidad de sedimentación globular (VSG), observados en pacientes con SARS-CoV-2 condicen con estos hallazgos. Más del 70% de los pacientes infectados tuvieron incrementados los valores de estos parámetros al momento del diagnóstico (1) (12) (14) (19) (24). Niveles de proteína C reactiva por encima de 10 mg/L se han encontrado en el 56% de los cuadros más leves y en el 82% de los más graves. Esto se correlaciona directamente con los niveles de citoquinas proinflamatorias y con la severidad del cuadro clínico (27). La ferritina sérica es otro de los parámetros de gran importancia que se eleva en este contexto inflamatorio. Más del 63% de los pacientes con COVID-19 presentaron incrementado este parámetro al ingreso o durante su internación. Los mayores niveles de ferritina han sido observados en aquellos pacientes con peor pronóstico y en los que presentaron más complicaciones sistémicas (14). Las altas concentraciones de mediadores proinflamatorios, la hipoxia, el estrés oxidativo, entre otros, son grandes estimulantes de la liberación de ferritina. Se presume que el aumento de la ferritina sería uno de los parámetros claves relacionados al empeoramiento de la enfermedad ya que el mismo es un reflejo de la sobreactivación de los macrófagos que se produce en los pacientes con SARS-CoV-2 (28). La IL-6, la proteína C reactiva y la ferritina se incrementan precozmente en pacientes que empeoran su condición clínica y evolucionan desfavorablemente; incluso estas variables fueron significativamente mayores (p<0,001) en pacientes que tuvieron un desenlace fatal (12) (29).
En relación al estado inflamatorio también se han descripto discretos aumentos en los niveles de procalcitonina (PCT) en pacientes infectados con SARS-CoV-2. La frecuencia de este hallazgo varió entre el 1%, según el estudio de Chen et al. (24), y el 35% según lo comunicado por Zhang et al. (30). En general, los niveles de PCT asociados a infección por SARS-CoV-2 en formas no severas de la enfermedad fueron menores de 0,25 ng/mL (con cultivos bacterianos negativos) (29). En casos de ausencia de coinfección bacteriana los niveles de PCT no superaron los puntos de corte propuestos para el diagnóstico de sepsis (31). En un estudio de 191 pacientes se encontraron niveles de PCT mayores de 0,5 ng/mL en el 25% de aquellos individuos que fallecieron, mientras que en los sobrevivientes, solo el 1% presentó valores mayores de estos niveles (29). Lippi et al. en un metaanálisis mostraron que los valores incrementados de PCT se asociaron con un riesgo casi 5 veces mayor de infección grave por SARS-CoV-2 (OR: 4,76; IC95%: 2,74-8,29) (32). Históricamente la PCT ha sido asociada al diagnóstico de sepsis. La producción y liberación amplificada a la circulación de esta molécula proviene de tejidos extratiroideos, presumiblemente de células del sistema mononuclear fagocítico como consecuencia de los altos niveles de IL-1â, TNFá e IL-6 que circulan en el organismo en esta situación. Sin embargo, la síntesis de este biomarcador es inhibida por las concentraciones de INF-ã, cuyos niveles se incrementan en infecciones de etiología viral (33). Por lo tanto, es de esperar que los valores de PCT permanezcan dentro del rango de referencia tal como sucede en los pacientes con infección por SARS-CoV-2 leve o moderada. Sin embargo, se ha documentado a la sepsis como una posible complicación de las formas graves de la enfermedad. La misma podría ser causada directamente por la propia infección viral o podría ser producto de una coinfección bacteriana, pero se necesita más evidencia para investigar la patogenia de la sepsis en el curso de la enfermedad COVID-19 (32). Un dato llamativo fue el encontrado en el estudio de Zhou et al. donde, tanto en aquellos pacientes hospitalizados que murieron como en los que no, la sepsis se desarrolló entre el día 9 [7,0-13,0] y el día 10 [7,0-14,0] de la internación (p=0,220) (29). Hasta el momento, la evidencia sugiere que la PCT sería un parámetro de utilidad ante la sospecha de coinfección bacteriana y sepsis. Sin embargo, las mediciones en serie a lo largo de la estadía hospitalaria podrían reflejar la evolución de la enfermedad hacia formas más severas y estar relacionadas al pronóstico de la misma (32).
Injuria hepática
La incidencia de injuria hepática en pacientes con COVID-19 osciló entre el 15% y el 53%. Los niveles anormales de alanina transaminasa (ALT) y aspartato transaminasa (AST) acompañados de discretos aumentos en la bilirrubina han sido los principales indicadores de la misma. La proporción de enfermos que presentaron daño hepático se relacionaron con formas progresivas de la infección y posiblemente por la infección directa de los hepatocitos. Diversos estudios mostraron que el daño hepatocitario fue mayor en aquellos que manifestaban formas de la enfermedad más severas y, por consiguiente, los niveles de transaminasas y bilirrubina que presentaron estos individuos fueron más elevados (1) (11) (12) (14) (34). En casos graves de infección por SARS-CoV-2 se han observado enfermos cuyos niveles séricos de ALT y AST alcanzaron cifras de hasta 7.590 y 1.445 UI/L, respectivamente (35). En los casos de injuria hepática severa aproximadamente el 50-55% de los pacientes presentaron hipoalbuminemia (19) (24). Los valores de albúmina observados en pacientes con infecciones graves oscilaron entre 26,3 y 30,9 g/L (35). Un dato llamativo fue el encontrado en el estudio de Chen et al., donde en un análisis retrospectivo de 99 casos, el 98% de ellos presentó hipoalbuminemia y solo el 43% presentó aumento de ALT y AST; la mortalidad en este grupo de pacientes fue del 11% (14). La injuria hepática fue informada hasta en el 78% de los pacientes que fallecieron por infección con SARS-CoV-2. Se considera que el daño hepático observado en la enfermedad por COVID-19 es una manifestación clínicopatológica frecuente, que puede aparecer en pacientes con manifestaciones leves hasta en presentaciones más graves (36). La demostración de los mecanismos de lesión hepática en la infección con SARS-CoV-2 es limitada. Los receptores tipo 2 de la enzima convertidora de angiotensina (ACE2) que utiliza el virus para ingresar a la célula e infectar al hospedador también son expresados por células hepáticas y biliares y la infección viral directa puede ser la clave por la cual se desarrolla la injuria hepática en los pacientes con COVID-19. También los niveles de citoquinas circulantes en estos pacientes podrían tener implicancia en el daño hepático. El patrón anátomo-patológico de esteatosis hepática microvascular con leve actividad lobular y portal que se ha observado en biopsias post mortem de los pacientes con COVID-19, podría estar relacionado con la infección per se del virus. Sin embargo, las drogas utilizadas como posible tratamiento de la enfermedad pueden producir alteraciones histológicas similares (35). Un reciente estudio mostró que el lopinavir/litonavir, usado como tratamiento potencial, podría ser el causante de este tipo de lesiones observadas en las biopsias (37). La evidencia bioquímica de lesión hepática por SARSCoV- 2 es frecuente; sin embargo, los mecanismos de daño producidos por este virus aún no son del todo claros (35).
Daño de órgano y daño pulmonar
El daño pulmonar o de órgano en pacientes con COVID-19 ha sido relacionado a los niveles incrementados de lactato deshidrogenasa (LDH) observados en los mismos (Tabla II). Los aumentos de LDH han sido informados en el 69-92% de los pacientes (1) (14) (19) (24). Tanto el daño generalizado de órgano, como la injuria pulmonar, hepática o miocárdica podrían ser los responsables de la elevación de LDH observada en la enfermedad COVID-19 (16). La magnitud de la injuria se vio reflejada en los niveles de LDH. Los pacientes con enfermedad leve presentaron valores de LDH menores que los pacientes con enfermedad grave y SDRA manifiesto. Niveles de LDH de hasta 20.740 UI/L han sido documentados en pacientes con cuadros severos (14). Los altos niveles de esta enzima guardan una estrecha relación con la progresión y el pronóstico desfavorable de la enfermedad. Las mediciones seriadas de LDH son de gran utilidad para predecir el pronóstico de la misma (38). Hallazgos observados con menos frecuencia en adultos con COVID-19 han sido los aumentos de creatinfosfoquinasa (CPK) y mioglobina (Tabla I) (16). En población pediátrica los niveles de CPK se han incrementado en más del 50% de los pacientes infectados (39) (40).
Tabla II. Parámetros de laboratorio: su significado clínico y relación con la progresión de la enfermedad por SARS-CoV-2
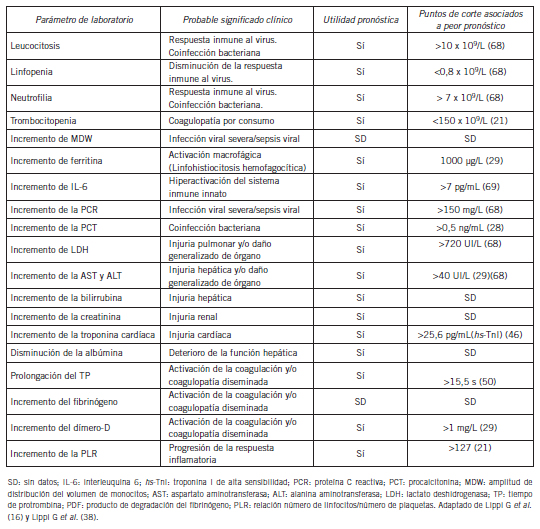
El aumento de estos parámetros de laboratorio estaría asociado al daño miocárdico y/o muscular que podrían presentar estos pacientes (14).
Injuria miocárdica, troponinas y péptidos natriuréticos
Chen et al. describieron un caso de un paciente de 61 años sin antecedentes de enfermedad cardiovascular crónica previa que después de haber desarrollado una insuficiencia respiratoria severa, con posterior insuficiencia cardíaca, terminó manifestando un paro cardiorrespiratorio y posteriormente falleció. Ésta fue una de las primeras evidencias de complicaciones cardiovasculares agudas en pacientes con COVID-19 (14). Se describió a la injuria miocárdica aguda (IMA) como la complicación cardiovascular que más se hace presente en pacientes con SARS-CoV-2 hospitalizados. La IMA es más prevalente en aquellos pacientes infectados que poseen comorbilidades preexistentes, sobre todo la HTA y en aquellos individuos que se encuentran hospitalizados en unidad de cuidados intensivos (UCI) (41). Guan et al. en un estudio de 1.099 pacientes con COVID-19 confirmado, mostraron que el 13,7% de los pacientes desarrolló IMA durante el curso de la enfermedad (42). También se observó que los pacientes hospitalizados que ingresaron a UCI tienen 13 veces más posibilidades de desarrollar IMA. Sin embargo, los individuos que desarrollaron IMA tuvieron mayor mortalidad intrahospitalaria independientemente de si requirieron o no cuidados intensivos (41). Estudios de seguimiento en Wuhan mostraron que el 7-17% de los pacientes hospitalizados presentaron IMA: 22,2% vs. 2,0% en pacientes graves (p<0,001) y 59% vs. 1% (p<0,001) en los pacientes que murieron (29). Otro estudio de 138 pacientes que clasificó la lesión cardíaca mediante troponina de alta sensibilidad (hs-Tn) mostró que la IMA estuvo presente en el 7,2% de la población en general y en el 22% que requirió atención en UCI (12). Un dato llamativo fue el informado por el comité nacional de salud de China donde el 12% de los pacientes sin enfermedad cardiovascular conocida tuvieron niveles elevados de hs-Tn o paro cardíaco durante la hospitalización por COVID-19 (18). Las concentraciones de hs-Tn se incrementaron en el 46% de los pacientes que murieron y solo en el 1% de los sobrevivientes (43). Zhou et al. utilizaron troponina I de alta sensibilidad (hs-TnI) para clasificar a las IMA. En el seguimiento se observó que a los 4 días posteriores al inicio de los síntomas, los niveles medios de hs-TnI fueron 8,8 pg/mL en los fallecidos y 2,5 pg/mL en los sobrevivientes (tres veces menor en los de mejor pronóstico). Durante el seguimiento se observó una curva ascendente, donde la mediana de hs-TnI entre los sobrevivientes no cambió significativamente (2,5-4,4 pg/mL), mientras que en los pacientes que murieron aumentó a 24,7 pg/mL en el día 7, a 55,7 pg/mL en el día 13, a 134,5 pg/mL en el día 19, y a 290,6 pg/mL en el día 22 (29) (43). La evidencia de IMA es consistente pero la patogenia del desarrollo de la misma en el COVID-19 aún no se conoce al 100%. Se postuló que el SARS-CoV-2 podría generar daño en el cardiomiocito por múltiples mecanismos: (a) por infección viral directa a los cardiomiocitos, la que se produciría por la unión del virus a receptores ACE2 homólogos a los de las células pulmonares existentes en el miocardio, (b) por hipoxemia secundaria a la neumonía del SARS-CoV-2, lo que llevaría a un daño celular hipóxico y apoptosis como producto de la menor oferta de oxígeno a los tejidos cardíacos por la menor captación pulmonar (41). La miocarditis ocasionada por la tormenta de citoquinas o secundaria a la linfohistiocitosis hemofagocítica podría ser otra de las razones (41) (43), y (c) la IMA podría ser consecuencia de la liberación de catecolaminas que se produce como resultado del estrés celular inflamatorio o secundario a la medicación utilizada para el tratamiento de la propia infección (41).
Lo que es claro, es que los valores anormales de troponina (por encima del percentilo 99 de la normalidad) son comunes en los pacientes con SARS-CoV-2; más aún cuando se utilizan métodos de alta sensibilidad para su determinación. Existen niveles de hs-Tn detectables en la mayoría de los pacientes con COVID-19 y los mismos se incrementan significativamente en aquellos pacientes de peor pronóstico (29) (44). Las concentraciones de troponinas elevadas en pacientes con COVID-19 son tan importantes como tener antecedentes de factores de riesgo cardiovascular (FRC). Los pacientes con COVID- 19, FRC presente y troponinas elevadas, conjuntamente con los pacientes con troponinas elevadas y sin FRC, mostraron tener mayor tasa de mortalidad que los pacientes con troponinas normales: FRC presentes y los sin FRC y troponinas normales: 69,4%, 37,5%, 13,3%, 7,62%, respectivamente (45). Debido a la prevalencia de IMA sería razonable que la medición de hs-Tn se realice tanto al inicio de la hospitalización de los pacientes con SARS-CoV-2, como también durante la internación mediante el monitoreo seriado; de esta manera sería más factible poder predecir la evolución de la enfermedad hacia un peor cuadro clínico y la detección precoz de IMA (46).
La elevación de los péptidos natriuréticos (PN) también se ha informado en pacientes infectados. Se documentó el caso de un paciente que presentó dolor de pecho, cambios en el segmento ST del electrocardiograma, sin evidencia de obstrucción coronaria, fracción de eyección del ventrículo izquierdo de 27%, valores de hs- Tn mayores de 99 y un valor de la fracción N terminal del péptido natriurético cerebral (NT-proBNP) mayor de 21.000 ng/mL (43) (47). Un caso similar fue el de un hombre sin antecedentes conocidos de enfermedad cardíaca con un NT-proBNP mayor de 22.000 ng/mL como consecuencia de un cuadro de miocarditis fulminante (43) (48). Un estudio de 54 pacientes que analizó el valor pronóstico del NT-proBNP en pacientes con COVID-19, mostró que los individuos que presentaban valores mayores de NT-proBNP también tuvieron otros parámetros de laboratorio asociados a la infección (proteína C reactiva y valor absoluto de linfocitos) peores al del grupo de pacientes que presentó niveles menores de NT-proBNP. El grupo con valores más altos de NTproBNP tuvo menor sobrevida que el grupo con valores de PN más bajos (p<0,001) (49). Los PN son marcadores asociados al estrés miocárdico y que frecuentemente se observan incrementados en pacientes con enfermedades respiratorias severas, insuficiencia cardíaca y presiones de llenado incrementadas. Los pacientes con COVID-19 pueden evidenciar incrementos en los niveles tanto del péptido natriurético cerebral (BNP) como del NT-proBNP; sin embargo, hasta el momento, la razón de su hallazgo es incierto y no necesariamente indica el desarrollo de insuficiencia cardíaca a menos que haya evidencia clínica de la misma (44). Por lo tanto, el aumento en los PN que se observa en pacientes con COVID-19 podría ser producto de la injuria miocárdica, consecuencia del estrés cardíaco, producto de la tormenta inflamatoria sistémica o resultado de una insuficiencia cardíaca concomitante con la infección viral (49).
Coagulopatía y SARS-CoV-2
El estado procoagulante que aparece en fase temprana en pacientes con COVID-19 es una de las características más preocupantes de esta enfermedad. La coagulopatía que desarrollan estos pacientes es sin duda alguna uno de las manifestaciones clínicas de peor pronóstico (1) (14) (29). La coagulación intravascular diseminada (CID) ha sido una característica común en aquellos pacientes que desarrollaron shock, disfunción multiorgánica y que murieron (50). En términos generales los pacientes graves con COVID-19 cumplen con la tercera definición del consenso internacional para sepsis (Sepsis-3) (51). Como se conoce, en los pacientes que desarrollan sepsis por diversos agentes infecciosos, la coagulopatía es uno de los factores claves y persistentes asociados a malos resultados (50). La CID que se desarrolla en la COVID-19 se caracteriza por una activación hiperexacerbada de los mecanismos de coagulación que llevan al individuo a un estado de trombosis microvascular generalizada (microangiopatía trombótica) y al consumo masivo de factores de coagulación. La trombocitopenia y la alteración de las pruebas básicas de coagulación, incluido el dímero D, reflejan esta condición (52). Los mecanismos que inducen el desbalance del equilibrio hemostático son diversos. La disfunción de las células endoteliales inducida por la infección viral y por el estado proinflamatorio generalizado generaría un exceso de trombina, un freno en la fibrinólisis y el desarrollo de un estado hipercoagulable (50). La respuesta inflamatoria sistémica manifestada por la hiperactivación macrofágica podría ser uno de los factores claves en la tendencia hacia la microtrombosis de los pacientes con COVID-19 por diferentes mecanismos (53). Las plaquetas activadas por la circulación de trombina libre también contribuirían al desbalance de la fibrinólisis (54). La linfohistiocitosis hemofagocítica, a través de la liberación del factor activador del plasminógeno, generaría un estado de hiperfibrinolisis, (reflejado por los incrementos de dímero D) (55). La hipoxia generalizada en estos pacientes también podría estimular la trombosis. El aumento de la viscosidad sanguínea a través de una vía de señalización dependiente del factor de transcripción inducible por hipoxia, produciría alteración en el equilibrio hemostático. La evidencia de microtrombos que ocluyen vasos pulmonares, encontrados en muestras de disecciones de tejido pulmonar de pacientes con COVID-19 denotaría dicha alteración (54). Inicialmente Han et al., en un estudio de 94 pacientes con SARS-CoV-2 que no recibieron tratamiento de anticoagulación oral, mostraron las alteraciones existentes en los parámetros de coagulación básicos. Se encontraron diferencias significativas (p<0,001) en los niveles de antitrombina III, productos de degradación del fibrinógeno (PDF), dímero D, fibrinógeno y tiempo de protrombina-actividad (p=0,001) entre los individuos infectados respecto del grupo control. No se encontraron diferencias significativas para tiempo de protrombina parcial activado (APTT) (p=0,518), tiempo de protrombina- seg (p=0,678), tiempo de trombina (p=0,137) ni en la relación internacional normalizada (p=0,809). Los niveles de PDF y dímero D mostraron diferencias en pacientes con enfermedad severa respecto de aquellos con enfermedad leve (p<0,001) (56). De todos los parámetros de coagulación, los aumentos en los niveles de dímero D han sido los más estudiados. Se observó que es uno de los marcadores de coagulopatía que mayor asociación tiene con la mortalidad en UCI de los pacientes con COVID-19 (50). Huang et al. mostraron que los niveles de dímero D en los pacientes graves (en UCI) fueron 5 veces mayores [pacientes en UCI: mediana 2,4 (0,6 - 14,4) mg/L frente a 0,5 (0,3 - 0,8) mg/L; p=0,004 de pacientes con enfermedad leve] (1). En una serie de 183 pacientes, Tang et al. encontraron que los valores de dímero D llegaron a ser 3,5 veces mayores en los pacientes que fallecieron por SARS-CoV-2 [mediana de óbitos: 2,12 (0,77 - 5,27) mg/L vs. no óbitos: 0,6 (0,35 - 1,29) mg/L (p<0,001]. Los valores de PDF y tiempo de protrombina también mostraron ser diferentes entre ambos grupos (p<0,001). En este estudio el 71% de los pacientes que murieron desarrollaron CID frente al 0,6% del grupo de sobrevivientes (50). Hallazgos similares fueron encontrados por Wang et al. donde los niveles de dímero D fueron 2,5 veces mayores en los pacientes que ingresaron a UCI y éste fue el único valor del perfil básico de coagulación que se vio alterado (12). El estudio de Zhou et al. realizado en 191 pacientes con COVID-19 determinó que un valor de dímero D mayor que 1,0 mg/L al momento de la admisión fue una de las principales variables predictivas asociadas a mortalidad a 28 días (OR: 18,42; IC95%: 2,64-128,55; p=0,003) (29). Finalmente en el estudio de Guan et al., donde analizaron datos de 1.099 pacientes infectados, los valores de dímero D por encima del límite de referencia (0,5 mg/L) se observaron con mayor frecuencia en pacientes con enfermedad grave (p=0,002) (27). En conclusión, las elevaciones de dímero D reflejan la exacerbación de la respuesta inflamatoria relacionada a la hiperactivación macrofágica y el estado trombofílico de los pacientes con SARS-CoV-2. El desarrollo de coagulopatía se asocia a peor pronóstico y mortalidad, sobre todo en pacientes en UCI (12) (26) (28) (50). Los incrementos de dímero D y el desarrollo de CID son episodios frecuentes en pacientes con formas graves de COVID-19 (57).
La trombocitopenia ha sido informada en menor grado que otros parámetros relacionados a la coagulación en pacientes con COVID-19 (Tabla I). En el estudio de Guan et al. el 36,2% de los pacientes presentó plaquetopenia, de éstos el 31,6% tenían enfermedad leve-moderada y el 57,7% tenía enfermedad grave (27). Sin embargo, en un estudio de 41 pacientes solo el 5% al ingreso de la hospitalización tenía plaquetopenia (1). En un metaanálisis de 9 estudios con 400 pacientes, que incluyó personas con enfermedad grave, el recuento de plaquetas fue significativamente menor en pacientes con COVID-19 grave (diferencia de medias ponderada - 31 x 109/L; IC95%: -35-29 x 109/L) (23). Por otro lado, la trombocitopenia se asoció con un riesgo cinco veces mayor de enfermedad grave por COVID-19 (OR: 5,1; IC95%, 1,8-14,6). Si bien la trombocitopenia se asoció a la presencia de coagulopatía en el seguimiento de los pacientes con SARS-CoV-2, el valor del recuento de plaquetas en la admisión hospitalaria no mostró ser, hasta el momento, uno de los marcadores pronósticos de mayor utilidad (58).
Daño y complicaciones renales
Las alteraciones renales en pacientes infectados con SARS-CoV-2 que manifiestan la forma severa de la enfermedad son un hallazgo frecuente. La presentación clínica va desde daño estructural leve, como la presencia de proteinuria, hasta la aparición de injuria renal aguda (IRA) en el contexto de falla multiorgánica. En un estudio prospectivo de cohortes de Wuhan el 43% 302 López LE y Mazzucco MD Acta Bioquím Clín Latinoam 2020; 54 (3): 293-307 de los pacientes con COVID-19 tuvieron proteinuria en la admisión y el 27% presentaron hematuria (59). La IRA se presentó en pacientes que habían requerido hospitalización y manifestaron la forma severa de la enfermedad. En muchos casos la magnitud del fracaso agudo fue tan severa que llevó al requerimiento de terapia de reemplazo renal como tratamiento paliativo (60). Diao et al. observaron que la prevalencia de IRA en los casos severos era de un 27% (61). Basados en la experiencia de países como EE.UU. y Europa, aproximadamente entre el 20% y el 40% de los individuos hospitalizados en UCI desarrolló IRA y éste es un importante factor de mortalidad en individuos con COVID-19 (62) (63). Algunos estudios han demostrado que la IRA tiende a hacerse manifiesta en la mayoría de los pacientes entre los días 11 y 15 de la estadía hospitalaria (12) (29) (59). Las causas de IRA en pacientes con COVID-19 son multifactoriales. Las comorbilidades cardiovasculares y los factores individuales predisponentes a desarrollarla son importantes contribuyentes. La depleción de volumen podría ser el desencadenante de IRA más frecuente en pacientes con SARS-CoV-2. Sin embargo, otros mecanismos como el síndrome cardiorrenal, las alteraciones hemodinámicas sistémicas, la lesión endotelial inflamatoria y el estado de hipercoagulabilidad observado en estos pacientes también podrían ser los responsables del daño renal (60). Además, algunos estudios demostraron la presencia del antígeno viral NP a nivel del túbulo renal en muestras de tejido de pacientes post mortem, lo que sugiere también la infección viral directa (dada la alta expresión de los receptores ACE2 en este órgano) como posible mecanismo de lesión renal (61). En la actualidad está surgiendo una comprensión de la fisiopatología y los mecanismos de daño renal agudo en el contexto de la enfermedad crítica y COVID-19; sin embargo, se necesitan más investigaciones para identificar a los pacientes con riesgo de desarrollar IRA (60).
Cheng et al. mostraron la relación de la enfermedad renal, mortalidad y los hallazgos del laboratorio en 701 pacientes internados con COVID-19. La IRA se presentó en el 5,1% de los pacientes. Los individuos que presentaron niveles elevados de creatinina al ingreso tuvieron peor pronóstico y desarrollaron más complicaciones. A su vez presentaron una tasa de mortalidad mayor (33,7%) que el grupo con niveles normales de creatinina al ingreso (13,2%) (59). Sin embargo, la presencia de IRA en COVID-19 podría subestimarse. Al igual que sucede en otras patologías, los valores de creatinina en la admisión podrían no siempre reflejar la verdadera función renal basal del individuo y los datos históricos del biomarcador podrían no estar siempre disponibles en el momento de la evaluación inicial (64). Respecto al valor pronóstico, también se ha observado que en los casos severos de la enfermedad y en los pacientes con mayor deterioro clínico, los niveles séricos de urea y creatinina incrementaban progresivamente días antes del deceso (12). La Figura 1 muestra cómo los pacientes con SARS-CoV-2 y peor pronóstico presentaron mayor variación (aumento) en los niveles de creatinina que el grupo de pacientes que se fue de alta, lo que se correlaciona con la aparición de complicaciones renales agudas. El monitoreo seriado de los niveles de creatinina y urea son útiles para el seguimiento de la enfermedad renal en pacientes internados y sus variaciones podrían reflejar la presencia de un daño renal agudo incipiente (12).

Figura 1. Variación de diferentes analitos en el tiempo en pacientes con COVID-19 que sobrevivieron y no sobrevivieron. IL-6: interleuquina 6; hs-troponina I: troponina I de alta sensibilidad. Entre el día 4 y 7 no se encontraron diferencias significativas (p>0,05) entre los sobrevivientes vs. los no sobrevivientes para Dímero D, II-6 y troponina I. En el día 9 se encontraron diferencias significativas (p<0,05) para el recuento de leucocitos, neutrófilos. La creatinina mostró diferencias significativas recién en el día 17 de seguimiento. Adaptado de Zhou et al. (29) y Wang et al. (12).
Monitoreo bioquímico y pronóstico de los pacientes con SARS-CoV-2
Las alteraciones de parámetros de laboratorio observadas en la infección por SARS-CoV-2 están asociadas íntimamente con el significado clínico de la enfermedad y con la aparición del daño orgánico secundario a la evolución de la misma. Muchas de las variables que se observan alteradas al ingreso han sido propuestas con fines pronósticos y/o de seguimiento, sobre todo en pacientes que requieren hospitalización (Tabla II). Un estudio de 138 pacientes hospitalizados con 24% de enfermos graves, mostró diferencias significativas en diversos parámetros de laboratorio, entre aquellos que necesitaron cuidados intensivos (UCI) y aquellos que no (12). Los pacientes que ingresaron a UCI (peor severidad) presentaron: un recuento de glóbulos blancos mayor (aumento del 50%), mayor recuento de neutrófilos (aumento del 70%), menor recuento de linfocitos (10% menos), valores más altos de LDH (aumento del 110%), mayores niveles de ALT (aumento del 50%), mayores niveles de AST (aumento del 80%), mayores niveles de bilirrubina total (aumento del 20%), mayor nivel de creatinina (aumento del 10%, dato sin menor implicancia), mayor nivel de hs-TnI (aumento del 120%), mayor nivel de dímero D (aumento del 250%) y mayor nivel de PCT (aumento del 20%). Con respecto a esta última, la tasa de pacientes con valores anormales ingresados en la UCI fue más de 3 veces mayor que la de los que no ingresaron (75% frente a 22%; p<0,001) (16). En el estudio de Wang et al., los pacientes que murieron desarrollaron con mayor frecuencia linfopenia, elevaciones de dímero D, empeoramiento de la función renal, injuria miocárdica y más daño tisular (12). Se han informado áreas bajo la curva (AUC) para predecir gravedad de la enfermedad de 0,844, 0,938, 1,000, 1,000, 0,844, 0,812 para LDH, proteína C reactiva, albúmina, recuento absoluto de linfocitos, porcentaje de linfocitos y porcentaje de neutrófilos respectivamente (19). Otros estudios también han demostrado el valor predictivo al ingreso y en el seguimiento, para predecir severidad y mortalidad, de parámetros de laboratorio como el valor absoluto de linfocitos, el recuento de glóbulos blancos, el dímero D, LDH, troponinas, PCT, ferritina, tiempo de protrombina, AST y ALT (1) (20) (30) (36). Un estudio realizado en China mostró la asociación existente entre el valor de Ct (carga viral) del virus con los parámetros bioquímicos e índices clínicos de severidad. Los valores bioquímicos se correlacionaron significativamente con la carga viral de SARS-CoV-2 y a su vez con la severidad de la enfermedad (score Murray). En algunos casos la asociación entre la carga viral y el parámetro de laboratorio fue inversa (albúmina, linfocitos) y en otros, directa (LDH, proteína C reactiva). Las combinaciones entre hipoalbuminemia, linfopenia, altas concentraciones de proteína C reactiva, LDH, ferritina, dímero D y baja saturación de oxígeno arterial en los pacientes infectados con SARS-CoV-2 al ingreso hospitalario pueden predecir lesión pulmonar aguda grave de una forma muy confiable (19). Finalmente, en un estudio de 1.099 pacientes de 552 hospitales, los parámetros de laboratorio con mayor capacidad pronóstica de la gravedad de la enfermedad por SARS–CoV-2 fueron: linfopenia (96,1% vs. 80,4%; OR: 5,96; IC95%: 2,58–13,75), trombocitopenia (57,7% vs. 31,6%; OR: 2,96; IC95%: 2,07–4,22) y leucocitosis (11,4% vs. 4,8%; OR: 2,54; IC95%: 1,43–4,52). El incremento de los biomarcadores y enzimas mostraron el siguiente grado de predicción: proteína C reactiva (81,5% vs. 56,4%; OR: 3,40; IC95%: 2,15–5,40), PCT (13,7% vs. 3,7%; OR: 4,14; IC95%: 2,06–8,33), LDH (58,1% vs. 37,2%; OR: 2,13; IC95%: 1,45–3,14), AST (39,4% vs. 18,2%; OR: 2,92; IC95%: 1,97–4,34), ALT (28,1% vs. 19,8%; OR: 1,59; IC95%: 1,04 –2,43) y dímero D (59,6% vs. 43,2%; OR: 1,94; IC95%: 1,27-2,97). El valor medio de hemoglobina también fue menor en pacientes con formas graves de COVID-19 (12,8 vs. 13,5 g/ dL; p<0,001) (28). Cada uno de estos parámetros pronósticos de laboratorio tiene un significado clínico y biológico específico que puede contribuir a reflejar la evolución hacia cuadros clínicos de peor evolución o pronóstico (38).
El panel de analitos de laboratorio para el seguimiento y pronóstico de pacientes enfermos con COVID-19 ha sido bien definido; sin embargo, una pregunta que hasta el momento no tiene una única respuesta es cuál es el intervalo de tiempo o “timing” para monitorear a los pacientes con estos biomarcadores. Algunos estudios (12) (29) mostraron las variaciones en el tiempo de las variables de laboratorio en pacientes internados con COVID-19, tanto para aquellos pacientes que sobrevivieron como para los que fallecieron. En la Figura 1 pueden verse los cambios en los parámetros bioquímicos que mayor relación mostraron con el pronóstico de los pacientes con COVID-19 y que deberían ser considerados como parámetros de seguimiento. Los pacientes con peor pronóstico presentaron un recuento linfocitario basal menor y lo disminuyeron durante toda su estadía hospitalaria; el recuento de glóbulos blancos se incrementó a expensas del aumento de los neutrófilos. La hs-Tn, ferritina, LDH, el dímero D y los parámetros de funcionalidad renal aumentaron a medida que avanzaba el deterioro de la enfermedad y aparecían las complicaciones sistémicas. Las variaciones observadas día a día no variaron significativamente, más aún en pacientes con buen pronóstico. Los enfermos que evolucionan hacia un estado severo de la enfermedad, muestran cambios en las variables de magnitud más considerable. El seguimiento con parámetros de laboratorio cada 48 o 72 h podría ser un buen timing y un punto clave en el control de pacientes con SARS-CoV-2 (12) (29). Resulta lógico considerar el uso de una frecuencia de monitoreo quizás mayor en aquellos pacientes que presenten una condición clínica que lo amerite.
Conclusiones
El avance de esta nueva enfermedad mundial COVID-19 es vertiginoso. El espectro clínico es complejo y variado. Oscila desde manifestaciones leves de la enfermedad (en la mayoría de los pacientes) hasta presentarse como una patología de manifestación sistémica. El grado de severidad de la misma guarda una estrecha relación con la desregulación de la respuesta inmune inducida por el virus. Los individuos que poseen comorbilidades preexistentes son los más propensos a contraer las formas severas de COVID-19 o evolucionar a un peor cuadro clínico (1) (11) (12) (14) (24) (25) (28) (29) (36). Las alteraciones de laboratorio informadas al momento del diagnóstico y durante la hospitalización son diversas y heterogéneas; van a depender del desenlace inmunológico de cada hospedador frente a la infección y de cómo sea la presentación del cuadro clínico (Tabla I). Marcadores como la ferritina (síndrome de activación macrofágica), IL-6 y proteína C reactiva (respuesta inflamatoria), dímero D (coagulopatía), LDH (injuria de órgano), troponinas (IMA), el recuento linfocitario (respuesta inmune) y ALT/ AST (injuria hepática) son claves y deben ser medidos tanto al ingreso como en el seguimiento de los pacientes con SARS-CoV-2, considerando un timing apropiado para cada paciente. Resulta de gran relevancia monitorear con diversas variables bioquímicas la evolución de la enfermedad (12) (16) (36). En este contexto no solo las pruebas de RT-qPCR son vitales para controlar el curso de la infección. El laboratorio clínico a través del diagnóstico in vitro proporciona información sumamente valiosa no solo en el diagnóstico etiológico inicial, sino también en el monitoreo, estadificación y pronóstico de los pacientes con COVID-19 (16). La asociación existente entre los hallazgos de laboratorio y el desarrollo de la enfermedad (Tabla II) hacen que el seguimiento bioquímico sea crucial para la toma de decisiones en estos pacientes (38).
Conflictos de intereses
Los autores declaran no tener conflictos de intereses respecto del presente trabajo.
1. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497–506.
2. De Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recentinsights into emerging coronaviruses. Nat Rev Microbiol 2016; 14: 523–34.
3. Hilgenfeld R, Peiris M. From SARS to MERS: 10 years of research on highly pathogenic human coronaviruses. Antiviral Research 2013; 100: 286–95.
4. Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China. N Engl J Med 2019; 382: 727-33. [ Links ]
5. Rothe C, Schunk M, Sothmann P, Bretzel G, Froeschl G, Wallrauch C, et al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany. N Engl J Med 2020 Mar 5; 382 (10): 970-1. [ Links ]
6. Phan LT, Nguyen TV, Luong QC, Nguyen TV, Nguyen HT, Le HQ, et al. Importation and human-to-human transmission of a novel coronavirus in Vietnam. N Engl J Med 2020 Feb 27; 382 (9): 872-4. [ Links ]
7. Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus– infected pneumonia. N Engl J Med 2020 Mar 26; 382 (13): 1.199-207.
8. World Health Organization. Coronavirus disease (COVID-2019) situation reports. Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports/. Fecha de acceso: 15 de mayo de 2020. [ Links ]
9. World Health Organization. Alocución de apertura del Director General de la OMS en la rueda de prensa sobre COVID-19 celebrada el 11 de marzo de 2020. Disponible en: https://www.who.int/es/dg/speeches/detail/whodirector-general-s-opening-remarks-at-the-media-briefing-on-covid-19-11-march-2020. Fecha de acceso: 30 de marzo de 2020. [ Links ]
10. He F, Deng Y, Li W. Coronavirus disease 2019 (COV- 19): What we know? J Med Virol 2020 doi: 10.1002/ jmv.25766. [ Links ]
11. Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet 2020; 395: 514-23. [ Links ]
12. Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020; 323 (11): 1061–9.
13. World Health Organization. Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans. Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus2019/technical-guidance/laboratory-guidance. Fecha de acceso: 15 de mayo de 2020. [ Links ]
14. Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395: 507-13. [ Links ]
15. Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020. doi:10.1001/jama.2020.2648. [ Links ]
16. Lippi G, Plebani M. Laboratory abnormalities in patients with COVID-2019 infection. Clin Chem Lab Med 2020 Mar 3;/j/cclm.ahead-of-print/cclm-2020-0198/cclm-2020-0198.xml. [ Links ]
17. Henry BM, Lippi G, Plebani M. Laboratory abnormalities in children with novel coronavirus disease 2019. Clin Chem Lab Med 2020 Mar 16:/j/cclm.ahead-of-print/cclm-2020-0272/cclm-2020-0272.xml. [ Links ]
18. Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol 2020 May; 17 (5): 259-60. [ Links ]
19. Liu Y, Yang Y, Zhang C, Huang F, Wang F, Yuan J, et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci China Life Sci 2020; 63: 364–74.
20. Zhang MQ, Wang XH, Chen YL, Zhao KL, Cai YQ, An CL, et al. Clinical features of 2019 novel coronavirus pneumonia in the early stage from a fever clinic in Beijing. 2020. Zhonghua Jie He He Hu Xi Za Zhi 2020 Mar 12; 43 (3): 215-8. [ Links ]
21. Qu R, Ling Y, Zhang YH, Wei LY, Chen X, Li X, et al. Platelet-to-lymphocyte ratio is associated with prognosis in patients with coronavirus disease-19. J Med Virol 2020 Mar 17;10.1002/jmv.25767. [ Links ]
22. Yang M, Hon KL, Li K, Fok TF, Li CK. The effect of SARS coronavirus on blood system: its clinical findings and the pathophysiologic hypothesis. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2003 Jun; 11 (3): 217-21. [ Links ]
23. Lippi G, Plebani M, Henry BM. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: a meta-analysis. Clin Chim Acta 2020; 506: 145-8. [ Links ]
24. Chen L, Liu HG, Liu W, Liu J, Liu K, Shang J, et al. Analysis of clinical features of 29 patients with 2019 novel coronavirus pneumonia. Zhonghua Jie He He Hu Xi Za Zhi. 2020 Feb 6; 43 (0): E005. [ Links ]
25. Xu XW, Wu XX, Jiang XG, Xu KJ, Ying LJ, Ma CL, et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS-Cov-2) outside of Wuhan, China: retrospective case series. BMJ 2020. doi: 10.1136/bmj.m606. [ Links ]
26. Jenne CN, Kubes P. Platelets in inflammation and infection. Platelets 2015; 26: 286-92. [ Links ]
27. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Characteristics of coronavirus disease 2019 in China. N Engl J Med 2020 Apr 30; 382 (18): 1.708-20. [ Links ]
28. Rosário C, Zandman-Goddard G, Meyron-Holtz EG, D’Cruz DP, Shoenfeld Y. The hyperferritinemic syndrome: macrophage activation syndrome, Still’s disease, septic shock and catastrophic antiphospholipid syndrome. BMC Med 2013; 11: 185.
29. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020 Mar 28; 395 (10229): 1.054-62. [ Links ]
30. Zhang JJ, Dong X, Cao YY, Yuan YD, Yang YB, Yan YQ, et al. Clinical characteristics of 140 patients infected by SARS-CoV-2 in Wuhan, China. Allergy 2020 Feb 19. doi: 10.1111/all.14238. Online ahead of print. [ Links ]
31. Hausfater P, Juillien G, Madonna-Py B, Haroche J, Bernard M, Riou B. Serum procalcitonin measurement as diagnostic and prognostic marker in febrile adult patients presenting to the emergency department. Crit Care 2007; 11 (3): R60. [ Links ]
32. Lippi G, Plebani M. Procalcitonin in patients with severe coronavirus disease 2019 (COVID-19): a meta-analysis. Clin Chim Acta 2020; 505: 190–1.
33. Linscheid P, Seboek D, Nylen ES, Langer I, Schlatter M, Becker KL, et al. In vitro and in vivo calcitonin I gene expression in parenchymal cells: a novel product of human adipose tissue. Endocrinology 2003; 144: 5.578-84. [ Links ]
34. Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020 May; 109 (5): 531-8. [ Links ]
35. Xu L, Liu J, Lu M, Yang D, Zheng X. Liver injury during highly pathogenic human coronavirus infections. Liver Int 2020 May; 40 (5): 998-1.004. [ Links ]
36. Zhang B, Zhou X, Qiu Y, Feng F, Feng J, Jia Y, et al. Clinical characteristics of 82 death cases with COVID-19. MedRxiv 2020. doi: 10.1101/2020.02.26.20028191 [ Links ]
37. Fan Z, Chen L, Li J, Tian C, Zhang Y, Huang S, et al. Clinical features of COVID-19 related liver damage. MedRxiv 2020. doi: 10.1101/2020.02.26.20026971. [ Links ]
38. Lippi G, Plebani M. The critical role of laboratory medicine during coronavirus disease 2019 (COVID-19) and other viral outbreaks. Clin Chem Lab Med 2020 Mar 19:/j/cclm.ahead-of-print/cclm-2020-0240/cclm- 2020-0240.xml. [ Links ]
39. Cai J, Xu J, Lin D, Xu L, Qu Z, Zhang Y, et al. A case series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis 2020 Feb 28; ciaa198. [ Links ]
40. Feng K, Yun YX, Wang XF, Yang GD, Zheng YJ, Lin CM, et al. Analysis of CT features of 15 children with 2019 novel coronavirus infection. Zhonghua Er Ke Za Zhi 2020 Feb 17; 58 (0): E008. [ Links ]
41. Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020 May; 109 (5): 531-8. [ Links ]
42. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical characteristics of 2019 novel coronavirus infection in China. MedRxiv 2020. doi:10.1101/2020.0 2.06.20020974. [ Links ]
43. Clerkin KJ, Fried JA, Raikhelkar J, Sayer G, Griffin JM, Masoumi A, et al. Coronavirus disease 2019 (COVID-19) and cardiovascular disease. Circulation 2020 May 19; 141 (20): 1.648-55. [ Links ]
44. Januzzi JL Jr. Troponin and BNP Use in COVID-19 - American College of Cardiology. Disponible en https://www.acc.org/latest-in-cardiology/articles/2020/03/18/15/25/troponin-and-bnp-use-in-covid19. 2020. Fecha de acceso: 20 de marzo de 2020. [ Links ]
45. Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, et al. Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). JAMA Cardiol 2020 Mar 27; e201017. [ Links ]
46. Lippi G, Lavie CJ, Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2019 (COVID-19): evidence from a meta-analysis. Prog Cardiovasc Dis 2020 Mar 10. doi: 10.1016/j.pcad.2020.03.001. Online ahead of print. [ Links ]
47. Hu H, Ma F, Wei X, Fang Y. Coronavirus fulminant myocarditis saved with glucocorticoid and human immunoglobulin. Eur Heart J 2020 Mar 16; ehaa190. [ Links ]
48. Zeng JH, Liu YX, Yuan J, Wang FX, Wu WB, Li JX, et al. First case of COVID-19 infection with fulminant myocarditis complication: case report and insights. Infection 2020 Apr 10; 1-5. doi: 10.1007/s15010-020- 01424. Online ahead of print. [ Links ]
49. Gao L, Jiang D, Wen X, Cheng X, Sun M, He B, et al. Prognostic value of NT-proBNP in patients with severe COV-19. MedRxiv 2020. doi: 10.1101/2020.03.07.20031575. [ Links ]
50. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18: 844-7. [ Links ]
51. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315: 801–10.
52. Lee AY, Connors JM, Kreuziger LB, Murphy M, Gernsheimer T, Lin Y. COV-19 and coagulopathy: frequently asked questions. Disponible en: https://www.hematology.org/CoV-19/CoV-19-and-coagulopathy. 2020. Fecha de acceso: 17 de abril de 2020. [ Links ]
53. Jose RJ, Manuel A. COVID-19 cytokine storm: the interplay between inflammation and coagulation. Lancet Respir Med 2020 Apr 27; S2213-2600(20)30216-2. [ Links ]
54. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatmentis associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020 May; 18 (5): 1.094-99. [ Links ]
55. Giannis D, Ziogas IA, Gianni P. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1, MERS-CoV and lessons from the past. J Clin Virol 2020 Jun; 127: 104362. [ Links ]
56. Han H, Yang L, Liu R, Liu F, Wu KL, Li J, et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med 2020 Mar 16;/j/cclm.ahead-of-print/cclm-2020-0188/cclm-2020-0188.xml. [ Links ]
57. Lippi G, Favaloro EJ. D-dimer is associated with severity of coronavirus disease 2019: a pooled analysis. Thromb Haemost 2020 May; 120 (5): 876-8. [ Links ]
58. Thachil J, Tang N, Gando S, Falanga A, Cattaneo M, Levi M, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020 May; 18 (5): 1.023-6. [ Links ]
59. Cheng Y, Luo R, Wang K. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int 2020 May; 97 (5): 829-38. [ Links ]
60. Ronco C, Reis T, Husain-Syed F. Management of acute kidney injury in patients with COVID-19. Lancet Respir Med 2020 May 14: S2213-2600(20)30229-0. [ Links ]
61. Diao B, Wang C, Wang R, Feng Z, Tan Y, Wang H, et al. Human kidney is a target for novel severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection. MedRxiv 2020; doi: 10.1101/2020.03.04.20031120. [ Links ]
62. Acute kidney injury in COVID-19 patients. ESICMtv Webinar. Posted April 17, 2020. Disponible en: https://www.esicm.org/blog/?p=2789. (Fecha de acceso: 29 de abril de 2020). [ Links ]
63. Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, et al. Presenting characteristics, comorbidities, and outcomes among 5.700 patients hospitalized with COVID-19 in the New York City area. JAMA 2020 Apr 22; 323 (20): 2.052-9. [ Links ]
64. Ramos M, López L, Benitez D, Castro M. Injuria renal aguda secundaria a crisis hipercalcémica: a propósito de un caso. Acta Bioquím Clín Latinoam 2019; 53 (2): 175-82. [ Links ]
65. Wang D, Ju XL, Xie F, Lu Y, Li FY, Huang HH, et al. Clinical analysis of 31 cases of 2019 novel coronavirus infection in children from six provinces (autonomous region) of Northern China. Zhonghua Er Ke Za Zhi 2020 Apr 2; 58 (4): 269-74. [ Links ]
66. Wang XF, Yuan J, Zheng YJ, Chen J, Bao YM, Wang YR, et al. Clinical and epidemiological characteristics of 34 children with 2019 novel coronavirus infection in Shenzhen. Zhonghua Er Ke Za Zhi 2020 Feb 17; 58(0): E008. [ Links ]
67. Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet 2020 Mar 7; 395 (10.226): 809-15. [ Links ]
68. Zhang G, Zhang J, Wang B, Zhu X, Wang Q, Qiu S. Analysis of clinical characteristics and laboratory findings of 95 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a retrospective analysis. Respir Res 2020 Mar 26; 21 (1): 74. [ Links ]
69. Eric AC, Hourmazd H. Interleukin-6 in COVID-19: a systematic review and meta-analysis. MedRxiv 2020. 03.30.20048058. [ Links ]
Recibido: 30 de abril de 2020
Aceptado: 10 de junio de 2020














