Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.54 no.3 La Plata set. 2020
VIROLOGÍA
Caracterización biológica de cepas del virus Encefalitis San Luis en células de la inmunidad innata
Cinthya Caula1a*, Paula María Cooke1a, María Elisa Rivarola2b, Marta Silvia Contigiani3b, Miguel Ángel Orsilles3a, Lorena Ivana Spinsanti4b
1 Dra. en Bioquímica. Bioquímica. Farmacéutica.
2 Dra. en Ciencias Biológicas. Bióloga.
3 Dr/a. en Ciencias Químicas. Bioquímico/a.
4 Dra. en Ciencias de la Salud con mención en Biomedicina. Bióloga.
a Universidad Católica de Córdoba, Unidad Asociada al CONICET, Área de Ciencias Agrarias, Ingeniería, Ciencias Agrarias y de la Salud.
b Universidad Nacional de Córdoba, Instituto de Virología “Dr. J. M. Vanella”, Facultad de Ciencias Médicas. Córdoba, Argentina.
* Autora para correspondencia.
Correspondencia Dra. CINTHYA CAULA Facultad de Ciencias Químicas. Universidad Católica de Córdoba Avenida Armada Argentina 3555 (X5016DHK) Córdoba, Argentina Tel.: (54) 351 4938000 Correo electrónico: caulacinthya@gmail.com
Resumen
Los flavivirus transmitidos por mosquitos son una amenaza actual y emergente en todo el mundo. Dentro de este género, el virus Encefalitis San Luis (VESL) causa una forma severa de enfermedad neuroinvasiva donde la respuesta inmune es un componente crucial de la defensa del huésped. En este trabajo se investigó la interacción entre VESL y células de la inmunidad innata, en un modelo de infección in vitro de monocitos humanos (células U937) con cepas de distinta virulencia y condiciones epidemiológicas de aislamiento (CbaAr-4005 y 78V-6507). Se evaluó la capacidad de infectar y replicar del virus, como también el efecto citopático y la cinética de viabilidad de monocitos durante la infección. Los resultados demostraron la susceptibilidad de los monocitos a la infección, replicación y muerte por ambas cepas virales. Sin embargo, se hallaron diferencias significativas entre ellas. La cepa epidémica y de mayor virulencia CbaAr-4005 registró una tasa de infección y replicación superior a la de la cepa endémica y de menor virulencia 78V-6507. Se comprobó también que el VESL indujo la muerte de monocitos humanos, dependiendo del tiempo post-infección (pi) y de la cepa. Así, CbaAr-4005 provocó a partir del día 3 pi el doble de mortalidad celular que 78V-6507. Además, en los monocitos infectados se observaron alteraciones de parámetros morfológicos que podrían relacionarse con el tipo de mecanismo de muerte celular asociado a la infección por VESL.
Palabras clave: Virus Encefalitis San Luis; Monocitos; Infección; Replicación; Muerte.
Abstract
Biological characterization of Saint Louis Encephalitis virus strains in innate immunity cells
Mosquitoes borne Flavivirus infections are an actual and emergent worldwide threat to human health. Within this genus, Saint Louis Encephalitis Virus (SLEV) causes a severe neuroinvasive disease where immune response is crucial for host survival. In this study the interaction between SLEV and innate immune cells was evaluated. An in vitro infection model with human monocytes (U937 cells) and strains with variations in virulence and isolation conditions (CbaAr-4005 and 78V-6507) were used. Infection capacity, replication capacity, cytopathic effect and monocyte viability kinetics were measured. The results showed susceptibility to infection and replication to both strains. However, significant differences were found among them. CbaAr-4005, the epidemic and more virulent strain, showed higher infection and replication ratios compared to 78V-6507. SLEV infection that induces cell death of human monocytes was also found in a post-infection time and in a strain dependent manner. Since day 3 post-infection, twice the mortality in CbaAr-4005 infected cells was observed. Furthermore, infected monocytes showed alterations in morphologic parameters that could be related with apoptosis mechanisms associated to SLEV infections.
Keywords: Saint Louis Encephalitis virus; Monocytes; Infection; Replication; Death.
Resumo
Caracterização biológica das estirpes do vírus Encefalite Saint Louis
Os Flavivírus transmitidos por mosquitos são uma ameaça atual e emergente no mundo todo. Nesse gênero, o vírus Encefalite Saint Louis (VESL) causa uma forma grave de doença neuroinvasiva onde a resposta imune é um componente crucial da defesa do hospedeiro. Neste trabalho nos investigamos a interação entre VESL e células de imunidade inata em um modelo de infecção in vitro de monócitos humanos (células U937) com estirpe de diferentes virulências e condições epidemiológicas de isolamento (CbaAr-4005 e 78V-6507). Foi avaliada a capacidade do vírus de infectar e replicar , assim como o efeito citopático e a viabilidade cinética dos monócitos durante a infecção. Os resultados demonstraram a suscetibilidade dos monócitos à infecção, replicação e morte por ambas as estirpes virais. No entanto, foram detectadas diferenças significativas entre eles. A estirpe epidémica e de maior virulenta CbaAr-4005 teve uma maior taxa de infecção e replicação do que a estirpe endémica e menos virulenta 78V-6507. Foi comprovado também que o VESL induziu a morte de monócitos humanos, dependendo do tempo pós-infecção (pi) e da estirpe. Assim, a CbaAr-4005 causou a partir do dia 3 pi o dobro da mortalidade celular o que a 78V- 6507. Além disso, alterações nos parâmetros morfológicos foram observadas nos monócitos infectados que poderiam estar relacionadas ao tipo de mecanismo de morte celular associado à infecção pelo VESL.
Palavras-chave: Vírus Encefalite Saint Louis; Monocitos; Infecção; Replicação; Morte.
Introducción
El virus Encefalitis San Luis (VESL) pertenece al género Flavivirus (familia Flaviviridae). Este género se encuentra incluido en los denominados arbovirus (del inglés arthropod borne viruses: virus transmitidos por artrópodos). Diversas especies virales de este género son responsables, cada año, de causar enfermedades severas y alta mortalidad en humanos (1). En la Argentina se conoce que circulan los flavivirus VESL (2), virus Oeste del Nilo (VON) (3), virus Dengue (VDEN) (4), virus Fiebre Amarilla (VFA) (2) y el recientemente introducido virus Zika (VZIK) (5). Desde el año 2002, el VESL experimenta una reemergencia como agente etiológico de encefalitis humana en Sudamérica (2) (6) (7).
En el año 2005 ocurrió en Córdoba un brote de encefalitis por VESL y se aisló la cepa CbaAr-4005 de mosquitos Culex quinquefasciatus recolectados en la casa de un paciente con encefalitis con diagnóstico positivo para VESL (6). Rivarola et al. (8) realizaron la caracterización biológica en modelo murino de CbaAr-4005 y la compararon con las cepas no epidémicas 78V-6507 y CorAn-9275. Estos investigadores observaron que la cepa CbaAr-4005 fue la más infecciosa y letal de las tres, ya que produjo los mayores porcentajes de morbilidad, signos de enfermedad neurológica e intervalos más estrechos de aparición de los síntomas. En función de esto se considera que la cepa CbaAr-4005 posee la mayor virulencia. En la infección por VESL, los factores que intervienen en la aparición de la enfermedad neurológica y su severidad no están completamente dilucidados. Las células de linaje mieloide juegan un papel importante en la patogénesis de los flavivirus. El reclutamiento de monocitos y macrófagos es un componente clave para el control de la replicación del virus en ganglios linfáticos y sangre, antes de su invasión al sistema nervioso central (SNC) (9)(10). Estas células interaccionan con el virus a través de receptores específicos e inducen un estado antiviral que promueve la erradicación del microorganismo (11). Sin embargo, la coevolución de los flavivirus con el hospedador vertebrado ha resultado en una serie de mecanismos que permiten la evasión viral e incluso la muerte por apoptosis de células de la inmunidad innata (12). Así, los mecanismos de muerte de la célula hospedadora pueden ser manipulados por el virus a fin de favorecer su supervivencia, su diseminación y la llegada de viriones al SNC por la disrupción de la integridad de la barrera hematoencefálica causada por las citoquinas inflamatorias liberadas por monocitos infectados (13).
La comprensión detallada de las consecuencias de la interacción entre VESL y células de la inmunidad es fundamental para identificar mecanismos de virulencia, factores de susceptibilidad del huésped y posibles focos de intervención terapéutica que puedan disminuir el daño a nivel del SNC. Este trabajo tiene como objetivos determinar la capacidad de infección y replicación de diferentes cepas de VESL sobre monocitos humanos y evaluar el efecto citopático sobre estas células inmunes.
Materiales y Métodos
Cepas de virus y stock viral
Se trabajó con las cepas de VESL 78V-6507 (1) y CbaAr-4005 (2), aisladas de mosquitos C. quinquefasciatus y almacenadas en el laboratorio de Arbovirus del Instituto de Virología “Dr. J. M. Vanella”, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba. Los stocks virales se obtuvieron inoculando, por vía intracerebral, ratones albinos suizos (RAS) cepa Rockefeller W-1 según lo descripto por Rivarola et al. (8). Posteriormente fueron titulados mediante el método de formación de placas de lisis bajo agar en células Vero (riñón de mono verde africano). El título viral se expresó como el número de unidades formadoras de placas (ufp) para el volumen de inóculo de la última dilución de virus en la que se observaron placas (14). Los stocks se alicuotaron y conservaron a –80 ºC hasta su utilización.
Línea celular U937
Para desarrollar el modelo in vitro de infección viral en células de la inmunidad innata se utilizó la línea celular de fenotipo monocítico U937 (American Type Culture Collection ATCC Nº CRL-1593.2TM). Las células se mantuvieron en suspensión, con medio de cultivo RPMI 1640 (Sigma-Aldrich, San Luis, Misuri, Estados Unidos) suplementado con 10% V/V de suero fetal bovino (SFB) (Gibco, Waltham, Massachusetts, Estados Unidos) y 1% V/V de gentamicina. Se incubaron a 37 °C y en atmósfera de CO2 al 5% V/V.
Infección de células U937
Se realizaron ensayos de infección, por triplicado, con cada cepa propuesta de VESL. Para ello, de las botellas de cultivos que presentaban una viabilidad superior al 95%, se tomó el volumen que contenía el número de células requerido para las determinaciones posteriores. Se centrifugó 3 minutos a 1.500 r.p.m, se descartó el sobrenadante y las células se resuspendieron en 200 μL de RPMI 1640. Las células fueron infectadas con un inóculo viral de 200 μL con un índice de multiplicidad de infección (MOI) cercano a 1. Después de 1 h de incubación en atmósfera húmeda con CO2 5% V/V a 37 ºC se descartó el virus no absorbido y se lavó dos veces con PBS. Como control negativo se utilizaron células incubadas con RPMI. Las células U937 infectadas y los controles negativos se cultivaron en placas a una densidad de 2x105 cel/mL en RPMI 1640 suplementado con SFB al 5% V/V. Se incubaron en estufa con atmósfera húmeda con CO2 5% V/V y 37 ºC durante 5 días. En cada pocillo se colocaron portaobjetos redondos a fin de obtener improntas para la detección de antígeno viral. Durante cinco días consecutivos se recolectaron células, sobrenadantes y portaobjetos a fin de realizar las diferentes determinaciones.
Detección de antígeno viral
La detección de antígeno viral (Ag VESL+) se realizó por inmunofluorescencia indirecta (IFI) sobre las células adheridas a portaobjetos. Las improntas se fijaron con acetona pura durante 20 min a 4 °C, luego se lavaron 2 veces con PBS filtrado y se conservaron a -20ºC. Al momento de realizar la IFI, se agregó albúmina bovina al 5% V/V, durante 30 min a 4 ºC, luego se adicionaron 50 μL de anticuerpo murino anti-VESL (SIGMA Chemical Co, St. Louis, Estados Unidos), en una dilución 1/100 (en albúmina bovina al 1% V/V) y se incubó durante 30 min a 37 ºC. Posteriormente, se lavó 3 veces con una solución de PBS con albúmina sérica bovina al 1% V/V y se agregaron 50 μL de anticuerpo de cabra anti-cadena ã de ratón conjugado con isotiocianato de fluoresceína FITC (SIGMA Chemical Co, St. Louis, Estados Unidos) en una dilución 1/300 en solución de lavado. Se incubó 30 min a temperatura ambiente en oscuridad y se lavó 3 veces con una solución de azul de Evans al 1% en PBS. Finalmente se montó cada impronta con Fluor-Save (SIGMA Chemical Co, St. Louis, Estados Unidos). El análisis se realizó utilizando un microscopio de epifluorescencia Olympus Motorized Inverted Research, Modelo IX81. Imaging Software: Cell M, Tokyo, Japón. Se utilizó el filtro de FITC verde 43IF550-W45 y filtros de balance azul-día 45-LBD-IF.
Cinética de replicación viral
Los sobrenadantes recolectados en los ensayos de infección con la carga viral acumulada desde el momento de la inoculación al día 1, 2, 3, 4 y 5 post-infección fueron conservados a -80 °C. Posteriormente se cuantificó la carga viral (como una medida para estimar la replicación) mediante PCR en tiempo real cuantitativa (qRT-PCR) utilizando sondas específicas para VESL.
Extracción del ARN viral
Para extraer el ARN viral se utilizó el kit de extracción de ADN/ARN de Axigen (AxyPrep viral DNA/RNA MiniPrep Kit, Union City, California, Estados Unidos) siguiendo las indicaciones del fabricante.
PCR en tiempo real
Para realizar la qRT-PCR se utilizaron cebadores específicos y las sondas fluorescentes TaqMan-MGB según lo descripto por Rivarola et al. (15). El ensayo fue realizado utilizando un equipo Applied Biosystems 7500 (Foster City, California, Estados Unidos). Las copias virales se estimaron por interpolación con una curva estándar obtenida por diluciones en serie de un plásmido de control (número de copias de 10 a 109). El ensayo se realizó por triplicado para evaluar la reproducibilidad intraexperimental y en tres tiempos distintos para determinar la variación entre ensayos.
Efecto citopático y viabilidad celular
Para la evaluación de estos parámetros se colectaron las células procedentes de los cultivos infectados con VESL a diferentes días post-infección; se lavaron dos veces con PBS y se resuspendieron en este buffer a una concentración final de 1 x 106 cel/μL. Se transfirieron 100 μL de la suspensión (que contenía 1 x 105 células) a un tubo de 5 μL y se agregaron 5 μL de 7-AAD (BD PharmingenTM). Se homogeneizó suavemente en vórtex, se incubó 15 min a TA en oscuridad y se agregaron 400 μL de buffer PBS. Las determinaciones fueron leídas en un citómetro FACS Calibur (Becton Dickinson, Franklin Lakes, Nueva Jersey, Estados Unidos) y como mínimo se registraron 50.000 eventos por tubo. Los resultados fueron analizados utilizando el software FlowJo versión 5.7.2
Análisis estadístico
Para el análisis estadístico se utilizó el valor medio de tres ensayos independientes ± desviación estándar (DE) y se analizaron por análisis de varianza (ANOVA) seguido por el test de a posteriori de Tuckey. El criterio para la significación estadística fue p<0,05. Para todos los análisis se utilizó el programa InfoStat versión 2014 e.
Resultados
Infección y replicación viral
En el modelo de infección experimental in vitro de células U937 con VESL, se identificó la presencia de antígeno viral (Ag VESL+) por IFI (Fig. 1). Se observaron células U937 Ag VESL+ desde el primer día post-infección y se registró una variación en el número de células Ag VESL+ según la cepa infectante. El porcentaje de células infectadas a los distintos días post-infección se determinó como una medida de la tasa de infección. Con la cepa 78V-6507 se alcanzó el máximo nivel de células infectadas en el día 3 post-infección (30,0 ± 6,4% de células U937 Ag VESL+), mientras que en los días posteriores se registró la disminución gradual en el porcentaje de células Ag VESL+ (día 4 post-infección: 17,3 ± 1,4% y día 5 post-infección: 10,0 ± 1,7%). Con la cepa CbaAr-4005 se observó una tasa de infección más baja en los tres primeros días post-infección. En los dos últimos días se registró un aumento significativo de células infectadas respecto al día 3 post-infección (día 4: 84,0 ± 7,8% y día 5: 93,3 ± 1,8% vs. día 3: 10,5 ± 1,5%; p<0,05) y también respecto a las infectadas con 78V-6507 (día 4: 17,3 ± 1,4% y día 5: 10,0 ± 1,7%) (Fig. 2).

Figura 1. Detección de antígeno viral de VESL (Ag VESL+) mediante inmunofluorescencia. Imágenes obtenidas con microscopio Olympus Motorized lnverted Research, Modelo IX81. lmaging Software: Cell M. Objetivo 60X.

Figura 2. Porcentajes de células U937 Ag VESL+ con cepas 78V-6507 y CbaAr-4005 de VESL a distintos días pi y obtenidos por inmunofluorescencia. (*) Indica un aumento estadísticamente significativo (p<0,05) en el porcentaje de células Ag VESL+ con CbaAr-4005 en los días 4 y 5 pi respecto al día 3 pi. (+) Indica un aumento estadísticamente significativo (p<0,05) en el porcentaje de células Ag VESL+ con CbaAr-4005 en los días 4 y 5 pi respecto a los mismos días con la cepa 78V-6507.
Los resultados cuantitativos de la carga viral en sobrenadantes de cultivo también difirieron según la cepa infectante. En la infección por 78V-6507, el primer día post-infección mostró mayor número de copias de ADN viral que CbaAr-4005 (51.500 ± 3.535 vs. 29.500 ± 2.121 copias de ADN viral, respectivamente, p<0,05). Entre los días 2 y 3 post-infección se produjo el máximo número de copias (día 2: 51.500 ± 1.500 y día 3: 262.000 ± 13.000 copias de ADN viral). En los días 4 y 5 post-infección no hubo variaciones en el número de copias virales, lo que indicó que 78V-6507 no se replicó en los últimos días del ensayo (día 4: 260.000 ± 12.583 y día 5: 224.500 ± 6.500 copias de ADN viral). Distintos fueron los resultados arrojados con la cepa CbaAr-4005 ya que el mayor número de copias se observó en los días 4 (827.000 ± 18.000 copias de ADN viral) y 5 post-infección (1.525.000 ± 25.000 copias de ADN viral) (Fig. 3).
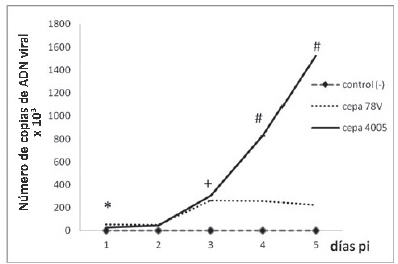
Figura 3. Carga viral de sobrenadantes de cultivos de células U937 infectadas con VESL cepa 78V-6507 y CbaAr-4005, obtenidos por qRT-PCR. Los valores se expresan como número de copias de ADN viral x 103. + Indica valores de copias significativamente mayores respecto al día anterior para la misma cepa infectante (p<0,05). * Indica valores de copias significativamente mayores para la cepa 78V- 6507 respecto a CbaAr-4005 (p<0,05). # Indica valores de copias significativamente mayores para CbaAr-4005 respecto de 70V-6500 (p<0,005).
Estos resultados muestran diferencias en la infección de U937 por VESL según la cepa infectante. Los altos valores de células infectadas y de copias de ADN viral obtenidos por la cepa CbaAr-4005, demuestran que ésta tiene mayor capacidad para infectar y replicar en las U937 que la cepa 78V-6507.
Cambios morfológicos de las células U937 por la infección con VESL
Las células U937 son no adherentes, por lo que crecen en suspensión cuando se cultivan. Al observarlas al microscopio poseen homogeneidad morfológica, se visualizan pequeñas, redondeadas y dispersas (Fig. 4.A). Cuando se infectaron con VESL se observó un efecto citopático representado por pérdida de la homogeneidad morfológica, granularidad citoplasmática, adhesión y agrupación celular. Las alteraciones mencionadas fueron más notorias con la cepa CbaAr-4005 en los días 4 y 5 post-infección (Fig. 4.B). Estos cambios fueron similares a los registrados en experimentos preliminares utilizando acetato forbol miristato (PMA) para inducir la maduración de las U937 a monocitos/macrófagos, proceso que fue dependiente de la concentración y el tiempo de exposición al agente (Fig. 4.C) (Fig. 4.D).

Figura 4. (A) Células U937 sin tratamiento, (B) Células U937 infectadas con VESL cepa CbaAr-4005, 4d pi., (C, D) Células U937 tratadas durante 4 días con PMA a dosis de 50 ng/mL y 100 ng/mL respectivamente. Imágenes obtenidas con microscopio Olympus Motorized lnverted Research, Modelo IXS 1. lmaging Software: Cell M. Objetivo 60X.
Cuando se analizó por citometría de flujo la distribución de las células U937 según su tamaño (forward scatter-FSC) y su complejidad citoplasmática (side scatter- SSC), se observó en los tres primeros días post-infección, en las células infectadas y en los controles negativos, una subpoblación predominante, con alto FSC, bajo SSC y alta viabilidad (más del 90% no colorearon 7-AAD) y en menor proporción una subpoblación con bajo FSC, alto SSC y baja viabilidad (más del 90% fueron (+) 7-AAD). A medida que transcurrieron los días post-infección, se observó disminución de tamaño y aumento en la complejidad citoplasmática de las células, lo que se reflejó en los cambios en la proporción de las subpoblaciones mencionadas. En las células infectadas por VESL en los días 4 y 5 post-infección se observó un aumento significativo de la subpoblación con bajo FSC y con alto SSC y una disminución de la subpoblación con alto FSC y bajo SSC. Esto fue más evidente con la cepa CbaAr-4005 (Fig. 5).
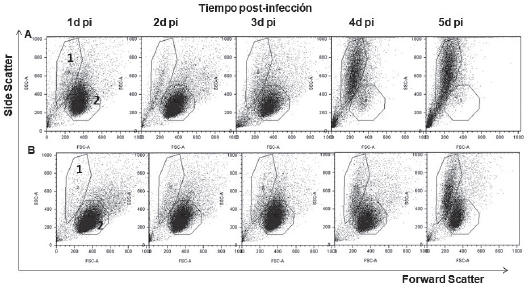
Figura 5. Distribución de side scatter (SSC) vs. forward scatter (FSC) de células U937. A: células U937 infectadas con VESL cepa CbaAr-4005. B: control negativo, U937 sin infectar. Las células fueron analizadas por FACS desde el día 1 al 5 post-infección (pi). 1. subpoblación de células con bajo FSC y alto SSC. 2. subpoblación de células con alto FSC y bajo SSC.
Impacto de la infección viral sobre la viabilidad de las células U937
La cinética de la viabilidad de las células U937 infectadas con VESL se evaluó por citometría de flujo a distintos días post-infección midiendo el porcentaje de células que no se colorearon con 7-AAD (células viables) de la ventana (gate) en los gráficos SSC vs. FSC. Así se demostró que la infección por VESL provocó una importante caída en la viabilidad de las U937 en los dos últimos días de los ensayos. La cepa CbaAr-4005 produjo una disminución significativa (p<0,05) en el porcentaje de células viables respecto de la cepa 78V-6507 y del control negativo en los días 4 (48 ± 10% vs. 76 ± 13% y 88 ± 12%; respectivamente) y 5 post-infección (38 ± 10% vs. 71 ± 9% y 82 ± 13%; respectivamente) (Fig. 6).

Figura 6. Cinética de la viabilidad de las células U937 infectadas con VESL obtenida por citometría de flujo. Gráfico de barras representando porcentajes de células viables (negativas para 7-AAD) en el control negativo, infección por cepa CbaAr- 4005 e infección por cepa 78V-6507. (*) Indica disminución estadísticamente significativa entre infección por cepa CbaAr-4005 respecto al control (-); p<0,01. (#} Indica disminución estadísticamente significativa entre infección por CbaAr-4005 respecto a 78V-6507; p<0,05.
Discusión y Conclusiones
En este trabajo se ha investigado la interacción entre cepas de VESL, flavivirus endémico en la Argentina y células de la inmunidad innata, en un modelo de infección in vitro de monocitos humanos (células U937) con cepas de distinta virulencia y condiciones epidemiológicas de aislamiento (CbaAr-4005 y 78V-6507). Se evaluó la capacidad de infectar y replicar del virus, así como el efecto citopático sobre las células U937. Se compararon los resultados obtenidos con cada cepa, ya que diferencias cuali o cuantitativas podrían estar relacionadas con la virulencia y condiciones de aislamiento de las mismas. U937 es una de las líneas celulares más utilizadas en modelos de investigación in vitro para la evaluación de la maduración del linaje monocítico y el subsiguiente análisis biológico de sus características funcionales (16). Esto se debe a que al inducir su diferenciación, estas células desarrollan características morfológicas y funcionales de maduración similares a las descriptas para las células monocíticas normales, cuyas funciones adquieren un gran repertorio (17) (18). Los monocitos, junto a los macrófagos y las células dendríticas (CD) son claves en el control de la replicación viral y la propagación de la infección por flavivirus (11). Asimismo, participan en el andamiaje de la respuesta adaptativa frente al patógeno, con consecuencia directa sobre el desarrollo y curso de la infección (19).
En este trabajo se demostró que células de linaje monocítico fueron susceptibles a la infección por VESL con las dos cepas estudiadas 78V-6507 y CbaAr-4005. Sin embargo, se observaron diferencias con cada una de ellas. La cepa CbaAr-4005 en el cuarto día de la infección registró un aumento significativo en la tasa de infección, y llegó en el último día (día 5 post-infección) a infectar al 93% de los monocitos. En la infección por 78V-6507 el pico de células infectadas se registró antes, en el tercer día, con un porcentaje menor (30%) de monocitos infectados, respecto a CbaAr-4005.
Estudios de infección de U937 con VDEN mostraron que estas células sin diferenciación previa a macrófagos, fueron susceptibles a la infección con los cuatro serotipos de VDEN sólo en presencia de anticuerpos opsonizantes y MOI superiores a 10 (20). Estos hallazgos en VDEN hacen que las U937 sean ampliamente utilizadas para evaluar el mecanismo de ADE (del inglés drive antibody-dependent enhancement), donde los anticuerpos no neutralizantes preexistentes formarían complejos inmunes con el nuevo serotipo. De esta manera se favorece la capacidad de infectar al macrófago mediante los receptores para la fracción Fc de las inmunoglobulinas (21). En la actualidad, con la emergencia del VZIK en Sud y Centroamérica se utilizan las U937 para evaluar la susceptibilidad al virus de la progenie mielomonocítica y también para analizar la existencia de ADE entre VDEN y VZIK (22). Son escasos los antecedentes bibliográficos que identifican las células blanco que infecta el VESL. Se demostró que los macrófagos peritoneales murinos fueron susceptibles a la infección in vitro por la cepa brasilera de VESL (SPAn 11916) sin registrarse el grado de infección ni de replicación (23). Otros trabajos han mostrado la susceptibilidad de células mieloides humanas (K562) y de neuroblastoma murino (Neuro2a) a la infección por VESL, cepa Parton, con una alta tasa de infección (24).
En la infección de monocitos humanos aislados de células mononucleares de sangre periférica (CMSP) con VDEN-2 cepa 16681 el porcentaje máximo de infección fue del 60% y se alcanzó en el día 2 post-infección. Se observó una disminución de las células infectadas en los días posteriores, hasta el 10% de infección en el día 5 post-infección (25). Similares resultados se obtuvieron en macrófagos murinos de médula ósea infectados in vitro con el Virus de la Encefalitis Japonesa (VEJ) cepa Beijing-1, con un pico en la infección del 55% al día 2 post-infección (26). Es importante destacar estos hallazgos en cuanto a la susceptibilidad de las U937 respecto a la infección por VESL. Se observó que las U937 fueron susceptibles a la infección por las cepas CbaAr-4005 y 78V-6507 con una MOI baja y sin necesidad de anticuerpos opsonizantes, ni diferenciación química, hecho que demostró que la cepa epidémica CbaAr-4005 posee un poder de infectividad muy alto.
Además de comprobar que ambas cepas de VESL infectan monocitos humanos, la cepa CbaAr-4005 demostró mayor capacidad de replicación en estas células, hecho que se tradujo en el mayor número de copias genómicas halladas con respecto a 78V-6507. Esto explicaría por qué casi la totalidad de los monocitos se encontraron infectados en los días en que se detectó un elevado nivel de carga viral. Rivarola et al. (27) comprobaron en modelo murino, que la cepa CbaAr-4005 se replicaba en diferentes órganos (cerebro, bazo, pulmón y riñón), lo que sugiere la existencia de algún tipo celular común en estos órganos que permitiera la replicación de VESL. Trabajos previos han informado que CD, macrófagos y neutrófilos actuarían como blancos de replicación para VON en bazo (28) (29). Asimismo, se ha visto que las células mieloides presentes en diversos tejidos linfoides como bazo, timo, médula ósea y nódulos linfáticos no drenantes son blanco de replicación del virus Encefalitis Equina del Este (arbovirus) (30). Dado que los monocitos son células comunes a los distintos órganos en los que se replicó VESL en el modelo de infección de Rivarola et al. (27), y en función de haber sido identificados en este trabajo como células blanco de VESL, se puede inferir que los monocitos serían unas de las células implicadas en la replicación del VESL durante la infección in vivo.
Es de destacar también que en la infección de ratones con VESL se sugirió que la cepa CbaAr-4005 lograría ingresar al SNC debido a su replicación previa en órganos periféricos, en base al tiempo de aparición del virus en los diferentes órganos, primero en bazo y riñón, luego en pulmón y por último en cerebro (15). Esto ha sido demostrado por Wang et al. (31), quienes utilizando ratones infectados por VON concluyeron que la replicación extraneuronal sería necesaria para la llegada del virus al SNC. También otro grupo de investigadores vinculó la replicación viral con la neuroinvasividad, ya que observaron que la supresión temprana de la replicación viral en los macrófagos y las CD, mediante tecnología de interferencia de ARN, fue clave en la prevención del desarrollo de enfermedad neurológica fatal en roedores (12).
Así, según los resultados de este trabajo y los antecedentes bibliográficos antes descriptos, se puede sugerir que los monocitos estarían implicados en la replicación extraneuronal de la cepa epidémica CbaAr-4005 de VESL en bazo, riñón y pulmón, lo que generaría un alto nivel de viremia que facilitaría la neuroinvasividad viral manifestada por esta cepa en modelo murino (27). En función de ello se podría considerar que los monocitos tendrían un importante rol en la fisiopatogénesis de la infección por VESL.
Dado que se han obtenido diferencias significativas en la capacidad de infección de las cepas de VESL estudiadas, está demostrado que distintas cepas virales pueden replicarse de manera diferente, condición probablemente regulada por mecanismos celulares que controlan la replicación y/o maduración viral (32) y este fenómeno a su vez puede constituir un factor determinante en la virulencia de una cepa (33). Actualmente muchos investigadores coinciden en que la virulencia es un proceso adaptativo que involucra tanto a los mecanismos de transmisibilidad y patogenicidad viral como al potencial de recuperación del hospedador (34). La virulencia también depende de la capacidad del virus para infectar las células del hospedador, multiplicarse en ellas, diseminarse y producir alteraciones que dan como resultado diferencias en la patogenicidad (35).
La mayor virulencia de la cepa CbaAr-4005, tanto en ratones (8) como en aves infectadas por VESL (36) podría deberse a múltiples factores. Según los resultados de este trabajo, uno de ellos sería la alta capacidad de CbaAr-4005 para infectar y replicarse en los monocitos. Otros investigadores han demostrado que la capacidad de infección y replicación del virus de la encefalitis transmitida por garrapatas (Tick Borne Encephalitis-TBEV) en macrófagos murinos se relacionaba con la virulencia de la cepa en el modelo animal in vivo (37).
Por otro lado, es importante destacar que el VESL toma como blanco para infectar y replicarse a una célula perteneciente a la inmunidad innata, como lo es el monocito. Por lo general, las células del linaje monocito-macrófago suelen tener éxito en eliminar a la mayoría de los microorganismos, sin embargo el patógeno puede evadir el poderío lítico de estas células logrando una “convivencia” y utilizándolas para su provecho (38). Se ha comprobado la subordinación de los monocitos por los flavivirus (11). Tal es el caso de VDEN que los utiliza para su replicación, aumentando la gravedad de la infección y el daño en el organismo del hospedador (39). Un comportamiento similar se le podría atribuir a cepa epidémica de VESL CbaAr-4005. Su alto grado de replicación permite inferir que logra evadir la capacidad microbicida del monocito y lo utiliza como reservorio para su propio beneficio. Esto le permite generar gran cantidad de viriones posibilitando la diseminación de la infección hacia otras células y tejidos, lo que beneficiaría su invasión al SNC. En cambio, VESL 78V-6507 no podría escapar de la acción del monocito. En la infección por esta cepa se comprobó que el monocito logró limitar, para luego inhibir, la replicación viral y con ello atenuar la eficacia de la infección por la cepa endémica. Esto explicaría, en parte, la menor virulencia de esta cepa hallada en modelo murino (8).
Para el VON ha sido identificada la estrategia que emplea el virus para evadir la inmunidad innata y así favorecer su replicación. El VON aumenta la biosíntesis de colesterol y genera su redistribución en la membrana plasmática de la célula huésped, lo que provocó una disrupción de los dominios rafts lipídicos y la inhibición de la acción de los interferones antivirales IFN á/â mediante señalización Jak/Stat (40). Para VESL no hay estudios preliminares que identifiquen los posibles mecanismos implicados en este proceso. En razón de lo expuesto y en base a estos resultados, se podría inferir un comportamiento particular de la cepa CbaAr-4005 reflejado por su alta capacidad de replicarse en una célula de la inmunidad innata, evadiendo la respuesta microbicida del monocito.
En este trabajo se comprobó que VESL provoca la muerte de monocitos humanos, hecho que depende del tiempo post-infección (a partir del tercer día) y de la cepa infectante (mayor con CbaAr-4005). Esto coincide con lo informado por Parquet et al. (24), donde VESL cepa Parton provocó la muerte celular según el tiempo post-infección. Sin embargo, en ese trabajo se halló un número importante de células muertas en días más tempranos post-infección. Las diferencias halladas respecto al tiempo en la inducción de muerte por VESL entre este trabajo y el de Parquet et al., se pueden justificar en el uso de cepas y líneas celulares diferentes. Así se obtuvo que a la misma MOI=1, la cepa epidémica CbaAr-4005 provocaba aproximadamente el doble de mortalidad que la cepa endémica 78V-6507 en la misma línea celular de monocitos humanos. Por otro lado, Parquet et al. (24) utilizando la misma cepa de VESL a MOI=1 pero en diferentes líneas celulares, obtuvieron distintos valores de mortalidad inducidos a diferentes tiempos de la infección. A partir de esta investigación y los antecedentes descriptos, se puede agregar que la muerte de células hospedadoras por VESL depende tanto de la cepa infectante, del tiempo de transcurso de la infección y del tipo de célula infectada por este virus.
En este trabajo se observaron también alteraciones morfológicas inducidas por la infección de VESL. Los monocitos mostraron disminución del tamaño celular y aumento de la complejidad citoplasmática a medida que avanzaba la infección. Esto hace inferir que la apoptosis podría ser el mecanismo de muerte de los monocitos en la infección por VESL. La apoptosis de células del SNC ha sido demostrada en ratones infectados por CbaAr-4005 (15) y en líneas celulares no monocíticas con la cepa Parton de VESL (24).
Agradecimientos
Los autores agradecen a la Dra. Ana Carro del Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales de la UBA, por cederles la línea celular U937, al bioquímico Javier Aguilar y al Dr. Pedro Gil del Instituto de Virología “Dr. J. M. Vanella”, Facultad de Ciencias Médicas, UNC, por el asesoramiento y colaboración en el uso de los cultivos celulares y técnicas de inmunofluorescencia.
Fuentes de financiación
Secretaría de Investigación y Vinculación Tecnológica, Universidad Católica de Córdoba.
Secretaría de Ciencia y Técnica (SECYT), Universidad Nacional de Córdoba. Ministerio de Ciencia y Técnica (MINCyT) provincia de Córdoba.
Fundación A. Roemmers.
Conflictos de intereses
Los autores declaran que no existen conflictos de intereses entre ellos ni entre las entidades con las cuales están involucrados.
1. Gubler DJ, Kuno G, Markoff L. Flaviviruses. In: Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, et al., editors. Fields virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins Publishers. p. 1.153-2; 2007. [ Links ]
2. Spinsanti LI, Díaz LA, Glatstein N, Arselán S, Morales MA, Farías AA, et al. Human outbreak of St. Louis encephalitis detected in Argentina, 2005. J Clin Virol 2008; 42 (1): 27-33. [ Links ]
3. Morales MA, Barrandeguy M, Fabbri C, Garcia JB, Vissani A, Trono K, et al. West Nile virus isolation from equines in Argentina, 2006. Emerg Infect Dis 2006;12 (10): 1.559-61. [ Links ]
4. Avilés G, Rangeón G, Vorndam V, Briones A, Baroni P. Dengue reemergence in Argentina. Emerg Infect Dis 1999; 5 (4): 575-8. [ Links ]
5. Ministerio de Salud de la Nación. Boletín Integrado de Vigilancia N° 327 – SE 37 – Septiembre de 2016.
6. Diaz LA, Ré V, Almirón WR, Farías A, Vázquez A, Sanchez- Seco MP, et al. Genotype III Saint Louis encephalitis virus outbreak, Argentina, 2005. Emerg Infect Dis 2006; 12 (11):1.752-4. [ Links ]
7. Diaz A, Coffey LL, Burkett-Cadena N, Day JF. Reemergence of St. Louis encephalitis virus in the Americas. Emerg Infect Dis 2018; 24 (12): 2.150-7. [ Links ]
8. Rivarola ME, Tauro LB, Llinás GA, Contigiani MS. Virulence variation among epidemic and non-epidemic strains of Saint Louis encephalitis virus circulating in Argentina. Mem Inst Oswaldo Cruz 2014; 109 (2): 197-201. [ Links ]
9. Turtle L, Griffiths MJ, Solomon T. Encephalitis caused by flaviviruses. QJM 2012; 105 (3): 219-23. [ Links ]
10. Dahm TA-O, Rudolph HA-O, Schwerk CA-O, Schroten H, Tenenbaum TA-O, Mediators I. Neuroinvasion and inflammation in viral central nervous system infections. Mediators Inflamm 2016; 2016: 1.466-861. [ Links ]
11. Ashhurst TM, van Vreden C, Muñoz-Erazo L, Niewold P, Watabe K, Terry RL, et al. Antiviral macrophage responses in flavivirus encephalitis. Indian J Med Res 2013; 138: 632-47. [ Links ]
12. Ye J, Zhu B, Fu ZF, Chen H, Cao S. Immune evasion strategies of flaviviruses. Vaccine 2013; 31 (3): 461-71. [ Links ]
13. Terry RL, Getts DR, Deffrasnes C, van Vreden C, Campbell IL, King NJC. Inflammatory monocytes and the pathogenesis of viral encephalitis. J Neuroinflammation 2012; 9 (1): 270. [ Links ]
14. Mitchell CJ, Monath TP, Sabattini MS, Cropp CB, Daffner JF, Calisher CH, et al. Arbovirus investigations in Argentina, 1977-1980. II. Arthropod collections and virus isolations from Argentine mosquitoes. Am J Trop Med Hyg 1985; 34 (5): 945-55. [ Links ]
15. Rivarola ME, Albrieu-Llinás G, Pisano MB, Tauro LB, Gorosito-Serrán M, Beccaria CG, et al. Tissue tropism of Saint Louis encephalitis virus: Histopathology triggered by epidemic and non-epidemic strains isolated in Argentina. Virology 2017; 505: 181-92. [ Links ]
16. Harris P, Ralph P. Human leukemic models of myelomonocytic development: a review of the HL-60 and U937 cell lines. J Leukoc Biol 1985; 37: 407-22. [ Links ]
17. Baek Y-S, Haas S, Hackstein H, Bein G, Hernandez- Santana M, Lehrach H, et al. Identification of novel transcriptional regulators involved in macrophage differentiation and activation in U937 cells. BMC Immunol 2009; 10: 18. [ Links ]
18. Sintiprungrat K, Singhto N, Sinchaikul S, Chen S-T, Thongboonkerd V. Alterations in cellular proteome and secretome upon differentiation from monocyte to macrophage by treatment with phorbol myristate acetate: insights into biological processes. J Proteomics 2010; 73 (3): 602-18. [ Links ]
19. Geissmann F, Manz MG, Jung S, Sieweke MH, Ley K. Development of monocytes, macrophages and dendritic cells. Science 2010; 327 (5966): 656-61. [ Links ]
20. Klomporn P, Panyasrivanit M, Wikan N, Smith DR. Dengue infection of monocytic cells activates ER stress pathways, but apoptosis is induced through both extrinsic and intrinsic pathways. Virology 2011; 409 (2): 189-97. [ Links ]
21. Puerta-Guardo H, Mosso C, Medina F, Liprandi F, Ludert JE, del Angel RM. Antibody-dependent enhancement of dengue virus infection in U937 cells requires cholester ol-rich membrane microdomains. J Gen Virol 2010; 91 (2): 394-403. [ Links ]
22. Chan JF-W, Yip CC-Y, Tsang JO-L, Tee K-M, Cai J-P, Chik KK-H, et al. Differential cell line susceptibility to the emerging Zika virus: implications for disease pathogenesis, non-vector-borne human transmission and animal reservoirs. Emerg Microbes Infect 2016; 5 (8): e93. [ Links ]
23. Barros VED, Ferreira BR, Livonesi M, Figueiredo LTM. Cytokine and nitric oxide production by mouse macrophages infected with Brazilian flaviviruses. Rev Inst Med Trop S Paulo 2009; 51 (3): 141-7. [ Links ]
24. Parquet MC, Kumatori A, Hasebe F, Mathenge EGM, Morita K. St. Louis encephalitis virus induced pathology in cultured cells. Arch Virol 2002; 147 (6): 1105-19. [ Links ]
25. Torrentes-Carvalho A, Azeredo EL, Reis SRI, Miranda AS, Gandini M, Barbosa LS, et al. Dengue-2 infection and the induction of apoptosis in human primary monocytes. Mem Inst Oswaldo Cruz 2009; 104 (8): 1.091-9. [ Links ]
26. Aleyas AG, George JA, Han YW, Rahman MM, Kim SJ, Han SB, et al. Functional modulation of dendritic cells and macrophages by Japanese encephalitis virus through MyD88 adaptor molecule-dependent and -independent pathways. J Immunol 2009; 183 (4): 2.462-74. [ Links ]
27. Rivarola ME. Procesos patogénicos e inmunológicos en la infección con Virus Encefalitis San Luis (VESL) en modelo murino. [Tesis de Doctorado en Ciencias Biológicas. Facultad de Ciencias Exactas, Físicas y Naturales. Universidad Nacional de Córdoba]; 2015. [ Links ]
28. Samuel MA, Diamond MS. Pathogenesis of West Nile Virus infection: a balance between virulence, innate and adaptive immunity, and viral evasion. J Virol 2006; 80 (19): 9.349-60. [ Links ]
29. Bai F, Kong K-F, Dai J, Qian F, Zhang L, Brown CR, et al. A paradoxical role for neutrophils in the pathogenesis of West Nile virus. J Infect Dis 2010; 202 (12): 1.804-12. [ Links ]
30. Vogel P, Kell WM, Fritz DL, Parker MD, Schoepp RJ. Early events in the pathogenesis of eastern equine encephalitis virus in mice. Am J Pathol 2005 Jan: 166 (1): 159-71. [ Links ]
31. Wang Y, Lobigs M, Lee E, Müllbacher A. CD8+ T cells mediate recovery and immunopathology in West Nile virus encephalitis. J Virol 2003; 77 (24): 13.323-34. [ Links ]
32. Diamond MS, Edgil D, Roberts TG, Lu B, Harris E. Infection of human cells by dengue virus is modulated by different cell types and viral strains. J Virol 2000; 74 (17): 7.814-23. [ Links ]
33. Lindenbach BD, Rice CM. Flaviviridae: the viruses and their replication. In: Knipe DM, Howley PM, editors. Fields Virology. Philadelphia: Lippincott-Raven Publishers; 2007. p. 1.101-51. [ Links ]
34. Lim SM, Koraka P, van Boheemen S, Roose JM, Jaarsma D, van de Vijver DAMC, et al. Characterization of the mouse neuroinvasiveness of selected European strains of West Nile Virus. PLoS One 2013; 8 (9): 1-14. [ Links ]
35. Nathanson N, Cole GA. Fatal Japanese encephalitis virus infection in immunosuppresed spider monkeys. Clin Exp Immunol 1970; 6 (1): 161-6. [ Links ]
36. Diaz LA, Nemeth NM, Bowen RA, Almiron WR, Contigiani MS. Comparison of Argentinean Saint Louis encephalitis virus non-epidemic and epidemic strain infections in an avian model. PLoS Negl Trop Dis 2011; 5 (5): 1-7. [ Links ]
37. Ahantarig A, Rüžek D, Vancová M, Janowitz A, Št’Astná H, Tesařová M, et al. Tick-borne encephalitis virus infection of cultured mouse macrophages. Intervirology 2009; 52 (5): 283-90.
38. Donadieu E, Bahuon C, Lowenski S, Zientara S, Coulpier M, Lecollinet S. Differential virulence and pathogenesis of West Nile viruses. Viruses 2013; 5 (11): 2.856-80. [ Links ]
39. Chaturvedi UC, Nagar R, Shrivastava R. Macrophage & dengue virus: Friend or foe? Indian J Med Res 2006; 124 (1): 23-40. [ Links ]
40. Mackenzie JM, Khromykh AA, Parton RG. Cholesterol manipulation by West Nile Virus perturbs the cellular immune response. Cell Host Microbe 2007; 2 (4): 229-39. [ Links ]
Recibido: 10 de octubre de 2019
Aceptado: 3 de marzo de 2020














