Introducción
La hepatotoxicidad se refiere a la disfunción o daño hepático que se asocia con una sobrecarga de fármacos o xenobióticos y es un fenómeno complejo que implica diferentes causas, entre las que se encuentran aspectos farmacocinéticos, la presencia y localización de enzimas de activación/desactivación y la capacidad del tejido para reparar un daño originado por el xenobiótico (1) (2) (3). Muchos de estos compuestos son destoxificados y eliminados por el hígado, la mayoría como conjugados, algunos se excretan sin ser modificados y otros son bioactivados a intermediarios reactivos que pueden llevar a un daño en el hígado u otros desórdenes, que incluyen el cáncer (4) (5).
Resulta pertinente señalar que el hígado es uno de los órganos más afectados por las especies radicalarias del oxígeno (ROS) (6) (7). Diferentes moléculas están involucradas en el desarrollo del daño hepático experimental en función de un mecanismo de estrés oxidativo, hecho evidente en la degeneración grasa, la fibrosis, la muerte hepatocelular y la carcinogenicidad (8) (9) (10) (11) (12).
En la actualidad existen pocos fármacos eficaces disponibles que estimulen la función hepática, ofrezcan protección al hígado de posibles daños y/o ayuden a regenerar las células hepáticas. Entonces, resulta interesante buscar fármacos alternativos para el tratamiento de enfermedades hepáticas (13). Por otra parte, las plantas medicinales juegan un papel clave en el cuidado de la salud humana. Aproximadamente el 80% de la población mundial depende del uso de medicina tradicional, que se basa predominantemente en material vegetal (14) (15). Las investigaciones sobre los beneficios medicinales de las plantas y las adaptaciones de la medicina tradicional se denominan Medicina Complementaria o Alternativa (16).
Los modelos animales representan una herramienta importante en las investigaciones biomédicas e implican la complejidad del animal, aspectos farmacocinéticos, farmacodinámicos y efectos toxicológicos (17) (18) (19).
En los modelos animales de estrés oxidativo existe un grupo numeroso de moléculas inductoras de daño hepático, aunque quizás los más utilizados son el acetaminofen y el CCl.. Solamente el modelo animal de estrés oxidativo inducido por CCl. ha sido empleado en más de 50 000 investigaciones (17) (18) (20) (21).
Los modelos de daño hepático inducido por xenobióticos presentan algunos inconvenientes. En ocasiones, el compuesto se metaboliza en el hígado y en otros órganos, especialmente en los pulmones y riñones (17) (22). Otro inconveniente importante de estos modelos es que en algunas ocasiones no se evidencia el daño hepático por los procedimientos moleculares mientras que los resultados histopatológicos lo demuestran, en cierta medida debido a que la recuperación de los parámetros bioquímicos es más rápida que la recuperación de la funcionalidad y arquitectura del hepatocito (23) (24) (25).
El estrés oxidativo y su relación con el uso de antioxidantes procedentes de algas marinas ha sido estudiado en diferentes procedimientos experimentales como modelos animales y cultivos de células, con resultados satisfactorios (26) (27).
Las algas marinas desde épocas ancestrales han sido empleadas como fitofármacos contra diferentes patologías (28) (29). Estudios in vitro, en modelos animales y en investigaciones epidemiológicas, han evidenciado una relación directa e inversa entre el consumo de algas y la incidencia de algunas enfermedades y síndromes, incluido el estrés oxidativo (30) (31) (32) (33) (34) (35) (36) (37). En diferentes revisiones se señalaron las propiedades hepatoprotectoras de las algas marinas (38) (39) (40).
Diversos autores han demostrado actividades antioxidantes en especies de algas marinas, explicadas en muchos casos por su composición de polifenoles y de polisacáridos como los fucoidanos, aunque se debe señalar que existen otras moléculas que podrían definir estas propiedades como son los carotenoides, los terpenoides, las ficobilinas y las vitaminas. Adicionalmente es importante señalar que la actividad antioxidante a su vez se relaciona con las propiedades hepatoprotectoras (41) (42) (43) (44) (45) (46) (47) (48) (49) (50) (51).
Desde el año 1997 el Grupo de Farmacología y Toxicología de la Facultad de Biología de la Universidad de La Habana en coordinación con el Laboratorio de Lípidos de la FCF-USP (Brasil) realiza investigaciones acerca de las algas marinas como fuentes naturales de antioxidantes y su relación con la neuro y hepatoprotección, explicadas a partir de su composición en polifenoles, con especial hincapié en los ácidos fenólicos.
A partir de estas consideraciones, el objetivo de este artículo de revisión fue resumir el estado de la ciencia hasta la fecha acerca del papel de los extractos y moléculas aisladas de las algas marinas como fuentes naturales de hepatoprotectores y su relación con las propiedades antioxidantes.
Las algas como fuentes de bioactivos antioxidantes
Desde épocas ancestrales, el reino vegetal tiene una extraordinaria importancia como fuente de fitofármacos. De acuerdo con Adewusi y Afolayan (13), existen más de cien plantas con 58 compuestos químicos con actividad hepatoprotectora; muchas de ellas se deben a sus propiedades antioxidantes; a modo de ejemplo, se podrían citar la silimarina y el resveratrol (52).
Durante los últimos años se ha incrementado el interés por su estudio debido principalmente a sus propiedades terapéuticas, incluida la actividad antioxidante y, en general, como fuentes de compuestos bioactivos (53).
Las algas poseen una amplia diversidad de compuestos antioxidantes entre los que se podría citar a los polisacáridos, carotenoides y a los compuestos fenólicos (49) (54). Cotas et al. (37) realizaron una amplia revisión acerca de los compuestos polifenólicos de las algas marinas y consideraron como los más importantes a los ácidos fenólicos, los florotaninos, las micosporinas, los terpenoides fenólicos, los flavonoides y los bromofenoles. Por otra parte, diferentes autores señalaron una relación directa entre el contenido de compuestos polifenólicos de las algas y las propiedades antioxidantes (43) (46).
Dentro del grupo de compuestos polifenólicos con actividad antioxidante, los subgrupos más interesantes son los ácidos fenólicos, los flavonoides y los florotaninos, lo que se explica por su amplia presencia en muchas especies y por su connotación como antioxidantes (55).
Diferentes autores han encontrado cantidades significativas de ácidos fenólicos en las algas. En las algas pardas Ascophyllum nodosum, Bifurcaria bifurcata y Fucus vesiculosus se han encontrado como los principales compuestos polifenólicos a los florotaninos y a los derivados de los ácidos fenólicos rosmarínico, hidroxibenzoico, quínico, p-coumárico y ferúlico así como a los flavonoides (56). Sin embargo, Generalic Mekinic et al. (57) en una amplia revisión sobre polifenoles de las algas pardas (Pheophyceae) señalaron como los más abundantes a los ácidos fenólicos gálico, 4-hidroxibenzoico, vanílico, protocatéquico, siríngico, cafeico, ferúlico y clorogénico. Rengasamy et al. (58) mediante la técnica de UHPLC-MS han identificado los ácidos protocatequinico y p- y m-hidroxibenzoico en 4 algas verdes y 4 algas rojas. Souza et al. (59) identificaron apigenina y ácido gálico en algas del género Gracilaria mediante la técnica de LC-MS. También Belda et al. (60) identificaron y cuantificaron 11 compuestos, de los cuales el más abundante era el ácido gálico. Yoshie et al. (61) han identificado ácido cafeico y otros compuestos polifenólicos en algas verdes del género Halimeda.
El grupo de investigación de Toxicología y Nutrición de la Universidad de La Habana tiene experiencia en el estudio de los ácidos fenólicos como fuentes de hepatoprotectores. Vidal et al. (62) identificaron los ácidos t-cinámico, p-coumárico y ferúlico en extractos acuosos del alga roja Bryothamnion triquetrum y sugirieron que estos compuestos estaban relacionados con sus propiedades antioxidantes. Posteriormente Vidal et al. (63) investigando las propiedades hepatoprotectoras y antioxidantes de B. triquetrum observaron en los animales tratados con el alga y con CCl4, la sobreexpresión de la enzima catalasa, incrementos en los niveles de GSH y la disminución de marcadores de daño hepático y peroxidativo, lo que evidencia las propiedades hepatoprotectoras de esta alga.
En algunas especies de algas verdes se han demostrado propiedades antioxidantes, relacionadas con la presencia de polifenoles. El alga Halimeda incrassata tiene un alto contenido de compuestos fenólicos; más de la mitad (63%) corresponden a ácidos fenólicos libres y el 37% son ésteres solubles de ácidos fenólicos (PASE). En la fracción de ácidos fenólicos libres, alrededor del 32% corresponde al ácido salicílico y una pequeña fracción se asoció al ácido ferúlico. En la fracción PASE, el componente mayoritario es el ácido salicílico (27%) (64). En Halimeda opuntia y Halimeda monile, una tercera parte de los polifenoles totales corresponden a ácidos fenólicos y el compuesto mayoritario es el ácido salicílico y, además, se encontraron los ácidos fenólicos cinámico, p-coumárico, gálico, pirogálico, ferúlico, cafeico y sináptico. En el alga H. opuntia el 44,6% corresponde a ácidos fenólicos libres y el 55,4% restante a los ésteres solubles e insolubles de ácidos fenólicos. En cambio, en el alga H. monile el 33% corresponden a ácidos fenólicos libres y el 66% son ésteres solubles e insolubles de ácidos fenólicos (65). Las propiedades antioxidantes y hepatoprotectoras de una fracción de ácidos fenólicos de H. incrassata se investigaron en ratas con lesiones hepáticas inducidas por CCl4. El pretratamiento con H. incrassata condujo a una reducción de aproximadamente el 50% en los niveles de sustancias reactivas al ácido tiobarbitúrico (TBARS) en el hígado y a una sobreexpresión génica de la enzima catalasa estudiada mediante la técnica RT-PCR (del inglés: reverse transcription polymerase chain reaction). Estos resultados evidencian el potencial antioxidante y hepatoprotector de esta alga para su aplicación en condiciones asociadas al estrés oxidativo (66).
Marcadores de daño hepático
En las algas marinas la protección al daño hepático podría ser explicada por varios mecanismos moleculares: a) la capacidad atrapadora de radicales libres (B. triquetrum), b) la inducción de enzimas antioxidantes hepáticas (H. monile, H. incrassata y B. triquetrum), c) el equilibrio de la velocidad de síntesis y liberación de triglicéridos (Sargassum polycystum y Ulva lactuca), d) la prevención del estrés oxidativo sobre el metabolismo del colesterol en el hígado (U. lactuca), e) el incremento de la excreción y disminución de la absorción y acumulación en el organismo de toxinas lipofílicas (Undaria pinnatifida), f) la protección a la necrosis y al daño del ADN (U. lactuca) y g) protección al funcionamiento de organelas como las mitocondrias (U. lactuca) (62) (63) (66) (67) (68) (69) (70) (71) (72).
El daño hepático inducido por xenobióticos está asociado con la severidad de la peroxidación lipídica y esto conlleva al daño de las membranas celulares y organelas del hepatocito, que a su vez implica una sensible afectación de la función de transporte de los hepatocitos y la consiguiente salida de metabolitos y enzimas hepáticas a través de la membrana plasmática, con incrementos de determinadas enzimas y metabolitos en el suero (8) (21) (73) (74) (75).
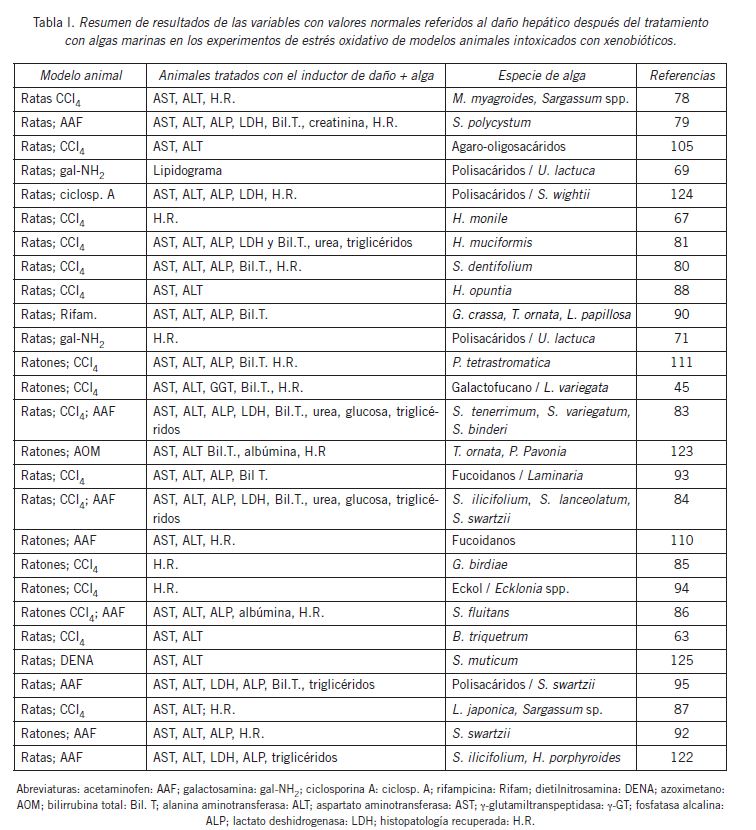
En el daño hepático se observan aumentos drásticos de las actividades de las enzimas alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), fosfatasa alcalina (ALP) y gamma-glutamiltranspeptidasa (Ɣg-GT) y de analitos como urea y bilirrubina en suero, adicionalmente acompañados de una disminución significativa en el total de proteínas y grupos sulfhidrilos no proteicos (NP-SH) en hígado y riñón, lo que indica la alteración extensa de la estructura y función del hígado (17) (73). También aumentan los niveles en suero de lípidos totales, triglicéridos, colesterol total y LDL (76) (77).
La relación de las enzimas transaminasas ALT/ALP juega un papel importante en definir el tipo de daño producido por las hepatotoxinas. La relación es mayor o igual a cinco durante el daño hepatocelular. La determinación de la relación ALT y AST y/o la combinación con bilirrubina total se recomienda principalmente para la evaluación de la lesión hepatocelular en estudios preclínicos. La evaluación de la enzima ALT se considera un método más específico y sensible para indicar el daño hepatocelular que la AST (73). La estimación de bilirrubina sérica, bilirrubina urinaria y urobilinógeno ayuda a conocer la capacidad del hígado para transportar aniones orgánicos y para metabolizar fármacos o xenobióticos.
La medición de las enzimas hepáticas sorbitol deshidrogenasa (SDH), glutamato deshidrogenasa (GLUD) y lactato deshidrogenasa (LDH) en la sangre resultan útiles para conocer el funcionamiento normal del hígado. Otros parámetros hepáticos medibles podrían ser la concentración de albúmina, las proteínas totales y el tiempo de protrombina, que son marcadores de la capacidad biosintética del hígado (18).
La mayoría de los trabajos demostraron el daño oxidativo por xenobióticos y la posterior recuperación de los animales tratados con algas marinas a través de las actividades de las enzimas ALT y AST. Diferentes autores han demostrado las propiedades hepatoprotectoras y antioxidantes en extractos de las algas Hypnea muciformis, Gracilaria birdiae, B. triquetrum, Chaetomorpha linum, Myagropsis myagroides, Laminaria japonica, Ulva reticulata Gracilaria crassa y Sargassum spp. (63) (69) (78) (79) (80) (81) (82) (83) (84) (85) (86) (87), en fracciones ricas en polifenoles de las algas H. opuntia y H. monile (38) (88) (89) y con moléculas aisladas de algas como polisacáridos, florotaninos y ficoesteroles (81) (90) (91) (92) (93) (94) (95) (96). En estos trabajos se ha encontrado una relación directa entre la actividad antioxidante y las propiedades hepatoprotectoras, evidenciada en la recuperación del animal a nivel molecular con valores normales de enzimas marcadoras y analitos.
Los análisis histopatológicos confirman la hepatotoxicidad por xenobióticos. Resulta interesante señalar que existe una concordancia entre los resultados de los exámenes microscópicos y los procedimientos moleculares para definir el daño hepático, por lo que se obtendría un diagnóstico más seguro (63) (97).
Según los resultados de la histopatología, la hepatotoxicidad se puede caracterizar en dos grupos principales, cada uno con un mecanismo de lesión diferente: hepatocelular y colestásico (1). La lesión hepatocelular o citolítica implica predominantemente elevaciones de los niveles de aminotransferasas séricas, generalmente antes de los aumentos en los niveles de bilirrubina total y de los aumentos moderados de la fosfatasa alcalina (1) (2) (73).
La mayoría de los autores que investigaron las propiedades hepatoprotectoras de las algas marinas han empleado ambos procedimientos, marcadores moleculares y estudios histopatológicos, lo que evidentemente resulta ideal pues se abarcan los daños moleculares y los que ocurren a nivel del tejido hepático (7) (80) (83) (84) (86) (93) (94).
En determinadas ocasiones la evaluación de las propiedades hepatoprotectoras de los extractos de las algas marinas se definen solamente a partir de los resultados de los análisis histopatológicos y no se determina el daño hepático con los marcadores moleculares AST y ALT. Por supuesto, la administración de un xenobiótico como el CCl4 conlleva un daño oxidativo agudo en el animal, y por tanto un daño en el tejido hepático, de manera que ambos están estrechamente relacionados (67) (82) (85) (88).
En la Tabla I se presenta un resumen de las variables del daño hepático provocado por los inductores y la recuperación por el tratamiento con algas marinas.
La lesión hepática secundaria tras la administración de xenobióticos como el CCl4 se debe a la inducción de procesos inflamatorios mediados por células de Kupffer y macrófagos que liberan algunas citoquinas, incluido el factor de necrosis tumoral (α-TNF) (98) (99) (100). El factor de crecimiento de hepatocitos (HGF) y el antígeno nuclear de células proliferantes (PCNA) se inducen en la etapa temprana (6 y 36 h, respectivamente) mientras que el factor ERK2 se activa a las 3 h de tratamiento con CCl4. Estas observaciones sugieren que el CCl4 induce concomitantemente ambos procesos, la lesión aguda y la regeneración del hígado (100). Esto explica, al menos en parte, por qué en algunas ocasiones, mientras los animales tratados con CCl4 presentan un daño hepático inmediato (6 a 12 h); a su vez se observa una rápida recuperación de los animales (48 h), referidos a los parámetros bioquímicos, no así en los resultados histopatológicos, lo que podría resultar un inconveniente de este modelo. Por otra parte, este hecho resalta la importancia de los estudios histopatológicos en este modelo (100) (101) (102).
Marcadores de daño oxidativo
La peroxidación lipídica es el proceso referido a la degradación oxidativa de los lípidos que conforman las biomembranas, en particular los ácidos grasos poliinsaturados y molecularmente ocurre a partir de la producción de varios tipos de especies reactivas de oxígeno (ROS), formando radicales alcoxi- y peroxilo, para producir posteriormente peróxidos de lípidos, los que dañan la membrana celular (8) (103). De esta manera, el daño hepático oxidativo se identifica a través de la determinación de moléculas obtenidas a partir de la lipoperoxidación.
La lipoperoxidación produce como metabolito final al malondialdehído (MDA), de manera que el aumento de los niveles de MDA en suero y tejido hepático es indicativo de peroxidación de lípidos y, a su vez, indicador de daño y alteraciones de biomembranas, estructuras y funciones celulares (104). La mayoría de los autores consideran al MDA como TBARS (sustancias reactivas al ácido tiobarbitúrico, siglas en inglés) en alusión a su determinación.
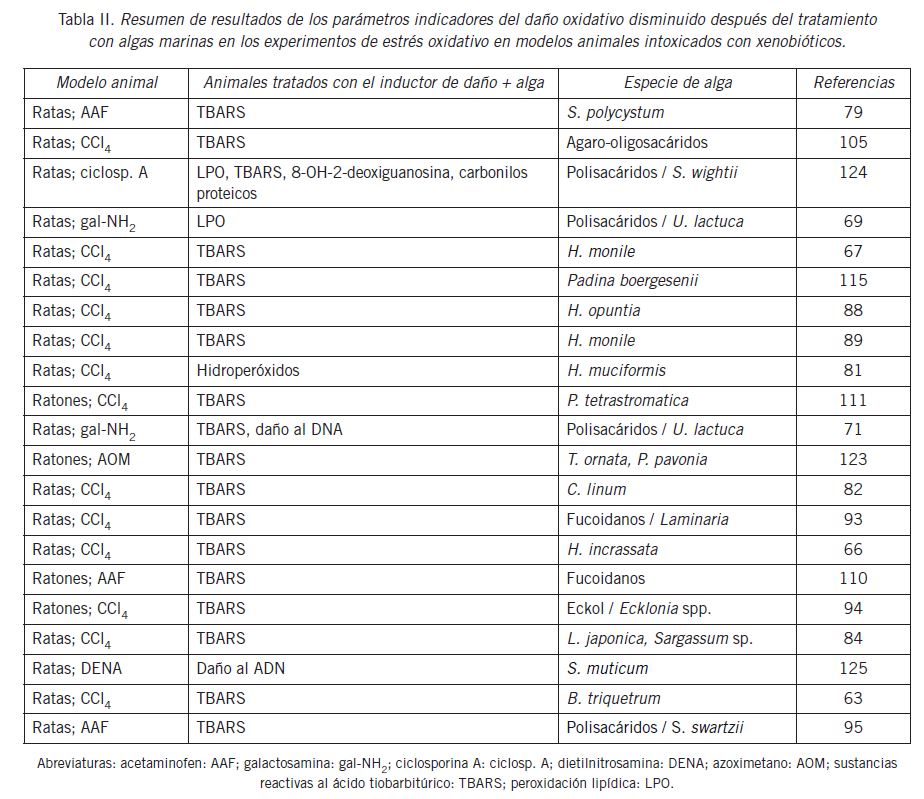
En trabajos referidos a investigar la capacidad antioxidante y hepatoprotectora de extractos y moléculas de algas marinas se han observado incrementos significativos de los niveles de MDA, con valores de 1,5 a 4,5 veces con respecto a los valores normales en suero y tejido hepático, lo que confirma una inducción exitosa del daño oxidativo. En estos trabajos, los animales se trataron con las algas marinas H. opuntia, H. monile, S. polycystum, Hypnea muciformis . Chaetomorpha linum con una reducción significativa de los niveles hepáticos y séricos de TBARS (67) (79) (82) (88) (94) (105).
De acuerdo con Vidal et al. (63) los animales tratados con CCl4 incrementaron significativamente los niveles de TBARS sérico y hepático mientras que el pretratamiento con el alga B. triquetrum condujo a una reducción significativa de TBARS (aproximadamente 1,93).
En diferentes investigaciones de este grupo se demostraron las propiedades antioxidantes y hepatoprotectoras de las algas verdes del género Halimeda (H. opuntia, H. monite y H. incrassata). En estas investigaciones se pudieron apreciar incrementos en los niveles de TBARS en los grupos tratados con CCl4, lo que confirma la inducción del daño oxidativo. Al administrar los extractos de las algas se pudo observar que los niveles de TBARS se redujeron aproximadamente al 50% en el hígado y en el suero (66) (67) (88) (89). Un estudio previo de este laboratorio de estrés oxidativo inducido por metilmercurio en ratas Wistar mostró que un extracto acuoso de H. incrassata fue eficaz al reducir significativamente los niveles de TBARS en suero e hígado y los síntomas clínicos neurológicos (106).
El 4-hidroxinonenal (HNE) ha sido empleado con resultados satisfactorios para estudiar el daño oxidativo a biomembranas debido a que es un producto de degradación de los ácidos grasos. Se une fácilmente a grupos funcionales de proteínas e inhibe importantes actividades enzimáticas (107). Bupesh et al. (81) investigaron las propiedades hepatoprotectoras de un extracto del alga H. muciformis y observaron que los valores de hidroperóxidos en los animales tratados con CCl4 se encontraban duplicados con respecto a los controles, mientras que en los tratados con el alga retornaban a valores normales. También Kim et al. (108) observaron incrementos en los niveles de hidroperóxidos séricos en animales tratados con CCl4, mientras que los valores de los ratones alimentados con Saengshik®, un alimento que contiene vegetales y algas, disminuían significativamente.
Un resumen de las variables del daño oxidativo provocadas por los inductores y la recuperación por el tratamiento con algas marinas se muestra en la Tabla II.
Defensas antioxidantes
Las defensas antioxidantes incluyen a las enzimas antioxidantes y determinados metabolitos como vitaminas (vitamina C y E) y el glutatión (GSH).
El GSH actúa en la inactivación de radicales libres, como los metabolitos tóxicos del CCl4 y el acetaminofen, de manera que existe una relación directa entre la disminución en las reservas de GSH y el daño oxidativo (109).
Diferentes investigadores (93) (94) (110), estudiando moléculas aisladas de algas como fucoidanos y eckol (florotanino aislado de Ecklonia spp.) encontraron una disminución de GSH en los animales tratados con CCl4 mientras que el tratamiento con esas moléculas restituyó los valores normales. Algunos autores al investigar extractos de las algas marinas H. muciformis, Padina tetrastromatica, H. monile y Chaetomorpha linum observaron un comportamiento similar en los niveles de GSH de animales tratados con CCl4 y su posterior recuperación por el tratamiento con el alga marina (67) (81) (82) (95) (111).
En algunos experimentos se ha observado que la administración de CCl4 conlleva incrementos en los niveles de GSH. Vidal et al. (63)(66) al investigar las propiedades hepatoprotectoras de H. incrassata y B. triquetrum observaron incrementos del GSH en los animales con lesiones hepáticas, mientras que los animales tratados con el alga y administración conjunta de CCl4 presentaban valores bajos de GSH. Esta situación podría ser explicada como una respuesta adaptativa contra el estrés oxidativo producido por el xenobiótico (109) (112).
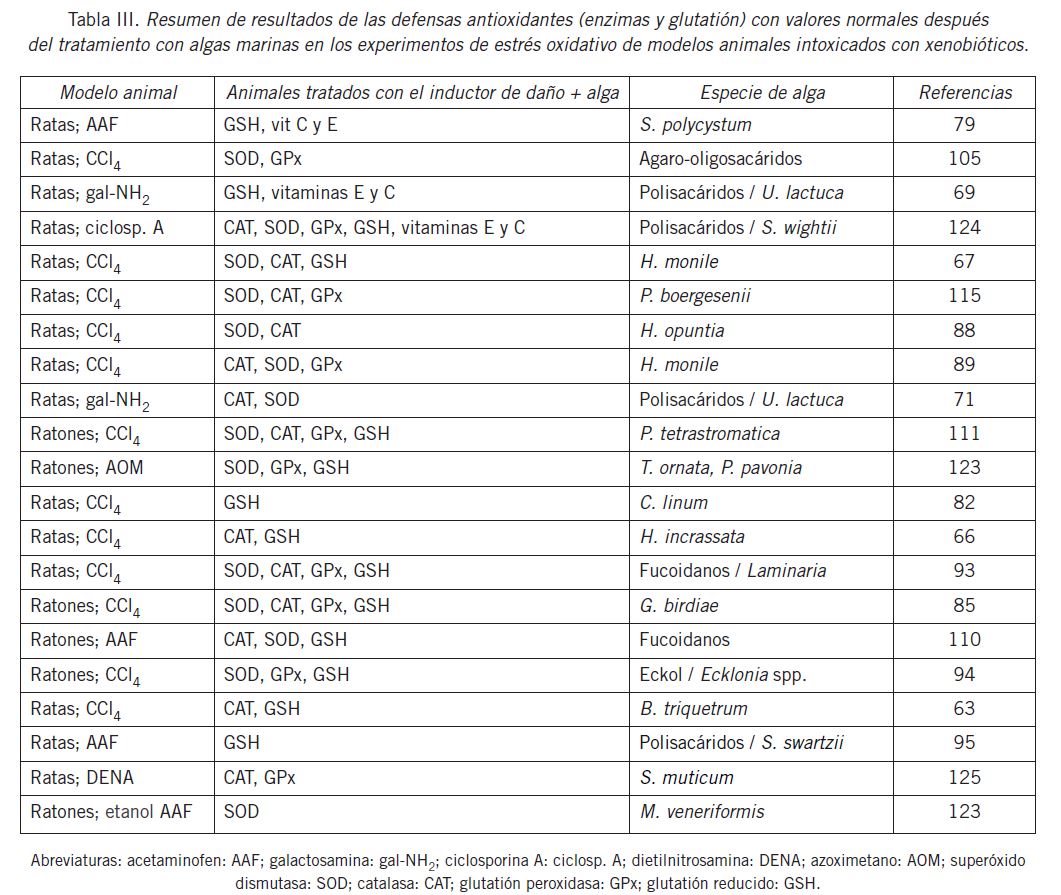
Los antioxidantes endógenos incluyen a las enzimas antioxidantes superóxido dismutasa (SOD), catalasa (CAT), glutatión peroxidasa (GPx), para-oxanasa y glutatión S-transferasa (GSTs). La actividad de estas enzimas se puede alterar durante el estrés oxidativo (113). Por otra parte, las algas marinas pueden alterar, generalmente incrementando, las actividades de estas enzimas.
Vidal et al. (63) observaron que la administración de CCl. disminuía la actividad de la CAT y al administrar el extracto de B. triquetrum la actividad retornaba a valores normales. También Mancini-Filho et al. (67) informaron incrementos en la actividad de la enzima CAT en ratas tratadas con H. monile. El tratamiento de dosis repetidas de extractos de Caulerpa prolifera, Laurencia obtusa y Padina boergesenii incrementa la actividad de esta enzima en animales con daño hepático (114) (115).
En diferentes investigaciones se han observado respuestas disímiles en las actividades de las enzimas antioxidantes en experimentos de estrés oxidativo con algas marinas. Silva et al. (88) no observaron variaciones en las actividades de las enzimas SOD, CAT y GPx en las ratas tratadas con CCl4; sin embargo, detectaron incrementos estadísticamente significativos en los grupos de animales tratados con el extracto de H. opuntia. Algunos autores (111) observaron decrementos significativos en las actividades de la enzima CAT y una posterior recuperación con el tratamiento con las algas mientras que El-Boshy et al. (93) no notaron cambios en las actividades de la enzima CAT. Vidal et al. (66) observaron que la administración de CCl. conducía a una disminución de la enzima CAT y que con el tratamiento con H. incrassata los valores se encontraban entre los correspondientes al grupo control y los tratados con CCl4.
El-Boshy et al. (93) y Gnana Silva et al. (111) observaron una disminución de la actividad de SOD con daño hepático y un posterior incremento con la administración del alga (fucoidanos de Laminaria spp. y P. tetrastromatica) mientras que Vidal et al. (66) investigando el alga B. triquetrum no observaron variaciones estadísticas en los diferentes grupos experimentales en la actividad de esta enzima. Silva et al. (88) no encontraron diferencias entre el grupo control y los animales tratados con CCl4, pero sí detectaron incrementos en la actividad de SOD en las ratas tratadas con H. opuntia. Por su parte, Mancini et al. (64) observaron incrementos en la actividad de SOD en ratas tratadas con H. monile y en los animales tratados con CCl4.
Silva et al. (88) y Batista-González et al. (89) investigando las propiedades hepatoprotectoras del alga H. opuntia no observaron diferencias en la actividad de GPx entre los grupos control y CCl4, pero sí incrementos en la actividad del grupo tratado con el alga. Resultados similares fueron informados por Li et al. (94) para esta enzima (GPx) con el florotanino eckol (Ecklonia stolonifera); sin embargo, El-Boshy et al. (93) y Gnana Silva et al. (111) no observaron cambios en la actividad de esta enzima investigando las algas marinas P. tetrastromatica y Laminaria spp. Se ha informado una alta actividad enzimática de SOD y GPx con la administración repetida de extractos de Caulerpa prolifera y Laurencia obtusa (114).
Estas disímiles respuestas de actividad enzimática podrían explicarse, en primer lugar, por la compleja y diferente composición de las distintas especies de algas. Otra explicación sería referida al modelo animal y su interacción con el medio ambiente, como modificaciones en la dieta, líneas de animales, variables experimentales como la vía de administración y tipo de inductor, entre otros factores (17) (18) (21).
Resulta interesante analizar el comportamiento uniforme de las enzimas antioxidantes en los estudios de las propiedades de hepatoprotección de moléculas aisladas de algas marinas. Li et al. (94) investigando las propiedades hepatoprotectoras del eckol, encontraron una disminución de las actividades de las enzimas SOD y GPx con la administración de CCl4, la que retornó a valores normales con el tratamiento del florotanino. Hong et al. (116) y Wang et al. (110), investigando fucoidanos aislados de algas pardas, obtuvieron resultados similares.
Algunos metabolitos secundarios de las algas como los polifenoles pueden funcionar indirectamente como antioxidantes a través de diferentes mecanismos; a) inhibición de los factores de transcripción redox-sensibles, como el factor nuclear-kB, b) inhibición de enzimas “prooxidantes”, tales como óxido nítrico sintasa inducible, lipoxigenasas y ciclooxigenasas y c) inducción de enzimas antioxidantes y de la fase II (110) (117) (118).
La inducción enzimática ocurre a través de la sobreexpresión de ARNm. Stevenson y Hurst (120) señalaron que los efectos antioxidantes de los polifenoles a través de la inducción de enzimas pueden ocurrir en concentraciones más bajas que las necesarias para la actividad atrapadora de radicales libres.
Anantachoke et al. (120) señalaron que los polifenoles de frutas tropicales podían ejercer el efecto antioxidante a través de la inducción de las enzimas CAT, SOD y GPx a partir de la sobreexpresión de ARNm. Yeh y Yen (121) sugirieron que los ácidos fenólicos de vegetales modulaban las enzimas antioxidantes de fase II como la conjugación con sulfatos y parecían inducir selectivamente transcripciones de ARNm hepático para SOD-Cu, Zn, GPx y CAT, probablemente a través de la regulación positiva de la transcripción de genes, así como del factor de transcripción Nrf2. De acuerdo con Wang et al. (110), los fucoidanos de algas marinas actúan como hepatoprotectores a través de la inhibición del CYP2E1 y de incrementos significativos en las actividades de las enzimas SOD y CAT, que podrían estar relacionados con la regulación del factor Nrf2. De manera que las algas marinas pueden presentar actividad hepatoprotectora relacionada con las propiedades antioxidantes por diferentes mecanismos incluidos la sobreexpresión génica, pero a su vez en un mismo experimento se pueden observar también propiedades de protección a otros órganos (122). Otros autores han observado incrementos de la actividad de enzimas no relativas directamente con el estrés oxidativo como la Na+, K+, Ca2+ y Mg2+ - ATPasa y sobreexpresión de genes supresores de tumores con tratamientos de extractos o moléculas aisladas de algas marinas (123) (124) (125).
Silva et al. (88) observaron que la administración de una fracción fenólica de H. opuntia provocaba una sobreexpresión de las enzimas antioxidantes CAT, SOD y GPx y esto explicaba sus propiedades hepatoprotectoras. En otras investigaciones (63) (66) (67) (89) observaron una sobreexpresión de los genes de las enzimas CAT, SOD y GPx del tejido hepático mediante la técnica de RT-PCR en las ratas tratadas con las algas marinas B. triquetrum, H. incrassata y H. monile. En la Tabla III se puede apreciar un resumen de los resultados de las enzimas y metabolitos antioxidantes de los experimentos de estrés oxidativo con los animales tratados con las algas marinas.
En resumen, las algas marinas presentan moléculas, como los compuestos polifenólicos, capaces de inducir la actividad de las enzimas antioxidantes en modelos animales, a su vez aportan al potencial antioxidante y, por lo tanto, coadyuvan a las propiedades hepatoprotectoras de estos organismos.
Conclusiones
La morbilidad de las enfermedades hepáticas, entre ellas algunas relacionadas con el estrés oxidativo, se considera alta a nivel mundial y, en contraposición, existen pocos fármacos disponibles para enfrentarlas (52).
Históricamente, las plantas han sido fuentes de medicamentos, desde extractos crudos a componentes activos purificados y muestran una amplia variedad de actividades terapéuticas.
Dentro del reino vegetal se encuentran las algas marinas. En la actualidad, las algas marinas han atraído la atención de muchos investigadores como fuentes de compuestos biológicamente activos; sus propiedades biológicas, la diversidad de sus moléculas, muchas con estructuras químicas complejas y novedosas que resultan difíciles de sintetizar, así como el número de moléculas con efectos similares y/o sinérgicos en un organismo determinado, son aspectos que refuerzan esta tendencia.
En algunas especies de algas se han demostrado propiedades antioxidantes, lo que ha sido relacionado con la presencia de diferentes compuestos químicos como los polifenoles. De esta manera, es posible vincular la actividad antioxidante a propiedades hepatoprotectoras en el estrés oxidativo producido por xenobióticos (38) (39) (40).
Este artículo examina el estado actual del conocimiento de las aplicaciones de extractos crudos y algunas moléculas aisladas de algas marinas en la protección del hígado. El análisis de la literatura consultada y los resultados de este grupo de investigación evidencian una relación estrecha entre las propiedades hepatoprotectoras y la actividad antioxidante. Adicionalmente en muchos casos la actividad antioxidante es explicada por su composición en compuestos polifenólicos, sobre todo ácidos fenólicos.
En resumen, en esta revisión se agregan más evidencias sobre las propiedades beneficiosas de las algas marinas como fuentes de antioxidantes y, a su vez, de hepatoprotectores, lo que refleja las potencialidades de estos organismos como fuentes de fitofármacos naturales.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses respecto del presente trabajo.












 uBio
uBio