Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.36 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2004
Estudio de sensibilidad antiviral de Virus Herpes simplex en pacientes trasplantados
H. Illán1*, N. Jacob2, E. Maiolo2, D. Cisterna1, R. Schiavelli2, M.C. Freire1
1Servicio de Neurovirosis, Dto. Virología, INEI, ANLIS- C. Malbran. Av. Vélez Sarsfield 563, CP 1281, Buenos Aires.
2Unidad de Trasplantes, Hospital Argerich. Av. Alte. Brown 240, Buenos Aires.
*Correspondencia: eillian@anlis.gov.ar
RESUMEN
La resistencia de virus Herpes simplex (VHS) a Aciclovir (ACV) ocurre en aproximadamente un 5% de los pacientes inmunocomprometidos. El tratamiento con análogos de nucleósidos, provoca la aparición de cepas VHS-ACV resistentes (ACVr). El mecanismo responsable de la resistencia a ACV son las mutaciones en los genes que codifican las enzimas timidina quinasa y/o ADN- polimerasa. En un estudio de aislamientos clinicos de pacientes inmunodeficientes, se encontró que el 96% de los VHS ACVr son debidos a una baja producción o ausencia de la enzima y un4% son cepas con alteración de la especificidad por el sustrato, casi no se obtuvieron cepas mutantes en la ADN-polimerasa (15). Los análogos de Pirofosfatos generan resistencia por mutación en el gen de la ADN-polimerasa. En este trabajo se presenta la metodología empleada para el estudio de los perfiles de sensibilidad a ACV y a Foscarnet (PFA) en una población de inmunosuprimidos. Se estudiaron 46 aislamientos de VHS en fibroblastos humanos, provenientes de muestras de trasplantados con lesiones vesiculares. De los 46 aislamientos, 26 resultaron VHS-1 y 20 VHS-2, tipificados por Inmunofluorescencia (IF) con anticuerpos monoclonales. Posteriormente se amplificaron y se les determinó su perfíl de sensibilidad en células Vero, utilizando 100 Dosis infectivas en cultivo de tejidos 50% (DICT50) de cada cepa viral y las drogas antivirales en diferentes concentraciones. La concentración inhibitoria 50%(CI50) se calculó a partir del porcentaje de inhibición del efecto citopático en función de la concentración de la droga. Ninguno de los aislamientos resultó resistente al PFA y solo dos de ellos, uno de VHS-1 y uno de VHS-2, fueron resistentesa ACV.
Palabras clave: resistencia, VHS, inmunosuprimidos.
SUMMARY
Antiviral sensitivity of Herpes simplex virus in immunocompromised patients. The Herpes simplex Virus (HSV) resistance to acyclovir (ACV) occurs in a 5% of the inmunocompromised patients, approximately. The treatment with analogs of nucleosides, causes the appearance of resistent HSV-ACV stocks(ACVr) which can be produced by alteration in genes coding for the TK or the DNA-polymerase. A previous large-scale clinical study on ACVr HSV strains isolated from patients infected with human immunodeficiency virus indicated that 96 % of ACVr HSV mutants were low producers of, or deficient in, TK activity (TK-), with 4 % being TK mutants with an altered substrate specificity. No DNA Pol mutants were isolated. The pirophosphate analogs generate resistance in the gene of DNA-polymerase by mutation. In this paper we show the methodology used for the determination of sensibilite profiles to ACV and Phoscarnet (PFA) in a population of inmunocompromised patients. We analized 46 HSV strain from vesicular injuries of transplanted patients. All samples, were inoculated in human fibroblasts and the HSV isolates were identified by inmunofluorescence whith monoclonal antibodies. These strains were amplified and the profile of susceptibility determinated in Vero cells, using 100 tissue culture inhibition dosis 50(TCID50)of each Viral stock and the specific antiviral drugs in different concentrations. The cytopathic effect (CPE) was evaluated after 72hs. post infection. The 50% inhibitory concentration (CI50) was calculated from the percentage of inhibition of the ECP based on the concentration of the drug. From 46 isolations, 26 were HSV-1 and 20 were HSV-2. Two of them, one HSV-1 andone HSV-2, were resistant to ACV and none of the isolates were resistant to PFA.
Key words: Resistance, HSV, inmunocompromised.
El VHS es un virus DNA de doble cadena, con una envoltura lipídica que contiene varias glicoproteínas (6). Se reconcen 2 serotipos.El VHS tipo 1 (VHS-1) produce lesiones generalmente en la región orofaríngea, mientras que el VHS tipo 2 (VHS-2) se relaciona a infeciones genitales.
El tratamiento adecuado se basa en el uso de drogas antiherpéticas, que pueden clasificarse en al menos 2 categorías: la primera, consiste en una variedad de análogos de nucleósidos: aciclovir (ACV), penciclovir (PCV), valaciclovir (VCV), ganciclovir (GCV), etc., dependen de la inducción de la timidina-kinasa (TK) viral para efectuar su acción antiviral1, y son las drogas de elección en la profilaxis y en el comienzo del tratamiento de infecciones mucocutáneas y encefalitis en pacientes inmunocompro-metidos. Su amplio uso ha derivado en la emergencia de cepas resistentes (ACVr) (16). La segunda categoría consiste en los análogos de pirofosfatos los cuales actúan por inhibición directa de la ADN-polimerasa viral (1). El foscarnet (PFA) es el más utilizado; se utiliza como tratamiento alternativo en pacientes con patologías producidas por cepas de VHS ACVr, aunque tiene mayor nefrotoxicidad que el ACV. La resistencia a PFA (PFAr) es menos frecuente.
Existen al menos tres mecanismos por los cuales el VHS puede adquirir resistencia a ACV y al resto de los análogos de nucleósidos: a) reducción de la actividad de la TK viral, b) alteración de la especificidad de sustrato de la TK viral, c) mutaciones en el gen que codifica la ADN polimerasa. Dado que el ACV y el resto de los análogos de nucleósidos actúan sobre iguales blancos, puede detectarse resistencia cruzada entre las distintas drogas (12). La resistencia a PFAsolo se produce por mutaciones en la ADN polimerasa viral (10, 1). De la misma manera, cuando los análogos de nucleósidos seleccionan poblaciones virales con cambios a nivel de la ADN polimerasa, pueden resultar además resistentes al PFA.
El VHS es uno de los principales patógenos virales oportunistas en pacientes trasplantados renales. Se asocia con infecciones mucocutaneas primarias y recurrentes, siendo éstas últimas, más severas y persisten por tiempos prologandos. En Argentina, el número de trasplantes renales y cardíacos se ha incrementado en los últimos años.
En este estudio, se presentan los resultados del análisis de la sensibilidad a ACV y a PFA en 46 aislamientos de VHS, (VHS-1=26 y VHS-2 =20), obtenidos de muestras vesiculares o de lesiones orales, genitales, perianales, abdomen, tórax, muslo, gluteos y de lesiones o vesículas diseminadas de 44 pacientes trasplantados renales (n=37) y cardiacos (n=7).
Se utilizaron como cepas de referencia sensibles de VHS -1 (cepa KOS: CI50ACV KOS= 0,02 mg/ml y CI50PFA-KOS= 10mg/ml) y de VHS-2 (cepa G: CI50ACV G= 0,03mg/ml y CI50PFA-G=10mg/ml).
Las pruebas de sensibilidad a ACV y PFA de las cepas de VHS se realizó mediante el método de reducción de ECP, según se ha descrito con anterioridad (9). Brevemente, se infectaron células Vero en placas de 96 pocillos (Corning Cat. 25861-96) con 100 DICT50de cada cepa de HSV, luego de 1 hora de adsorción se agregó Minimum Esential Medium con 2% de suero fetal bovino, conteniendo ACV en diferentes concentraciones de 0,005; 0,02; 0,05; 0,2; 0,5; 2; 5; 20; 50 y 200 mg/ml y PFA en concentraciones de 10; 25; 50; 100 y 200 mg/ml. La concentración inhibitoria 50% (CI50) se definió como la concentración requerida para reducir el efecto citopático (ECP) en un 50%. El valor de la CI50para cada droga representa el CI50 media de tres ensayos independientes.
La susceptibilidad antiviral depende de la naturaleza de cada droga antiherpética. En consecuencia, la resistencia antiviral para ACV, se define por el incremento de 100 veces el valor de la CI50con respecto a la cepas de referencias de VHS-1 y VHS-2. Mientras que para PFA, ese incremento es de 5 veces el valor de la CI50 (13).
En función de lo establecido previamente como valor de corte, se determinó que dos aislamientos fueron resistentes a ACV, un VHS-1 (muestra 325 con CI50ACV=30 mg/ml) y el otro un VHS-2 (muestra 171 con CI50ACV=10 mg/ml). La distribución del número de muestras en función de los valores de CI50 de ACV de todos los aislamientos evaluados se representa en el gráfico de la figura 1.
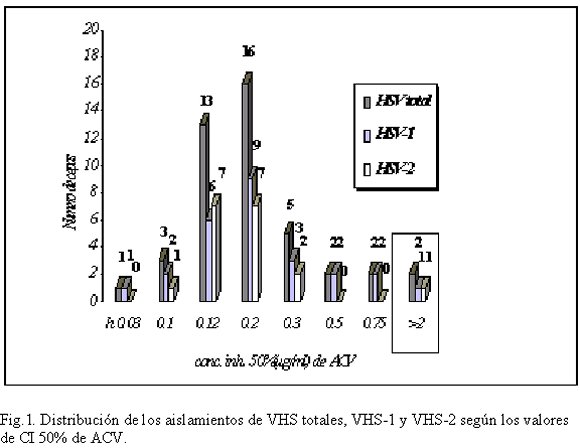
Posteriormente, se evaluó la susceptibilidad al PFA de los aislamientos, todos resultaron sensibles a esta droga. La distribución del número de muestras en función de los valores de CI50de ACV de todos los aislamientos evaluados se representa en el gráfico de la figura 2.
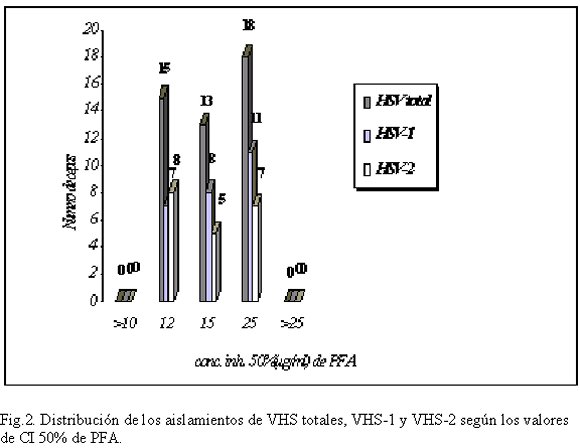
La cepa resistente a ACV de VHS-1 provenía de una lesión perianal con vesículas diseminadas, que presentó un paciente de 32 años, de sexo femenino, 3 años después de un trasplante renal con donante cadavérico, sin conocimiento del título de anticuerpos anti-VHS previo al transplante.
La cepa resistente a ACV de VHS-2 se aisló de una muestra de hisopado de vesículas diseminadas en abdomen y torax de un paciente de 20 años de edad, de sexo masculino, receptor de trasplante renal con donante vivo relacionado. Dicho paciente había recibido profilaxis post-trasplante inmediato con GCV debido a que no presentaba anticuerpos anti citomegalovirus previo al trasplante y su donante presentaba alto titulo de dichos anticuerpos. A los 11 días post-trasplante presentó un episodio de rechazo agudo con antigenemia para CMV negativa y elevación de transaminasas. Diez días después, padeció el primer episodio de VHS, con vesículas diseminadas, elevación de transaminasas, IgM para VHS positiva y aislamiento de VHS negativo. Se inició tratamiento con ACV. Posteriormente, a los 8 meses ocurrió el segundo episodio de VHS diseminado, con aislamiento positivo y tipificado por IF como VHS-2.
De los 44 aislamientos restantes, 3 VHS-2, pertenecían a un paciente trasplantado renal, obtenidos en 3 episodios sucesivos. Los valores obtenidos de CI50 fueron de 0,2 mg/ml, 0,5 mg/ml y 1,0 mg/ml, respectivamente. El segundo aislamiento(CI50ACV=0,5mg/ml) se obtuvo 30 días después del primero (CI50ACV=0,2mg/ml), en ese periodo el paciente recibió tratamiento de 21 días con ACV desde la aparición de los primeros síntomas. Al presentarse el segundo episodio, se inició nuevo tratamiento y pasados 5 días, las lesiones se generalizaron, obteniéndose la muestra para el tercer aislamiento (CI50ACV=1mg/ml). Al considerar los valores de CI50de los 3 aislamientos de VHS-2 obtenidos, se observó una disminución de la sensibilidad hasta llegar a un valor de CI50 límite en el tercer aislamiento.
Este es el primer estudio que describe los perfiles de sensibilidadde cepasdeHSV en pacientes inmuno-suprimidosportrasplante en nuestro país. Según nuestro conocimiento, de acuerdo con las estadìsticas publicadas por otros autores, la resistencia de las cepas de VHS a ACV ocurre en aproximadamente un 5% de los pacientes inmunocomprometidos (2). En nuestro trabajo hemos podido determinar esos datos, coincidiendo con los porcentajes previamente mencionados,debido a que el índice obtenido fue de 4,54%, considerando un total de 44 muestras, (en el caso del paciente con 3 muestras, solo se consideró la primera muestra estudiada). No hubo cepas resistentes al PFA.
Generalmente la mayoría de las cepas VHS- ACVr aisladas son TK deficientes(TK-), siendo excepcionales los aislamientos TK+ con alteración en la especificidad por el sustrato de la TK viral (3, 11), o mutaciónes en el gen de la ADN-polimerasa (4, 8, 5 ). Sedeberían realizar estudios para observar la afinidad y presencia o ausencia de la TK viral, para determinar el tipo de alteración. El VHS-2 esta asociado con una mayor prevalencia de resistencia (7), de acuerdo con el estudio de las frecuencias de mutación, las cepas de VHS-2 tienen mayor probabilidad de resistencia a análogos de nucleósidos que las cepas de VHS-1 (14, 17). En este estudio el porcentaje de resistencia en VHS-1 fue de 3,84% y en VHS-2 de 5,0. Esta diferencia no es significativa como para evaluarla prevalencia de cada una de ellas, debido a que la aparición, recurrencia, origen y tratamiento presentadas en cada uno de los pacientes no son las mismas.
Si bien ambas cepas resistentes tuvieron buena respuesta clínica a la administración de ACV, la correlación entre los resultados de sensibilidad in vitro a ACV de estas cepas resistentes y la respuesta clínica en cada uno de los pacientes,fue difícil de evaluar, debido a que en cada episodio se disminuyeron los niveles de tratamiento inmunosupresor.
Se observó la aparición de una cepa al límite de los valores de resistencia al ACV al evaluar 3 cepas obtenidas de un mismo paciente en cada uno de los episodios sucesivos.
Finalmente concluímos que debido al estado de inmunosupresión de este tipo de pacientes, las cepas de VHS son capaces de reactivar con mayor facilidad, por lo tanto al utilizar ACV como tratamiento por largos periodos de tiempo pueden emerger o seleccionarse poblaciones virales resistentes, con mucha mayor frecuencia por alteraciones a nivel de la TK, quedando como droga alternativalos antivirales que actuan a nivel de la ADN-polimerasa.
De acuerdo con la una mayor toxicidad de los antivirales que actuan a nivel de la ADN-polimerasa, especialmente en trasplantados renales por la nefrotoxicidad, no se debería aplicar habitualmente un tratamiento con ACV. En aquellos casos que indefectiblemente requieran de dicho tratamiento, se debera tener un mejor control y evaluar la sensibilidad al ACV de los aislamientos de VHS obtenidosen cada episodio recurrente.
BIBLIOGRAFÍA
1. Andrei, G, Snoeck R, De Clercq E (1995) Susceptibilities of Several Drug-Resistant Herpes Simplex Virus Type 1 strains to alternative antiviral compounds. Antimicrob. Agets Chemother. 39: 1632-1635. [ Links ]
2. Christophers J, Clayton J (1998) Survey of resistence of herpes simplex virus to acyclovir in northwest England. Antimicrob. Agents Chemother 42: 868-872. [ Links ]
3. Collins P, Larder BA, Oliver M, Kemp S, Smith I, Darby G (1989) Characterization of a DNA polymerase mutant of herpes simplex virus from severely immunocompromised patient receiving acyclovir. J. Gen. Virol. 70: 375-382. [ Links ]
4. Crumpacker CS, Schnipper LE, Marlowe P, KowalskyPN, Hershey BJ, Levin MJ (1982) Resistance to antiviral drugs of herpes simplex virus isolated from a patient treated with acyclovir. N. Engl. J. Med. 306: 343-346. [ Links ]
5. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Strauss SE, et al. (1987) Clinical isolate of herpes simplex virus type 2 that induces a thymidine kinase with altered substrate specifity. Antimicrob. Agents Chemother. 31: 1117-1125. [ Links ]
6. Whitley RJ (2001) Herpes Simplex viruses. In: Fields B, Knipe D, Howley PM (Ed) forth Edition, Chapter 73, Lippincott Williams & Wilkins. [ Links ]
7. Gimeno C (1996) Virus herpes simplex resistentes a drogas antivirales: incidencia y significación clínica en pacientes inmunocomprometidos (Tesis doctoral). Madrid: Facultad de Medicina, Universidad Complutense. [ Links ]
8. Hwang C, Ruffner KL, Coen DM (1992) A point mutation within a distinct conserved region of the herpes simplex virus DNA polymerase gene confers drug resistance. J. Virol 66: 1774-1776. [ Links ]
9. Isenberg (1992) Antiviral Susceptibility Testing. Clinical Microbiology Procedures Handbook. American Society for Microbiology. [ Links ]
10. Nugier F, Collins P, Larder BA, Langlois M, Aymard M, Darby G (1991) Herpes simplex virus isolates from an immunocompromised patient who failed to respond to acuclovir treatment express thymidine kinase with altered substrate specifity. Antiviral Chem. Chemother. 2: 295-302. [ Links ]
11. Sacks SL, Wanklin RJ, Reece DE, Hicks KA, Tyler KL, Coen DM (1989) Progressive esophagitis from acyclovir-resistant herpes simplex. Clinical roles for DNA polymerase mutants and viral heterogeneity. Ann. Intern. Med. 111: 893-899. [ Links ]
12. Safrin S, Assaykeen T, Follansbee S, Mills J (1990) Foscarnet therapy for acyclovir-resistant mucocutaneous herpes simplex virus infection in 26 AIDS patients: preliminary data. J. Infect. Dis. 161: 1078-1084. [ Links ]
13. Safrin S, Elbeik T, Phan L, Robinson D, Rush,J, Elbaggari A, et al. (1994) Correlation between response to acyclovir and foscarnet therapy and in vitro susceptibility result for isolates of herpes simplex virus from human inmunodeficiency virus-infected patients. Antimicrob. Agents Chemother. 38: 1246-1250. [ Links ]
14. Sarisky R, Nguyen T, Duffy K, Wittrock R, Learny J (2000) Difference in incidence of spontaneous mutations between herpes simplex types 1 and 2. Antimicrob. Agents Chemother. 44: 1524-1529. [ Links ]
15. Suzutani T, Ishioka K, De Clerq E, Ishibashi K, Kaneko H, Kira T, et al. (2003) Differential Mutation patterns in thymidine kinase and DNA polymerase genes of herpes simplex virus type 1 clones passaged in the presence of Acyclovir or Penciclovir. Antimicrob. Agents Chemother. 44: 1707-1713. [ Links ]
16. Vinckier F, Boogaerts M, De Clercq D, De Clercq E (1987) Chronic herpetic infection in an inmunicompromised patient: report of a case. J. Oral Maxillofac. Surg. 45: 723-728. [ Links ]
17. Young Kyoo Shin, Guang-Yun Cai, Weinberg A, Learny J, Levin M (2000) Frequency of acyclovir- resistant herpes simplex virus in clinical specimens and laboratory isolates. J. Clin. Microbiol. 39: 913-917. [ Links ]
Recibido: 25/11/03.
Revisado: 31/05/04.














