Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.36 no.3 Ciudad Autónoma de Buenos Aires July/Sept. 2004
Hallazgos patológicos en cerdos afectados con el síndrome del desmedro multisistémico postdestete de la República Argentina
J. Sarradell1*, A.M. Pérez2, E. Comba3, N. Pereira3, L. Anthony1, M. Andrada4,J. Segalés5
1Cátedra de Patología General, Anatomía y Fisiología Patológicas, Facultad de Cs. Veterinarias- Ov. Lagos y Ruta 33, (2170) Casilda, Argentina; 2Department of Medicine and Epidemiology. School of Veterinary Medicine. University of California Davis, USA; 3Cátedra de Microbiología, Facultad de Cs. Veterinarias- Ov. Lagos y Ruta 33, (2170) Casilda, Argentina; 4Departamento de Morfología, Anatomía y Anatomía Patológicas Comparadas, Facultad de Veterinaria-ULPGC, España; 5Centre de Recerca en Sanitat Animal (CReSA) - Dept. de Sanitat i d'Anatomia animals, Fac. Veterinària (UAB), Bellaterra, Barcelona, España
*Correspondencia: E-mail. jsarrade@fveter.unr.edu.ar
RESUMEN
El síndrome del desmedro multisistémico postdestete (PMWS) fue descrito por primera vez en Canadá en el año 1991 y desde entonces un número creciente de casos han sido diagnosticados en todo el mundo. En la Argentina, el PMWS fue reportado por primera vez recientemente. Se estudiaron 48 cerdos de 5 a 12 semanas de edad con signos característicos de PMWS procedentes de 19 granjas. Si bien se desconoce la distribución real del virus en nuestro país se observó desde el año 2001 un número creciente de granjas con PMWS y distribuidas en las principales provincias productoras. La histopatología fue una herramienta diagnóstica importante en casos sospechosos de PMWS con la observación de diferentes grados de lesión. En los animales estudiados las infecciones secundarias pudieron ser importantes, ya sea por patógenos oportunistas o por complicaciones bacterianas.
Palabras clave: Síndrome del desmedro multisistémico post-destete, patología, cerdos.
SUMMARY
Pathological findings in pigs affected by the postweaning multisystemic wasting syndrome in Argentina. Postweaning multisystemic wasting syndrome was first described in Canada in 1991 and at present an increasing number of cases has been diagnosed worldwide. In Argentina the first cases of PMWS were reported recently. Forty eight 5 to 12 week old pigs with signs characteristic of PMWS from 19 farms were studied. Although the real distribution of the virus in our country is not known it was observed an increasing number of farms with PMWS distributed in the major producing provinces. The histopathology was an important tool in diagnosis of suspicious cases of PMWS with the observation of different degrees of lesion. In the studied animals, the secondary infections, either by opportunistic pathogens or secondary bacteria could be important.
Key words: Postweaning multisystemic wasting syndrome, pathology, pigs.
INTRODUCCIÓN
El síndrome del desmedro multisistémico postdestete o síndrome multisistémico de adelgazamiento postdestete (PMWS, siglas derivadas del ingles "Postweaning multisystemic wasting syndrome") fue descrito inicialmente en Saskatchewan (Canadá) en el año 1991 (6) y luego en Francia, el Reino Unido, España, Italia y los Estados Unidos (1, 3, 28). Posteriormente un número creciente de casos han sido diagnosticados en todo el mundo (3, 28). En la Argentina los primeros casos de PMWS fueron recientemente reportados (26) en una granja de producción porcina localizada en el sureste de la Provincia de Córdoba, remitidos al Servicio de Anatomía Patológica de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Rosario. La confirmación de la presencia del genoma viral se realizó mediante la técnica de hibridación in situ (22). Reportes posteriores de casos realizados en el país (17, 20) sugieren una posible emergencia del patógeno en nuestro medio.
La presentación clínica de PMWS se caracteriza por retraso en el crecimiento corporal, palidez, algunas veces ictericia y finalmente la muerte. En algunos animales se puede observar un aumento en el tamaño de los linfonódulos superficiales. La edad de los animales afectados con PMWS suele oscilar más comúnmente entre las 5 y las 12 semanas. La morbilidad y la letalidad son muy variables, y se sugieren valores de 4-20% y 70-90%, respectivamente (14, 18, 22, 27, 28).
En algunas investigaciones se considera al circovirus porcino tipo 2 (PCV-2) como el único agente infeccioso necesario para el desarrollo del PMWS (4, 10, 12). Este virus se clasifica taxonómicamente como perteneciente a la familia Circoviridae, género Circovirus. Es un virus con ADN, de cadena simple, circular, pequeño (17 nm de diámetro) y no envuelto (28). Aunque el virus se replica en el núcleo celular (30), los cuerpos de inclusión se encuentran generalmente en el citoplasma y sólo raramente en el núcleo de macrófagos. Si bien no existe evidencia suficiente para demostrar si los materiales víricos observados corresponden a una infección vírica productiva en macrófagos o bien a fagocitosis de materiales víricos producidos en otras localizaciones (8), el hallazgo de materiales víricos en el núcleo de macrófagos, hepatocitos y células epiteliales y endoteliales sugiere que estos tipos celulares podrían jugar un papel importante en la replicación viral (10, 23, 24).
Otros aspectos referidos a la patogenia del PMWS son también inciertos. Algunos reportes sugieren que la infeccion por PCV-2 no seria suficiente, siendo necesaria la coinfección con otros agentes como parvovirus porcino (2, 11), virus de la enfermedad de Aujeszky (19) o virus del síndrome respiratorio y reproductivo porcino (3, 18, 24, 29) para producir PMWS. Otros autores sugieren que la sola inmunoestimulación puede ser decisiva en la presentación del síndrome (12, 13), aunque una vez que los animales enfermaron hay evidencias de que ocurre una inmunosupresión (7, 22, 25). La infección por patógenos oportunistas en cerdos con PMWS (5, 6, 15) y las coinfecciones bacterianas en los animales afectados con el PMWS (16), suelen ser importantes desde un punto de vista clínico. Factores ambientales y de manejo también pueden colaborar en la presentación (14, 21).
La enfermedad es emergente en nuestro medio, no existiendo información suficiente referida a la extensión y características de su presentación en nuestro país. El objetivo de esta comunicación es presentar los hallazgos anatomopatológicos, histopatológicos y bacterioló-gicos realizados en cerdos afectados con PMWS de la República Argentina.
MATERIALES Y MÉTODOS
La población en estudio incluyó muestras formoladas y animales enviados para necropsias al Servicio de Anatomía Patológica de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Rosario entre Noviembre de 2001 y Diciembre de 2003. Durante el periodo en estudio, 48 de 65 cerdos de 5 a 12 semanas de edad remitidos al servicio fueron diagnosticados como posibles casos de PMWS. Cuarenta y seis de estos animales provinieron de 19 granjas de producción porcina localizadas en las provincias de Santa Fe (n=13), Córdoba (n=3), Buenos Aires (n=1). En dos de los casos analizados no fue posible identificar el origen real de los animales. Los cerdos presentaban todos, o la mayor parte de los siguientes hallazgos compatibles con PMWS: retraso en el crecimiento corporal (Fig. 1), disnea, palidez, algunas veces ictericia y finalmente la muerte.

Figura 1. Cerdo de 7 semanas de edad con adelgazamiento y retraso en el crecimiento afectado con PMWS.
Se seleccionaron los órganos que presentaron las lesiones más representativas y se realizó la técnica de hibridación in situ para la detección de PCV-2 en el Servicio de Diagnóstico Anatomopatológico de la Facultad de Veterinaria de la Universidad Autónoma de Barcelona-España, de acuerdo con los descrito por Rosell y cols., en 1999 (22).
Muestras de 0,5 cm de espesor procedentes de linfonódulos, tonsilas, placas de Peyer, pulmón, corazón, hígado, riñón, intestinos u otros tejidos con lesiones sospechosas fueron fijadas en formol tamponado al 10% durante 24-48 horas, procesadas según el método de rutina para microscopía óptica, incluidas en parafina y seccionadas con micrótomo a 4-5 µm para tinción de hematoxilina y eosina (H&E). Se realizó una clasificación de los diferentes estados de infección (inicial, intermedio y final) de acuerdo con el tipo de lesiones histopatológicas presentes en los linfonódulos mesentéricos (Fig. 2). Para el estudio bacteriológico se utilizaron 22 de los 48 cerdos de acuerdo con el estado de conservación del cadáver (eutanasia o escasas horas de muerto) y se tomaron muestras de los principales órganos internos, tales como: sistema nervioso central, líquido cefalorra-quídeo, pulmones, hígado, bazo y riñón. Las mismas fueron cultivadas en agar sangre equina al 10% y agar de Mac Conkey. Las placas se incubaron en aerobiosis a 37 ºC por espacio de 24 a 48 Hs. Las colonias fueron identificadas mediante de pruebas bioquímicas convencionales (9).
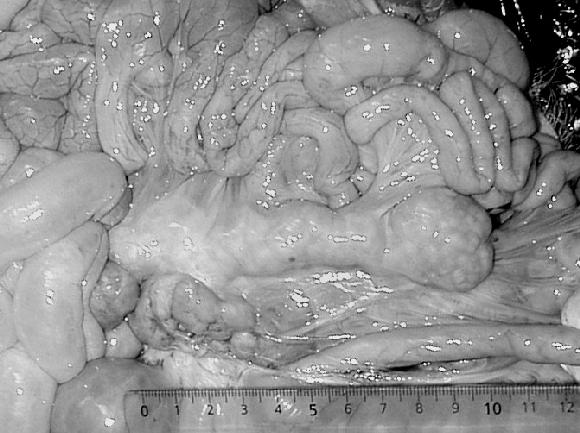
Figura 2. Linfonódulo mesentérico visiblemente aumentado de tamaño de un cerdo afectado con PMWS.
RESULTADOS
Los hallazgos anatomopatológicos incluyeron el aumento generalizado de los linfonódulos, especialmente inguinales superficiales, mediastínicos y mesentéricos (Fig. 2), hidropericardio, ascitis, presencia de manchas blanquecinas difusas en el hígado y riñones (Fig. 8 A) y, consolidación de los lóbulos pulmonares creaneoven-trales (Fig. 3 A). Histopatológicamente, la enfermedad se caracterizó por:
A
B
C
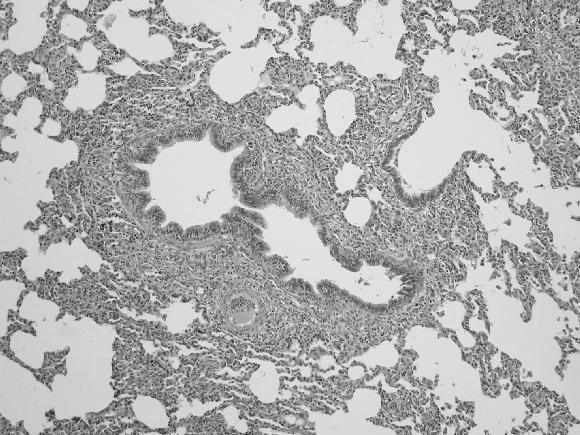
Figura 3. Pulmón de un cerdo afectado con PMWS. Consolidación en la región craneoventral de coloración rosa grisáceo y de tipo multifocal distribuida por todo el parénquima pulmonar (A); Bronconeumonía intersticial con infiltrado tipo histiocitario, linfocitario, H&E 20x (B) y de células gigantes mulinucleadas, H&E 40x (C), presentes principalmente en la región peribronquial, septos alveolares y septos interlobulillares.
Pulmón: grados variables de neumonía broncointers-ticial con infiltrado granulomatosoen todos los animales (Fig. 3 A, B y C).
Hígado: infiltrado periportal de tipo histiocitario (Fig. 4) en todos los casos; en uno de los animales, inflamación periportal con presencia de células mononucleares de tipo histiocitario, desorganización de sinusoides, necrosis masiva de hepatocitos y cuerpos apoptóticos.
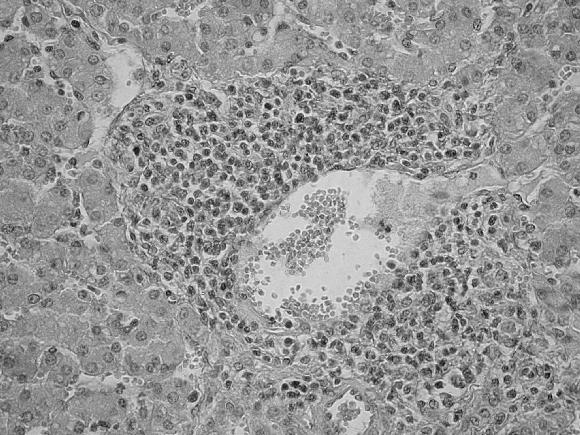
Figura 4. Hígado, presencia de infiltrado de células mononucleadas de tipo linfohistiocitario periportal. Coloración de H&E.
Íleon (placas de Peyer): grados variables de depleción linfocitaria en las placas de Peyer e infiltrado granu-lomatoso difuso en mucosa y submucosa compuesto por linfocitos, células tipo histiocitario y células gigantes multinucleadas (Fig. 5); en uno de los animales destacó la presencia de Cryptosporidium spp. en la superficie de los enterocitos (Fig. 4).
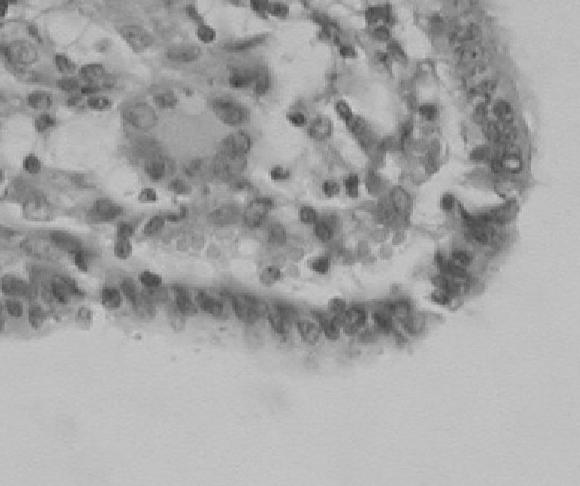
Figura 5. Intestino delgado. Infiltrado compuesto por células gigantes multinucleadas y células tipo histiocitario en la mucosa y presencia de Cryptosporidium spp. (Flecha) en la superficie de enterocitos. Coloración de H&E 40x.
Linfonódulos: linfoadenitis granulomatosa, con presencia de células tipo macrófagos, células gigantes multi-nucleadas y moderada cantidad de polimorfonucleares eosinófilos; también se observó depleción linfocitaria en áreas interfoliculares con disminución o ausencia en el número de folículos linfoides.
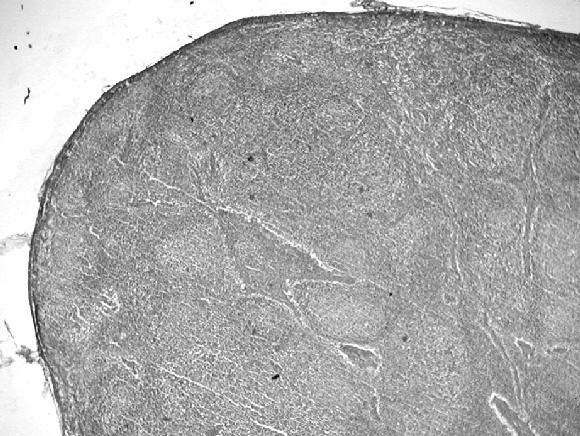
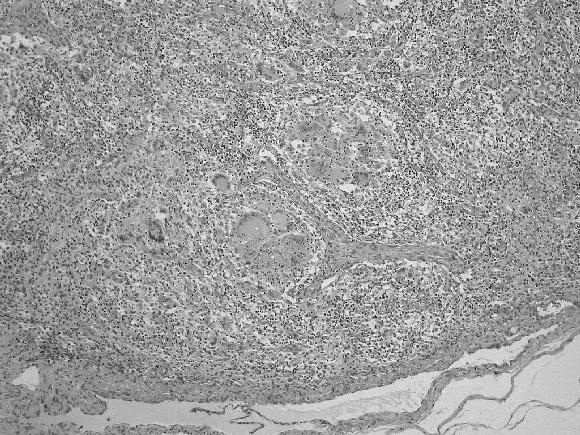
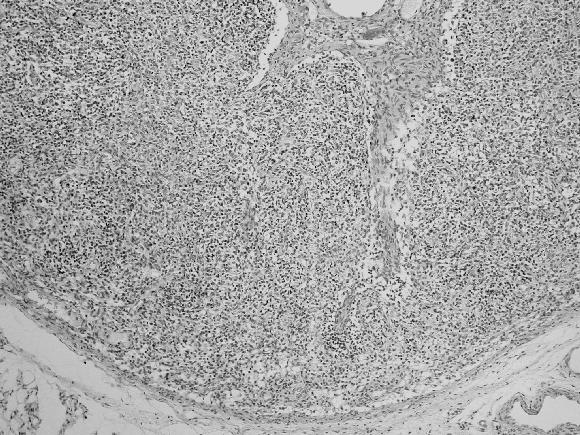
Se observaron 12 animales en estado inicial, que presentaron infiltrado formando micronódulos de células tipo histiocitario y células gigantes multinucleadas en los centros germinales de las áreas foliculares y leve depleción linfocitaria en el área interfolicular (Fig. 6 A); 25 en estado intermedio por la ausencia de folículos, la presencia de infiltrado de células tipo histiocitario y células gigantes multinucleadas y moderada depleción linfocitaria en el área interfollicular (Fig. 6 B); y 11 en estado final, cuando había ausencia de folículos linfoides, escasas células gigantes multinucleadas y severa depleción linfocitaria (Fig. 6 C).
A
B
C
D
Figura 6. Linfonódulos mesentéricos. Coloración de H&E. A: Animal clínicamente normal; B: Presencia de micronódulos de infiltrado de tipo histiocitario y de células gigantes multinucleadas que ocupa el centro de los folículos linfoides y depleción linfocitaria leve en los espacios interfoliculares, estado inicial del PMWS; C: Ausencia de folículos linfoides e infiltrado tipo histiocitario, de células gigantes multinucleadas en forma difusa y moderada depleción linfocitaria en las áreas interfoliculares de un estado intermedio del PMWS; D: Severa depleción linfocitaria y ausencia de folículos linfoides en un linfonódulo, estado final del PMWS.
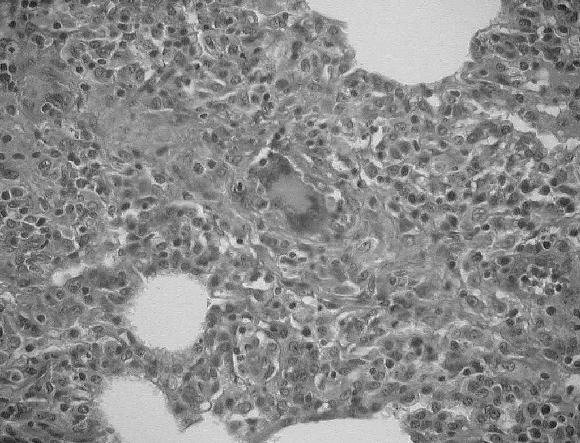
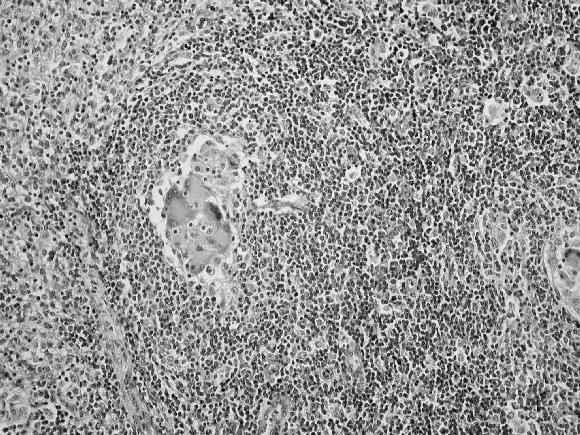
En 6 casos destacó además, la presencia de cuerpos de inclusión característicos de la infección por PCV-2 en el citoplasma de macrófagos (Fig. 7) y en uno de los casos, en células gigantes multinucleadas de los linfo-nódulos. El hallazgo de cuerpos de inclusión fue más frecuente en los casos clasificados como en estado intermedio e inicial y no fue observada en los casos en estado final.
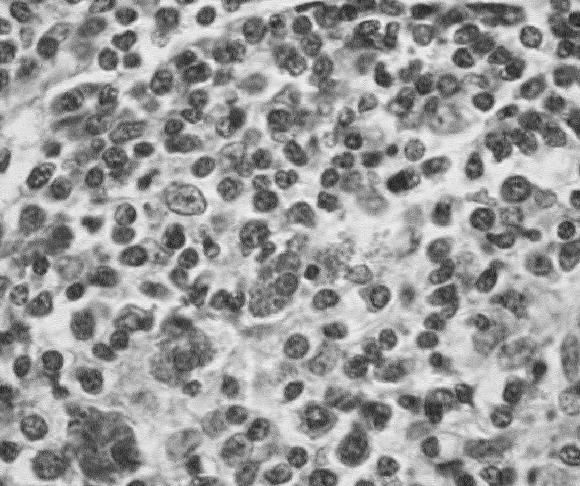
Figura 7. Linfonódulo mesentérico de un cerdo afectado con PMWS. Múltiples cuerpos de inclusión esféricos, anfotéricos presentes en el citoplasma de células tipo macrófagos característicos de la infección con PCV-2. Coloración de H&E.
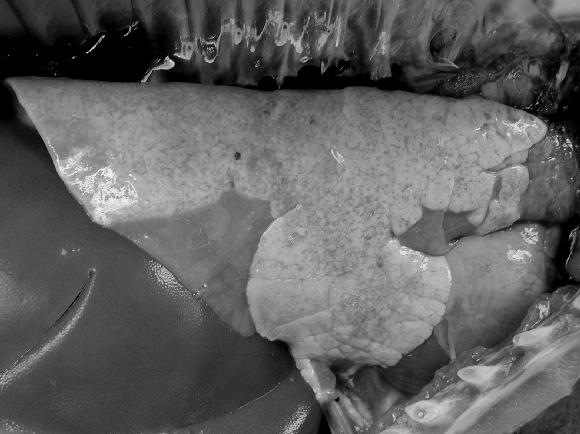
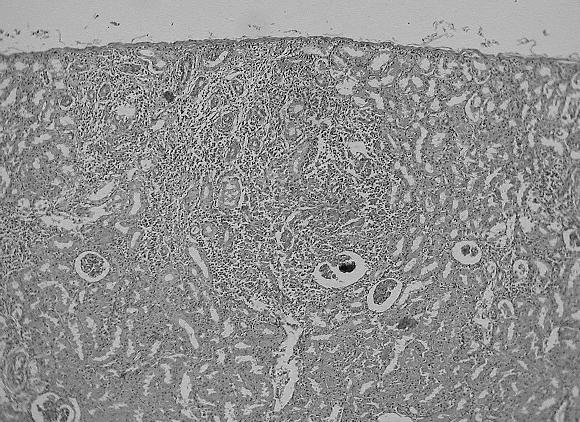
Riñón: todos los animales presentaron de leve a moderado infiltrado histiocitario granulomatoso, formando focos visibles macroscópicamente (Fig. 8 A) en 11 de los animales examinados (Fig. 8 B).

A
B
Figura 8.: Riñón de cerdo afectado con PMWS. A: Múltiples focos blanco - grisáceos distribuidos por la corteza renal; B: Infiltrado multifocal tipo granulomatoso compuesto por células tipo histiocitario, gigantes multinucleadas y linfocitario.
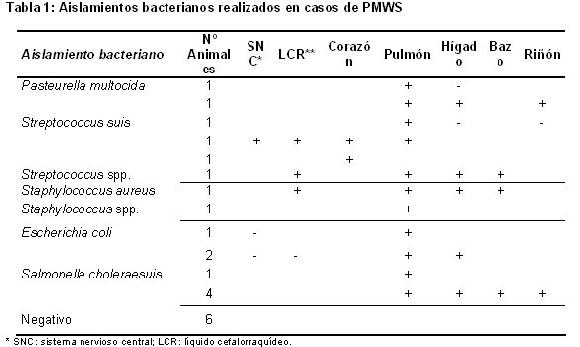
Los resultados bacteriológicos se encuentran resumidos en la Tabla 1. Se aisló en primer lugar Salmonella choleraesuis (5 animales), seguido por Escherichia coli y Streptococcus suis (3 animales), Pasteurella multocida (2 animales), Streptococcus spp. (1 animal), Staphy-lococcus aureus (1 animal), Staphylococcus spp. (1 animal) y resultado negativo (6 animales).
La confirmación de la presencia del virus en las áreas lesionadas (Fig. 9), fue realizada mediante la técnica de hibridación in situ (22), en 9 órganos pertenecientes a 6 animales que presentaron las lesiones más representativas.
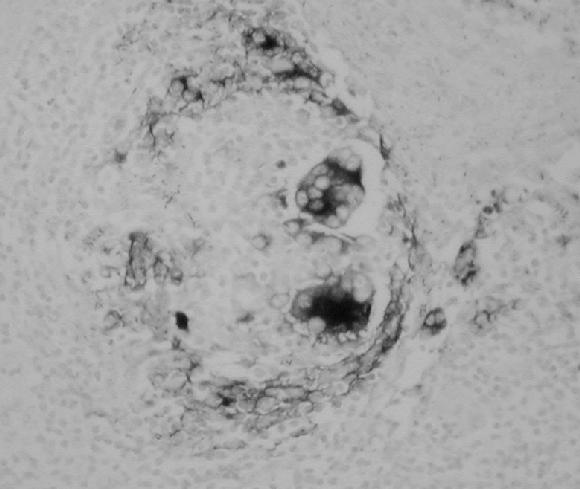
Figura 9. Linfonódulo mesentérico. Marcada presencia de ácidos nucleicos de PCV-2 en el citoplasma de macrófagos y células gigantes multinucleadas. Técnica de Hibridación in situ 40x.
DISCUSIÓN
Se desconoce la distribución real del PCV-2 en nuestro país, si bien en los países en los que se han realizado pruebas serológicas el virus aparece ampliamente distribuido en la poblaciones porcinas (3, 28). El número creciente de granjas con PMWS reportadas en este estudio, su distribución en las principales provincias productoras de cerdos y lo publicado por otros autores (17, 20), sugieren una distribución amplia del síndrome en nuestro país. Serían necesarios otros estudios para confirmar este hallazgo.
Las observaciones anatomopatológicas realizadas en los cerdos afectados naturalmente por el PMWS en la República Argentina se caracterizaron por la presencia de un aumento generalizado de los linfonódulos, especialmente inguinales superficiales, mediastínicos y mesentéricos, hidropericardio, ascitis, presencia de manchas blanquecinas difusas en el hígado y riñones y, consolidación de los lóbulos pulmonares creaneoventrales. Histopatológicamente destacó la presencia de infiltrados granulomatosos constituidos principalmente por células tipo histiocitario y gigantes multinucleadas. Estos hallazgos no presentaron diferencias con los datos aportados por otros autores (3, 22, 28).
No está muy claro el mecanismo patogénico a través del cual el PCV-2 es capaz de causar enfermedad y probablemente no sea un factor suficiente, aunque, una vez que los animales enferman, los cambios en las subpo-blaciones celulares de los linfonódulos o de células sanguíneas evidencian que se encuentran inmunode-primidos (7, 22, 25). En nuestro trabajo observamos que las coinfecciones bacterianas en los animales afectados con el PMWS pueden ser importantes, con origen principalmente en el tracto digestivo y respiratorio y en forma septicémica, observación similar a la obtenida por Pallares y cols en el 2002 (16) sobre un número mayor de casos. No fue posible establecer una relación de los aislamientos con el grado y/o extensión de las lesiones de PMWS. En uno de los casos se observó la presencia de Cryptosporidium spp., un patógeno muy raro en cerdos postdestete y terminación. Esto fue descrito también por Núñez y cols. en el 2003 (15). Los diferentes grados de depleción linfocitaria presente en todos los animales, la existencia de lesiones microscópicas en órganos linfoides (22) y la infección por patógenos oportunistas (15) refuerzan la hipótesis de la severa inmunodepresión que cursan los animales cuando se desarrolla el síndrome.
El PCV-2 es un virus ADN, del cual se sabe que se replica en el núcleo celular (30). En nuestro caso observamos la presencia de cuerpos de inclusión en el citoplasma de macrófagos, hallazgos que se encuentran en la línea de otros autores (3). Sin embargo, llamó la atención, en un caso, la presencia de células gigantes multinu-cleadas cargadas de cuerpos de inclusión. No se conoce si los materiales víricos observados corresponden a una infección vírica productiva en macrófagos o bien a fagocitosis de materiales víricos producidos en otras localizaciones (8).
El PCV-2 fue considerado como apatógeno durante muchos años, pero el creciente número de reportes de casos en todo mundo han hecho cambiar esta idea y actualmente aparece como un importante patógeno emergente. Se requieren estudios adicionales de la epide-miología y la inmunología de estas infecciones para el mejor conocimiento y control de este síndrome.
En conclusión los hallazgos histopatológicos observados permitieron confirmar diagnósticos clínicos, sugiriendo que la histopatología es una herramienta importante para el diagnóstico de casos sospechosos de PMWS. Los diferentes grados de lesión podrían sugerir diferentes estados clínicos, aunque serían necesarios mayores estudios para confirmar el hallazgo. En estos animales las infecciones secundarias pueden ser importantes, ya sea por patógenos oportunistas o por complicaciones bacterianas. Se debería comenzar a considerar al PMWS como un problema importante para la producción porcina de la República Argentina y serían necesarios mayores estudios sobre técnicas de diagnóstico, patogenia de este tipo de infecciones, distribución y métodos de control del PMWS.
Agradecimientos: A los Médicos Veterinarios y productores responsables del envío de las muestras utilizadas en este estudio.
BIBLIOGRAFÍA
1. Allan GM, McNeilly F, Kennedy S, Daft B, Clarke EG, Ellis JA, Haines DM, Meehan BM, Adair BM (1998) Isolation of porcine circovirus-like viruses from pigs with a wasting disease in the USA and Europe. J. Vet. Diagn. Invest. 10: 3-10. [ Links ]
2. Allan GM, Kennedy S, McNeilly F, Foster JC, Ellis JA, Krakowka SJ, Meehan BM, Adair BM (1999) Experimental reproduction of severe wasting disease by co-infection of pigs with porcine circovirus and porcine parvovirus. J. Comp. Pathol. 121: 1-11. [ Links ]
3. Allan GM, Ellis JA (2000) Porcine circoviruses: a review. J. Vet. Diagn. Invest. 12: 3-14. [ Links ]
4. Bolin SR, Stoffregen WC, Nayar GP, Hamel, Al (2001) Postweaning multisystemic wasting syndrome induced after experimental inoculation of cesarean-derived, colostrum-deprived piglets with type 2 porcine circovirus. J. Vet. Diagn. Invest. 13: 185-194. [ Links ]
5. Carrasco L, Segalés J, Bautista MJ, Gómez-Villamandos JC, Rosell C, Ruiz-Villamor E, Sierra MA (2000) Intestinal chlamydial infection concurrent with postweaning multisys-temic wasting syndrome in pigs. Vet. Rec. 146:21-23. [ Links ]
6. Clark E (1997) Post-weaning multisystemic wasting syndrome. Proceedings of the American Association of Swine Practioners, Quebec City 28: 499-501. [ Links ]
7. Darwich L, Segales J, Domingo M, Mateu E (2002) Changes in CD4(+), CD8(+), CD4(+) CD8(+), and immunoglobulin M-positive peripheral blood mononuclear cells of postweaning multisystemic wasting syndrome-affected pigs and age-matched uninfected wasted and healthy pigs correlate with lesions and porcine circovirus type 2 load in lymphoid tissues. Clin. Diagn. Lab. Immunol. 9: 236-42. [ Links ]
8. Gilpin DF, Stevenson LS, McCullough K, Krakowka S, Meehan BM, McNeilly F, Foster C, Adair B, Welsh M, Allan GM (2001) Studies on the in vitro and in vivo effect of porcine circovirus type 2 infection of porcine monocytic cells. Proceedings of the ssDNA viruses of plants, birds, pigs and primates: porcine post-weaning multisystemic wasting syndrome (European Society of Veterinary Virology), 97. [ Links ]
9. Holt JG (1994) Bergeys Manual of Determinative Bacteriology, Ninth edition, Williams and Wilkins eds, Baltimore, USA. [ Links ]
10. Kennedy S, Moffett D, McNeilly F, Meehan B, Ellis J, Krakowka S, Allan GM (2000) Reproduction of lesions of postweaning multisystemic wasting syndrome by infection of conventional pigs with porcine circovirus type 2 alone or in combination with porcine parvovirus. J. Comp. Pathol. 122: 9-24. [ Links ]
11. Krakowka S, Ellis JA, Meehan B, Kennedy S, McNeilly F, Allan G (2000) Viral wasting syndrome of swine: experimental reproduction of postweaning multisystemic wasting syndrome in gnotobiotic swine by coinfection with porcine circovirus 2 and porcine parvovirus. Vet. Pathol. 37: 254-63. [ Links ]
12. Krakowka S, Ellis J, McNeilly F, Ringler S, Rings D, Allan G (2001) Activation of the immune system is the pivotal event in the production of Wasting Disease in pigs infected with Porcine Circovirus-2 (PCV-2). Vet. Pathol. 38: 31-42. [ Links ]
13. Kyriakis SC, Saoulidis K, Lekkas S, Miliotis CHC, Papoutsis PA, Kennedy S (2002) The effects of immuno-modulation on the clinical and pathological expression of postweaning multisystemic wasting syndrome. J. Comp. Pathol. 126: 38-46. [ Links ]
14. Madec F, Eveno E, Morvan P, Hamon L, Blanchard P, Cariolet R, Amenna N, Morvan H, Truong C, Mahé D, Albina E, Jestin A (2000) Postweaning multisystemic wasting syndrome (PMWS) in France: clinical observations from follow-up studies on affected farms. Livest. Prod. Sci. 63: 223-233. [ Links ]
15. Núñez A, McNeilly F, Perea A, Sanchez-Cordon PJ, Huerta B, Allan G, Carrasco L. (2003) Coinfection by Cryptospo-ridium parvum and porcine circovirus type 2 in weaned pigs. J. Vet. Med. B. Infect. Dis. Vet. Public. Health. 50: 255-8. [ Links ]
16. Pallares FJ, Halbur PG, Opriessnig T, Sorden SD, Villar D, Janke BH, Yaeger MI, Larson DJ, Schwartz KJ, Yoon KJ, Hoffman LJ (2002) Porcine circovirus type 2 (PCV-2) coinfections in US field cases of postweaning multisystemic wasting syndrome (PMWS). J. Vet. Diagn. Invest. 14: 515-9. [ Links ]
17. Perfumo CJ, Cappuccio JA, Machuca MA, Quiroga MA, Massone AE, Idiart JR, Schwartz K, Janke BH (2003) Estudios anatomopatológicos comparativos de las lesiones en los linfonódulos y bazo de cerdos con síndrome multisistémico de adelgazamiento postdestete y síndrome de dermatitis y nefropatía. VII Congreso Nacional de Producción Porcina y XIII Jornada de Actualización Porcina, pag. 17, 09-11 de Octubre de 2003, Río Cuarto, Córdoba, República Argentina. [ Links ]
18. Quintana J, Segalés J, Rosell C, Calsamiglia M, Rodríguez-Arrioja GM, Chianini F, Folch JM, Maldonado J, Canal M, Plana-Duran J, Domingo M (2001) Clinical and pathological observations on pigs with postweaning multisystemic wasting syndrome. Vet. Rec. 149: 357-61. [ Links ]
19. Rodríguez-Arrioja GM, Segalés J, Rosell C, Quintana J, Ayllon S, Camprodon A, Domingo M (1999) Aujeszkys di-sease virus infection concurrent with postweaning multi-systemic wasting syndrome in pigs. Vet. Rec. 144: 152-3. [ Links ]
20. Romanini S, Ambrogi A, Carranza A, Pelliza B, Suarez L, Dolso I, Torno H (2003) Síndrome multisistémico de adelgazamiento postdestete en diferentes sistemas de manejo en producción porcina. VII Congreso Nacional de Producción Porcina y XIII Jornada de Actualización Porcina, pag. 31, 09-11 de Octubre de 2003, Río Cuarto, Córdoba, República Argentina. [ Links ]
21. Rose N, Larour G, Le Diguerher G, Eveno E, Jolly JP, Blanchard P, Oger A, Le Dimna M, Jestin A, Madec F (2003) Risk factors for porcine post-weaning multisystemic wasting syndrome (PMWS) in 149 French farrow-to-finish herds. Prev. Vet. Med.61: 209-25. [ Links ]
22. Rosell C, Segales J, Plana-Duran J, Balasch M, Rodriguez-Arrioja GM, Kennedy S, Allan GM, McNeilly F, Latimer KS, Domingo M (1999) Pathological, immunohistochemical, and in-situ hybridization studies of natural cases of postweaning multisystemic wasting syndrome (PMWS) in pigs. J. Comp. Pathol. 120: 59-78. [ Links ]
23. Rosell C, Segalés J, Domingo M (2000) Hepatitis and staging of hepatic damage in pigs naturally infected with porcine circovirus type 2. Vet. Pathol. 37: 687-692. [ Links ]
24. Rovira A, Balasch M, Segalés J, Garcia L, Plana-Duran J, Rosell C, Ellerbrok H, Mankertz A, Domingo M (2002) Experimental inoculation of conventional pigs with porcine reproductive and respiratory syndrome virus and porcine circovirus 2. J. Virol. 76: 3232-9. [ Links ]
25. Sarli G, Mandrioli L, Laurenti M, Sidoli L, Cerati C, Rolla G, Marcato PS (2001) Immunohistochemical characterisation of the lymph node reaction in pig post-weaning multisystemic wasting syndrome (PMWS). Vet. Immunol. Immunopathol. 83: 53-67. [ Links ]
26. Sarradell J, Perez AM, Andrada M, Rodriguez F, Fernandez A, Segales J (2002 a) PMWS in Argentina. Vet. Rec. 150: 323. [ Links ]
27. Segalés J, Domingo M (1999) Actualización en el conocimiento de la circovirosis porcina. XXXII Semana nacional del ganado porcino (SEPOR 99). 14-16 de septiembre de 1999, Murcia, España. [ Links ]
28. Segalés J, Domingo M (2002) Postweaning multisystemic wasting syndrome (PMWS) in pigs. A review. Vet. Q. 24: 109-24. [ Links ]
29. Segalés J, Calsamiglia M, Rosell C, Soler M, Maldonado J, Martin M, Domingo M (2002) Porcine reproductive and respiratory syndrome virus (PRRSV) infection status in pigs naturally affected with post-weaning multisystemic wasting syndrome (PMWS) in Spain. Vet. Microbiol. 85: 23-30. [ Links ]
30. Tischer I, Peters D, Rasch R, Pocuili S (1987) Replication of porcine circovirus: induction by glucosamine and cell cycle dependence. Arch. of Virol. 96: 39-57. [ Links ]
Recibido: 03/03/04
Revisado: 09/08/04














