Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.36 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2004
Inmunoglobulinas en pacientes con actinomicetoma por Nocardia brasiliensis
L. J. Méndez-Tovar1*, R. Mondragón-González1, P. Manzano-Gayosso2,R. López-Martínez2, F. Hernández-Hernández2, A. Bonifaz3, A. Anides Fonseca4, J. Araiza3, F. Vega-López5.
1Unidad de Investigación Médica en Dermatología y Micología, Hospital de Especialidades, Centro Médico Nacional Siglo XXI, IMSS.
2Laboratorio de Micología Médica, Departamento de Microbiología y Parasitología, Facultad de Medicina, UNAM,
3Laboratorio de Micología Médica, Servicio de Dermatología, Hospital General de México, SS.
4Servicio de Dermatología y Micología, Hospital de Especialidades, Centro Médico Nacional Siglo XXI, IMSS.
5Dermatology Unit, Middlesex Hospital, London, UK.
*Correspondencia: E-mail: ljmt@servidor.unam.mx
RESUMEN
Considerando que algunos autores han reportado un aumento en la cantidad de algunas inmunoglobulinas en los pacientes con actinomicetoma, en este trabajo nos propusimos determinar diferencias en la producción de IgG1, IgG2, IgG3, IgG4 e IgM en 25 pacientes con actinomicetoma por Nocardia brasiliensis y 25 personas sanas provenientes de una zona endémica de micetoma. La determinación de inmunoglobulinas se realizó por medio de la técnica de ELISA. Para sensibilizar las placas se emplearon 6 antígenos de N. brasiliensis: un antígeno crudo denominado NB y cinco derivados del mismo (NB2, NB4, NB6, NB8 y NB10) separados por punto isoeléctrico. Los niveles de las cuatro subclases de IgG fueron mayores en los sueros de los pacientes que en el suero de los controles, con una diferencia máxima en IgG3 e IgG4; para esta última subclase, los seis antígenos fueron altamente reactivos. La concentración de IgM fue igual en ambos grupos. Es probable que como ocurre en otras infecciones, en la fisiopatogenia del actinomicetoma influya no sólo el aumento o deficiencia de una clase de inmunoglobulina, sino la relación que existe entre las diferentes subclases.
Palabras clave: actinomicetoma, Nocardia brasiliensis, inmunoglobulinas.
SUMMARY
Immunoglobulins in patients with Nocardia brasiliensis actinomycetoma. Considering that some authors have reported an increasing of some immunoglobulins in actinomycetoma patients, in this study we propose to determine differential production of IgG1, IgG2, IgG3, IgG4 and IgGM in 25 patients with actinomycetoma and 25 healthy individuals from a mycetoma endemic area. Immunoglobulins were determined by ELISA technique. To sensibilize the plates, six Nocardia brasiliensis antigens were used: a crude antigen denominated NB and five derivatives (NB2, NB4, NB6, NB8 and NB10) obtained by their isoelectric point. Results showed that all IgG subclasses were higher in the patients’ sera than in control sera, with a maximal difference to IgG3 and IgG4. To the latter subclass, six antigens were highly reactives. IgM levels were similar in both groups. As it occurs in other infections, in the actinomycetoma pathogenesis probably participate the increase or deficiency of a determined immunoglobulin class, as well as the relationship between different subclasses.
Key words: actinomycetoma, Nocardia brasiliensis, immunoglobulins.
INTRODUCCIÓN
De manera general se acepta que la respuesta inmunológica es de suma importancia en la fisiopatogenia del micetoma; sin embargo, los estudios realizados hasta el momento no son suficientes para definir los mecanismos de defensa y su participación en el desarrollo de la enfermedad. Los agentes etiológicos del micetoma pueden ser hongos o bacterias y las especies de cada grupo son numerosas: seis de Actinomicetales (1) y aproximadamente 31 especies de hongos (2). Debido al gran número de agentes y la variabilidad antigénica que existe entre ellos, los resultados de los estudios inmunoló-gicos in vitro o in vivo realizados con uno o varios de los agentes no necesariamente son aplicables en todos ellos.
A nivel mundial, México es el país que tiene el mayor número de casos de actinomicetoma causado por Nocardia brasiliensis (3, 4). Las primeras investigaciones de la inmunidad en pacientes con actinomicetoma por N. brasiliensis, fueron realizadas por González-Ochoa et al. (5), quienes utilizaron la prueba de fijación de complemento y encontraron que los pacientes con títulos de anticuerpos elevados tenían mal pronóstico, mientras que los pacientes con respuesta positiva a antígenos aplicados por vía intradérmica y títulos bajos de anticuerpos presentaban una rápida curación.
En 1977 Mahgoub et al. (6) estudiaron la concentración sérica de IgG, IgM e IgA en un grupo de 22 pacientes con micetoma y 20 controles; encontraron mayor concentración de IgG en el suero de los controles que en el de los pacientes, mientras que en la IgM y en la IgA tuvieron concentraciones más elevadas en los pacientes. A pesar de tener altas concentraciones de IgM, esta inmunoglo-bulina parecía no tener un efecto protector en los pacientes, ya que éstos presentaban una progresión constante de la enfermedad. Los mismos autores publicaron que los títulos de anticuerpos fijadores de complemento y los anticuerpos precipitantes están elevados durante el micetoma activo y desaparecen con la curación (7).
En la década de los 70s,Natvig y Kunkel (8) publicaron una revisión sobre los isotipos de inmunoglobulinas y las subclases de cada una de ellas. Estos autores describieron la existencia de dos subclases de IgA (IgAα1 e IgAα2) y cuatro subclases de inmunoglobulina G (IgG1, IgG2, IgG3 e IgG4). La mayor parte de IgM se encuentra en forma de molécula pentamérica, aunque se pueden encontrar monómeros los cuales no se consideran subclases de la misma. En esa revisión, aunque los autores suponen que la existencia de subclases indicaba diversidad en la función de cada isotipo de inmuno-globulina, no describen asociaciones directas entre infecciones y subclases de estas moléculas.
Como resultado de las investigaciones que reportaron la existencia de subclases de inmunoglobulinas, en algunas patologías diseminadas o crónicas, es importante documentar el aumento o la disminución de las clases de anticuerpo y también determinar la subclase predominante o deficiente; así, personas que sufren infecciones frecuentes con bacterias capsuladas, generalmente presentan niveles séricos bajos de IgG2 (16). En la filariasis, Hussain R et al. (7) demostraron que la concentración de las subclases de igG variaban de acuerdo a la evolución: IgG4 aumenta hasta 17 veces en los pacientes asintomáticos con microfilarias circulantes, comparados con los niveles correspondientes en pacientes con elefantiasis. En esta misma parasitosis, Atmadia et al. (1) encontraron que los niveles de IgG4 disminuían después del tratamiento, lo que podría indicar que los antígenos liberados por los parásitos ejercen un efecto inmunomodulador.
Los estudios en humanos demuestran que las subclases de IgG se producen en cantidades diferentes dependiendo del antígeno que induce la respuesta inmune; por ejemplo, antígenos polisacarídicos inducen preferentemente la síntesis de IgG1 e IgG2, mientras que los antígenos virales inducen IgG3 e IgG4 (9). En 1996 Nussbaum et al. (10) demostraron, en un modelo murino, que los anticuerpos de la subclase IgG3 originados contra un antígeno capsular de Cryptococcus neoformans para el cual no son eficientes,impiden la unión al mismo epítope de los anticuerpos de la subclase IgG1 que son protectores contra la infección por este agente, estableciendo así una inhibición competitiva.
Hasta el momento, los estudios de las inmuno-globulinas en el micetoma se han enfocado a determinar la concentración total de los diferentes isotipos de inmunoglobulinas por medio de técnicas de inmunopre-cipitación utilizando antígenos crudos. Sin embargo, en el caso del actinomicetoma por N. brasiliensis, es probable que alguno o varios de los antígenos producidos por este actinomiceto induzcan la producción específica de alguna subclase de IgG que impida montar una respuesta protectora adecuada.
El objetivo de este estudio fue determinar los niveles séricos de IgG1, IgG2, IgG3, IgG4 e IgM en un grupo de pacientes con actinomicetoma causado por N. brasiliensis utilizando antígenos semipurificados y compararlos con los niveles de las mismas inmunoglobulinas de un grupo de individuos sanos procedentes de la misma zona endémica de micetoma que los pacientes.
MATERIALES Y MÉTODOS
Pacientes y controles
Se estudiaron 25 pacientes (6 mujeres y 19 hombres) con actinomicetoma sin tratamiento previo, en quienes por medio de examen directo, estudio histológico, cultivo y pruebas fisiológicas de las colonias desarrolladas, se determinó que el agente causal era N. brasiliensis; como grupo control, se estudiaron 25 personas adultas, aparentemente sanas, sin antecedentes de micetoma. Tanto los pacientes como los controles eran originarios del estado de Morelos, México.
Antígenos
El antígeno crudo de N. brasiliensis fue obtenido de la cepa 253 MM-UNAM, crecida en caldo dextrosa Sabouraud a 25 ºC en agitación, durante 9 días (fase log). La masa bacteriana fue cosechada por filtración y sometida a 20 ciclos de agitación con perlas de vidrio de 0.5 mm de diámetro, de un minuto cada uno, en un homogenizador de tejidos (Biopsec®). El producto obtenido fue colocado en tubos de 50 ml y centrifugado a 10,000 g durante 60 minutos a 10 ºC. El sobrenadante fue dializado contra agua destilada estéril durante 8 h; se determinó la concentración de proteínas por el método de Bradford (11) y se almacenó a 4 ºC. De este material denominado antígeno crudo (NB), se obtuvieron 20 fracciones separadas de acuerdo a su punto isoeléctrico mediante un equipo Rotofor®.A cada una de ellas, se le determinó la concentración de proteínas. Se realizó un estudio preliminar (12) de proliferación in vitro utilizando células mononucleares de sangre periférica de pacientes con actino-micetoma empleando las 20 fracciones antigénicas.Los resultados mostraron que la proliferación celular fue mayor con las primeras diez fracciones, las mismas que mostraron la concentración de proteínas más elevada; al no encontrar diferencias significativas entre las fracciones pares e impares, para los estudios de inmunoglobulinas se eligieron las primeras y se denominaron NB2, NB4, NB6, NB8 y NB10 (Cuadro 1).

De cada sujeto de ambos grupos, se obtuvieron 5 ml de sangre periférica, se separó el suero y se determinaron los niveles de IgG1, IgG2, IgG3, IgG4 e IgM por la técnica de ELISA (13). Inicialmente se realizó una cinética para determinar la concentración óptima de los antígenos y la dilución de los sueros; el resultado de este estudio fue 10 ¼g/ml de antígeno y una dilución de 1:100 de suero. Las placas fueron sensibilizadas con los antígenos correspondientes y mantenidas a 4 ºC durante toda la noche; se adicionó el suero y se incubó durante 1 h a 37 ºC; posteriormente se agregó el conjugado (anticuerpo monoclonal murino Zymed Lab®) a una dilución de 1:1000. Las placas fueron reveladas con tetrametilbenzidina (Sigma) y se leyeron a una longitud de onda de 450 nm. Los resultados fueron graficados utilizando promedio, mediana, percentil 25 y percentil 75. Para determinar la significancia de las diferencias entre ambos grupos se utilizó la prueba U de Mann-Whitney (programa de SPSS v10®), considerando que cuando se trata de eventos biológicos de alta variabilidad, un valor p d£ 0,05 es estadísticamente significativo.
RESULTADOS
Como se observa en la Figura 1, todas las subclases de IgG se detectaron en mayor cantidad en el suero de los pacientes que en el suero de los controles con los seis antígenos probados.
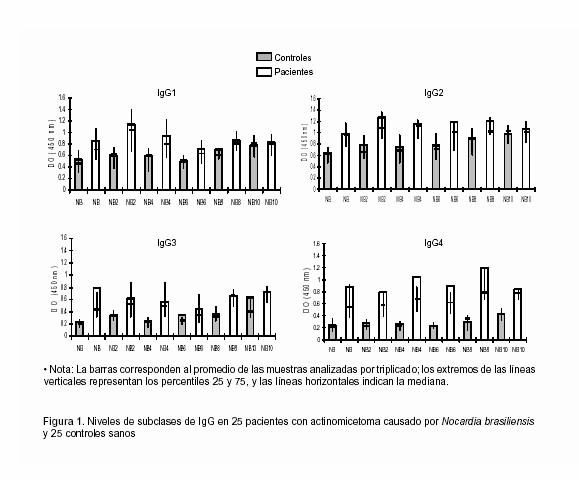
Los niveles de IgG1 fueron mayores en los sueros de los pacientes con los cinco primeros antígenos (NB, NB2, NB4, NB6 y NB8) que en los sueros de los controles; con el antígeno NB10, no hubo diferencia estadísticamente significativa (p= 0,861).
En relación a IgG2, la diferencia entre ambos grupos fue variable. Las lecturas de inmunoglobulina contra NB2 fueron 60% más elevados en suero de los pacientes que en los sueros de los controles. Con los antígenos NB6 y NB10, no se detectaron diferencias con significancia estadística (p = 0,076 y 0,781 respectivamente).
Excepto con NB6, los niveles de IgG3 fueron notablemente mas elevados en los sueros de los pacientes comparados con los controles, sobre todo con NB y NB4 que tuvieron niveles superiores tres y dos veces respectivamente.
En el suero de los pacientes se observaron valores muy elevados de IgG4 en presencia de todos los antígenos cuyas lecturas fueron entre dos y cuatro veces superiores a los obtenidos en los controles. La prueba de U de Mann-Whitney dio un valor p de cero con todos los antígenos probados lo que indica una gran diferencia en ambos grupos.
Los niveles de IgM fueron semejantes entre pacientes y controles con la mayoría de antígenos: NB, NB2, NB4, NB10 cuyos valores de p, fueron mayores a 0,05; mientras que únicamente los antígenos NB6 y NB8 mostraron diferencias significativas entre pacientes y controles con un valor p = 0,008 en ambos casos.
DISCUSIÓN
La determinación de títulos o concentración sérica de las inmunoglobulinas históricamente ha sido muy útil como herramienta de diagnóstico y/o pronóstico de muchas enfermedades infecciosas micóticas o bacterianas; por ejemplo, en la histoplasmosis y coccidioidomicosis desde hace algunas décadas se sabe que el aumento constante de inmunoglobulina G se asocia con diseminación de la enfermedad (14). Cole et al. en 1988 (15), reportaron el aislamiento de una glucoproteína de la pared de las esférulas de Coccidioides immitis que estimula la respuesta de tipo Th2, con elevadas concentraciones de inmunoglobulinas en pacientes, induciendo así una respuesta inmune celular deficiente. En las infecciones diseminadas y crónicas causadas por bacterias como Mycobacterium leprae, y M. tuberculosis, los pacientes también presentan una respuesta tipo Th2 con predominio de IL-4, IL-10 (16) con elevados títulos de inmunoglo-bulinas las cuales no tienen efecto protector.
Como resultado de las investigaciones que reportaron la existencia de subclases de inmunoglobulinas, en algunas patologías diseminadas o crónicas, es importante documentar el aumento o la disminución de las clases de anticuerpo y también determinar la subclase predominante o deficiente; así, personas que sufren infecciones frecuentes con bacterias capsuladas, generalmente presentan niveles séricos bajos de IgG2 (17).En la filariasis, Hussain R et al. (18) demostraron que la concentración de las subclases de IgG variaban de acuerdo a la evolución: IgG4 aumenta hasta 17 veces en los pacientes asintomáticos con microfilarias circulantes, comparados con los niveles correspondientes en pacientes con elefantiasis. En esta misma parasitosis, Atmadja et al. [19] encontraron que los niveles de IgG4 disminuían después del tratamiento, lo que podría indicar que los antígenos liberados por los parásitos ejercen un efecto inmunomodulador.
Recientemente Singhvi et al. (20) estudiaron la concentración de IgM, IgG e IgA en suero de pacientes con actinomicetoma causado por Actinomadura madurae, A. pelletieri y Streptomyces somaliensis, y eumicetoma causado por Madurella mycetomatis. En los micetomas causados por M. mycetomatis y por A. pelletieri se produce un aumento estadísticamente significativo de estas inmunoglobulinas, mientras que los títulos en los pacientes afectados porA. madurae y S. somaliensis son iguales a los del grupo control.
El aumento en los niveles de inmunoglobulinas agrava la evolución del micetoma, hecho demostrado por Ximenez et al. (21), en animales de experimentación, al administrarles inmunoglobulinas por vía parenteral. Salinas-Carmona et al (22), demostraron que los ratones inoculados experimentalmente con agentes de micetoma, presentan un incremento constante de inmunoglobulinas, principalmente de IgG a partir del día 14 post infección, sin que se presentara una mejoría de la patología asociada a ese incremento.
En este estudio, se demuestra que todas las subclases de inmunoglobulina G están aumentadas en los pacientes con actinomicetoma. Aunque se buscaba encontrar diferencias de respuesta utilizando diferentes antígenos citoplasmáticos semipurificados o antígeno crudo con concentraciones variables de proteínas, no se documentaron diferencias constantes atribuibles especialmente a alguno de ellos.
Es un hecho referido por varios autores que el micetoma es más grave en aquellos pacientes con aumento de inmunoglobulinas, el presente estudio muestra que las diferencias son principalmente en relación a IgG ya que la IgM dio valores sin diferencia significativa en ambos grupos.
Los resultados muestranque como ocurre en otras patologías, no solamente es importante conocer los títulos de isotipos de las inmunoglobulinas de manera general, sino que, el exceso de algunas subclases como IgG3 oIgG4 demostradas en el presente estudio pudiera interferir con la unión de las fracciones del complemento e impedir la destrucción de los agentes en los tejidos favoreciendo la progresión de la enfermedad.
BIBLIOGRAFÍA
1.Boiron P, Locci R, Goodfellow M, Gumaa SA, Isik K, Kim B, McNeil MM, Salinas-Carmona MC, Shojaei H (1998) Nocardia, nocardiosis and mycetoma. Med. Mycol. 36 (suppl 1): 26-37. [ Links ]
2.McGinnis MR (1996) Mycetoma. Dermatol. Clin. 14: 97-104. [ Links ]
3.Buot G, Lavalle P, Mariat F, Suchil P (1987) Étude épidemiologique des mycétomes au Mexique. A propos de 502 cas. Bull. Soc. Path. Exot. 80: 329-335. [ Links ]
4.López-Martínez R, Méndez-Tovar LJ, Lavalle P, Welsh O, Saúl A, Macotela-Ruiz E (1992) Epidemiología del micetoma en México: estudio de 2105 casos. Gac. Med. Mex. 128: 477-481. [ Links ]
5.González-Ochoa A, Shibayama H, Félix D, Anaya M (1962) Immunological aspects of actinomycotic mycetoma and nocardiosis. Proceedings of XII International Congress of Dermatology, p. 542-551, Washington D.C. USA. [ Links ]
6.Mahgoub ES, Gumma SA, El Hassan AM (1977) Immu-nological status of mycetoma patients. Bull. Soc. Pathol. Exot. 70: 48-53. [ Links ]
7.Mahgoub ES (1975) Serological diagnosis of mycetoma. Mycoses: Pan Am Health Organization, Washington DC. 304: 154-161. [ Links ]
8.Natvig JB, Kunkel HG (1973) Human immunoglobulins: classes, subclasses, genetic variants, and idiotypes. Adv. Immunol. 16: 1-59. [ Links ]
9.Papadea C, Check IJ (1989) Human IgG and IgG subclasses: biochemical, genetic and clinical aspects. Crit. Rev. Clin. Lab. Sci. 27: 27-58. [ Links ]
10.Nussbaum G, Yuan R, Cassadevall A, Scharff MI (1996) Immunoglobulin G3 blocking antibodies to the fungal pathogen Cryptococcus neoformans J. Exp. Med. 183: 1905-1909. [ Links ]
11.Bradford MM (1976) A rapid and sensitive method for the quantization of micrograms quantities of protein utilizing the principle of protein-dye binding. Analyt. Biochem. 72: 248-254. [ Links ]
12.Solis y Quintal W. Estudio preliminar de la respuesta inmune celular en pacientes con actinomicetoma. Tesis de Especialidad en Dermatología, UNAM, México. 1998. [ Links ]
13.Voller A, Bidwell D, Bartlett A (1980) Enzyme-linked immunosorbent assay. En: Rose NR, Friedman H (2º Edition), Manual of Clinical Immunology, Washington DC, p. 359-371. [ Links ]
14.Smith CE, Saito MT, Simons SA (1956) Pattern of 39500 serologic tests in coccidioidomycosis. J.A.M.A. 160: 546-552. [ Links ]
15.Cole GT, Seshan KR, Franco M, Bukownik E, Sun SH, Hearn VM (1988) Isolation and morphology of an immunoreactive outer wall fraction produced by spherules of Coccidioides immitis. Infect. Immun. 56: 2686-2694. [ Links ]
16.Modlin RL (1994) Th1-Th2 paradigm: insights from leprosy. J. Invest. Dermatol. 102: 828-832. [ Links ]
17.Scott MG, Briles DE, Nahm NH (1990) Selective IgG subclass expression: biologic, clinical and functional aspects. En Shakib F (Ed), The human IgG subclasses: molecular analysis of structure, function and regulation. Oxford, Pergamon Press, p. 161-183. [ Links ]
18.Hussain R, Grögl M, Ottesen EA (1987) IgG antibo-dy subclasses in human filariasis. J. Immunol. 139:2794-2798. [ Links ]
19.Atmadja AK, Atkinson R, Sartono E, Partono F, Yazdan-bakhsh M, Maizels MR (1995)Differential decline in filaria-specific IgG1, IgG4, and IgE antibodies in Brugia malayi-infected patients after diethylcarbamazine chemotherapy. J. Infect. Dis. 172: 1567-1572. [ Links ]
20.Singhvi A, Joshi KR, Sharma JC, Vyas MC (1996)Immunolobulin profile in mycetoma. Indian. J. Pathol. Microbiol. 39: 203-206. [ Links ]
21.Ximenez C, Melendro EI, González-Mendoza A, García MA, Martínez A, Ortiz-Ortíz L (1980)Resistance to Nocardiabrasiliensis infection in mice immunized with either Nocardia or BCG. Mycopathologia 70: 117-122. [ Links ]
22.Salinas-Carmona M, Torres-López E, Ramos AI, Licon-Trillo A, González-Spencer D (1999) Immune response to Nocardia brasiliensis antigens in an experimental model of actinomycetoma in BALB/c mice. Infect. Immun. 67:2428-2432. [ Links ]
Recibido: 4/2/2004
Aceptado: 22/11/2004














