Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.37 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2005
Estudio multicéntrico de fungemias por levaduras en la República Argentina
L. Rodero1, G. Davel1*, M. Soria1, W. Vivot1, S. Córdoba1, C. E. Canteros1, A. Saporiti2 y participantes del Grupo EMIFN3
1Departamento Micología, INEI, ANLIS, Dr. Carlos G. Malbrán, Vélez Sarsfield 563 (1281), Ciudad Autónoma de Buenos Aires; 2Laboratorio Central de Salud Pública, La Plata, Provincia de Buenos Aires;
3Grupo EMIFN, Argentina.
*Correspondencia. E-mail: gdavel@anlis.gov.ar
RESUMEN
La incidencia de candidemias aumentó aproximadamente en un 500% en hospitales de alta complejidad y se observó un cambio en la distribución de especies del género Candida, con un incremento de las levaduras no Candida albicans. Con el objeto de conocer la distribución de especies asociadas a fungemias por levaduras en Argentina y determinar su sensibilidad a los antifúngicos de uso convencional, se realizó un estudio multicéntrico durante el período abril 1999 a abril 2000. Participaron 36 instituciones del país. Se colectaron 265 aislamientos de levaduras provenientes de hemocultivos, que se identificaron utilizando pruebas morfológicas, fisiológicas y bioquímicas y la determinación de la concentración inhibitoria mínima se realizó en base al estándar del NCCLS. La distribución de especies fue: Candida albicans (40,75%), Candida parapsilosis (28,67%), Candida tropicalis (15,84%), Candida famata (3,77%), Cryptococcus neoformans (3,77%), Candida glabrata (2,64%) y otras (4,53%). La mayoría de los aislamientos fueron sensibles a anfotericina B, fluconazol e itraconazol. La mortalidad asociada a las fungemias por levaduras estudiadas (n=265) fue del 30%, siendo más baja a lo descrito (33-54%) y fue menor en los pacientes que recibieron tratamiento antifúngico (26,3%), que en los no tratados (47%).
Palabras clave: fungemias por levaduras, infección fúngica nosocomial, sensibilidad a antifúngicos
SUMMARY
Multicenter study of bloodstream infections due to yeasts in Argentina. The incidence of candidemia has increased approximately 500% in high-complexity hospitals. A change in the spectrum of Candida infections due to species other than Candida albicans has also been detected. Between April 1999 and April 2000 a multicenter study was performed in order to determine the species distribution associated to candidemias in Argentina and the susceptibility profile of the isolates to the current antifungal drugs. Thirty six institutions have participated. All the 265 yeast strains isolated from blood cultures were identified by morphological, physiological, and biochemical tests. The antifungal susceptibility testing of isolates was performed based on the reference NCCLS procedure. The distribution of species was: Candida albicans (40.75%), Candida parapsilosis (28.67%), Candida tropicalis (15.84%), Candida famata (3.77%), Cryptococcus neoformans (3.77%), Candida glabrata (2.64%), and others (4.53%). Most of the isolates were susceptible to amphotericin B, fluconazole and itraconazole. Mortality associated to the fungemia by yeasts episodes (n=265) was 30%, lower than results previously determined (33-54%). The mortality percentage in patients who received antifungal therapy versus patients without treatment was 26.3% and 47%, respectively.
Key words: fungemia by yeasts, fungal nosocomial infection, antifungal susceptibility
INTRODUCCIÓN
La inmunosupresión causada tanto por infección con VIH como por las terapias inmunosupresoras y los desórdenes autoinmunes, junto con el desarrollo de tecnologías y procedimientos invasores para curar o aumentar la supervivencia de neonatos de bajo peso y pacientes con enfermedades mortales, quemaduras extensas, traumatismos y heridas graves trajo aparejado un cambio en la población hospitalaria, donde el grupo de pacientes gravemente enfermos, inmunodeprimidos y debilitados aumentó dramáticamente. Esta situación conllevó un incremento notable en la frecuencia y gravedad de infecciones fúngicas sistémicas, causadas no sólo por los agentes ya conocidos sino también por patógenos emergentes, hasta no hace mucho considerados no patógenos o contaminantes de laboratorio (1, 3, 5, 7, 15).
La emergencia de estas infecciones fúngicas sistémicas en el ámbito hospitalario, como una complicación importante de los procesos antes mencionados y la morbimortalidad asociada, han generado un grave problema sanitario debido a su alto costo social y económico (1, 12, 16).
Datos del Sistema Nacional de Control de Infecciones Nosocomiales del CDC de Estados Unidos de Norteamérica (EEUU) muestran que durante la última década los hongos causaron el 7,9% del total de infecciones nosocomiales en hospitales grandes y pequeños, y ascendieron a un 9% entre 1990-1996, emergiendo como el quinto patógeno nosocomial. Asimismo, entre los microorganismos que causan infección del torrente sanguíneo y que se aíslan en hemocultivos, los hongos ocupan el cuarto lugar, por delante de otros tan comunes como Escherichia coli. Las especies de género Candida causaron el 78% de las infecciones fúngicas en pacientes inmunocomprometidos o gravemente enfermos, con una mortalidad que superó el 55%; la incidencia de las candidemias aumentó aproximadamente en un 500% en hospitales de alta complejidad y se observó un cambio en la tendencia de la distribución de especies, con un incremento de levaduras diferentes de Candida albicans (1, 3, 12-14).
En nuestro país poco se conoce con respecto a la incidencia real de estas infecciones; sin embargo, es difícil pensar que puedan ser menores a las de EEUU.
Estudios referentes a infecciones oportunistas en población pediátrica realizados por este Departamento en colaboración con el Hospital de Niños Sor María Ludovica de La Plata y el Hospital de Niños Ricardo Gutiérrez de la Ciudad Autónoma de Buenos Aires, mostraron que la incidencia de estas infecciones fúngicas era mayor que la de Europa y EEUU y la mayoría de ellas era causada por levaduras del género Candida (19). La frecuencia en que las distintas especies de Candida estaba asociada a estas infecciones también era diferente, aunque C. albicans, C. tropicalis y C. parapsilosis fueron las más importantes y causaron el 95% de ellas (19). También se detectó esta diferencia mediante un estudio multicéntrico sobre infecciones nosocomiales realizado en doce Centros de Salud de Argentina, pertenecientes a las provincias de Mendoza, Chaco, Chubut, Salta, Neuquén, Misiones, Buenos Aires y la Ciudad Autónoma de Buenos Aires (20). Esta distribución de especies es similar a la encontrada en países altamente desarrollados unas décadas atrás, antes del auge de las drogas triazólicas (9).
El control de las infecciones fúngicas sistémicas de origen hospitalario requiere, además del establecimiento de medidas de control tendientes a reducir su número, el conocimiento de los microorganismos patógenos hospitalarios y su sensibilidad frente a drogas antifúngicas con el fin de lograr una disminución de las tasas de morbimortalidad.
Sin embargo, no es habitual que esta información esté disponible en la mayoría de los hospitales, por lo que consideramos necesario realizar un estudio multicéntrico en diferentes centros de salud del país con el objeto de brindar esta información a los participantes y conocer, a nivel global, la distribución de especies asociadas a candidemias en nuestro país y su perfil de resistencia a los antifúngicos de uso convencional, como una herramienta para el control y tratamiento de estas patologías.
MATERIALES Y MÉTODOS
Diseño del estudio
Se realizó un estudio multicéntrico, de corte transversal, prospectivo, durante el período abril 1999 a abril 2000. En él participaron el Departamento Micología del INEI- ANLIS Dr. Carlos G. Malbrán y 35 instituciones del ámbito público y privado ubicadas en 9 provincias y la Ciudad Autónoma de Buenos Aires, que se detallan a continuación: Buenos Aires, H.I.G.A. San Martín, Hospital de Niños Sor M. Ludovica, Hospital Iriarte de Quilmes, H.I.G.A Rossi, Hospital Posadas, Hospital Fiorito, H.I.G.A. V. López y Planes, Hospital Interzonal de AgudosPiñeyro, Hospital San Juan de Dios, Hospital Ramón Santa-marina de Tandil, Hospital Provincial Héroes de Malvinas, Hospital D. Paroissien, Hospital Eva Perón, Hospital H. Cestino, Hospital Municipal Gral. de Agudos Mi Pueblo, Hospital Narciso López, Hospital Gral. de Agudos Dr. A. Oñativia; Chubut, Hospital Regional de Comodoro Rivadavia; Entre Ríos, Hospital San Martín de Paraná; Mendoza, Hospital Dr. H. Notti, Hospital Dr. J. Lencinas; Misiones, Hospital Provincial de Pediatría de Misiones; Neuquén, Hospital Provincial Castro Rendón de Neuquén; Santa Cruz, Hospital Regional de Río Gallegos; Santa Fe, Hospital de Niños Orlando Alassia, Hospital José Cullen; Tucumán, Centro de Salud Zenón Santillán; Ciudad Autónoma de Buenos Aires, Hospital de Niños Ricardo Gutiérrez, Hospital de Clínicas José de San Martín, Hospital P. Elizalde, Hospital J. A. Fernández, Hospital Británico, Instituto de Cardiología Fundación Favaloro, Hospital Tornú, Hospital Alemán. Las instituciones participantes cuentan con un número promedio de 236 camas, en un rango de 150-400.
Los laboratorios de estos hospitales remitieron todos los aislamientos de levaduras provenientes de hemocultivos durante el período que abarcó el estudio, al Departamento de Micología del INEI- ANLIS Dr. Carlos G. Malbrán, para su identificación y la realización de las pruebas de sensibilidad in vitro. Sólo se aceptó un aislamiento por paciente.
Se registraron los siguientes datos del paciente: edad, sexo, fecha de internación, fecha de recolección del primer hemocultivo positivo, enfermedad de base, factores de riesgo asociados, tratamiento antifúngico y supervivencia.
Identificación de los microorganismos
Todas las levaduras fueron reaisladas en cajas de Petri con agar morfología (YM), con el fin de obtener cepas puras. Se realizaron la prueba de tubo germinativo (8) y el estudio de formación de clamidoconidias en medio de bilis de Feo (4). En el caso de que ambas pruebas fueran positivas, se identificó la levadura como C. albicans. Los aislamientos restantes fueron identificados utilizando pruebas bioquímicas, fisiológicas y morfológicas de acuerdo a la metodología de Kreger van-Rij modificada en este Departamento (2, 8).
Pruebas de sensibilidad in vitro
Se ensayó la actividad de anfotericina B (AMB) (Sigma, Chemical Co., St. Louis, MO, EEUU), fluconazol (FCZ) (Pfizer, Argentina) e itraconazol (ITZ) (Janssen, Argentina), utilizando dos micrométodos en medio líquido: uno considerado NCCLS modificado y otro propuesto por el EUCAST (European Committee for Antimicrobial Susceptibility Testing), ambos basados en el método de referencia M27-A publicado por el NCCLS (9, 20, 21).
Con el fin de analizar los resultados se calcularon las CIM50 y CIM90, que representan la CIM a la que son inhibidos el 50 y el 90% de los aislamientos, respectivamente, y el porcentaje de aislamientos resistentes.
Los controles de calidad se efectuaron mediante ensayos con C. parapsilosis ATCC 22019 y C. krusei ATCC 6258.
Determinación de cepas resistentes
Con el fin de determinar los aislamientos sensibles y resistentes frente al fluconazol y al itraconazol se consideraron los puntos de corte propuestos por Rex et al. (18). Para anfotericina B aún no se han establecido valores de corte, por lo tanto no fueron analizados. Los aislamientos con valores de CIM para fluconazol ≤ 8 µg/ml fueron considerados sensibles, entre 16 y 32 µg/ml sensibles según la dosis y ≥ 64 µg/ml resistentes. Para itraconazol las CIMs ≤ 0,12 µg/ml fueron consideradas sensibles, entre 0,25 y 0,5 sensibles según la dosis y ≥1 µg/ml resistentes.
Análisis de los datos
Se diseñó una base de datos con el fin de ingresar la información recolectada en la ficha correspondiente a cada muestra y su posterior análisis.
Análisis estadístico
La prueba de Chi cuadrado de Pearson se utilizó para analizar la mortalidad asociada a la ausencia de tratamiento antifúngico.
RESULTADOS
Durante un período de un año, en las 35 instituciones participantes se detectaron 265 fungemias por levaduras. El 38% ocurrió en hospitales pediátricos.
La distribución de las especies de levaduras se muestra en la Tabla 1. C. albicans fue el agente causal del 40,75% de estas infecciones, lo que la convierte en la especie más frecuente. Sin embargo, la mayoría de las candidemias fue causada por otras especies de levaduras; C. parapsilosis fue la más frecuente de este grupo (28,67%), seguida de C. tropicalis (15,84%).
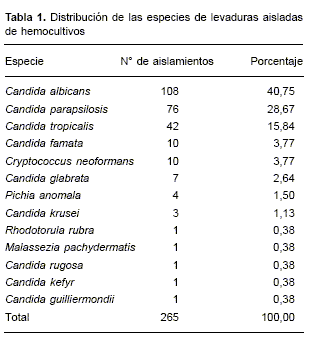
Los resultados de este estudio muestran que C. albicans es la especie que se asocia con mayor frecuencia a infecciones en pacientes menores de un año y en adultos mayores de 35 años; C. tropicalis fue aislada de hemocultivos con la misma frecuencia, independientemente de la edad del paciente.
El 99,3% de los aislamientos presentó una CIM para anfotericina B ≤ 1 µg/ml. Utilizando los puntos de corte propuestos por el NCCLS y realizando la metodología NCCLS-M (considerando la CIM como el 80% de inhibición del crecimiento), se determinó que el 11,6% de las levaduras eran resistentes a fluconazol (CIM ≥ 64 µg/ml) y el 16% a itraconazol (CIM ≥ 1 µg/ml), mientras que utilizando la lectura del punto final como el 50% de inhibición propuesta por el EUCAST, estos porcentajes disminuyeron a 1,9% y 0,75%, respectivamente (Tabla 2).

En la Tabla 3 se muestran los resultados de las pruebas de sensibilidad in vitro para el conjunto de los aislamientos de C. albicans, C. parapsilosis y C. tropicalis, por las dos metodologías utilizadas en este estudio.
Tabla 3. Perfil de sensibilidad in vitro de todos los aislamientos de las especies de Candida más frecuentemente aisladas frente a los antifúngicos de uso convencional
La mortalidad asociada a las candidemias estudiadas fue de 30%. El 82% de los pacientes incluidos en este estudio recibieron tratamiento antifúngico y las drogas más utilizadas fueron anfotericina B y fluconazol como se muestra en la Tabla 4. Cuando se analizaron los pacientes que recibieron tratamiento antifúngico versus los pacientes no tratados, el porcentaje de mortalidad asociada fue de 26,3% y de 47%, respectivamente. La prueba Chi cuadrado de Pearson, demostró que no hay independencia entre las variables (p<0,01), es decir que el resultado clínico (muerte/supervivencia) depende del empleo de antifúngicos.

DISCUSIÓN
Las infecciones del torrente sanguíneo figuran entre las más graves y las especies del género Candida han emergido como un importante patógeno nosocomial. Para reducir su morbimortalidad es necesario conocer la distribución de las especies asociadas a candidemias y la sensibilidad a los antifúngicos de uso habitual en el ámbito hospitalario.
En este estudio la mayoría de estas infecciones (59,25%) fueron causadas por levaduras no C. albicans, a diferencia de lo detectado en estudios realizados en EEUU, Canadá y Europa (3, 12, 15).
C. albicans fue el principal agente etiológico de candidemias nosocomiales (40,75%), observándose la misma distribución, pero con menor frecuencia que en la mayoría de las comunicaciones internacionales (3, 12, 15). Pfaller et al. mostraron resultados similares para América Latina (14).
C. parapsilosis fue la más común de las levaduras diferentes de C. albicans asociadas a candidemias (28,5%), como observáramos en nuestro estudio anterior, donde se incluyeron otras candidiasis sistémicas nosocomiales, aunque la frecuencia fue mayor (20). Sin embargo, no alcanzó el altísimo porcentaje detectado por Pfaller et al. (14). Esta distribución concuerda con la encontrada en Canadá y Europa, pero es diferente a la de EEUU donde C. glabrata es la segunda especie asociada a candidemias (3, 6, 12, 14, 15). Dado que C. parapsilosis es responsable de infecciones hospitalarias relacionadas al manejo inadecuado de los catéteres o contaminación de material quirúrgico, el aumento de candidemias asociadas a esta especie y la disminución de las causadas por C. albicans, estarían indicando fallas en las medidas de control de la infección nosocomial (1).
C. tropicalis causó el 15,84% de las fungemias levaduriformes ocupando el tercer lugar en frecuencia, hecho que coincide con lo comunicado por Pfaller et al.(14) para América Latina, pero difiere de lo encontrado por otros investigadores (3, 6, 12, 14).
C. glabrata sólo causó el 2,64% de las candidemias en este estudio, coincidiendo con una de las series de América Latina (12). Esto probablemente se debe a la frecuencia de utilización de fluconazol, relativamente baja en los hospitales incluidos en este estudio, ya que esta especie está asociada al 75% de las candidemias de los pacientes en tratamiento con fluconazol (21). Esta reducida presión de selección producida por las drogas triazólicas se confirma por la baja frecuencia de recuperación de C. krusei, intrínsecamente resistente a fluconazol.
Candida famata surge como una especie emergente de importancia en nuestro país, donde es más frecuente que C. krusei y C. guilliermondii, a diferencia de lo que ocurre en América del Norte (3, 12). Con menor frecuencia aparece Pichia anomala.
Con respecto a los datos de sensibilidad, lo más destacable es que la mayoría de las CIMs para todos los antifúngicos son bajas. Muy pocos aislamientos de las especies de Candida, en especial de C. parapsilosis, resultaron resistentes al fluconazol y al itraconazol (Tablas 2 y 3). Estos resultados son similares a los datos obtenidos en el programa SCOPE de vigilancia nosocomial (1995-1996) en el cual se observa un 90% de cepas de Candida sensibles a los triazoles (12). Cabe destacar que los porcentajes de resistencia a las drogas azólicas detectados por el método de la NCCLS modificado (20) son más altos que los obtenidos por el método propuesto por el EUCAST (21) para las cepas de C. albicans y C. tropicalis, que tienen un mayor crecimiento residual (trailing effect). La lectura a las 24 hs. de incubación y al 50 % de inhibición del desarrollo (CIM50) parece ser mejor que la lectura a las 48 hs. y al 80% de inhibición del desarrollo (CIM80) para estas cepas.
En este trabajo hemos incluido los resultados por dos métodos de microdilución con el fin de hacerlos comparables a los de las publicaciones internacionales. Como puede verse, los porcentajes de resistencia de los aislamientos autóctonos de C. albicans y C. tropicalis, que presentan mayor crecimiento residual, determinados por el método propuesto por el EUCAST, tienen valores similares a los de las publicaciones internacionales, mientras que cuando se realiza la lectura a las 48 hs. de incubación y al 80% de inhibición del desarrollo, el porcentaje de aislamientos resistentes es superior y, además, suele no correlacionar con lo que se observa in vivo.
El documento M27-A es un estándar de referencia que ha permitido sentar las bases para el desarrollo de otras metodologías, más accesibles pero que obtengan resultados similares al estándar. Los métodos de microdilución con RPMI-2% de glucosa han sido aceptados internacionalmente porque proporcionan resultados equivalentes al M27-A, son más fáciles de realizar, más económicos y permiten la obtención más rápida de resultados. En la actualidad el EUCAST, equivalente al NCCLS, ha propuesto un método de microdilución con el fin de mejorar la correlación in vitro -in vivo. El criterio de elección del coeficiente de inhibición para los azoles aplicado en la determinación de la CIM (80% vs. 50%) de las cepas que tienen un mayor crecimiento residual, es un punto álgido. Al igual que lo comunicado por Rodríguez-Tudela et al. (21), en este estudio se evidencia que estas cepas son resistentes o sensibles dependiendo del criterio. Según este investigador, en algunos casos clínicos los pacientes respondían a un tratamiento estándar a pesar que el aislamiento tenía una CIM80 de 128 µg/ml, pero la CIM50 era de 0,25 o 0,5 µg/ml (comunicación personal).
Esta observación coincide con las comunicaciones de Odds et al. (10) y Rex et al. (17). El primero de ellos afronta esta problemática desde una perspectiva in vitro y el segundo correlaciona los resultados in vitro de estas cepas peculiares con la respuesta al tratamiento en un modelo experimental de infección fúngica. Ambos grupos concluyen que para los azoles y la 5-fluorocitosina, la determinación de la CIM50 puede ser más adecuada. Estas observaciones fueron determinadas in vitro e in vivo y quizá no sean extrapolables al humano. El uso de la CIM50 para determinar la sensibilidad de las levaduras a los azoles parecería ser más adecuada, ya que no varía de forma sustancial de la CIM si se exceptúan los aislamientos con alto crecimiento residual, pero es necesario realizar estudios de correlación in vitro -in vivo que determinen con exactitud cuál es el método más adecuado.
La mortalidad asociada a las candidemias estudiadas (30%), fue menor de lo comunicado por Rege et al., que varía entre 33-54% (16). Es probable que se deba a que el 82% de los pacientes incluidos en este estudio recibieron tratamiento antifúngico. El porcentaje de mortalidad asociada en los pacientes que recibieron tratamiento antifúngico versus los pacientes no tratados fue de 26,3% y de 47%, respectivamente. El análisis estadístico de ambas series de pacientes demostró que el resultado clínico (muerte / supervivencia) depende del empleo de antifúngicos.
Aunque los resultados de este estudio no pueden considerarse representativos de todo el país, debido a que no se realizó una selección aleatoria de los centros participantes, sino que su inclusión fue voluntaria, consideramos de suma importancia haber realizado este primer estudio de fungemias por levaduras, ya que ha permitido tener un primer acercamiento con la situación de esta patología en los hospitales de nuestro medio.
La vigilancia de las infecciones graves causadas por las especies del género Candida, realizada en el laboratorio, puede ser una importante herramienta en la epidemiología de la infección fúngica nosocomial, para alertar sobre los cambios epidemiológicos y de sensibilidad a antifúngicos.
3GRUPO EMIFN: A. Burkett, Hospital de Niños Ricardo Gutiérrez; N. Tiraboschi, Hospital de Clínicas José de San Martín; R. Pereda, Hospital P. Elizalde; L. Guelfand, Hospital J. A. Fernández; I. Agorio, Hospital Británico; A. Fernández, Instituto de Cardiología Fundación Favaloro; S. Carabelli, Hopital Tornú; C. E. Canteros Hospital Alemán; S. Mestroni, H.I.G.A. San Martín; H. Demkura, Hospital de Niños Sor M. Ludovica; J. Herrera, Hospital Iriarte de Quilmes; S. Sallaber, H.I.G.A Rossi; P. Capece, Hospital Posadas; S. Fernández, Hospital Fiorito; H. Gullo, H.I.G.A. V. López y Planes; M. Ferreira, Hospital Interzonal de Agudos Piñeyro; P. Featherstone, Hospital San Juan de Dios; I. Ortega, Hospital Ramón Santamarina de Tandil; G. Posse, Hospital Provincial Héroes de Malvinas; L. Mónaco, Hospital D. Paroissien; A. Tuduri, Hospital Eva Perón; C. Giner, Hospital H. Cestino; M. M. Gatti, Hospital Municipal Gral. de Agudos Mi Pueblo; A. Benavidez, Hospital Narciso López ; M. Bergami, Hospital Gral. de Agudos Dr. A. Oñativia; C. Mayoral, Hospital de Niños Orlando Alassia; M. E. Nardín, Hospital José Cullen; C. Latapie, Centro de Salud Zenón Santillán; N. Petrussi, Hospital San Martín de Paraná; L. Rosaenz, Hospital Dr. H. Notti; H. Pagella, Hospital Dr. J. Lencinas; N. Schmidt, Hospital Provincial Castro Rendón de Neuquén; S. Grenón, Hospital Provincial de Pediatría de Misiones; M. Letunic, Hospital Regional Dr. Sanguinetti de Comodoro Rivadavia; A. Vargas, Hospital Regional de Río Gallegos.
BIBLIOGRAFÍA
1. Abid-Said D, Anaissie E, Uzun O, Raad I, Piazcowsky H, Vartivarian S (1997) The epidemiology of hematogenous candidiasis caused by different Candida species. Clin. Infect. Dis. 24:1122-1128. [ Links ]
2. Davel G, Nuñez V, Mancebo G (1991) Método de identificación de levaduras basado en sus propiedades bioquímicas y fisiológicas. V Congreso Argentino de Micología, Resumen 59, Santa Fe Argentina. [ Links ]
3. Diekema DJ, Messer SA, Brueggemann AB, Coffman SL, Doern GV, Herwaldt LA, et al. (2002) Epidemiology of candidemia: 3-year results from emerging infections and epidemiology of lowa organisms study. J. Clin. Microbiol. 40: 1298-1302. [ Links ]
4. Feo M (1974) Estudio de las condiciones de formación de las clamidosporas. Rev. Latinoamer. Microbiol. 16: 105-110. [ Links ]
5. Fridkin SK, Jarviws WR (1996) Epidemiology of nosocomial fungal infections. Clin. Microbiol. Rev. 9: 499-511. [ Links ]
6. Hernández-Sampelayo T, Navarro-Gómez ML, Hernández-Molina JM, Gómez-Campderá (1997) Importancia de las infecciones fúngicas en pediatría. Rev. Clin. Española 197: 60-66. [ Links ]
7. Jarvis WR (1995) Epidemiology of nosocomial fungal infections, with emphasis on Candida species. Clin. Infect. Dis. 20:1526-1530. [ Links ]
8. Kreger-van Rij NJW (1984) The yeasts, a taxonomic study. 3th Ed. Elsevier, Amsterdam. [ Links ]
9. National Committee for Clinical Laboratory Standards (1997) Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard. Document M27-A. National Committee for Clinical Laboratory Standards. Villanova, PA. [ Links ]
10. Odds F, Vranckx CL, Woestenborghs F (1995) Antifungal susceptibility testing of yeasts: evaluation of technical variables for test automation. Antimicrob. Agents Chemother. 39: 2051-2060. [ Links ]
11. Pfaller MA, Diekema DJ, Jones RN, Messer SA, Hollis R J, the SENTRY participant group (2002) Trends in antifungal susceptibility of Candida spp. isolated from pediatric and adults patients with bloodstream infection: Sentry Antimicrobial Surveillance Program, 1997 to 2000. J. Clin. Microbiol. 40: 852-856. [ Links ]
12. Pfaller MA, Diekema DJ (2002) Role of sentinel survillance of candidemia: trends in species distribution and antifungal susceptibility. J. Clin. Microbiol. 40: 3551-3557. [ Links ]
13. Pfaller MA, Jones RN, Doren GV, Sader HS, Hollis RJ, Messer SA et al. (1998) International surveillance of bloodstream infection due to Candida species: frequency of ocurrence and antifungal susceptibilities of isolates collected in 1997 in the United States, Canada, and South America for the SENTRY program. J. Clin. Microbiol. 36: 1886-1889. [ Links ]
14. Pfaller MA, Jones RN, Doren GV, Sader HS, Messer SA, Houston A, et al. (2000) Bloodstream infection due to Candida species: SENTRY antimicrobial surveillance program in North America and Latin America 1997-1998. Antimicrob. Agents Chemother. 44: 747-751. [ Links ]
15. Pfaller MA, Jones RN, Doren GV, Fluit AC, Verhoef J, Sader HS, et al. (1999) International surveillance of blood stream infections due to Candida species in the European SENTRY program: species distribution and antifungal susceptibility including the investigational triazole and echinocandin agents. SENTRY Participant Group (Europe). Diagn. Microbiol. Infect. Dis. 35: 19-25. [ Links ]
16. Rege M, Gentry LO, Garey KW (2004) Risk factors for overall and attributable mortality in hospitalized patients with bloodstream candidemia 44th Annual ICCAC, Resumen K745 Washington DC, EEUU. [ Links ]
17. Rex JH, Nelson PW, Paetznick VL, Lozano-Chiu M, Espinel-Ingroff A, Anaissie EJ (1998) Optimizing the correlation between results of testing in vitro and therapeutic outcome in vivo for fluconazole by testing critical isolates in a murine model of invasive candidiasis. Antimicrob. Agents Chemother. 42: 129-134. [ Links ]
18. Rex JH, Pfaller MA, Galgiani JN, Barlett MS, Espinel-Ingroff A, Ghannoum MA, et al. (1997) Development of interpretative breakpoints for antifungal susceptibility testing: conceptual framework and analysis of in vitro-in vivo correlation data for fluconazole, itraconazole, and Candida infections. Clin. Infect. Dis. 24: 235-247. [ Links ]
19. Rodero L, Boutureira M, Demkura H, Burkett A, Fernández M, Losso M, et al. (1997) Infecciones por levaduras: agentes causales y su resistencia a antifúngicos en pacientes pediátricos hospitalizados y en adultos HIV positivos. Rev. Argent. Microbiol. 29: 7-15. [ Links ]
20. Rodero L, Davel G, Córdoba S, Soria M, Canteros C, Hochenfellner F, et al. (1999) Estudio multicéntrico sobre candidiasis nosocomial en la República Argentina. Rev. Argent. Microbiol. 31: 114-119. [ Links ]
21. Rodríguez-Tudela JL, Martínez-Suárez JV (1995) Defining conditions for microbroth antifungal susceptibility tests: influence of RPMI and RPMI-2% glucose on the selection of endpoint criteria. J. Antimicrob. Chemother. 35: 739-749. [ Links ]
Aceptado: 7/11/05














