Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.37 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2005
Neosporosis bovina: conceptos generales, inmunidad y perspectivas para la vacunación
D.P. Moore1, A.C. Odeón1*, M.C. Venturini2, C.M. Campero1
1Estación Experimental Agropecuaria, Patología Veterinaria, Instituto Nacional de Tecnología Agropecuaria (INTA), CC 276, 7620 Balcarce, Argentina.
2Facultad de Ciencias Veterinarias de la Universidad Nacional de La Plata (UNLP), 1900 La Plata, Argentina.
*Correspondencia. E-mail: aodeon@balcarce.inta.gov.ar
RESUMEN
Neospora caninum es agente causal de aborto en bovinos de regiones ganaderas de todo el mundo. Su ciclo de vida es heteroxeno siendo el perro (Canis familiaris) y el coyote (Canis latrans) los hospedadores definitivos reconocidos hasta el presente. La infección transplacentaria es un eficiente mecanismo de transmisión de la enfermedad pero existe evidencia que demuestra la transmisión postnatal en los bovinos. Debido a las pérdidas económicas que causa la neosporosis, diversas técnicas diagnósticas han sido desarrolladas. La fisiopatología del aborto causado por N. caninum no ha sido completamente esclarecida. La modulación del sistema inmune por efecto de la preñez ocasiona un período de susceptibilidad al aborto por N. caninum. Aunque la resistencia al parásito ha sido asociada con una respuesta de linfocitos T tipo 1, dicha respuesta inmune es incompatible con una preñez exitosa. Sin embargo, los mecanismos inmunes presentes en animales crónicamente infectados protegen del aborto ante una segunda exposición al protozoo. La comprensión de esa respuesta inmune adquirida constituye un desafío para el desarrollo de inmunógenos. Este trabajo menciona conceptos generales de la neosporosis bovina haciendo énfasis en los mecanismos inmunes y las perspectivas para la vacunación.
Palabras clave: bovinos, inmunidad, Neospora caninum, vacuna
SUMMARY
Bovine neosporosis: general concepts, immunity and perspectives for vaccination. Neospora caninum causes abortions in cattle worldwide. The Neospora-cycle of life is heteroxenous. Dogs (Canis familiaris) and coyotes (Canis latrans) are the definitive hosts known at present. Although, transplacental infection is an efficiently mode of transmission in cattle; there are also experimental and field data that prove horizontal transmission. Several techniques are available for diagnosis since neosporosis is recognized as a disease that causes economic losses in cattle. The mechanisms that produce the abortion are not completely understood. The immunomodulation observed during the pregnancy, is associated with a susceptible period where Neospora-abortion can occur. Resistance to the parasite is dependent on T helper cell 1 cytokine responses. This has important repercussions for pregnant female bovine because strong T helper cell 1 cytokine responses are incompatible with successful pregnancy. However, it was demonstrated that chronically infected cows develop immune mechanisms against the abortion caused by a second Neospora-exposure. The comprehension of those mechanisms is needed for the formulation of Neospora-vaccines that prevent bovine neosporosis. General concepts about neosporosis with emphasis in the immune response and perspectives for vaccination are mentioned in the present review.
INTRODUCCIÓN
Antecedentes de la neosporosis
La neosporosis fue descrita por primera vez en caninos como un síndrome neuromuscular causado por un protozoo intracelular denominado Neospora caninum (19, 44). Dicho agente fue posteriormente relacionado no sólo con la producción de abortos en bovinos (103) sino también con disminución de la producción de carne y leche (42). Aunque el perro fue descrito como hospedador definitivo de la enfermedad en forma experimental (78) y natural (16); también el coyote (Canis latrans) puede comportarse como hospedador definitivo (51). Actualmente la neosporosis es definida como una enfermedad parasitaria que afecta caninos, bovinos, ovinos, caprinos, búfalos, ciervos y equinos, causada por N. caninum (42, 43). Equinos, caprinos, ovinos, ciervos, búfalos e inclusive el perro pueden comportarse como hospedadores intermediarios (41, 42, 43). En equinos, se ha descrito otra especie causante de meningoencefalitis denominada N. hughesi (74).
Aunque la enfermedad es causante de pérdidas reproductivas, productivas y económicas en áreas ganaderas de todo el mundo, hasta el presente no existe tratamiento o inmunógeno capaz de prevenir la infección en los bovinos (42). Mayor información acerca de los antecedentes de la neosporosis puede encontrarse en otras revisiones bibliográficas (40, 41, 42, 43).
El agente etiológico y taxonomía
N. caninum es un protozoo intracelular obligado, perteneciente al phylum Apicomplexa y a la familia Sarcocystidae. Mediante microscopía electrónica se reconocen organelas características de ese phylum como por ejemplo, micronemas, roptrias y gránulos densos (43, 46). N. caninum es morfológicamente similar a Toxoplasma gondii, y está relacionado taxonómicamente a otros protozoos formadores de quistes como Hammondia heydorni e Isospora bigemina (43, 46). Los estadios parasitarios reconocidos en su ciclo son: taquizoíto, bradizoíto y esporozoíto. Los taquizoítos y bradizoítos se encuentran en hospedadores intermediarios, mientras que los esporozoítos se eliminan en las heces del perro (43, 78). Los taquizoítos tienen forma de media luna o globular, miden 3 a 7 µm de largo por 1 a 5 µm de ancho. Los bradizoítos tiene una replicación más lenta que los taquizoítos y están contenidos en quistes tisulares de forma redonda u oval. Asimismo, los bradizoítos miden hasta 107 µm y tienen una pared de 4 µm. Los taquizoítos y quistes tisulares son intracelulares. Los taquizoítos han sido detectados en neuronas, macrófagos, fibroblastos, células endoteliales, miositos, células renales y hepatocitos (43). Los quistes tisulares, han sido observados en el tejido nervioso y muscular (46). Por último, los ooquistes eliminados en las heces del hospedador definitivo son esféricos o subesféricos, miden 10 a 11 µm, no tienen color y contienen dos esporocistos con cuatro esporozoítos cada uno (78). Los estados enteroepiteliales en el perro no han sido descriptos hasta el presente. Mayor información acerca del agente etiológico y su taxonomía puede encontrarse en otro trabajo (46).
Ciclo de vida
El ciclo de vida parasitario conocido hasta el presente se encuentra ilustrado en la figura 1. Los hospedadores definitivos adquieren la infección al ingerir tejidos de hospedadores intermediarios conteniendo quistes. La pared del quiste es degradada por los jugos gástricos liberando las formas parasitarias que iniciarán los estados entero-epiteliales (43). Luego de realizar una fase de reproducción asexual y sexual en el intestino, los ooquistes son eliminados en las heces del hospedador definitivo. Los perros que consumen tejidos infectados pueden eliminar ooquistes manteniendo su condición de seronegativos (46). Por otro lado, un canino que se comporte como hospedador intermediario puede ser seropositivo y transmitir la infección verticalmente a sus cachorros o presentar miositis, parálisis y dermatitis (41). La frecuencia con la cual los perros pueden adquirir la infección en la naturaleza es motivo de debate, sin embargo, la exposición postnatal de los caninos está demostrada por el incremento de la seroprevalencia en perros de mayor edad (17).

Siendo infectivos a las 24 hs. después de su eliminación en las heces, los ooquistes ingresan a los hospedadores intermediarios por la vía oral (46, 78, 108). Los esporozoítos liberados en el aparato gestrointestinal del hospedador intermediario son capaces de alcanzar las vías sanguínea y linfática accediendo a todos los tejidos, no obstante sólo se ha informado la presencia de quistes en el sistema nervioso central (SNC) y el tejido muscular (41, 42). Aunque el bovino puede infectarse por la vía oral siendo el ciclo de vida heteroxeno (37, 42, 76, 106), la principal vía de transmisión es la congénita (4, 56, 87). Esta vía ha sido también demostrada experimentalmente en ovinos, caprinos, ratones, caninos, felinos, porcinos y primates (5, 41, 42, 43). Por otro lado, si bien la transmisión vertical es la forma de infección más frecuente en bovinos, ello no explicaría debidamente el elevado número de hatos infectados. El hecho de haberse determinado que los bovinos pueden tener seroconversión por una exposición postnatal (56, 78, 106) avala la importancia de la transmisión horizontal (106), motivando intensa investigación el descubrimiento de otras vías de infección postnatal. Además, la transmisión vertical no sería un mecanismo suficiente para mantener la infección en una población bovina debido a que su eficiencia es inferior al 100% (5).
En una hembra bovina, luego de una infección oral (infección exógena) o por reactivación de quistes tisulares en estado de latencia adquiridos congénitamente (infección endógena), el parásito alcanza la vía sanguínea y es capaz de atravesar la placenta accediendo al feto. Luego de invadir el feto, puede ocasionarse el aborto o la transmisión vertical con nacimiento de un ternero clínicamente normal pero congénitamente infectado (42, 43).
El protozoo puede ser eliminado a través del semen en toros (85) y su ácido desoxirribonucleico (ADN) ha sido ocasionalmente detectado en muestras de semen congelado (26). Aunque los toros se comportan como hospedadores intermediarios (82) sería poco probable la ocurrencia de transmisión venérea; sin embargo, esta posibilidad aún no ha sido investigada.
Considerando que los taquizoítos adicionados artificialmente a la leche resultaron infectivos para terneros (109), la eliminación del protozoo a través de la glándula mamaria debería ser motivo de investigación. En el posparto o tras el aborto, la placenta con presencia de taquizoítos (99) podría servir como fuente de infección para otra vaca que la ingiera. Sin embargo, dos terneros y dos vacas libres de N. caninum mantuvieron dicha condición luego de consumir placentas naturalmente infectadas (35).
El hecho de haberse informado que el coyote puede comportarse como hospedador definitivo (51) y que otras especies, como por ejemplo los ciervos, pueden servir como hospedadores intermediarios (43), avalan la existencia de ciclos de vida silvestre de N. caninum (Figura 1). Si bien existen evidencias de exposición natural y experimental a N. caninum en otros cánidos salvajes y aves (46), el riesgo epidemiológico de estas especies es aún desconocido.
Patogénesis de la neosporosis
Aunque la patogénesis de la neosporosis en el bovino es parcialmente conocida, se han logrado importantes avances para comprender los mecanismos involucrados en la muerte fetal o la transmisión vertical (42, 62, 114, 115). Los bradizoítos alojados en los quistes tisulares del SNC en una hembra bovina gestante pueden reactivarse bajo ciertas influencias hormonales e inmunológicas originando parasitemia (25, 62, 90, 96, 101). Al producirse parasitemia, ya sea por reactivación de quistes latentes o como resultado de una infección oral, los taquizoítos no sólo atraviesan la placenta produciendo necrosis e inflamación sino que acceden a los tejidos fetales por vía sanguínea (40, 42). En las células infectadas del feto, se inician procesos de multiplicación mediante endodiogenia que ocasionan daño celular con necrosis e inflamación (para características de las lesiones histopatológicas ver Diagnóstico), o se forman quistes tisulares capaces de persistir durante toda la vida del animal (43). Mecanismos hormonales e inmunes maternos ocurridos durante la gestación, sumado al desarrollo del sistema inmune fetal (ver sección de inmunidad y gestación) actuarían determinando si la infección desencadena la muerte del feto, el nacimiento de un ternero congénitamente infectado o el nacimiento de un ternero libre de infección (114). Aunque se ha estimado que transcurren 3-4 semanas entre la infección fetal y el aborto (12, 45), la gestación puede concluir con el nacimiento de un ternero infectado, que en caso de ser hembra, transmitirá la enfermedad a su descendencia, teniendo también alto riesgo de abortar (106, 116).
La reactivación de una infección latente estaría asociada a un eficiente mecanismo de transmisión vertical más que a un proceso que desencadene el aborto, al menos en rodeos endémicamente infectados (4, 34, 88, 101). Como contraparte, la manifestación epizoótica de la enfermedad está asociada a la presentación de tormentas de abortos en animales infectados horizontalmente (76, 79, 89).
Aspectos inmunes durante la gestación
La madre gestante adapta su metabolismo y sistema inmune proporcionando un medio homeostático y nutrientes al "concepto" (placenta, feto y fluidos). Asimismo, la preñez está condicionada por mecanismos de tolerancia o rechazo. Factores ambientales externos (infecciones o estrés) pueden desequilibrar el balance madre- concepto ocasionando el aborto. Los mencionados mecanismos de tolerancia (locales y sistémicos) y los mecanismos de rechazo durante la preñez fueron recientemente revisados (104).
Favorecida por los altos niveles de progesterona, la respuesta inmune Th2 (mediada por linfocitos helper tipo 2) mantiene la preñez mediante la producción de IL4 (interleuquina 4), IL5, IL6, IL9 e IL10 y reducción de la producción de moléculas pro-inflamatorias como IL12 e (interferón gamma) IFN-g, las cuales son perjudiciales para la vida fetal (32, 91). Uno de los mecanismos más importantes de rechazo del feto involucra un desbalance entre la respuesta Th1/Th2 a favor de la respuesta Th1 y producción de IFN-g y otras citocinas asociadas a este tipo de respuesta (57, 91). Las interleucinas IL-2, IL-3, y IL-12 promueven actividades citolíticas en macrófagos y NK (del término en inglés: natural killer), activan la protrombina facilitando la coagulación y la trombosis y estimulan la producción de inmunoglobulinas que activan la cascada del complemento. Las infecciones que promueven una respuesta Th1 alteran el sincitiotrofoblasto. Más aún, el IFN-g es capaz de actuar directamente sobre este tejido induciendo abortos espontáneos (31, 32).
Aspectos inmunes en las infecciones por N. caninum
La respuesta inmune generada en las infecciones parasitarias varía según el tipo de parásito. Mientras que los parásitos multicelulares que viven en el espacio extracelular inducen una respuesta Th2 con producción de IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, IgG1 e Ig E, los protozoos intracelulares como N. caninum, estimulan una respuesta inmune Th1 dominada por la producción de IL-12, IFN-g, FNT e IgG2 (107). Estas últimas citocinas activan vías que generan radicales libres y ON, los cuales son letales para dichos parásitos (58).
En la neosporosis bovina, se desconoce si el tipo de respuesta inmune generada por la ingestión de ooquistes (36) es similar a la lograda por inoculación de taquizoítos, ya sean inactivados (6, 7) o vivos (8, 60, 115). Más aún, existirían diferencias entre la respuesta inmune generada por infección prenatal o postnatal (80, 115). Además, existen evidencias acerca de la variación de antígenos existente entre los estadios de taquizoítos o bradizoítos (50, 77, 97). El conocimiento de estas diferencias resulta de importancia para el desarrollo de las medidas de control (73).
Inmunidad mediada por anticuerpos
Las infecciones naturales y experimentales de animales logradas a partir de taquizoítos u ooquistes de N. caninum han permitido la caracterización de la IMA (inmunidad mediada por anticuerpos) (36, 53). En animales experimental y naturalmente infectados, la avidez de la IgG tiende a incrementarse con el curso de la infección, permitiendo la identificación de animales crónica o recientemente infectados (18).
Se ha postulado que el desarrollo de anticuerpos específicos probablemente limita la parasitemia o facilita la lisis de los taquizoítos extracelulares (54). Ratones deficientes de células B y de anticuerpos, murieron presentando lesiones de encefalitis necrotizante multifocal cuando fueron inoculados con N. caninum (49). En otro estudio donde se investigó el rol de las células T utilizando ratones BALB/c, se concluyó que células CD4+ promovieron la producción de anticuerpos específicos, los cuales resultaron de importancia en la protección durante estadios avanzados de la enfermedad (102).
Diferentes estudios realizados en ratones han descripto que luego de la infección por N. caninum, los anticuerpos predominantes son del isotipo IgG2 siendo bajos o nulos los niveles de IgG1 (49, 69). Se observó un aumento de mortalidad en ratones con elevada proporción IgG1: IgG2 (18). Estos hallazgos son coincidentes con lo informado en bovinos experimentalmente infectados, en los cuales existió una respuesta dependiente de células cooperadoras Th1 asociada a la producción de IgG2 (114). Sin embargo, similares niveles de IgG1 e IgG2 fueron encontrados luego del desafío experimental con taquizoítos vivos (7).
Inmunidad mediada por células
Los mecanismos dependientes de la IMC (inmunidad mediada por células) son relevantes para controlar un parásito intracelular obligado como N. caninum, especialmente por su habilidad para evadir la respuesta inmune (54).
La IMC que involucra a los linfocitos T cooperadora con la producción de IFN-g, IL-12 e IL-2 está asociada a resistencia al protozoo. Experiencias "in vitro" demostraron que el tratamiento de células con IFN-g recombinante inhibió la multiplicación intracelular de N. caninum (59). Ante la estimulación con antígeno de N. caninum lisado, las células mononucleares de sangre periférica (CMSP) de bovinos infectados proliferaron y produjeron IFN-g entre los 4 y 8 días post inoculación (71). Aunque el cultivo primario de células de cerebro bovino es altamente susceptible a la infección por N. caninum, la infección puede ser inhibida por adición de IFN-g y FNT (Factor de Necrosis Tumoral) (117). También ha sido informado que un grupo de antígenos de bajo peso molecular de taquizoítos de N. caninum (30 kDa) estimularon la proliferación in vitro de linfocitos T CD4+ obtenidos a partir de terneros experimentalmente infectados (73). En ese mismo trabajo, la proliferación celular fue acompañada por incremento en la concentración de IFN-g (73). Más aún, tratando células con el sobrenadante de células CD4+ que respondieron a antígenos de N. caninum se logró inhibir la multiplicación del parásito (49). Cuando se infectaron terneros por la vía oral, las CMSP cultivadas in vitro respondieron al antígeno de N. caninum a los 7 días después del desafío. Este tipo de respuesta resultó evidente en CMSP, células de bazo y células de los ganglios mesentéricos, inguinales y bronquiales hasta 2,5 meses después de la infección (36). Recientemente, se ha postulado que los mecanismos dependientes de linfocitos citotóxicos serían posibles candidatos para impedir la transmisión vertical en bovinos (100). Sin embargo, los linfocitos T CD4+ predominaron sobre los linfocitos T CD8+ (células citotóxicas) en linfonódulos maternos y fetales de bovinos inoculados experimentalmente a los 140 días de gestación (15).
Experimentos realizados con ratones han permitido caracterizar no sólo la IMC sino también la dinámica de las citocinas durante las infecciones por N. caninum. La susceptibilidad de estas especies puede ser aumentada mediante la neutralización de IL-12 e IFN-g (65). La producción de IL-12 y luego IFN-g, resulta un hallazgo constante luego de las infecciones experimentales (49, 64). Sin embargo, la IL-12 no fue capaz de impedir el progreso de la enfermedad (18). Por otro lado, se ha mencionado que la neutralización de la IL-4 sumado a la inoculación de una cepa no virulenta de N. caninum y posterior desafío con una cepa virulenta, logró reducir la transmisión vertical en ratones (69, 70). La IL-10, también involucrada en la respuesta Th2, ha sido asociada a la depleción de IFN-g presente en ratones susceptibles a N. caninum (65).
La información acerca del rol de las citocinas en respuesta a las infecciones por N. caninum en bovinos es escasa. No obstante, algunos estudios (1, 6, 7, 8, 114) indican que los mecanismos asociados a la respuesta Th1 con producción de IFN-g e IgG2 sería la adecuada para controlar la infección. Es necesario establecer si este tipo de respuesta resulta negativa durante la preñez. La modulación de las citocinas podría ser un mecanismo estratégico para la prevención de la transmisión vertical y el aborto.
Finalmente, resulta de interés el rol del óxido nítrico (ON); este metabolito, originado a partir de nitrógeno y producido por macrófagos activados, tiene diversas funciones entre las cuales se mencionan la inmunosupresión y la destrucción de parásitos intracelulares (107). La adición de un inhibidor del ON a células del bazo de ratones infectados estimuló la respuesta IMC específica e inespecífica (65). En contraste, ratones deficientes en óxido nítrico sintetasa, enzima que produce ON, son susceptibles a N. caninum (102).
Inmunidad, gestación e infección por N. caninum
Las infecciones con parásitos Apicomplexa tienen efectos nocivos para la preñez (21). Sin embargo, existen dos posturas controversiales que explican la fisiopatología de aborto causado por protozoos intracelulares. Primero, la preñez favorecida por una respuesta Th2 compromete la resistencia al parásito ocasionándose parasitemia e infección transplacentaria. Segundo, una eficiente respuesta Th1 hacia el parásito podría comprometer la preñez (90). Un reciente trabajo que caracterizó la expresión génica de citoquinas en fetos y vaquillonas inoculadas a los 110 días de gestación describe que existió un balance entre las respuestas Th1/Th2 (1). En dicho estudio se sugiere que la infección del huésped podría ser favorecida por la expresión de IL-4 e IL-10 (respuesta Th2).
Los posibles mecanismos por los cuales Leishmania major o Plasmodium falciparum causan abortos están sustentados en los desbalances entre la respuesta inmune Th1 y Th2 a favor de la primera (90). T. gondii tiene un efecto adverso sobre la preñez, sin embargo la infección está relacionada al momento de la gestación. Este parásito no es transmitido congénitamente en mujeres y ovejas crónicamente infectadas (93); sin embargo, especies de roedores como Mus musculus y Apodemus sylvaticus transmiten el protozoo en forma vertical cuando poseen quistes tisulares (86). Roberts y col. (93) proponen que la madre puede controlar la infección durante el 1° trimestre debido a que tiene una respuesta Th1 bien establecida, siendo bajos los niveles de progesterona y la respuesta Th2. Por otro lado, la transmisión vertical ocurre durante el 3° trimestre cuando los altos niveles de progesterona asociada a la respuesta Th2 son incapaces de controlar el protozoo. En contraste, un reciente trabajo menciona que la reactivación parasitaria sería expontánea e independiente de la respuesta inmune (92). Sin embargo, ese mismo trabajo sugiere que el ambiente presente en la interfase materno-fetal favorecería el pasaje de N. caninum a través de la placenta.
Durante un brote de abortos ocasionado por N. caninum, las vacas crónicamente infectadas resultaron menos propensas a sufrir pérdidas reproductivas que vacas infectadas recientemente, siendo baja la avidez de la IgG en este último grupo (79). En contraste, se ha mencionado que la baja avidez de anticuerpos no necesariamente está asociada con una reciente infección por N. caninum aunque puede ser un indicador de riesgo de aborto (95).
Investigando la dinámica de anticuerpos en vacas infectadas con N. caninum a lo largo de la gestación, Paré y col. (88) describieron que aquellos animales con altos títulos séricos hacia el final del período de gravidez parían terneros clínicamente normales pero congénitamente infectados. Sin embargo, cuando los títulos séricos se incrementaban durante la mitad de la gestación existían altas probabilidades que se produzca el aborto (53, 88). Adicionalmente, en otros estudios se postuló que la respuesta inmune de vacas preñadas infectadas naturalmente está asociada a la parasitemia, existiendo una elevación en la concentración de anticuerpos 4-5 meses antes de la parición (53, 101).
Se ha sugerido que los estrógenos placentarios incrementados durante la mitad de la gestación bovina tendrían efectos negativos sobre la IMC favoreciendo tanto la reactivación de bradizoítos como así también la parasitemia (90). Como contraparte, otros autores atribuyen un efecto inmunosupresor debido a los elevados niveles de progesterona existentes desde los primeros meses de la gestación hasta semanas antes del parto (60).
La transmisión congénita de N. caninum o la ocurrencia del aborto en bovinos está relacionada con el momento de la gestación en que la madre es infectada (114). En ese estudio, las vacas infectadas antes de la preñez no transmitieron la enfermedad a su descendencia. Las vacas infectadas en el 7° mes de gestación parieron terneros vivos congénitamente infectados. Por último, en el grupo de vacas infectadas durante el 3° mes de gestación, murieron 5 de 6 fetos (114). Otro trabajo, en el cual hembras bovinas gestantes fueron infectadas con N. caninum a los 70, 140 y 210 días de gestación, determinó una sólida respuesta IMC en los animales desafiados tempranamente (55). Todos los terneros nacidos de estas vacas resultaron seronegativos y no hubo evidencia de respuesta IMC. Sin embargo, los terneros nacidos de hembras desafiadas a los 140 y 210 días de gestación fueron seropositivos y existió una respuesta IMC positiva detectada en CMSP, células del bazo y células de ganglios hepáticos, mesentéricos y retro-faríngeos. Estos resultados sugieren que la IMC de vacas preñadas desafiadas durante el 1° tercio de la gestación protegen de la infección fetal. Como contraparte, la infección fetal tendría lugar durante el 2° y 3° tercio siendo factible el aborto y el nacimiento de terneros congénitamente infectados, respectivamente (55).
La infección por N. caninum, acompañada por incrementos en los niveles de IFN-g ha sido postulada como mecanismo fisiopatológico del aborto (62, 114). Otros autores sostienen que la limitada producción de IFN-g en respuesta a la presencia de IL-10 secretada por las células del trofoblasto, impediría el control de la multiplicación de N. caninum durante la preñez (49). Asimismo la reactivación de los bradizoítos desde los lugares de latencia podría deberse al descenso de los niveles de IFN-g (49).
Estudios realizados en fetos bovinos infectados experimentalmente con N. caninum a los 159 y 169 días de gestación, evidenciaron que la IMC determinada por pruebas de linfoproliferación y producción de IFN-g fue variable entre los fetos (8). En dicho trabajo, no existió correlación entre la respuesta celular y la severidad de las lesiones fetales (8). Se encontró que la producción de citocinas e IFN-g estuvo asociada a una respuesta celular tipo 1 en 4 de los 5 fetos en estudio (8). Además, una respuesta predominantemente tipo 2 fue indicada por la presencia de IgG1 específica a N. caninum. Se sugirió que un desbalance entre las respuestas celulares 1 y 2, a favor de la tipo 2, con producción de IL-4, ocurrió en los fetos que tuvieron limitada capacidad para resolver la infección (8).
Aunque el número de macrófagos presentes en la interfase materno fetal se incrementa notablemente en el 3° tercio de la preñez (98), durante dicho período es común el nacimiento de terneros congénitamente infectados (114). Recientemente, Maley et al., (72) han propuesto que las severas lesiones observadas en la placenta explicarían la patogénesis del aborto causado por N. caninum.
Resumiendo, luego que una hembra bovina ingiere ooquistes o sufre una reactivación, los factores que influencian la infección fetal serían el modo de infección de la madre, el momento de la gestación, la respuesta inmune materna y la respuesta inmune del feto (62). Así, un balance a favor de una respuesta Th1 durante el primer trimestre de la gestación bovina controlaría la infección pero resultaría nociva en la interfase materno fetal. Por otra parte, la modulación a favor de una respuesta inmune Th2 observada en el segundo trimestre de la gestación no permitiría controlar la infección y el parásito ocasionaría lesiones inflamatorias no sólo en la placenta sino también en el feto (62). Durante el tercer trimestre se observaría infección congénita siendo menor la probabilidad de observarse un aborto debido a la maduración del sistema inmune fetal (62). Considerando que la mayoría de los abortos observados naturalmente ocurren entre el tercer y sexto mes de gestación, la fisiopatología del aborto por N. caninum se explicaría por la incapacidad de controlar la infección debido a una respuesta inmune tipo Th2 durante el segundo tercio de la gestación. Asimismo, los abortos durante el primer tercio asociados a una exacerbada respuesta inmune Th1 han sido observados sólo en reproducciones experimentales (114) o en ratones (31) quedando aún por demostrase que altos niveles de IFN-g y bajos niveles de IL4 son suficientes eventos como para causar abortos en el bovino. Al respecto, aunque los terneros hijos de vaquillonas naturalmente infectadas nacieron congénitamente infectados, no se observaron abortos siendo adecuados los niveles de IFN-g durante el segundo trimestre de la gestacion (84).
Signos clínicos
Los abortos son observados entre el 3° y 9° mes de la gestación aunque con mayor frecuencia en el tercio medio (2). El feto muerto en el útero puede ser reabsorbido, momificado, o expulsado con avanzado grado de autólisis. Más comúnmente ocurre el nacimiento de terneros clínicamente normales pero crónicamente infectados. Aunque no es patognomónico, la momificación es un hallazgo frecuente, habiéndose descripto en casos naturales (116) y experimentales (14). Los terneros infectados en el útero pueden tener signos neurológicos y bajo peso al nacimiento (13, 43). El examen clínico puede revelar ataxia, disminución del reflejo patelar o falta de sensibilidad propioceptiva (40); sin embargo, son escasos los trabajos que describen esta forma de la enfermedad en neonatos. Eventualmente pueden presentarse anormalidades congénitas como exoftalmia o asimetría ocular (27).
Epidemiología e impacto económico de la infección por N. caninum
La enfermedad ha sido diagnosticada en razas de bovinos para leche y para carne en Europa, África, Australia, Nueva Zelanda y América (40). En Inglaterra se considera que se producen 6000 abortos anuales debido a N. caninum y, asignándole una pérdida de 800 dólares americanos por cada aborto, se pierden aproximadamente 4,8 millones de dólares (22). En California, EE.UU., las pérdidas anuales serían de 35 millones de dólares y en Australia 85 millones de dólares en la industria lechera y 25 millones de dólares para la producción de carne (22). Si bien existen datos epidemiológicos acerca de la neosporosis en otros países de Latinoamérica (41, 42), no se dispone información acerca de las pérdidas económicas causada por N. caninum para esa región.
Situación en la Argentina
Los primeros trabajos en el país acerca de la neosporosis permitieron identificar vacas serorreactoras (110). Posteriormente, se confirmó su presencia mediante inmunohistoquímica (IHQ) en tejidos fetales, (27) y por inoculación en ratones (9). Otros relevamientos seroepidemiológicos en las provincias de Santa Fe y Córdoba detectaron una prevalencia del 15 al 27,5% en 320 bovinos lecheros, siendo positivos los 8 rodeos en estudio (47). En fetos provenientes de frigoríficos, se encontró que 20 de 82 (24%) y 1 de 22 (4,5%) especímenes de rodeos para leche y para carne, respectivamente, tenían anticuerpos a N. caninum (111). La distribución de la enfermedad ha sido parcialmente caracterizada, estableciéndose que 52,9% de 17 rodeos para carne y 92,3% de 52 rodeos para leche tuvieron al menos 1 animal seropositivo (81). En dicho trabajo se postuló que la diferente situación epidemiológica podía tener su explicación en los sistemas de producción existentes. Aunque puede existir asociación entre la prevalencia de N. caninum y el tipo de explotación considerado; el potencial de dicho agente como etiología de importantes pérdidas reproductivas ha sido destacado en rodeos bovinos para carne (83). Investigando las causas de aborto en Argentina se involucró a N. caninum en 7,3% de 354 casos (29).
Para una mejor caracterización de la situación epidemiológica regional, otras técnicas serológicas deberían ser aplicadas. Utilizando sueros bovinos, los resultados de un enzimo inmuno ensayo indirecto (ELISA, del término sajón enzyme-linked immunoassay) tuvieron buena concordancia con aquellos obtenidos mediante inmunofluorescencia indirecta (IFI) (48).
Trabajos tendientes a lograr el aislamiento de N. caninum a partir de homogeneizados de SNC de fetos bovinos abortados han permitido identificar quistes de N. caninum en el SNC de ratones (Mus musculus) y meriones (Meriones unguiculatus) inoculados con tejido cerebral de fetos bovinos y terneros prematuros infectados (112, 113). N. caninum ha sido aislada desde la materia fecal de un canino infectado naturalmente, demostrando el rol espontáneo de esta especie como hospedador definitivo (16). Por otro lado, recientemente se ha informado que 44% de 84 zorros (Dusicyon culpaeus y Dusicyon griseus) resultaron seropositivos N. caninum (75) restando por demostrarse la posibilidad que estas especies se comporten como hospedadores definitivos.
En rodeos para leche de nuestro país se han estimado las pérdidas en unos 80 millones de dólares por año considerando el costo por abortos, la reposición por eliminación de vientres seropositivos, el intervalo parto concepción y la menor producción láctea de la vaquillona en su primera lactancia (Campero y Odeón, datos no publicados).
Diagnóstico
La infección por N. caninum puede demostrarse mediante la utilización de pruebas inmunodiagnósticas, por técnicas histopatológicas, moleculares y de aislamiento (41, 42). Las pruebas inmunodiagnósticas disponibles son la inmunofluorescencia indirecta (IFI), ELISA, aglutinación directa, inmunohistoquímica (IHQ) y electroforesis combinada con inmunodetección (Western Immunblot) (40, 41). La histopatología y la IHQ realizadas en tejidos bovinos fetales son técnicas diagnósticas relevantes en las infecciones por N. caninum (5). El diagnóstico presuntivo de aborto por N. caninum puede emitirse ante la presencia de lesiones como meningoencefalitis necrotizante multifocal (MENM), miocarditis, miositis, nefritis, hepatitis, neumonía y adrenalitis focales no supurativas caracterizadas por la presencia de células mononucleares (5). La presencia del parásito en dichas lesiones puede confirmarse mediante IHQ realizada sobre tejidos fetales formolados (5). Aunque su sensibilidad es baja, probablemente debido a los escasos parásitos presentes en tejidos autolizados, resulta una técnica diagnóstica vigente (5).
Por otro lado, el impacto de la técnica de PCR ha sido notable, permitiendo esclarecer ciertos aspectos epidemiológicos (40, 41, 42). Debido a la alta eficiencia que tiene N. caninum para transmitirse en forma vertical, los resultados positivos por IHQ o PCR deberán estar siempre asociados a problemas reproductivos y utilización de otras técnicas diagnósticas, no sólo para identificar dicho protozoo sino también para descartar otras causas de aborto. El aislamiento de N. caninum es difícil y costoso como técnica diagnóstica (33), sin embargo se han lograron aislamientos en regiones ganaderas de todo el mundo (42).
Tratamiento y prevención
Existe información acerca de la sensibilidad in vitro de N. caninum a ciertos antimicrobianos (67). De un total de 43 substancias probadas, 17 ocasionaron una reducción total del número de taquizoítos cultivados in vitro (67). Dentro de las drogas más efectivas están la clindamycina, diclazuril, robenidina y pyrimethamina. La eficacia de dichas drogas en bovinos no ha sido aún estudiada. Recientemente, se ha informado que utilizando toltrazuril y ponazuril, los cuales son derivados de una droga llamada triazinona utilizada en el tratamiento de las coccidiosis en mamíferos, se logró disminuir las lesiones cerebrales de terneros inoculados experimentalmente (52). Actualmente no existe tratamiento en los bovinos que los libere de la enfermedad (5).
La transferencia embrionaria (TE) es una técnica adecuada para evitar la transmisión vertical de la enfermedad (10, 28, 66, 105). A los fines de evitar la infección postnatal de los bovinos se ha recomendado impedir el acceso de los perros a las fuentes de agua, pasturas, galpones y silos donde se almacene alimento (5, 41). Es importante también recolectar y eliminar fetos abortados y placentas para evitar la infección de los caninos (105).
Perspectivas para la vacunación en la neosporosis bovina
Si bien las pérdidas reproductivas pueden presentarse más de una vez en gestaciones subsiguientes, las tasas de repetición del aborto por neosporosis son relativamente bajas (<5%) (3, 116). Estudios no sólo experimentales (115) sino también de campo (79) avalan la presencia de mecanismos inmunes que protegen contra el aborto en bovinos crónicamente infectados. La tasa de infección vertical en ratones infectados en forma aguda o crónica fue menor en el segundo grupo y disminuyó en sucesivas preñeces (92). Si bien se ha logrado inducir el aborto cuando la inoculación experimental se realizó en vacas libres de infección (114), dicho evento no fue observado cuando el desafío se realizó a las 10 semanas de gestación en vacas naturalmente infectadas (115). Aunque un inmunógeno capaz de inducir una respuesta inmune comparable a la observada en bovinos crónicamente infectados no evitaría la infección y/o la transmisión vertical, podría resultar de interés para evitar el aborto. En un reciente estudio, la respuesta inmune humoral y celular generada por la inoculación de taquizoítos inactivados en vaquillonas Holando Argentino durante el 2º tercio de la gestación, fue comparada con aquella observada en animales similares crónicamente infectados (84). Las respuestas inmunes observadas en ambos grupos resultaron similares en términos de la generación de anticuerpos específicos y producción de IFN-g. Sin embargo, también se observaron desiguales relaciones entre IgG1 e IgG2 en animales inoculados con taquizoítos inactivados de N. caninum comparados con aquellas observadas en animales infectados naturalmente sugiriéndose que los mecanismos inmunes desencadenados fueron diferentes (84).
Para evitar la infección postnatal posiblemente sea necesario el desarrollo de vacunas orales capaces de generar una respuesta inmune a nivel de mucosa gastrointestinal. Dicha respuesta podría limitar el acceso de los esporozoítos a los sistemas linfáticos y gastrointestinal.
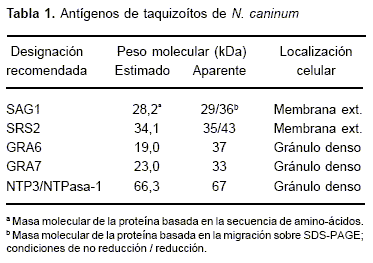
Diversos antígenos, tales como SAG1, SRS2, GRA2, GRA6 o GRA7, NTP3/NTPASA, los cuales han sido asociados a los gránulos densos, micronemas y otras proteínas de superficie de los taquizoítos (Tabla 1), serían capaces de inducir una respuesta inmune de protección (63). Diversos clones de ADN pertenecientes a estos antígenos han sido descriptos y permitirán el desarrollo de vacunas a sub-unidades (63).
La existencia de una vacuna viva atenuada de T. gondii (Toxovax®) para controlar la toxoplasmosis ovina (23, 39), alienta el desarrollo de un inmunógeno similar para la neosporosis bovina. Sin embargo, la vacunación de ovejas preñadas con Toxovax® no protege del aborto ante el desafío con N. caninum (61). Por otro lado, la vacunación con N. caninum protege a los ratones cuando el desafío es realizado con una cepa virulenta de T. gondii (68).
Cuando se infectaron ovejas con N. caninum durante la mitad de la gestación, aquel grupo de animales que había sido desafiado antes de la preñez tuvo un 50% de fetos vivos (24). Asimismo, el aborto inducido experimentalmente con taquizoítos de N. caninum en bovinos fue evitado inoculando dicho protozoo antes de la preñez (60).
Habría ventajas y desventajas al usar una vacuna viva o una vacuna inactivada en la neosporosis bovina. Al utilizar una vacuna viva, el protozoo replicaría dentro de las células ocasionando que el antígeno parasitario sea presentado con antígenos del CMH (Complejo Mayor de Histocompatibilidad) clase 1 quedando satisfecha la estimulación de linfocitos T CD8+, los cuales son importantes en los mecanismos de protección (64). Al aplicar una vacuna inactivada, por ejemplo taquizoítos de N. caninum, se estaría estimulando el procesamiento de un antígeno exógeno. Por el contrario, en la enfermedad natural se generaría el procesamiento de antígenos endógenos por ser N. caninum un parásito intracelular obligado, siendo de esta manera disímil la respuesta celular generada. Sin embargo, queda por dilucidarse si una vacuna, aun siendo inactivada, no protege contra el aborto en rodeos naturalmente expuestos. Más aún, existen graves desventajas al usar una vacuna viva existiendo posibilidad de ocasionar infección crónica y transmisión vertical persistente.
La seguridad e inocuidad de una vacuna inactivada debería compensarse con el desarrollo de un apropiado adyuvante con adecuado sistema de liberación que garantice una buena respuesta inmune. Choromanski y Block (30) han descrito que un inmunógeno inactivado genera altos títulos de anticuerpos séricos, siendo inocuo y seguro. Una vacuna inactivada con Havlogen como adyuvante (NeoGuard®) ha sido recientemente aprobada por el Departamento de Agricultura de los EE.UU. Un laboratorio privado (Intervet) describe en su boletín técnico que la vacuna es segura para su uso en bovinos preñados sanos. En uno de sus ensayos, vaquillonas preñadas vacunadas con 2 dosis a los 56 y 77 días de gestación en forma subcutánea (SC) fueron posteriormente desafiadas con un inóculo intramuscular a los 95 días de gestación. El grupo de 18 animales sin inmunizar tuvo una tasa de abortos del 22%. Las 18 vaquillonas inmunizadas tuvieron terneros vivos y sanos. Como contrapartida, otro trabajo demostró que aquel inmunógeno no previene la transmisión vertical de N. caninum en bovinos (62). Recientemente, los efectos de la vacunación fueron evaluados en novillos engordados en corrales. Después de la vacunación existió un aumento transitorio del consumo y ganancia diaria de peso en el grupo tratado. Asimismo, no hubo diferencia en el rendimiento, peso vivo o peso y calidad de la res (11). Romero y col. (94) describieron una significante reduccción en la tasa de abortos utilizando una vacuna comercial (1º dosis aplicada entre los 75 y 90 días de gestación y 2º dosis con 30 días de intervalo) en rodeos lecheros de Costa Rica. La tasa de abortos fue 11,2% (49/438) y 20,8% (91/438) en animales vacunados y animales que recibieron un placebo, respectivamente (94).
Los actuales inmunógenos comerciales ocasionan la producción de anticuerpos anti-N. caninum los cuales no pueden ser diferenciados de aquellos producidos en infecciones naturales. Más aún, existe controversia debido a la utilización de la vacuna debido a que la eliminación de animales seropositivos a la enfermedad ha sido sugerido como medida de control (105). Es necesario establecer programas nacionales de saneamiento tendientes a reglamentar el uso de inmunógenos y/o medidas de control.
La neosporosis bovina tiene aún numerosos enigmas debido a la excelente adaptación del parásito a su huésped. Aunque se han dilucidado numerosos aspectos de la biología de N. caninum, la neosporosis constituye aún un gran desafío para parasitólogos, inmunólogos y veterinarios. Es necesaria la comprensión de los mecanismos inmunes desencadenados en las infecciones por N. caninum para desarrollar inmunógenos que eviten las pérdidas reproductivas o la transmisión de la enfermedad.
Agradecimientos: Al Consejo Nacional de Investigaciones Científicas y Técnicas de la República Argentina y a la Fundación Antorchas por el financiamiento otorgado a D.P. Moore durante su Formación de Postgrado y Beca Postdoctoral, respectivamente. La presente Revisión Bibliográfica es parte de la Introducción de la Tesis Doctoral enviada por D.P. Moore a la Facultad de Ciencias Veterinarias de la Universidad Nacional de La Plata, Argentina.
BIBLIOGRAFÍA
1. Almeria S, De Marez T, Dawson H, Araujo R, Dubey JP, Gasbarre LC (2003) Cytokine gene expression in dams and foetuses after experimental Neospora caninum infection of heifers at 110 days of gestation. Parasite Immunol. 25: 383-392. [ Links ]
2. Anderson ML, Blanchard PC, Barr BC, Dubey JP, Hoffman RL, Conrad PA (1991) Neospora-like protozoan infection as a major cause of abortion in California dairy cattle. J. Am. Vet. Assoc. 198: 241-244. [ Links ]
3. Anderson ML, Palmer CW, Thurmond MC (1995) Evaluation of abortions in cattle attributable to neosporosis in selected dairy herds in California. J. Am. Vet. Med. Assoc. 207: 1206-1210. [ Links ]
4. Anderson ML, Reynolds JP, Rowe JD, Packham AE, Barr BC, Conrad PA (1997) Evidence of vertical transmission of Neospora sp. infection in dairy cattle. J. Am. Vet. Med. Assoc. 210: 1169-1172. [ Links ]
5. Anderson ML, Andrianarivo AG, Conrad PA (2000) Neosporosis in cattle. An. Reprod. Sci. 60-61: 417-431. [ Links ]
6. Andrianarivo AG, Choromanski L, McDonough SP, Packham AE, Conrad PA (1999) Immunogenicity of a killed whole Neospora caninum tachyzoite preparation formulated with different adjuvants. Int. J. Parasitol. 29: 1613-1625. [ Links ]
7. Andrianarivo AG, Rowe JD, Barr BC, Anderson ML, Packham AE, Sverlow KW, et al. (2000) A POLYGEN tm - adjuvanted killed Neospora caninum tachyzoite preparation failed to prevent foetal infection in pregnant cattle following i.v./i.m. experimental tachyzoite challenge. Inter. J. Parasitol. 30: 985-990. [ Links ]
8. Andrianarivo AG, Barr BC, Anderson ML, Rowe JD, Packham AE, Sverlow KW, Conrad PA (2001) Immune responses in pregnant cattle and bovine fetuses following experimental infection with Neospora caninum. Parasitol. Res. 87: 817-825. [ Links ]
9. Bacigalupe D, Venturini MC, Unzaga JM, Machuca M, Alvarez ML, Di Lorenzo C, et al. (1998) Infecciones transplacentarias por Neospora caninum en bovinos. Memorias XVI Congreso Panamericano de Ciencias Veterinarias. p. 143. Santa Cruz de la Sierra. Bolivia. [ Links ]
10. Baillargeon P, Fecteau G, Paré J, Lamothe P, Sauvé R (2001) Evaluation of the embryo transfer procedure proposed by the International Embryo Transfer Society as a method of controlling vertical transmission of Neospora caninum in cattle. J. Am. Vet. Med. Assoc. 218: 1803-1806. [ Links ]
11. Barling KS, Lunt DK, Graham SL, Choromanski LJ (2003) Evaluation of an inactivated Neospora caninum vaccine in beef feedlot steers. J. Am. Vet. Med. Assoc. 222: 624-627. [ Links ]
12. Barr BC, Anderson ML, Dubey JP, Conrad PA (1991) Neospora-like protozoal infections associated with bovine abortions. Vet. Pathol. 28: 110-116. [ Links ]
13. Barr BC, Conrad PA, Breitmeyer R, Sverlow K, Anderson ML, Reynolds J, et al. (1993) Congenital Neospora infection in calves born from cows that had previously aborted Neospora-infected fetuses: four cases 1990-1992. J. Am. Vet. Med. Assoc. 202: 113-117. [ Links ]
14. Barr BC, Rowe JD, Sverlow KW, BonDurant RH, Ardans AA, Oliver MN, Conrad P.C (1994) Experimental reproduction of bovine fetal Neospora infection and death with a bovine Neospora isolate. J. Vet. Diagn. Invest. 6: 207-215. [ Links ]
15. Bartley PM, Kirvar E, Wright S, Swales C, Esteban-Redondo I, Buxton D, et al. (2004) Maternal and fetal immune responses of cattle inoculated with Neospora caninum at mid-gestation. J. Comp. Path. 130: 81-91. [ Links ]
16. Basso W, Venturini L, Venturini MC, Hill DE, Kwok OC, Shen SK, et al. (2001) First isolation of Neospora caninum from the feces of a naturally infected dog. J. Parasitol. 87: 612-618. [ Links ]
17. Basso W, Venturini L, Venturini MC, Moore DP, Rambeau M, Unzaga JM, et al. (2001b) Prevalence of Neospora caninum infection in dogs from beef-cattle farms, dairy farms, and from urban areas of Argentina. J. Parasitol. 87: 906-907. [ Links ]
18. Baszler TV, Long MT, McElwain TF, Mathison BA (1999) Interferon-g and interleukin-12 mediate protection to acute Neospora caninum infection in BALB/c mice. Int. J. Parasitol. 29: 1635-1646. [ Links ]
19. Bjerkas I, Mohn SF, Presthus J (1984) Unidentified cystforming sporozoon causing encephalomyelitis and myositis in dogs. Z. Parasitenkd. 70: 271-274. [ Links ]
20. Björkman C, Näslund K, Stenlund S, Maley SW, Buxton D, Uggla A (1999) An Ig. G avidity ELISA to discriminate between recent and chronic Neospora caninum infection. J. Vet. Diagn. Invest. 11: 41-44. [ Links ]
21. Brabin L, Brabin BJ (1992) Parasitic infections in women and their consequences. Adv. Parasitol. 31: 1-81. [ Links ]
22. Brittain R (2000) A review of current reports on bovine neosporosis. Association Europenne Transfert Embryonnaire. Newsletter. 11: 8-10. [ Links ]
23. Buxton D, Innes EA (1995) A commercial vaccine for toxoplasmosis. Parasitol. 110: 11-16. [ Links ]
24. Buxton D, Maley SW, Thompson KM, Trees AJ, Innes EA (1997) Experimental infection of non-pregnant and pregnant sheep with Neospora caninum. J. Comp. Path. 117: 1-16. [ Links ]
25. Buxton D, McAllister MM, Dubey JP (2002) The comparative pathogenesis of neosporosis. Trends Parasitol. 18: 546-552. [ Links ]
26. Caetano-da-Silva A, Ferre I, Collantes-Fernández E, Navarro V, Aduriz G, Ugarte-Garagalza C, et al. (2004) Occasional detection of Neospora caninum DNA in frozen extended semen from naturally infected bulls. Theriogenology. 62: 1329-1336. [ Links ]
27. Campero CM, Anderson ML, Conosciuto G, Odriozola H, Bretschneider G, Poso MA (1998) Neospora caninum associated abortion in dairy herd in Argentina. Vet. Rec. 143: 228-229. [ Links ]
28. Campero CM, Moore DP, Lagomarsino H, Odeón AC, Castro M, Visca H (2003a) Serological status and abortion rate in progeny obtained by natural service or embryo transfer from Neospora caninum-seropositive cows. J. Vet. Med. Series B. 50: 458-460. [ Links ]
29. Campero CM, Moore DP, Odeón AC, Cipolla AL, Odriozola E (2003b) Aetiology of bovine abortion in Argentina. Vet. Res. Com. 27: 359-369. [ Links ]
30. Choromanski L, Block W (2000) Humoral immune responses and safety of experimental formulations of inactivated Neospora-vaccines. Parasitol. Res. 86: 851-853. [ Links ]
31. Clark DA, Croitoru K (2001) Th1/Th2, 3 imbalance due to cytokine-producing NK, gamma delta T and NK-gamma-delta T cells in murine pregnancy decidua in success or failure of pregnancy. Am. J. Reprod. Immunol. 45: 257-265. [ Links ]
32. Clark DA, Arck PC, Chaouat G (1999) Why did your mother reject you? Immunogenetic determinants of the response to environmental selective pressure expressed at the uterine level. Am. J. Reprod. Immunol. 41: 5-22. [ Links ]
33. Conrad PA, Barr BC, Sverlow KW, Anderson M, Daft M, Kinde H, et al. (1993) In vitro isolation and characterization of a Neospora sp from aborted bovine fetuses. Parasitol. 106: 239-249. [ Links ]
34. Dannatt LC (1998) Neospora caninum antibody levels in an endemically-infected dairy herd. Irish Vet. J. 52: 200-201. [ Links ]
35. Davison HC, Guy CS, Mcgarry JW, Guy F, Williams DJ, Kelly DF, Trees AJ (2001) Experimental studies on thetransmission of Neospora caninum between cattle. Res. Vet. Sci. 70: 163-168. [ Links ]
36. De Marez T, Liddell S, Dubey JP, Jenkins MC, Gasbarre L (1999) Oral infection of calves with Neospora caninum oocysts from dogs: humoral and cellular immune responses. Int. J. Parasitol. 29: 1647-1657. [ Links ]
37. Dijkstra T, Barkema HW, Eysker M, Wouda W (2001) Evidence of post-natal transmission of Neospora caninum in Dutch dairy herds. Inter. J. Parasitol. 31: 209-215. [ Links ]
38. Dijkstra T, Barkema HW, Björkman C, Wouda W (2002) A high rate of seroconversion for Neospora caninum in a dairy herd without an obvious increased incidence of abortions. Vet. Parasitol. 109: 203-211. [ Links ]
39. Dubey JP (1994) Toxoplasmosis. J. Am. Vet. Med. Assoc. 205: 1593-1598. [ Links ]
40. Dubey JP (1999a) Neosporosis in cattle: biology and economic impact. J. Am. Vet. Med. Assoc. 214: 1160-1163. [ Links ]
41. Dubey JP (1999b) Recent advances in Neospora and neosporosis. Vet. Parasitol. 84: 349-367. [ Links ]
42. Dubey JP (2003) Neosporosis in cattle. J. Parasitol. 42-56. [ Links ]
43. Dubey JP, Lindsay DS (1996) A review of Neospora caninum and Neosporosis. Vet. Parasitol. 67: 1-59. [ Links ]
44. Dubey JP, Carpenter JL, Speer CA, Topper MJ, Uggla A (1988) Newly recognized fatal protozoan disease of dogs. J. Am. Vet. Med. Assoc. 192: 1269-1285. [ Links ]
45. Dubey JP, Lindsay DS, Anderson ML, Davis SW, Shen SK (1992) Induced transplacental transmission of Neospora caninum in cattle. J. Am. Vet. Med. Assoc. 201: 709-713. [ Links ]
46. Dubey JP, Barr BC, Barta JR, Bjerkas I, Björkman C, Blagburn BL, et al. (2002) Redescription of Neospora caninum and its differentiation from related coccidian. Int. J. Parasitol. 32: 929-946. [ Links ]
47. Echaide IE, Valentini B, Baszler TV (1998) Detección de anticuerpos contra Neospora caninum en bovinos de la cuenca lechera de Santa Fe y Córdoba. Resultados preliminares. XII Reunión Científico Técnica, Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico. p. 71.Mar del Plata, Argentina. [ Links ]
48. Echaide I, Valentini B, Mondino D, Torioni S (2002) Neosporosis bovina: análisis seroepidemiológico de un hato lechero mediante IFA y ELISA. XIV Reunión Científico Técnica, Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico. PAR-01.Villa General Belgrano, Córdoba, Argentina. [ Links ]
49. Eperon S, Bronnimann K, Hemphill A, Gottstein B (1999) Susceptibility of B-cell deficient C57BL/6 (MT) mice to Neospora caninum infection. Parasite Immunol. 21: 225-236. [ Links ]
50. Fuchs N, Sonda S, Gottstein B, Hemphill A (1998) Differential expression of cell surface and dense granule associated Neospora caninum proteins in tachyzoites and bradyzoites. J. Parasitol. 84: 753-758. [ Links ]
51. Gondim LF, McAllister MM, Pitt WC, Zemlicka DE (2004) Coyotes (Canis latrans) are definitive hosts of Neospora caninum. Int. J. Parasitol. 34: 159-161. [ Links ]
52. Gottstein B, Kritsner S, Cannas A, Sager H, Greif G (2001) Toltrazuril and ponazuril for treatment of experimental murine and bovine neosporosis. 18th International Conference of the World Association for the Advancementof Veterinary Parasitology, Resumen B9. Stresa, Italia. [ Links ]
53. Guy CS, Williams DJL, Kelly DF, McGarry JW, Guy F, Björkman C, et al. (2001) Neospora caninum in persistently infected pregnant cows: spontaneous transplacental infection is associated with an acute increase in maternal antibody. Vet. Rec. 149: 443-449. [ Links ]
54. Hemphill A (1999) The host-parasite relationship in neosporosis. Adv. Parasitol. 43: 47-104. [ Links ]
55. Hemphill A, Gottstein B, Conraths FJ, De Meerschman F, Ellis JT, Innes EA, et al. (2000) A European perspective on Neospora caninum. Inter. J. Parasitol. 30: 877-924. [ Links ]
56. Hietala SK, Thurmond MC (1999) Postnatal Neospora caninum transmission and transient serologic responses in two dairies. Int. J. Parasitol. 29: 1669-1676. [ Links ]
57. Hill JA, Polgar K, Anderson DJ (1995) T-helper 1-type immunity to trophoblast in women with recurrent spontaneous abortion. J. Am. Med. Assoc. 273: 1933-1936. [ Links ]
58. Hunter CA, Reiner SL (2000) Cytokines and T cells in host defense. Curr. Opin. Immunol. 12: 413-418. [ Links ]
59. Innes EA, Panton WR, Marks J, Trees AJ, Holmdahl J, Buxton D (1995) Interferon gamma inhibits the intracellular multiplication of Neospora caninum, as shown by incorporation of 3H Uracil. J. Comp. Path. 113: 95-100. [ Links ]
60. Innes EA, Wright SE, Maley SW, Rae A, Schock A, Kirvar E, et al. (2001a) Protection against vertical transmission in bovine neosporosis. Int. J. Parasitol. 31: 1523-1534. [ Links ]
61. Innes EA, Lunden A, Esteban I, Marks J, Maley SW, Wright S, et al. (2001b) A previous infection with Toxoplasma gondii does not protect against a challenge with Neospora caninum in pregnant sheep. Parasite Immunol. 23: 121-132. [ Links ]
62. Innes EA, Andrianarivo AG, Björkman C, Williams DJL, Conrad PA (2002) Immune responses to Neospora caninum and prospects for vaccination. Trends Parasitol. 18: 497-504. [ Links ]
63. Jenkins MC (2001) Advances and prospects for subunit vaccines against protozoa of veterinary importance. Vet. Parasitol. 101: 291-310. [ Links ]
64. Kaspar LH, Khan IA. (1998) Antigen-specific CD8+ T-cells protect against lethal toxoplasmosis in mice infected with Neospora caninum, Infect. Immun. 66: 1554-1560. [ Links ]
65. Khan IA, Schwartzman JD, Fonseka S, Kasper LH (1997) Neospora caninum: role for immune cytokines in host immunity. Exp. Parasitol. 85: 24-34. [ Links ]
66. Landmann JK, Jillella D, O'Donoghue PJ, McGowan MR (2002) Confirmation of the prevention of vertical transmission of Neospora caninum in cattle by the use of embryo transfer. Aust. Vet. J. 80: 502-503. [ Links ]
67. Lindsay, DS, Rippey NS, Cole RA, Parsons LC, Dubey JP, Tidwell RR, Blagburn BL (1994) Examination of the activities of 43 chemotherapeutic agents against Neospora caninum tachyzoites in cultured cells. Am. J. Vet. Res. 55: 976-981. [ Links ]
68. Lindsay DS, Lenz SD, Dykstra CC, Blagburn BL, Dubey JP (1998) Vaccination of mice with Neospora caninum: response to oral challenge with Toxoplasma gondii oocysts. J. Parasitol. 84: 311-315. [ Links ]
69. Long ML, Baszler TV (1998) Modulation of congenital Neospora caninum transmission by in vivo priming with avirulent challenge and neutralization of interleukin-4. 73rd Annual meeting of the American Society of Parasitologists, Hawai, USA. [ Links ]
70. Long MT, Bazler TV (2000) Neutralisation of maternal IL-4 modulates congenital protozoal transmission: comparison of innate versus acquired immune responses. J. Immunol. 164: 4768-4774. [ Links ]
71. Lundén A, Marks J, Maley SW, Innes EA (1998) Cellular immune responses in cattle experimentally infected with Neospora caninum. Parasite Immunol. 20: 519-526. [ Links ]
72. Maley SW, Buxton D, Rae AG, Wright SE, Schock A, Bartley PM, et al.. (2003) The pathogenesis of neosporosis in pregnant cattle: inoculation at mid-gestation. J. Comp. Path. 129: 186-195. [ Links ]
73. Marks J, Lundén A, Harkins D, Innes EA (1998) Identification of Neospora antigens recognized by CD4+ Tcells and immune sera from experimentally infected cattle. Parasite Immunol. 20: 303-309. [ Links ]
74. Marsh AE, Barr BC, Madigan J, Lakritz J, Nordhausen R, Conrad PA (1996) Neosporosis as a cause of equine protozoal myeloencephalitis. J. Am. Vet. Med. Assoc. 209: 1907-1913. [ Links ]
75. Martino PE, Montenegro JL, Preziosi JA, Venturini C, Bacigalupe D, Stanchi NO, et al. (2004) Serological survey of selected pathogens of free-ranging foxes in southern Argentina. Rev. Sci. Tech. 23: 801-806. [ Links ]
76. McAllister MM, Huffman EM, Hietala SK, Conrad PA, Anderson ML, Salman MD. (1996a) Evidence suggesting a point source exposure in an outbreak of bovine abortion due to neosporosis. J. Vet. Diagn. Invest. 8: 355-357. [ Links ]
77. McAllister MM, Parmley SF, Weiss LM, Welch VJ, McGuire AM (1996b) An immunohistochemical method for detecting bradyzoite antigen (BAG5) in Toxoplasma gondii-infected tissues cross-reacts with a Neospora caninum-bradyzoite antigen J. Parasitol. 82: 354-355. [ Links ]
78. McAllister MM, Dubey JP, Lindsay DS, Jolley WR, Wills RA, McGuire AM (1998) Dogs are definitive hosts of Neospora caninum. Int. J. Parasitol. 28: 1473-1478. [ Links ]
79. McAllister MM, Björman C, Anderson-Sprecher R, Rogers DG (2000) Evidence of point-source exposure to Neospora caninum and protective immunity in a herd of beef cows. J. Am. Vet. Med. Assoc. 217: 881-887. [ Links ]
80. McAllister MM (2001) Do cows protect fetuses from Neospora caninum transmission? Trends Parasitol. 17: 6. [ Links ]
81. Moore DP, Campero CM, Odeón AC, Poso MA, Cano D, Leunda MR, et al. (2002) Seroepidemiology of beef and dairy herds and fetal study of Neospora caninum in Argentina. Vet. Parasitol. 107: 303-316. [ Links ]
82. Moore DP, Draghi MG, Campero CM, Cetrá B, Odeón AC, Alcaraz E, et al. (2003a) Serological evidence of Neospora caninum infections in beef bulls in six counties of the Corrientes province, Argentina. Vet. Parasitol. 114: 247-252. [ Links ]
83. Moore DP, Campero CM, Odeón AC, Chayer R, Bianco M (2003b) Reproductive losses due to Neospora caninum in a beef herd in Argentina. J. Vet. Med. B. 50: 304-308. [ Links ]
84. Moore DP, Leunda MR, Zamorano PI, Odeón AC, Romera SA, Cano A, et al. (2005) Immune response to Neospora caninum in naturally infected heifers and heifers vaccinated with inactivated antigen during the second trimester of gestation. Vet. Parasitol. 130: 29-39. [ Links ]
85. Ortega-Mora LM, Ferre I, del-Pozo I, Caetano-da-Silva A, Collantes-Fernandez E, Regidor-Cerrillo J, et al. (2003) Detection of Neospora caninum in semen of bulls. Vet Parasitol. 117: 301-308. [ Links ]
86. Owen MR, Trees AJ (1998) Vertical transmission of Toxoplasma gondii from chronically infected house (Mus musculus) and field (Apodemus sylvaticus) mice determined by polymerase chain reaction. Parasitology. 116: 299-304. [ Links ]
87. Paré J, Thurmond MC, Hietala SK (1996) Congenital Neospora caninum infection in dairy cattle and associated calfhood mortality. Can. J. Vet. Res. 60: 133-139. [ Links ]
88. Paré J, Thurmond MC, Hietala SK (1997) Neospora caninum antibodies in cows during pregnancy as a predictor of congenital infection and abortion. J. Parasitol. 83: 82-87. [ Links ]
89. Patitucci AN, Charleston WAG, Alley MR, O´ Connor RJ, Pomroy WE (1999) Serological study of a dairy herd with a recent history of Neospora abortion. N. Z. Vet. J. 47: 28-30. [ Links ]
90. Quinn HE, Ellis JT, Smith NC (2002) Neospora caninum: a cause of immune-mediated failure of pregnancy? Trends in Parasitol. 18: 391-394. [ Links ]
91. Raghupathy R (1997) Th1-type immunity is incompatible with successful pregnancy. Immunol. Today. 18: 478-482. [ Links ]
92. Rettigner C, De Meerschman F, Focant C, Vanderplasschen A, Losson B (2004) The vertical transmission following the reactivation of a Neospora caninum chronic infection does not seem to be due to an alteration of the systemic immune response in pregnant CBA/Ca mice. Parasitology. 128: 149-60. [ Links ]
93. Roberts CW, Walker W, Alexander W (2001) Sexassociated hormones and immunity to protozoan parasites. Clin. Microbiol. Rev. 14: 476-788. [ Links ]
94. Romero JJ, Pérez E, Frankena K (2004) Effect of a killed whole Neospora caninum tachyzoite vaccine on the crude abortion rate of Costa Rican dairy cows under field conditions. Vet. Parasitol. 123: 149-519. [ Links ]
95. Sager H, Gloor M, Börkman C, Kritzner S, Gottstein B (2003). Assessment of antibody avidity in aborting cattle by a somatic Neospora caninum tachyzoite antigen IgG avidity ELISA. Vet. Parasitol. 112: 1-10. [ Links ]
96. Sawada M, Kondo H, Tomioka Y, Park C, Morita T, Shimada A., et al. (2000). Isolation of Neospora caninum from the brain of a naturally infected adult dairy cow. Vet. Parasitol. 90: 247-252. [ Links ]
97. Schares G, Dubremetz JF, Dubey JP, Bärwald A, Loyens A, Conraths JF (1999) Neospora caninum: Identification of 19-, 38-, and 40-kDa surface antigens and a 33-kDa dense granule antigen using monoclonal antibodies. Exp. Parasitol. 92: 109-119. [ Links ]
98. Schlafer DH, Fisher PJ, Davies CJ (2000) The bovine placenta before and after birth: placental development and function in health and disease. An. Reprod. Sci. 60-61: 145-160. [ Links ]
99. Shivaprassad HL, Ely R, Dubey JP (1989) A Neospora- like protozoon found in an aborted bovine placenta. Vet.Parasitol. 34: 145-148. [ Links ]
100. Staska LM, McGuire TC, Davies CJ, Lewin HA, Baszler TV (2003) Neospora caninum-infected cattle develop parasitespecific CD4+ Cytotoxic T Lymphocytes. Infection and Immunity. 71: 3272-3279. [ Links ]
101. Stenlund S, Kindahl H, Magnusson U, Uggla A, Björkman C (1999) Serum antibody profile and reproductive performance during two consecutive pregnancies of cows naturally infected with Neospora caninum. Vet. Parasitol. 85: 227-234. [ Links ]
102. Tanaka T, Hamada T, Inoue N, Nagasawa H, Fujisaki K, Suzuki N, Mikami T (2000). The role of CD4+ or CD8+T cells in the protective immune response of BALB/c mice to Neospora caninum. Vet. Parasitol. 90: 183-191. [ Links ]
103. Thilsted JP, Dubey JP (1989) Neosporosis-like abortions in a herd of dairy cattle. J. Vet. Diagn. Invest. 1: 205-209. [ Links ]
104. Thellin O, Heinen E (2003) Pregnancy and the immune system: between tolerance and rejection. Toxicology. 185: 179-184. [ Links ]
105. Thurmond MC, Hietala S (1995) Strategies to control Neospora infection in cattle. The Bovine Practitioner. 29: 60-63. [ Links ]
106. Thurmond M, Hietala S, Blanchard PC (1997) Herd-based diagnosis of Neospora caninum-induced endemic and epidemic abortion in cows and evidence for congenital and postnatal transmission. J. Vet. Diagn. Invest. 9: 44-49. [ Links ]
107. Tizard J (1992) Inmunología Veterinaria. Cuarta Edición. Nueva Editorial Interamericana, S.A. México. p. 280-294. [ Links ]
108. Trees AJ, McAllister MM, Guy CS, McGarry JW, Smith RF, Williams DJL (2002.) Neospora caninum: oocyst challenge of pregnant cows. Vet. Parasitol. 109: 147-154. [ Links ]
109. Uggla A, Stenlund S, Holmdahl OJM, Jakubek EB, Thebo P, Kindahl H, et al. (1998) Oral Neospora caninum inoculation of neonatal calves. Int. J. Parasitol. 28: 1467-1472. [ Links ]
110. Venturini L, Di Lorenzo C, Venturini C, Romero J (1995) Anticuerpos anti-Neospora sp. en vacas que abortaron. Vet. Arg. 12: 167-170. [ Links ]
111. Venturini MC, Venturini L, Bacigalupe D, Machuca M, Echaide I, Basso W, et al. (1999) Neospora caninum infections in bovine fetuses and dairy cows with abortions in Argentina. Int. J. Parasitol. 29: 1705-1708. [ Links ]
112. Venturini MC, Bacigalupe D, Venturini L, Rambeaud M, Campero CM, Moore DP, et al. (2000) Detección de Neospora caninum en ratones inoculados con cerebros de fetos bovinos abortados. XXI Congreso Mundial de Buiatría, p. 95, Punta del Este, Uruguay. [ Links ]
113. Venturini MC, Bacigalupe D, Venturini L, Basso W, Moore DP, Unzaga JM, et al. (2001) Isolation of Neospora sp. from the brain of a dairy calf in Argentina. The 18th International Conference of the World Association for the Advancement of Veterinary Parasitology, B9, Stresa, Italy. [ Links ]
114. Williams DJL, Guy CS, McGarry JW, Guy F, Tasker L, Smith RF, et al. (2000) Neospora caninum-associated abortion in cattle: the time of experimentally-induced parasitaemia during gestation determines foetal survival. Parasitol. 121: 347-358. [ Links ]
115. Williams DJL, Guy CS, Smith RF, Guy F, McGarry JW, Macay JS, et al. (2003) First demonstration of protective immunity against foetopathy in cattle with latent Neospora caninum infection. Inter. J. Parasitol. [ Links ]
116. Wouda W, Moen AR, Schukken YH (1998) Abortion risk in progeny of cows that experienced a Neospora caninum epidemic. Theriogenology. 49: 1311-1316. [ Links ]
117. Yamane I, Kitani H, Kokuho T, Shibahara T, Haritani M, Hamaoka T, et al. (2000) The inhibitory effect of interferon gamma and tumor necrosis factor alpha on intracellular multiplication of Neospora caninum in primary bovine brain cells. J. Vet. Med. Sci. 62: 347-351. [ Links ]
Recibido: 6/9/04
Aceptado: 28/11/05














