Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541versão On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.1 Ciudad Autónoma de Buenos Aires jan./mar. 2006
L. Ramos*, S. Mellado, S. Ramadán, L. Bulacio, C. López
CEREMIC (Centro de Referencia en Micología) Facultad de Ciencias Bioquímicas y Farmacéuticas.
Universidad Nacional de Rosario. Suipacha 531, (2000) Rosario
*Correspondencia. E-mail: ramos.laura@tower.com.ar
RESUMEN
Las especies del género Malassezia integran la flora habitual del ser humano, pero en ocasiones, causan diversas afecciones. Durante mucho tiempo, el diagnóstico temprano se vio demorado por la dificultad de obtener los cultivos de estos hongos. El objetivo de este trabajo es evaluar las ventajas del empleo de la microscopía de fluorescencia con blanco de calcoflúor para la observación de especies de Malassezia, tanto de material extraído de los pacientes, como de los cultivos. La técnica de fluorescencia ofrece, en comparación con la coloración tradicional de azul de lactofenol, la ventaja de facilitar además de la observación de los elementos fúngicos, observar el patrón de brotación de estos organismos, útil para la identificación. El análisis de materiales clínicos con la coloración de blanco de calcoflúor y posterior observación con microscopio de fluorescencia, resulta entonces un método sencillo y rápido para la identificación presuntiva y contribuye, por lo tanto, al diagnóstico temprano.
Palabras clave: Malassezia, calcoflúor, hongos, piel, fluorescencia
ABSTRACT
The use of calcofluor white for identification of Malassezia species. Fungi of Malassezia genus are known as normal flora in human beings. However, different pathologies due to Malassezia, have been described. Traditionally, early diagnosis was delayed because of the difficulties in culture isolation of these organisms. The aim of this work, is to evaluate the technique of observation microscopy with calcofluor, for identification of Malassezia in both, clinical samples and isolates. In comparison to traditional method of direct examination with lactophenol-blue, calcofluor method offers an advantage because it turns easier the observation of fungal elements and its budding pattern. This technique contributes then, to identify species of Malassezia. The analysis of clinical specimens with calcofluor followed by observation under fluorescence microscopy is a simple and rapid method for the identification, and contribute therefore to the early diagnosis.
Key words: Malassezia, calcofluor, fungi, skin, fluorescence
Algunas especies del género Malassezia pueden formar parte de la flora habitual de la piel humana (18) y de la mayoría de los animales de sangre caliente, fundamentalmente en áreas ricas en glándulas sebáceas (5, 22).
En los últimos años, Malassezia ha sido aislada con mayor frecuencia debido a su comportamiento oportunista. Esto se correlaciona con el aumento de pacientes inmunocomprometidos, ya sea por diversas patologías o instauración de terapias inmunosupresoras (9, 15, 28). Entre las enfermedades a las que se asocia Malassezia, se pueden mencionar pitiriasis versicolor (2, 4), foliculitis (3), dermatitis seborreica (6, 7), dermatitis atópica (10) y fungemia asociada a catéteres (9, 14, 21) entre otras (12).
El dimorfismo de este género, y la dificultad que presentó durante mucho tiempo su recuperación en cultivos, debida a sus requerimientos nutricionales (26), hizo que las diferentes formas se atribuyeran inicialmente a distintos agentes etiológicos, Pityrosporum para la fase levaduriforme, y Malassezia para la filamentosa (1). En 1996 se hizo una revisión taxonómica, aceptándose el nombre de Malassezia como el correcto para el género. Se agregó además, a las especies conocidas (Malassezia furfur, Malassezia sympodialis y Malassezia pachydermatis), cuatro nuevas: Malassezia slooffiae, Malassezia obtusa, Malassezia globosa y Malassezia restricta (16). Recientemente, se han descrito otras especies, Malassezia japonica (30) y Malassezia dermatis (31) en humanos, y Malassezia equi y Malassezia nana en animales (19, 27).
Como se mencionó anteriormente, los elementos de las diferentes especies del género Malassezia pueden existir tanto en forma filamentosa como levaduriforme, siendo esta última la asociada a piel humana.
El propósito de este trabajo fue estudiar las características micromorfológicas de especies del género Malassezia empleando blanco de calcoflúor, en comparación con la coloración tradicional de azul de lactofenol.
La técnica del blanco de calcoflúor se basa por una parte, en la propiedad que tiene dicha sustancia de emitir fluorescencia al ser activada por radiación ultravioleta, y por otra, en la afinidad que presenta por la celulosa y la quitina presentes en la pared celular de los organismos fúngicos (13). El examen de los materiales clínicos con blanco de calcoflúor está considerado como un método rápido y fácil para la identificación de hongos (29).
Se estudiaron 151 pacientes que concurrieron al CEREMIC, con diagnóstico presuntivo de pitiriasis versicolor, dermatitis seborreica o foliculitis. A los pacientes se les tomó muestras de escamas de piel, por raspado con bisturí descartable, que se recolectaron en portaobjetos estériles. Luego se les realizó examen microscópico directo con azul de lactofenol y por fluorescencia con blanco de calcoflúor. La preparación con blanco de calcoflúor consiste en depositar sobre un portaobjetos el material a analizar (escamas o alícuota de colonia), y sobre el mismo agregar una gota de solución del fluorocromo (blanco de calcofluor M2r (Sigma) 0,1g, azul de Evans (Sigma) 0,05 g, agua destilada 100ml) (11), y una gota de KOH 10%, colocándose luego el cubreobjetos. El preparado se observa en un microscopio con sistema de fluorescencia (lámpara de mercurio, objetivos específicos y filtros para trabajar con longitud de onda de 390-420 nm). Posteriormente se procedió a la siembra en medio Agar Dixon modificado (ADm) (16) y en Agar Sabouraud glucosa, con y sin el agregado de aceite de oliva estéril, y se incubaron 10 días a 32 °C. El estudio morfológico de las cepas aisladas consistió en la evaluación de las características macroscópicas analizando el tiempo de desarrollo de las colonias, textura, márgenes y color de las mismas, así como las microscópicas: forma y tamaño celular, y también el patrón de brotación de las levaduras. Se completó la información con el estudio fisiológico convencional de los aislamientos (17), con el agregado de la prueba de esculina y de termotolerancia (23, 24). También se realizó la confirmación de la identidad de las especies por la técnica molecular de PCR fingerprinting (25), realizada a cepas conservadas, según lo descrito por Crespo y col. (8).
Las características de los cultivos fueron comparadas con cepas de referencia: M. slooffiae (JG 554), obtenida de la École Nationale Veterinaire College d´Alfort, Maisons-Alfort, Francia; M. furfur (CBS 1878), M. sympodialis (CBS 7222) y M. pachidermatis (CBS 1337), del CBS (Centraalbureau voor Schimmelcultures, Delft, The Netherlands); M. globosa (GM 35) y (GM 7) del GM (Gillian Midgley, St. Thomas´Hospital, London, UK); M. restricta (RA 42.2.C) del RA (Ruth Ashbee, Department of Microbiology, University of Leeds, UK) y M. obtusa del INEI ANLIS "Dr. Carlos Malbrán" (Departamento de Área Micología, Buenos Aires, Argentina).
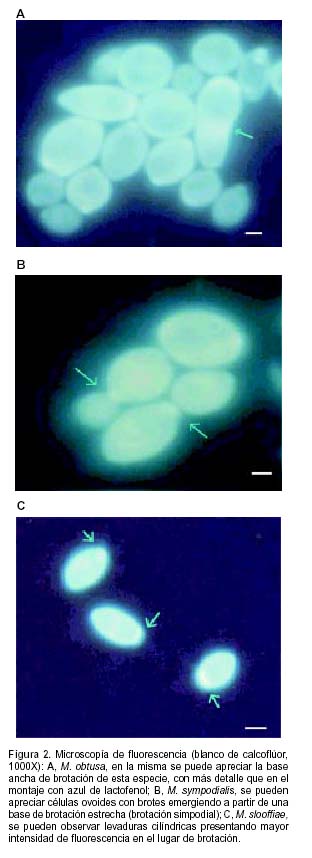
De las 151 muestras analizadas, 107 (70,86%) presentaron examen directo positivo, con elementos compatibles con especies de Malassezia. Se observaron filamentos, levaduras, o una combinación de ambos. Sólo se registró la presencia de filamentos en los pacientes con cuadros de pitiriasis versicolor, aunque en 36 casos de pacientes con aspectos clínicos de pitiriasis versicolor, sólo se observó una gran cantidad de elementos levaduriformes. Los resultados de la evaluación directa de los materiales, se detallan en la Tabla 1. Tanto con azul de lactofenol, como con el fluorocromo, se logró observar las características microscópicas de estas levaduras (Figura 1). El método de fluorescencia permitió realizar una observación más clara de la base de brotación, ya que en esta zona se aprecia un aumento de la intensidad de la fluorescencia (Figura 2).

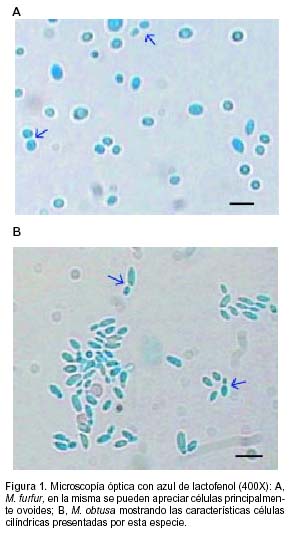
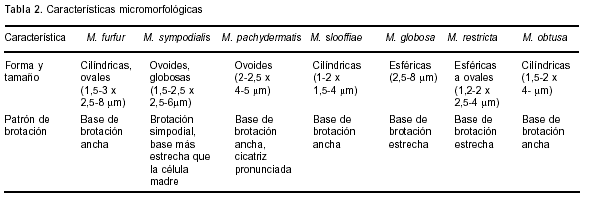
Con respecto a los cultivos, se obtuvieron colonias de cuatro especies de Malassezia: M. sympodialis, M. furfur, M. slooffiae y M. obtusa, cuyas características micromorfológicas se describen en la Tabla 2. Tanto estas características como la macromorfología de las colonias aisladas y de las cepas de referencia, fueron coincidentes con lo descripto en la bibliografía (16, 20).
La correcta identificación de los aislamientos provenientes de pacientes con diagnósticos presuntivos de patologías debidas a agentes del género Malassezia, es muy importante para encarar estudios epidemiológicos y poder así describir el rol etiológico de las especies de Malassezia. Estos estudios aún son escasos, debido fundamentalmente a las dificultades halladas históricamente en el aislamiento, mantenimiento e identificación de estas levaduras.
Si bien con la microscopía directa tradicional se apreciaron correctamente las características micromorfológicas que presentan las distintas especies, con la técnica de blanco de calcoflúor la base de brotación se observó más nítidamente. Esto es atribuible a que estos hongos presentan una pared más gruesa que otras especies, y fundamentalmente a que la quitina de la región de brotación es más abundante debido a la gran síntesis de pared. Esto ocasiona mayor intensidad de fluorescencia ya que la quitina es el componente de pared al cual se une el fluorocromo. Aunque aplicada en forma aislada, esta técnica no es suficiente para la diferenciación a nivel de especie, debido a que algunas de las mismas presentan características micromorfológicas muy parecidas; es una técnica simple y rápida para aquellos casos en los que la obtención o mantenimiento de cultivos resulta imposible. Se transforma así en una herramienta muy útil para el diagnóstico y por lo tanto para la instauración de una terapia adecuada. Por estas razones, el uso del blanco de calcoflúor es de gran utilidad para el estudio morfológico y permite complementar las pruebas fisiológicas, constituyendo una excelente herramienta para la identificación de levaduras del género Malassezia.
Este trabajo fue presentado en el XVII Congreso Latinoamericano de Microbiología y X Congreso Argentino de Microbiología, realizado en la Ciudad Autónoma de Buenos Aires del 17 al 21 de octubre de 2004.
REFERENCIAS
1. Aspíroz MC, Moreno LA, Rubio MC. Taxonomía de Malassezia furfur: Estado de la cuestión. Rev Iberoam Micol 1997; 14: 147-149. [ Links ]
2. Aspíroz MC, Ara M, Rezusta A, Rubio C. Isolation of Malassezia globosa and M. sympodialis from patients with pityriasis versicolor in Spain. Mycopathologia 2002; 154: 111-117. [ Links ]
3. Bäck O, Faegermann J, Hörnqvist R. Pityrosporum folliculitis: A common disease of the young and middle-aged. J Am Acad Dermatol 1985; 12: 56-61. [ Links ]
4. Ballesté R, Fernández N, Calegari L, Gezuele E. Pitiria- sis versicolor en lactantes. Rev Med Uruguay 2000; 16: 257-260. [ Links ]
5. Bandhaya M. The distribution of Malassezia furfur and Malassezia pachydermatis on normal skin. S E J Asian Trop Med Public Health 1993; 24: 343-346. [ Links ]
6. Bergbrant IM. Seborrhoeic dermatitis and Pityrosporum ovale: cultural, immunological and clinical studies. Acta Dermatol Venéreol Suppl (Stockh ) 1991; 167: 1-36. [ Links ]
7. Crespo Erchiga V, Ojeda Martos A, Vera Castaño A, Crespo Erchiga A, Sánchez Fajardo F. Aislamiento e identificación de Malassezia spp en pitiriasis versicolor, dermatitis seborreica y piel sana. Rev Iberoam Micol 1999; 16: 16-21. [ Links ]
8. Crespo MJ, Albarca ML, Cabañes FJ. Evaluation of different preservation and storage methods for Malassezia spp. J Clin Microbiol 2000; 38: 3872-3875. [ Links ]
9. Donowitz GR, Maki DG, Crnich CJ, Pappas PG, Rolston KVI. Infections in the neutropenic patien-new views of an old problem. Hematology 2001; 1: 113-119. [ Links ]
10. Faegermann J. Atopic dermatitis and fungi. Clin Microbiol Rev 2002; 15: 545-563. [ Links ]
11. Finegold AM, Baron EJ. Métodos ópticos para el diagnóstico de laboratorio de las enfermedades infecciosas. En: Bailey/Scott, Editorial Médica Panamericana. Diagnóstico Microbiológico. Séptima edición. Buenos Aires. 1989, p. 115-116. [ Links ]
12. Fridkin S K, Jarvin WR. Epidemiology of nosocomial fungal infections. Clin Microbiol Rev 1996; 9: 499-511. [ Links ]
13. Gip L, Abelin J. Differential Staining of Fungi in Clinical Specimens Using Fluorescent Whitening Agent (Blankophor). Mycosen 1986; 30: 21-24. [ Links ]
14. González Cuevas A, Alayeto J, Juncosa T, García-Fructuoso MT, Moreno J, Latorre C. Sepsis neonatal por Malassezia furfur. Rev Iberoam Micol 1999; 16: 157-160. [ Links ]
15. Groll AH; Walsh TJ. Uncommon opportunistic fungi: new nosocomial threats. Clin Microbiol Infec 2001; 7: 8-24. [ Links ]
16. Guého E, Midgley G, Guillot J. The genus Malassezia with description of four new species. Antonie van Leeu-wenhoek 1996; 69: 337-355. [ Links ]
17. Guillot J, Gueho E, Lesourd M, Midgley G, Chévrier G, Dupont B. Identification of Malassezia species. A practical approach. J Mycol Med 1996; 6: 103-110. [ Links ]
18. Gupta AK, Kohli Y. Prevalence of Malassezia species on various body sites in clinically healthy subject representing different age groups. Med Mycol 2004; 42: 35-42. [ Links ]
19. Hirai A, Kano R, Makimura K, Duarte ER, Hamdan JS, Lachance MA et al. Malassezia nana sp. nov., a novel lipid-dependent yeast species isolated from animals. Int Syst Evol Microbiol 2004; 54: 623-627. [ Links ]
20. de Hoog GS, Guarro J, Gené J, Figueras MJ. Basidio-mycetous yeasts. Genus: Malassezia. En: Centraalbureau voor Schimmelcultures and Universitat Rovira I Virgili, Reus, Spain editors. Atlas of Clinical fungi (2nd edition), 2000, p. 144-155. [ Links ]
21. Kessler AT, Kourtis AP, Simon N. Peripheral thromboembolism associated with Malassezia furfur sepsis. J. Pediatr Infect Dis 2002; 21: 813-824. [ Links ]
22. Leeming JP, Notman FH, Holland KT. The distribution and ecology of Malassezia furfur and cutaneous bacteria on human skin. J Appl Bacteriol 1989; 67: 47-52. [ Links ]
23. Mayser O, Haze P, Papavassilis C, Pickel M, Gründer K, Guého E. Differentiation of Malassezia species: selectivity of Cremophor El, castor oil and ricinoleic acid for M. furfur. Br J Dermatol 1997; 137: 208-213. [ Links ]
24. Mayser P, Pickel M, Hazel P. Different utilization of neutral lipids by Malassezia furfur and Malassezia sympodialis. Med Mycol 1998; 36: 7-14. [ Links ]
25. Mellado S, Ramadán S, Bulacio L, López C, Ramos L. Utilización del cebador M13 en la identificación de las especies del género Malassezia. XXIII Reunión Anual Sociedad de Biología de Rosario. Publicación Anual de la Soc. de Biol.de Rosario, 2003; p.175. Rosario, Argentina. [ Links ]
26. Nazarro-Porro M, Caprilli F, Nazarro P, Morpurgo ME. Growth requeriments and lipid metabolism of Pityrosporum orbiculare. J Investig Dermatol 1976; 66: 178-182. [ Links ]
27. Nell A, James SA, Bond CJ, Hunt B, Herrtage ME. Identification and distribution of a novel Malassezia species yeasts on normal equine skin. Vet. Rec 2002; 150: 395-8. [ Links ]
28. Quindós G. Las micosis en el amanecer del siglo XXI. Rev Iberoam Micol 2002; 19: 1-4. [ Links ]
29. Ramos L, Riccomi A, Bracalenti BC. Uso del “Blancophor” (fluorocromo) en la identificación de hongos en materiales de piel por microscopía directa. Rev Iberoam Micol 1990; 7: 107-110. [ Links ]
30. Sugita T, Takashima M, Kodama M, Tsuboi R, Nishikawa A. Description of a new yeast species, Malassezia japonica, and its detection in patients with atopic dermatitis and healthy subjects. J Clin Microbiol 2003; 41: 4695-4699. [ Links ]
31. Sugita T, Takashima M, Shinoda T, Suto H, Unno T, Tsuboi R et al. New yeast species, Malassezia dermatis, isolates from patients with atopic dermatitis. J Clin Microbiol 2002; 40: 1363-1367. [ Links ]
Recibido: 25/10/04
Aceptado: 13/02/06














