Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541versão On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.1 Ciudad Autónoma de Buenos Aires jan./mar. 2006
M. García Heredia1, S. D. García2, E. F. Copolillo3, M. Cora Eliseth3, A. D. Barata3, C. A. Vay2, R. A. de Torres1, N. Tiraboschi4, A. M. R. Famiglietti2 *
1Carrera de Especialización en Bacteriología, Escuela de Graduados, Facultad de Farmacia y Bioquímica, UBA; 2Laboratorio de Bacteriología, Departamento de Bioquímica Clínica, Hospital de Clínicas «José de San Martín», Facultad de Farmacia y Bioquímica, UBA; 3Sección Patología del Tracto Genital Inferior y Colposcopia, 1° Cátedra de Obstetricia, Hospital de Clínicas «José de San Martín», Facultad de Medicina, UBA; 4Laboratorio de Micología, División Infectología, Hospital de Clínicas «José de San Martín», Facultad de Medicina, UBA, Av. Córdoba 2351 (CP 1120) Ciudad Autónoma de Buenos Aires.
*Correspondencia. E-mail: famiglie@ffyb.uba.ar
RESUMEN
La mujer embarazada es más susceptible tanto a la colonización como a la infección vaginal por levaduras. El objetivo de este trabajo fue determinar la prevalencia de levaduras aisladas de exudados vaginales de mujeres embarazadas y evaluar la sensibilidad a los antifúngicos de uso frecuente. Se estudiaron 493 pacientes en el período comprendido desde diciembre de 1998 hasta febrero de 2000. La prevalencia de Candida spp. fue 28% (Candida albicans 90,4%, Candida glabrata 6,3%, Candida parapsilosis 1,1%, Candida kefyr 1,1%, especies no identificadas 1,1%). Se determinó la sensibilidad a fluconazol, ketoconazol, itraconazol y nistatina por el método de difusión en agar Shadomy. Todos los aislamientos de C. albicans, C. kefyr y C. parapsilosis fueron sensibles in vitro a los antifúngicos probados, mientras que 1 de 6 aislamientos de C. glabrata presentó resistencia extendida a todos los azoles, pero sensibilidad a nistatina. En mujeres embarazadas C. albicans fue la levadura más frecuentemente aislada de exudados vaginales y continúa siendo ampliamente sensible a los antifúngicos; sólo en C. glabrata se observó resistencia a los azoles. Se recomienda la identificación de la levadura a nivel de especie particularmente en el caso de falla terapéutica y en infecciones recidivantes o crónicas.
Palabras clave: candidiasis, embarazo, resistencia antifúngica
ABSTRACT
Prevalence of vaginal candidiasis in pregnant women. Identification of yeasts and susceptibility to antifungal agents. Pregnant women are more susceptible to both vaginal colonization and infection by yeast. Our objectives were to determine the prevalence in pregnant women of yeasts isolated from vaginal exudates and their susceptibility to current antifungal drugs. A total of 493 patients was studied between December 1998 and February 2000. The prevalence of Candida spp. was 28% (Candida albicans 90.4%; Candida glabrata 6.3%; Candida parapsilosis 1.1%, Candida kefyr 1.1%; unidentified species 1.1%). The diffusion test in Shadomy agar was employed to determine the susceptibility to fluconazole, ketoconazole, itraconazole and nistatine. All C. albicans, C. kefyr and C. parapsilosis isolates were susceptible in vitro to the antifungal agents tested, while 1 in 6 C. glabrata isolates showed resistance to azole drugs; all strains were susceptible to nistatine. In pregnant women, C. albicans was the yeast most frequently isolated from vaginal exudates; it continues to be highly susceptible to antifungal drugs. Azole resistance was detected only among C. glabrata isolates. Identification to the species level is recommended, specially in cases of treatment failure and recurrent or chronic infection.
Key words: candidiasis, pregnancy, antifungal resistance
INTRODUCCIÓN
La candidiasis vulvovaginal (CVV), particularmente en la mujer en edad reproductiva, es una causa frecuente de consulta ginecológica.
Las levaduras causantes de vaginitis forman parte del contenido microbiano habitual de los tractos gastroin-testinal, genital, respiratorio, y de la piel y mucosas del ser humano.
Tanto la colonización como la infección vaginal micótica son más frecuentes en el embarazo y en mujeres con otros factores predisponentes. Las infecciones suelen ser de origen endógeno por modificación del ecosistema microbiano intestinal o vaginal, ya sea después de un tratamiento antibiótico o por disminución de las defensas inmunitarias del huésped como en el caso de corticoterapia, enfermedades inmunosupresoras, diabetes no controlada, obesidad, estrés, uso de anticonceptivos hormonales o terapia de reemplazo hormonal. Otros factores que contribuyen a la infección son el uso de pantalones ajustados, ropa interior de nylon y la utilización de duchas vaginales (5, 8).
La portación asintomática de Candida spp. en vagina en mujeres no gestantes oscila entre 10 y 17% y aumenta hasta un 35% en el embarazo (14). Se estima que hasta un 75% de las mujeres sexualmente activas sufren candidiasis vaginal al menos una vez en la vida y entre el 5 a 10% de ellas la padecen en forma recurrente (tres o más episodios en 1 año) (8, 18).
Históricamente, el agente etiológico de la candidiasis vaginal fue Candida albicans, ampliamente sensible a los antifúngicos, y la persistencia o recurrencia de la infección se atribuyó a otros factores, en muchos casos no identificados (7). En los últimos años, el tratamiento profiláctico de infecciones oportunistas con fluconazol llevó a la reducción de C. albicans y a la selección de Candida glabrata en el ecosistema microbiano. Asi mismo, la detección de cepas de C. albicans con resistencia secundaria al fluconazol, generó interés por conocer en qué grado la resistencia a las drogas antifúngicas podía relacionarse con candidiasis vaginal recidivante (20).
El surgimiento de aislamientos resistentes a los antifúngicos en el género Candida plantea la necesidad de identificar las levaduras y determinar la sensibilidad a drogas antifúngicas, especialmente en aquellos casos de fracasos terapéuticos.
El objetivo de este trabajo fue establecer la prevalencia de las diferentes especies del género Candida aisladas de vulvovaginitis de mujeres embarazadas, y determinar la sensibilidad a los antifúngicos utilizados para su tratamiento.
MATERIALES Y MÉTODOS
Pacientes y muestras
Entre el 1° de diciembre de 1998 y el 29 de febrero de 2000, se estudiaron 493 exudados vaginales de pacientes atendidas en la División de Obstetricia del Hospital de Clínicas “José de San Martín” de la Universidad de Buenos Aires.
Se tomaron muestras por hisopado de fondo de saco vaginal (FSV) previa colocación de espéculo, una de FSV anterior para determinar el pH con tiras reactivas y cuatro muestras de FSV posterior:
1- En tubo con 1 ml de KOH 10% para la prueba de aminas y posterior observación microscópica de elementos levaduriformes.
2- En 1 ml de solución fisiológica para observación en fresco de células, parásitos y levaduras.
3- Se realizaron dos extendidos en portaobjetos, uno para coloración de Gram para observación de bacterias, y otro para coloración de May Grunwald Giemsa prolongado para búsqueda de Trichomonas vaginalis.
4- En medio de transporte Stuart para su posterior cultivo en agar base Columbia suplementado con proteosa peptona N° 3 (Difco, Detroit, Michigan) y 5% de sangre humana. Los cultivos fueron incubados a 37 °C en atmósfera con 5% de CO2 durante 48 h.
Todos los aislamientos de levaduras fueron conservados en 1 ml de agua destilada estéril a –20 °C para su posterior identificación y pruebas de sensibilidad.
Identificación de levaduras
Las levaduras se identificaron por la producción de tubo germinativo, filamentos, clamidoconidias y el desarrollo en medio cromogénico. Para ello se cultivaron en agar agua con 1% de leche y luego de 3 h de incubación a 37 °C se realizó la observación microscópica para la búsqueda de tubo germinativo. Los filamentos y clamidoconidias fueron observados después de 72 h de incubación a 28 °C (16). Se realizó cultivo en CHROMagar Candida (CHROMagar Company, Paris, France) para la identificación presuntiva de especies de levaduras según el color de las colonias.
Las levaduras fueron identificadas como C. albicans cuando presentaron tubo germinativo, filamentización y clamidoconidias en el agar leche o presentaron color verde en el CHROMagar (16). Aquellos aislamientos donde la metodología mencionada no pudo determinar la especie, se identificaron por API 32 C (bioMérieux, France).
Sensibilidad a los antifúngicos
Se determinó la sensibilidad a 4 antifúngicos en 94 de las 139 levaduras aisladas. El método utilizado fue la difusión en agar Shadomy y se emplearon tabletas de nistatina (50 µg), fluconazol (15 µg), ketoconazol (15 µg), itraconazol (10 µg) (Rosco Diagnóstica, Dinamarca).
Se preparó el inóculo resuspendiendo las colonias (a partir de los aislamientos en agar sangre con desarrollo de 24 h) en solución fisiológica estéril hasta turbidez equivalente al tubo 0,5 de la escala de McFarland y posterior dilución 1:1.
Las placas con el medio de Shadomy se incubaron a 35 °C durante 25 min y luego se agregó 1 ml del inóculo y se homogeneizó con movimientos circulares hasta cubrir toda la superficie de la placa. El exceso de líquido se removió y se dejó secar 10 min a temperatura ambiente, luego se colocaron las pastillas antifúngicas y se incubó a 37 °C.
La lectura de los halos de inhibición se realizó a las 24 h (4). Se consideró sensible a fluconazol y ketoconazol cuando el halo de inhibición fue ≥ 20 mm, resistente ≤ 11 mm, y sensible a nistatina e itraconazol cuando el halo fue ≥ 15 mm, resistente sin halo. Para nistatina se consideró un halo de inhibición nítido, sin colonias en su interior, mientras que para los compuestos azólicos no se consideró el desarrollo de colonias pequeñas internas dentro del halo de inhibición.
Se incluyeron como control de calidad: C. albicans ATCC 68548 y Candida krusei ATCC 6258.
Análisis estadístico
Para cada especie se compararon los porcentajes de sensibilidad a los antifúngicos mediante test χ2 (p< 0,05).
RESULTADOS
La edad promedio de las pacientes fue 25 años (16 - 42 años), el 49% cursaba el segundo trimestre de embarazo, el 29% el tercer trimestre y el 22% el primer trimestre.
En 139 de 493 muestras estudiadas (28%) se aislaron levaduras. Todas las pacientes presentaron síntomas de infección vaginal.
La frecuencia relativa de las diferentes especies de Candida en 94 de los 139 aislamientos estudiados fue: C. albicans 90,4%, C. glabrata 6,3%, Candida parapsilosis 1,1%, Candida kefyr 1,1% y Candida spp. 1,1%.
Los 85 aislamientos de C. albicans fueron de color verde en el CHROMagar; el 72,3% produjo tubo ger-minativo y 76,6% filamentización con formación de clamidoconidias. El desarrollo de colonias “distintas a verde” en el agar cromogénico correspondió a Candida no C. albicans, excepto un aislamiento que no pudo identificarse a nivel de especie.
La CVV se asoció con Lactobacillus spp. en el 86% de los casos, vaginosis bacteriana en el 12% y Streptococcus agalactiae en el 2%.
Al analizar la correlación entre el examen directo y el cultivo, se observaron elementos levaduriformes y/o seudomicelios en 75 de 94 exudados vaginales con Candida spp. El valor predictivo positivo (VPP) para la observación microscópica post-KOH y el valor predictivo negativo (VPN) fueron 0,79 y 0,20, respectivamente. No se observó presencia de seudomicelios en el examen directo cuando se obtuvo desarrollo de C. glabrata.
El perfil de sensibilidad a los antifúngicos se presenta en la Tabla 1. En 1 de 6 aislamientos de C. glabrata se observó resistencia a los compuestos azólicos. No hubo diferencia estadísticamente significativa al comparar la sensibilidad a los distintos antifúngicos para cada especie de Candida (p = 0,1328), probablemente relacionada al bajo número de cepas.
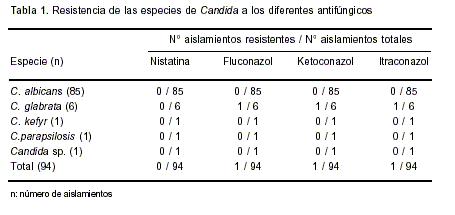
Los aislamientos de C. kefyr y C. parapsilosis fueron sensibles a todos los antifúngicos probados.
DISCUSIÓN
En la población de mujeres embarazadas estudiada la prevalencia de CVV fue 28% y es comparable a lo comunicado por otros autores (17), pero menor que la hallada en el tercer trimestre de embarazo (1) y mayor que en mujeres adultas en etapa fértil no embarazadas (3, 12).
En los últimos años se realizaron varios estudios que demuestran que C. albicans es aún la especie más frecuentemente responsable de la candidiasis vulvovaginal (74 - 94%), mientras que otras especies, C. glabrata y C. krusei, son menos frecuentes y sus hallazgos se relacionan con mayor resistencia a los antifúngicos (15, 20, 21).
En este estudio, C. albicans también fue la especie más frecuentemente aislada, seguida por C. glabrata (6,3%). Otros autores encontraron entre 6,2% y 16,3% de C. glabrata (3, 5, 6, 11, 12, 15, 23) y habitualmente relacionada a vaginitis crónica (9).
Es conocida la resistencia natural a fluconazol en C. krusei, pero en nuestra serie no se aisló dicha especie. Tanto C. krusei como C. glabrata se asocian al uso generalizado de drogas azólicas, especialmente en pacientes VIH positivos con candidiasis orofaríngeas (3, 10, 13, 20, 23).
C. albicans generalmente presenta sensibilidad a fluconazol, mientras que C. glabrata puede adquirir resistencia a los azoles con o sin previa exposición a dichas drogas (15).
A pesar que todos los aislamientos de C. albicans fueron sensibles in vitro a los antifúngicos probados, está descrito el desarrollo de resistencia en esta especie (20, 22). En nuestra serie sólo 1/6 de las cepas de C. glabrata presentó resistencia extendida a todos los azoles ensayados, pero fue sensible a nistatina.
En las CVV pueden ser aisladas más de una especie de levadura con distinto comportamiento frente a los antifúngicos, y el tratamiento puede seleccionar el sobredesarrollo de especies resistentes. La implementación del agar cromogénico para el cultivo del exudado vaginal en el que se observen levaduras y/o seudohifas en el examen microscópico, sería de gran utilidad para la detección de infecciones mixtas por más de una especie de Candida.
Se puede concluir que en la población estudiada de mujeres embarazadas las levaduras del género Candida son aún ampliamente sensibles a los antifúngicos y se debe sospechar resistencia si se aisla C. glabrata. Se recomienda la identificación a nivel de especie y si es posible pruebas de sensibilidad a los antifúngicos en caso de falla terapéutica y candidiasis recidivante o crónica.
Agradecimientos: Este trabajo fue realizado con el apoyo del Proyecto UBACYT 01/ B078.
BIBLIOGRAFÍA
1. Balaka B, Agbere AD, Baeta S, Kessie K, Assimadi K. Bacterial flora in the genital tract the last trimester of pregnancy. J Gynecol Obstet Biol Reprod 2003; 32: 555-61. [ Links ]
2. Bauters TGM, Dhont MA, Temmerman MIL, Nelis HJ. Prevalence of vulvovaginal candidiasis and susceptibility to fluconazole in women. Am J Obstet Gynecol 2002; 187: 569-74. [ Links ]
3. Buscemi L, Arechavala A, Negroni R. Estudio de las vulvovaginitis agudas en pacientes adultas, sexualmente activas, con especial referencia a la candidiasis, en pacientes del hospital de infecciosas Francisco J. Muñiz. Rev Iberoam Micol 2004; 21: 177-81. [ Links ]
4. Carrillo-Muñoz AJ, Abarca L, Quindós G, Arévalo P, Bornay F, Cabañes FJ, et al. Multicenter evaluation of Neo-Sensitabs, a standardized diffusion method for yeast susceptibility testing. Rev Iberoam Micol 1999; 16: 92-6. [ Links ]
5. Corsello S, Spinillo A, Osnengo G, Penna C, Guaschino S, Beltrame A, et al. An epidemiological survey of vulvovaginal candidiasis in Italy. Eur J Obstet Gynecol Reprod Biol 2003; 110: 66-72. [ Links ]
6. Erdem H, Cetin M, Timuroglu T, Cetin A, Yanar O, Pahsa A. Identification of yeast in public hospital primary care patients with or without clinical vaginitis. J Gynecol 2003; 43: 312-6. [ Links ]
7. Eschenbach DA. Chronic vulvovaginal candidiasis. N Engl J Med 2004; 351: 851-2. [ Links ]
8. Fidel PL, Barousse M, Espinosa T, Ficarra M, Sturtevant J, Martin DH, et al. An intravaginal live Candida challenge in humans leads to new hypothesis for the immuno-pathogenesis of vulvovaginal candidiasis. Infect Immun 2004; 72: 2939-46. [ Links ]
9. Fidel PL, Vázquez JA, Sobel JD. Candida glabrata: review of epidemiology pathogenesis and clinical disease with comparison to C. albicans. Clin Microbiol Rev 1999; 12: 80-96. [ Links ]
10. García-Martos P, Domínguez I, Marín P, García-Agudo R, Avofi S, Mira J. Sensibilidad a antifúngicos de levaduras patógenas emergentes. Enferm Infecc Microbiol Clin 2001; 19: 249-56. [ Links ]
11. Holland J, Young ML, Lee O, Chen SC-A. Vulvovaginal carriage of yeasts other than Candida albicans. Sex Transm Infect 2003; 79: 249-50. [ Links ]
12. Namkinga LA, Matee MI, Kivaisi AK, Kullaya A, Mneney EE. Identification of Candida strains isolated from Tanzanian pregnant women with vaginal candidiasis. East Afr Med J 2005; 82: 226-34. [ Links ]
13. Mac Neill C, Weisz J, Carey JC. Clinical resistance of recurrent Candida albicans vulvovaginitis to fluconazole in the presence and absence of in vitro resistance. J Reprod Med 2003; 48: 63-8. [ Links ]
14. Margariti PA, Astorri AL, Mastromarino C, Morace G. Mycotic vulvovaginitis. Recenti Prog Med 1997; 88: 479-84. [ Links ]
15. Mujica MT, Finquelievich JL, Jewtuchowicz CA, Iovannitti CA. Prevalencia de Candida albicans y Candida no albicans en diferentes muestras clínicas. Período 1999-2001. Rev Arg Microbiol 2004; 36: 107-12. [ Links ]
16. Negroni R, Guelfand L. Manual de procedimientos para laboratorios de Micología Médica. Acta Bioquím Clín Latinoam 1999; Supl. 1. [ Links ]
17. Omar AA. Gram stain versus culture in the diagnosis of vulvovaginal candidiasis. East Mediterr Health J 2001; 7: 925-34. [ Links ]
18. Reyna Figueroa J, Morales Range V, Ortiz Ibarra FJ, Casanova Román G, Beltrán Zúniga M. Effectiveness of a clinimetric scale for diagnosing vulvovaginal candidosis. Ginecol Obstet Mex 2004; 72: 219-26. [ Links ]
19. Rylander E, Berglund A-L, Krassny C, Petrini B. Vulvovaginal Candida in a young sexually active population: prevalence and association with oro-genital sex and frequent pain at intercourse. Sex Transm Infect 2004; 80: 54-7. [ Links ]
20. Saporiti AM, Gómez D, Levalle S, Galeano M, Davel G, Vivot W, Rodero L. Candidiasis vaginal: etiología y perfil de sensibilidad a agentes antifúngicos de uso clínico. Rev Arg Microbiol 2001; 33: 217-22. [ Links ]
21. Sobel JD, Harold C, Wiesenfeld HC, Martens M, Danna P, Hooton TM, et al. Maintenance fluconazole therapy for recurrent vulvovaginal candidiasis. N Engl J Med 2004; 351: 876-83. [ Links ]
22. Sobel JD, Zervos M, Reed BD, Hooton T, Soper D, Nyirjesy P, et al. Fluconazole susceptibility of vaginal isolates obtained from women with complicated Candida vaginitis: clinical implications. Antimicrob Agents Chemother 2003; 47: 34-8. [ Links ]
23. Sojakova M, Liptajova D, Borovsky M, Subik J. Fluconazole and itraconazole susceptibility of vaginal yeast isolates from Slovakia. Mycopathologia 2004; 15: 163-9. [ Links ]
Recibido: 22/08/05
Aceptado: 9/01/06














