Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541versão On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.1 Ciudad Autónoma de Buenos Aires jan./mar. 2006
Gustavo E. Giusiano
Cátedra de Microbiología e Inmunología. Facultad de Medicina. Departamento de Micología. Instituto de Medicina Regional.
Universidad Nacional del Nordeste, Av. Las Heras 727, 3500 Resistencia, Chaco, Argentina
*Correspondencia. E-mail: gusgiusi@bib.unne.edu.ar
RESUMEN
El estudio del género Malassezia se mantuvo postergado durante años debido a sus estrictos requerimientos nutricionales y su variabilidad morfológica. La posibilidad de su aislamiento y la aplicación de métodos moleculares condujeron a la revisión taxonómica del género y a la renovación en el interés por su importancia clínica. Actualmente se conocen 11 especies, 10 lipofílicas, y dado que muchas de ellas tienen características morfológicas, fisiológicas y bioquímicas similares, las técnicas convencionales no resultan satisfactorias para diferenciarlas. Actualmente, los métodos moleculares prometen una mejor diferenciación y permiten avanzar en el conocimiento de la ecología y epidemiología de este género. Se han observado notables variaciones en la sensibilidad antifúngica de algunas especies, aunque no existe un método estandarizado para evaluar la relevancia clínica. Si bien poco se conoce sobre la bioquímica de estas levaduras, se ha observado que las enzimas que producen favorecen la invasión de los tejidos del hospedador, por lo que serían un importante factor de virulencia. Malassezia ha sido reconocido como comensal de piel humana y animal, pero su implicancia en procesos patológicos, que incluyen desde afecciones cutáneas hasta infecciones sistémicas, ha centrado la atención de recientes investigaciones en determinar el verdadero rol patogénico de estas levaduras.
Palabras clave: Malassezia, taxonomía, fisiología, morfología, patogenia, diagnóstico
ABSTRACT
Malassezia. Current knowledge and study perspectives. The study of Malassezia has been postponed for many years due to its nutritional requirements and its morphological variability. Molecular biology methods led to a taxonomic revision of this genus and to a new interest for its clinical importance. Nowadays, 11 Malassezia species are known, 10 are lipophilic, having similar morphological, physiological and biochemical characteristics, therefore, conventional techniques are not useful to differentiating them. Molecular methods are an accurate tool in the identification and they lead to a better knowledge of the ecology and epidemiology of this genus. Noteworthy antifungal susceptibility variations have been observed in some species, although there is not a standard method for these yeasts. There are few data about their biochemical characteristics, and the enzymes they produce might be important virulence factors, favouring host tissue invasion. Malassezia has been recognised as a member of the normal human and animal skin. Its implication in pathologic processes, including skin diseases to systemic infections, is the main issue in current investigations in order to determine the real pathogenic role of these yeasts.
Key words: Malassezia, taxonomy, physiology, morphology, pathogenicity, diagnostic
INTRODUCCIÓN
El estudio de las levaduras lipofílicas del género Malassezia ha estado relegado por más de un siglo y medio debido a una serie de factores inherentes al hongo. Sus estrictos requerimientos nutricionales, su capacidad de presentar simultáneamente forma micelial y de levadura y la inestabilidad morfológica de este último estado, han condicionado su aislamiento e identificación, dificultando por muchos años su estudio in vitro (16, 35, 36, 45, 59, 60). Malassezia ha sido reconocido como habitante normal de la piel humana y de animales, pero su implicancia en diversos procesos patológicos, que incluyen desde una serie de afecciones cutáneas hasta infecciones sistémicas, ha centrado la atención de las investigaciones más recientes (3, 11, 28, 36, 38).
La taxonomía y nomenclatura de Malassezia fue confusa y caótica hasta fines de la década del 90. El desarrollo de técnicas fisiológicas y moleculares para diferenciar sus especies condujo a la revisión de la taxonomía del género. Simultáneamente hubo una renovación en el interés sobre su importancia clínica, lo que impulsó a nuevas investigaciones para estudiar cuál es la relación de estas levaduras con determinadas enfermedades de piel y conocer el verdadero rol patogénico que juega cada una de ellas.
Historia, taxonomía y morfología
Eichstedt, en 1846, fue el primero en reconocer la naturaleza fúngica de la pitiriasis versicolor (PV), y quien describió la presencia de levaduras y micelios en materiales obtenidos de pacientes con esta afección. Robin, en 1853, lo nombró Microsporon furfur, al observar células redondeadas en la piel de pacientes con caspa. En 1874 Malassez informó sobre células brotantes de varias formas en el estrato córneo de pacientes con diversas enfermedades de piel. Casi medio siglo después de conocida la etiología de la PV, Baillon, en 1889, creó el género Malassezia en honor a Malassez, con Malassezia furfur (M. furfur) como especie tipo. La denominación de la especie hace alusión a las finas escamas, de consistencia furfurácea o parecida al salvado, que se desprenden de las lesiones en esta afección (3, 16, 26, 30, 37, 45, 60).
En 1904 Sabouraud enfatizó sobre la presencia de dos morfologías en las preparaciones de materiales de lesiones de piel. Creó el género Pityrosporum para la fase levaduriforme y mantuvo el nombre de M. furfur para la micelial. Para complejizar más la situación, la morfología variable de las levaduras llevó a algunos taxónomos a separarlas en dos especies. Castellani y Chalmers en 1913, llamaron Pityrosporum ovale (P. ovale) a la forma oval y en 1951 Gordon denominó P. orbiculare a las levaduras esféricas presentes en piel con y sin lesiones (3, 7, 16, 25, 26, 35, 45). Este fue el primer indicio de que el agente de la PV formaba parte de la biota normal de piel. P. orbiculare fue asociado a PV, y P. ovale a pitiriasis capitis (caspa) y dermatitis seborreica (DS). Por largo tiempo muchos autores creyeron que las levaduras y el micelio que observaban en las preparaciones microscópicas de materiales clínicos eran distintos organismos (11, 25, 35, 45).
En 1925 Weidman introdujo el nombre de P. pachydermatis para una especie no lipofílica aislada de animales, a la cual Dodge en 1935 propone incluirla dentro del género Malassezia (26).
Castellani y Chalmers, en 1913, fueron los primeros que lograron cultivar el agente de la PV. Benham, en 1939, fue quien por primera vez notó la necesidad de sustancias grasas exógenas en el medio de cultivo. Shifrine y Marr, en 1963, demostraron la incapacidad de este organismo para producir ácidos grasos de cadena corta, siendo ésta una condición sine qua non para su desarrollo. Esto permitió la formulación de medios de cultivo y mantenimiento, importantes para el estudio de la bioquímica, taxonomía y fisiología de este género desconocido (7, 16, 45).
En posteriores estudios se observó la inestabilidad de las formas oval y redondeada y que éstas podían cambiar de una a otra, según el medio o las condiciones de cultivo. También se aceptó la relación entre la fase levaduriforme y micelial y la posibilidad de conversión entre ellas. Esta situación fue resuelta a fines de la década del 70 cuando diferentes grupos independientes indujeron in vitro la producción de micelio a partir de la levadura. Posteriormente, en 1986, estudios micológicos, inmunológicos y análisis genéticos, confirmaron la inestabilidad morfológica de este hongo y que la levadura (oval o redondeada) y el micelio eran sólo estados simples del complejo ciclo de vida de un mismo hongo. M. furfur describía entonces sólo la fase micelial de un hongo cuyas, fases levaduriformes recibían los nombres de P. ovale y P. orbiculare, según su morfología. A partir de ese momento se deja sin efecto el uso del término Pityrosporum, adoptándose la denominación de Malassezia para cualquiera de las formas que se observen de este hongo (13, 19, 27, 37, 45, 56, 63, 68, 76). En 1989, Guého y Meyer confirman la sinonimia de las especies P. ovale y P. orbiculare al demostrar una complementariedad ADN/ADN superior a 85% (29, 30).
En 1990 Simmons y Guého presentaron una nueva especie lipofílica, M. sympodialis, en base al bajo contenido G+C (54% comparado con 66% de M. furfur) y a la gemación simpodial (71). Guillot y Guého en 1996, a través de técnicas de biología molecular, secuenciando el rARN y por comparación del ADN nuclear introdujeron 4 especies más (30, 34). A partir de ese momento, estudios genómicos y ribosomales permitieron conocer, caracterizar y clasificar las especies que hasta hoy componen este género. Malassezia actualmente está conformado por 11 especies: M. furfur, M. sympodialis, M. globosa, M. restricta, M. obtusa, M. slooffiae, M. dermitis, M. yamatoensis, M. japonica, M. pachydermatis y M. nana. También se ha postulado a M. equi, aunque hasta el momento se considera como una especie tentativamente nombrada pero todavía no formalmente descrita (30, 44, 64, 73, 74, 75).
La aplicación de técnicas moleculares, especialmente secuenciación de ADN ribosomal, ha permitido también encontrar la posición taxonómica del género. Malassezia ha sido incluido dentro del orden Malasseziales, clase Ustilagomycetes, phylum Basidiomycota y hasta la actualidad no se han descrito teleomorfos (11, 20, 37).
Fisiología, bioquímica y patogenicidad
Malassezia exhibe características morfológicas, moleculares y fisiológicas diferentes de otros géneros levaduriformes. Las células pueden ser globosas a subglobosas, ovales o cilíndricas, dependiendo de la especie (30, 35, 57). Se reproducen por brotación unipolar dejando una prominente y característica cicatriz en la célula madre (10, 11). La forma levaduriforme fue comúnmente asociada a piel normal y la micelial a procesos patológicos. Recientemente se ha informado que no todos los aislamientos de Malassezia son capaces de producir esta transformación y que la forma de levadura tiene la misma capacidad patogénica (3, 36).
Desde el punto de vista fisiológico la principal característica de estas levaduras es que son obligatoriamente lipofílicas, debido a que tienen un defecto en la capacidad de sintetizar ácidos grasos saturados de C12–C16, lo que se manifiesta en el requerimiento de una fuente exógena de esos ácidos grasos para su desarrollo (11, 13, 16, 28, 36, 45, 53, 56, 60). M. pachydermatis es la única especie del género que no requiere de sustancias lipídicas para su desarrollo (10, 14, 55, 79). Esta especie causa dermatitis y otitis externa en animales; ocasionalmente ha sido aislada de piel humana e implicada en infecciones nosocomiales sistémicas en neonatos prematuros (14, 36, 55, 79).
Debido a su carácter lipofílico, la mayoría de estas levaduras se encuentran como comensales en áreas del cuerpo con glándulas sebáceas; bajo la influencia de ciertos factores, endógenos o exógenos, pueden volverse patógenas. Malassezia puede causar o estar asociado a determinados desórdenes dermatológicos, tanto en humanos como en animales. En sujetos con condiciones predisponentes pueden causar infecciones sistémicas (2, 11, 13, 16, 28, 53, 56, 60). En la Tabla 1 se listan la afecciones que se reconocen asociadas a Malassezia.

Han sido informadas infecciones fúngicas invasoras en neonatos prematuros y pacientes con alimentación lipídica. En el año 1981 se publicó el primer caso de fungemia en un recién nacido pre-término sometido a nutrición lipídica parenteral, hoy hay más de 150 casos informados, la mayoría asociados a catéteres y con el mismo tipo de alimentación (2, 24, 50, 57, 66, 72). Es esencial, en población de riesgo con factores predisponentes, considerar la posibilidad de una infección sistémica causada por este agente que no desarrolla en los medios comunes para aislamiento. El reconocimiento de las levaduras en tejidos o en fluidos corporales, y su subsiguiente aislamiento, son necesarios para el desarrollo de una conducta terapéutica apropiada.
La asociación de las especies de Malassezia a diversas patologías ha impulsado el estudio de su ecología y capacidad patogénica. La cuestión clínica que se plantea en la actualidad es cuál es la relación particular entre las especies y determinados desordenes dermatológicos, debatiéndose si las levaduras de Malassezia son un fenómeno secundario o tienen significado como patógeno primario.
Está demostrado que hongos de este género son agentes etiológicos de la PV y la foliculitis por Malassezia (FC), que se asocia a la DS y exacerba la dermatitis atópica (DA). Por otro lado, se lo ha encontrado como agente secundario en otras afecciones de piel, pero el mecanismo patogénico está aún sin resolver. Tampoco se conoce si determinadas especies se asocian particularmente a alguna de estas patologías (3, 17, 28, 36, 37, 57, 60).
Entre los mecanismos patogénicos de este género, es conocida su gran capacidad queratolítica que produce la ruptura mecánica o química de la queratina de las células invadidas. Por otro lado, Malassezia produce una enzima con actividad lipoxigenasa que resulta en la producción de lipoperóxidos. Estos pueden dañar las membranas celulares y consecuentemente interferir con la actividad celular. Este mecanismo ha sido particularmente estudiado en PV. Asimismo, diversas teorías se han propuesto para explicar el mecanismo por el cual la pigmentación de la piel resulta alterada en la PV. Actualmente todas están en revisión, e incluso se postula la posibilidad de una sumatoria de mecanismos. Entre los más consistentes se cuentan el bloqueo en la transferencia del melanosoma al queratinocito, la producción de productos indólicos que son potentes filtros ultravioleta, la inhibición de la producción de melanina por sustancias como el ácido azelaico y la intoxicación de los melanocitos por inhibición de la tirosinasa a partir de metabolitos como el ácido dicarboxílico. Basado en estudios de los últimos 5 años, el organismo más frecuentemente asociado a la PV no es M. furfur como fue considerado por muchos años. M. globosa y M. sympodialis son las especies informadas con mayor frecuencia en esta afección (3, 8, 15, 36, 37).
El conocimiento que se tiene sobre los patrones bioquímicos de Malassezia es escaso y los pocos estudios fueron realizados antes de la revisión del género, cuando se consideraba la existencia de sólo dos especies, M. furfur y M. pachydermatis. Probablemente esos resultados deben ser reevaluados, ya sea porque correspondan a otra especie, o bien por la posibilidad de la existencia de mezclas en los cultivos. El amplio espectro de especies de Malassezia reconocido en la actualidad hace interesante el estudio de los patrones bioquímicos y del comportamiento de cada una de ellas.
Se ha demostrado la capacidad lipasa y lipoxigenasa de M. furfur y M. pachydermatis, tanto in vivo como in vitro, como así también la actividad hidrolasa extracelular (5, 49, 67). También se ha confirmado que producen fosfolipasas y proteasas. La actividad fosfolipasa causa la liberación de ácido araquidónico. Como los metabolitos del ácido araquidónico están involucrados en la inflamación en la piel, esto ha sido sugerido como el mecanismo por el cual las especies del género Malassezia podrían desencadenar un proceso inflamatorio (3, 10).
De la misma manera que otras levaduras, la actividad fosfolipasa y proteinasa de Malassezia spp., puede ser considerada un potencial determinante de virulencia y probablemente juegue un activo rol en la invasión de los tejidos del hospedador (5, 10, 67). La exposición a la fosfolipasa y a la proteinasa producidas por los microorganismos induce la formación de poros en las membranas de las células epiteliales de los mamíferos, afectando las funciones celulares y favoreciendo la invasión del tejido (10). Esto explicaría el papel de estas enzimas en la ocurrencia de lesiones de piel. Las fosfolipasas podrían ser consideradas uno de los tantos factores involucrados en la compleja interacción entre las levaduras y el hospedador, llevando al desarrollo de lesiones cutáneas (5).
Si bien la relación entre DS y Malassezia fue sugerida por Sabouraud en 1932, Malassez en 1874, fue el primero en asociarlo con descamaciones del cuero cabelludo, en alusión a la caspa. En los últimos años el género Malassezia ha sido considerado importante en la etiología de la DS, basándose en la observación del alto recuento de estos agentes en los materiales obtenidos de estas afecciones, la efectividad de los tratamientos antimicóticos y la recolonización en los casos de recurrencia (17, 28, 36, 57, 60). El mecanismo exacto no está aún determinado, pero el proceso inflamatorio que dispararía el desarrollo de la dermatitis estaría relacionado con las enzimas antes nombradas y la liberación de ácido araquidónico. Se ha observado que la cantidad de lípidos que se presentan en la piel de los individuos con esta afección es significativamente mayor que en los sujetos controles, y que fallas en la inmunidad mediada por células pueden facilitar la supervivencia del hongo sobre la piel (28).
Malassezia spp. produce foliculitis por oclusión folicular y posterior sobrecrecimiento en el folículo piloso. Esto es favorecido por factores externos y/o la reducida resistencia del hospedador (3, 11, 16, 28). La inflamación se debería a la presencia de los metabolitos de la levadura y a los ácidos grasos libres producidos como resultado de la actividad lipasa de este hongo (3, 10, 16, 17, 18).
El rol de Malassezia en la DA fue por primera vez sugerido por Clemmensen y Hort en 1983, quienes describieron los efectos positivos del tratamiento con ketoconazol en pacientes con eczemas en áreas seborreicas (11, 16). La etiología de esta afección es una predisposición genética que se manifiesta como una reactividad cutánea anormal a determinados alergenos (16, 28). De la misma manera que Candida, Malassezia es considerado un factor exacerbador de DA en zonas seborreicas, ya que los síntomas iniciales o subsecuentes exacerbaciones pueden ser disparados por este hongo (11, 60). Se han hecho estudios en pacientes con esta distribución que demostraron un 78% de positividad a las pruebas cutáneas con extractos de proteínas de Malassezia spp. (8, 11, 16, 28). Como la función de barrera está afectada y el intenso prurito resulta en excoriaciones, los antígenos del organismo presente en la piel entran en contacto con el sistema inmune y generan una respuesta. Estas levaduras pueden inducir una reacción eczematosa en pacientes con DA, siendo un importante factor disparador (11, 16). Se considera entonces que Malassezia juega un importante rol como alergeno. Por otro lado, un reciente trabajo asegura que los niveles de IgE anti M.furfur son marcadores específicos de la DA de cabeza y cuello y están correlacionados con la gravedad de la enfermedad (4).
El rol de Malassezia como secundario a otras afecciones está en estudio. Se ha observado que la sobreinfección de la psoriasis por las especies de este género puede causar una exacerbación de la misma, y el tratamiento de ella resulta en un mejoramiento de la afección. Probablemente los metabolitos de las levaduras contribuyen con la inflamación asociada con esta enfermedad.
LABORATORIO
Diagnóstico directo
La morfología peculiar de Malassezia lo hace reconocible en muestras clínicas y la microscopia directa es la de mayor importancia. La fase levaduriforme y/o micelial son fácilmente observables en el examen micológico directo con hidróxido de potasio con tinta Parker (Quink) azul negro permanente, solución de Albert o azul de metileno (1%), o en preparaciones histológicas coloreadas con ácido peryódico de Schiff (3, 9, 36, 65, 79). También es recomendado el uso de blanco de Calcofluor como método más selectivo, con el que la visualización es mejor (11, 57).
La PV es diagnosticada también por la observación de las lesiones bajo la lámpara de Wood, las cuales fluorescen con un característico color oro o amarillo vivo. Sin embargo, es importante considerar que este examen es positivo en 1/3 de los casos, limitando el uso de esta técnica como único medio diagnóstico (36, 69). Por otro lado, estudios recientes in vitro sugieren que sólo M. furfur genera los compuestos indólicos que fluorescen bajo la luz de Wood (53, 80).
Aislamiento e identificación
Dada la característica lípido-dependiente, las especies de Malassezia requieren de medios de cultivos especiales para su aislamiento, excepto M. pachydermatis. Los medios con mejores rendimientos son el medio de Dixon y el medio de Leeming y Notman. Para asegurar el aislamiento de todas las especies, la temperatura de incubación ideal es 32 °C, con un rango de 31 a 35 °C, durante un tiempo promedio de 7 días (46, 78). Medios suplementados, por ejemplo Sabouraud con aceite de oliva, han sido utilizados en el pasado pero tienen poco rendimiento, ya que algunas especies no desarrollan o tienen una sobrevida corta en este medio. M. globosa, M. obtusa y M. restricta necesitan medios más complejos, principalmente las dos últimas (31, 57).
El género Malassezia tiene características morfológicas y fisiológicas distintivas que permiten diferenciarlo de otras levaduras. Sin embargo, debido a que sus especies comparten muchas de estas características, no existe un método simple y rápido para su tipificación (23, 36). En la Tabla 2 se presenta el esquema de identificación propuesto por Guého y Guillot, basado sus características bioquímicas y fisiológicas (30, 35). Esta metodología no permite diferenciar todas las especies actualmente conocidas y necesita de experiencia en la interpretación, ya que no siempre da resultados claros. Esto se debe a que algunas especies son fisiológicamente muy similares, originando patrones semejantes y por lo tanto, resultados confusos.
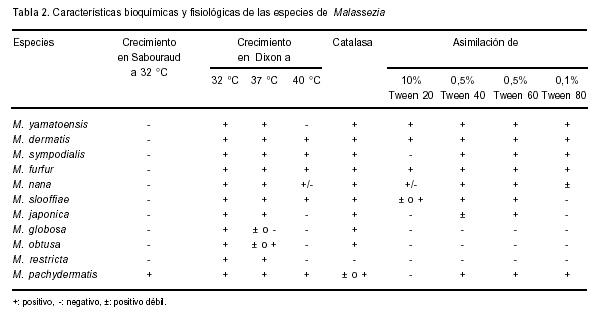
Otras pruebas adicionales han sido propuestas para mejorar la diferenciación de algunas especies. Entre ellas, la alta resistencia de M. furfur al polidocanol y la producción de pigmento en medios con triptofano (52, 54). También la capacidad de M. furfur de crecer en medios con Cremophort (aceite de castor) y la hidrólisis de la esculina (detección de β-glucosidasa) por M. sympodialis (51).
El desarrollo de diversas técnicas moleculares ayudó a resolver las desventajas de los métodos convencionales, si bien estos últimos siguen siendo una alternativa válida para diferenciar algunas especies en los laboratorios que no tienen acceso a una tecnología más compleja. En los últimos años se han propuesto varios métodos basados en la reacción en cadena de la polimerasa (PCR) con restricción enzimática (PCR-REA), en la amplificación al azar del ADN (RADP), en la electroforesis de campo pulsante (PFGE) y en la digestión por enzimas de restricción de productos de PCR (PCR-RFLP) (21, 23, 33, 41, 70, 77). Estos permiten sólo la identificación de algunas especies, basados en una sola región genómica y la detección y caracterización de mezclas en los cultivos, pero aún se busca un método certero, reproducible, simple y de bajo costo que permita la diferenciación genotípica de todas las especies hoy conocidas. En el año 2005, una técnica de PCR-RFLP fue propuesta por Mirhendi et al. para identificar las 11 especies de Malassezia (58).
Ecología de las especies de Malassezia
Las especies lípido dependientes del género Malassezia forman parte de la biota cutánea normal de la piel en el ser humano. Los recién nacidos sanos a término no están colonizados, la colonización ocurre durante el primer mes de vida y es generalmente asintomática (2, 28, 32, 48, 56, 60, 78). M. pachydermatis, la única especie no lipofílica, es primariamente zoofílica, coloniza animales de sangre caliente y es raramente encontrada en piel humana. Por otro lado, M. nana y M. equi, solamente han sido aisladas de animales (14, 44, 55, 64, 79).
Las especies lipofílicas tienen una amplia distribución en áreas de la piel con abundantes glándulas sebáceas. La mayor densidad se encuentra en pecho, oídos, espalda, cara y cuero cabelludo. Esta densidad es alta en individuos sanos a partir de la pubertad, por el incremento en la actividad de las glándulas sebáceas, y decrece con la edad debido a la reducción en el nivel de lípidos de la piel (16, 28, 36, 45, 56, 57).
Algunos grupos estudiaron la distribución de estas especies, tanto como saprofitas en sujetos sanos como asociadas a afecciones dermatológicas. En sus informes se observa una notable variación en la prevalencia en las diferentes regiones geográficas. M. globosa, M. sympodialis y M. furfur emergen, en este orden, como las especies más comúnmente aisladas de la biota normal y como agentes de diversas patologías (6, 11, 12, 37, 40, 42, 57, 60).
Algunas especies de Malassezia se asocian con mayor frecuencia con ciertas afecciones y se ha postulado la preferencia de algunas de ellas por determinados sitios anatómicos. Las variables que afectan la prevalencia son numerosas y diversas, entre ellas, la distribución geográfica, la edad, el origen étnico de la población y la composición lipídica del estrato córneo (11, 16, 23, 36, 38, 40, 42, 57, 60).
Es importante tener en cuenta que las diferencias epidemiológicas observadas en los diversos estudios, pueden deberse no sólo a factores étnicos y geográficos, sino también a la metodología utilizada, desde los medios de cultivos hasta las técnicas de identificación. Como consecuencia de la revisión reciente del género, los resultados de trabajos anteriores deben ser evaluados cuidadosamente, porque en ellos no se distinguen las especies hoy conocidas. Por otro lado, los problemas expuestos en la identificación por métodos convencionales hacen que actualmente los estudios epidemiológicos realizados con esa metodología sean cuestionados, ya que algunas especies sólo pueden ser diferenciadas por métodos moleculares (36, 57, 79).
Sensibilidad antifúngica
Los estrictos requerimientos de estas levaduras complican el estudio de la sensibilidad antifúngica in vitro. Se han ensayado diferentes metodologías, pero hasta el momento no existe un método estandarizado ni el criterio para determinar las CIMs o funguicidas (43, 61). Esto hace difícil establecer una conclusión de valor sobre la actividad in vitro de los distintos antifúngicos y que esos resultados tengan además relevancia clínica.
Se ha observado que Malassezia es sensible in vitro a los azólicos a bajas concentraciones, siendo el ketoconazol el más potente inhibidor, seguido por el itraconazol. Es también sensible, aunque con una mayor variabilidad entre las CIM, frente al fluconazol, bifonazol, econazol, miconazol, clotrimazol y nuevos azólicos como el albaconazol y voriconazol (1, 22, 35, 43, 61).
Se han informado variaciones en la sensibilidad a los azólicos entre algunas de las especies. M. sympodialis, M. slooffiae y M. obtusa son las especies más sensibles del grupo, mientras que M. globosa, M. restricta, M. pachydermatis y M. furfur son las menos sensibles. Dentro de ellas, la especie que demostró mayor sensibilidad es M. sympodialis y las menos sensibles fueron M. pachydermatis, y M. furfur (61, 62).
También se ha ensayado la terbinafina y la amorolfina, pero su actividad es menor que la de los derivados azólicos. M. sympodialis es altamente sensible a la terbinafina, así como M. furfur, M. globosa y M. obtusa son más tolerantes a este antifúngico. Por otro lado, se han detectado cepas de M. furfur que han experimentado rangos que van desde altamente sensibles a relativamente resistentes a terbinafina (39, 47).
Estos estudios han sido realizados en momentos que el género Malassezia incluía sólo 7 especies. Sería importante observar el comportamiento de las nuevas especies que hoy incluye el género.
CONCLUSIONES
Los estrictos requerimientos y la variabilidad morfológica del género Malassezia han frenado por más de 150 años el estudio in vitro de estas levaduras. Aún hoy, la metodología de laboratorio presenta grandes complicaciones para su aislamiento, mantenimiento e identificación, si bien la aplicación de métodos moleculares ha permitido obtener una correcta clasificación taxonómica del género y sus especies.
El género Malassezia está actualmente relacionado con diversas afecciones cutáneas, favorecido por la actividad de sus enzimas o metabolitos involucrados en procesos de inflamación de la piel, o capaces de dañar membranas celulares. Por otro lado, es un potencial productor de infecciones sistémicas nosocomiales, que puede ser subdiagnosticado dado que no se aísla en los medios de cultivo habituales. Quizás con la aplicación de la tecnología actual será posible conocer el rol patogénico que juega cada una de las especies, su tendencia a colonizar determinadas áreas del cuerpo, su mayor o menor virulencia y su sensibilidad a los antifúngicos.
Si bien la identificación a nivel de especie aún no tiene una aplicación clínica directa, estudios epidemiológicos y ecológicos permitirán correlacionar la distribución de las distintas especies de Malassezia con factores fisicoquímicos, inmunológicos y biogeográficos del hospedero y con ello ampliar el conocimiento sobre la patogenia de este género emergente. Además, con el aporte de posteriores estudios, la tipificación del agente podría jugar un papel importante en la selección de la terapia adecuada, pues se demuestran variaciones en la sensibilidad entre las distintas especies de Malassezia.
Agradecimiento: a la Lic. Magdalena Mangiaterra por su ayuda en la discusión del presente manuscrito.
BIBLIOGRAFÍA
1. Ahn KJ, Ashbee AR. Determination of minimum inhibitory concentrations of several azole antifungal for Malassezia furfur. Ann Dermatol 1996; 8: 187-94. [ Links ]
2. Arribi A. Funguemia por levaduras lipofílicas: ¿una rareza o simplemente infravalorada? Enf Infecc Microbiol Clin 1999; 17: 53-5. [ Links ]
3. Ashbee HR, Evans EG. Immunology of diseases associated with Malassezia species. Clin Microbiol Rev 2002; 15: 21-57. [ Links ]
4. Bayrou O, Pescquet C, Flahault A, Artigou C, Abauf N, Leynadier F. Head and neck atopic dermatitis and Malassezia-furfur-specifc IgE antibodies. Dermatol 2005; 211: 107-13. [ Links ]
5. Cafarchia C, Otranto D. Association between phospholipase production by Malassezia pachydermatis and skin lesions. J Clin Microbiol 2004; 42: 4868-9. [ Links ]
6. Canteros C, Soria M, Rivas C, Lee W, López Joffre MC, Rodero L, et al. Especies de Malassezia aisladas de patologías de piel en un centro asistencial de la ciudad de Buenos Aires, Argentina. Rev Argent Microbiol 2003; 35: 156-61. [ Links ]
7. Castellani A, Chalmers AJ. Pityrosporum ovale. En: Castellani A, Chalmers AJ, editors. Manual of Tropical Medicine. London, Baillere Tindall and Cox, 1913, p. 1747. [ Links ]
8. Clemmensen OJ, Hjorth N. Treatment of dermatitis of the head and neck with ketoconazole in patients with type I sensitivity to Pityrosporum orbiculare. Sem Dermatol 1983; 2: 26-9. [ Links ]
9. Cohen MM. A simple procedure for staining tinea versicolor (M. furfur) with fountain pen ink. J Invest Dermatol 1954; 22: 9-10. [ Links ]
10. Coutihno SD, Paula CR. Proteinase, phospholipase, hyaluronidase and chondroitin-sulphate production by Malassezia pachydermatis. Med Mycol 2000; 38: 73-6. [ Links ]
11. Crespo Erchiga V, Delgado Florencio V. Malassezia species in skin diseases. Curr Op Infect Dis 2002; 15: 133-42. [ Links ]
12. Crespo Erchiga V, Ojeda Martos A, Vera Casaño A, Crespo Erchiga A, Sánchez Fajardo F, Guèho E. Mycology of pityriasis versicolor. J Mycol Med 1999; 9: 143-8. [ Links ]
13. Cunningham AC, Leeming JP, Ingham E, Gowland G. Differentiation of three serovars of Malassezia furfur. J Appl Bacteriol 1990; 67: 439-46. [ Links ]
14. Chang HJ, Miller HL, Watkins N, Arduino MJ, Ashford DA, Midgley G. An epidemia of Malassezia pachydermtis in an intensive care nursery associated with colonization of health care workers’ pet dogs. N Engl J Med 1998; 338: 706-11. [ Links ]
15. Faergemann J. Antibodies to Pityrosporum orbiculare in patients with tinea versicolor and controls of various ages. J Invest Dermatol 1983; 80: 133-5. [ Links ]
16. Faergemann J. Atopic dermatitis and fungui. Clin Microbiol Rev 2002; 15: 545-63. [ Links ]
17. Faergemann J. Pityrosporum species as cause of allergy and infection. Allergy 1999; 54: 413-9. [ Links ]
18. Faergemann J, Bergbrant IM, Dohsé M, Scott A, Westgate G. Seborrhoeic dermatitis and Pityrosporum (Malassezia) foliculitis - characterization of inflammatory cells and mediators in the skin by immunohistochemistry. Br J Dermatol 2001; 144: 549-56. [ Links ]
19. Faergemann J, Tjernlund U, Scheynius A. Antigenic similarities and differences in genus Pityrosporum. J Invest Dermatol 1982; 78: 28-31. [ Links ]
20. Fell JW, Boekhout T, Fonseca A. Biodiversity and systematics of basidiomycetous yeast as determined by large-subunit rDNA D1/D2 domain sequence analysis. Int Syst Evol Microbiol 2000; 50: 1351-71. [ Links ]
21. Gaitanis G, Velegraki A, Frangoulis E, Mitroussia A, Tsigonia A, Tzimogianni A, et al. Identification of Malassezia species from patients skin scales by PCR-RFLP. Clin Microbiol Infect 2002; 8: 162-73. [ Links ]
22. Garau M, Pereiro M Jr, del Palacio A. In vitro susceptibilities of Malassezia species to a new triazole, albaconazole (UR-98259), and other antifungal compounds. Antimicrob Agents Chemother 2003; 47: 2342-4. [ Links ]
23. Giusiano G, Bustillo S, Mangiaterra M, Deluca G. Identificación de especies de Malassezia por PCR-REA. Rev Argent Microbiol 2003; 35: 162-6. [ Links ]
24. González-Cuevas A, Alayeto J, Juncosa T, García-Fructuoso MT, Moreno J, Latorre C. Sepsis neonatal por Malassezia furfur. Rev Iberoam Micol 1999; 16: 157-60. [ Links ]
25. Gordon MA. The lipophilic mycoflora of the skin. In vitro culture of Pityrosporum orbiculare. Mycologia 1951; 43: 524-35. [ Links ]
26. Gordon MA. Malassezia pityrosporum pachydermatis (Weidman) Dodge 1935. Sabouraudia 1979; 17: 305-9. [ Links ]
27. Guého E. Reévaluation du genre Malassezia à l’aide de la microscopie électronique et des comparations genomiques. Bull Soc Fr Mycol Méd 1988; 27: 245-54. [ Links ]
28. Guého E, Boekhout T, Ashbee HR, Guillot J, Van Belckum A, Faergemann J. The role of Malassezia species in the ecology of human skin and as pathogen. Med Mycol 1998; 36: 220-9. [ Links ]
29. Guého E, Meyer SA. A reevaluation of the genus Malassezia by means of genome comparison. Antonie van Leeuwenhoek 1989; 55: 245-51. [ Links ]
30. Guého E, Midgley G, Guillot J. The genus Malassezia with description of four new species. Antonie van Leeuwenhoek 1996; 69: 337-55. [ Links ]
31. Guillot J, Bond R. Malassezia pachydermatis. A review. Med Mycol 1999; 37: 295-306. [ Links ]
32. Guillot J, Chermette R, Ghého E. Prevalence du genre Malassezia chez les mammifères. J Mycol Med 1994; 4: 72-9. [ Links ]
33. Guillot J, Deville M, Berthelemy M, Provost F, Guého E. A single PCR-restriction endonuclease analysis for rapid identification of Malassezia species. Letters Appl Microbiol 2000; 31: 400-3. [ Links ]
34. Guillot J, Guého E. The diversity of Malassezia yeast confirmed by rRNA sequence and nuclear comparisons. Antonie van Leeuwenhoek 1996; 69: 337-55. [ Links ]
35. Guillot J, Guého E, Lesourd M, Midgley G, Chèvrier G, Dupont B. Identification of Malassezia species. A practical approach. J Mycol Med 1996; 6: 103-10. [ Links ]
36. Gupta AK, Batra R, Bluhm R, Boekhout T, Dawson T. Skin diseases associated with Malassezia species. J Am Acad Dermatol 2004; 51: 785-98. [ Links ]
37. Gupta AK, Bluhm R, Summerbell R. Pityriasis versicolor. J Europ Acad Dermatol Venereol 2002; 16: 19-33. [ Links ]
38. Gupta A, Kohli Y. Prevalence of Malassezia species on various body sites in clinically healthy subjects representing different age groups. Med Mycol 2004; 42: 35-42. [ Links ]
39. Gupta AK, Kohli Y, Faergemann J, Summerbell RC. In vitro susceptibility of seven Malassezia species to ketoconazole, voriconazole, itraconazole and terbinafine. Br J Dermatol 2000; 142: 758-65. [ Links ]
40. Gupta AK, Kohli Y, Faergemann J, Summerbell RC. Epidemiology of the Malassezia yeast associated with pityriasis versicolor in Ontario, Canada. Med Mycol 2001; 39: 199-206. [ Links ]
41. Gupta AK, Kohli Y, Summerbell RC. Molecular differentiation of seven Malassezia species. J Clin Microbiol 2000; 38: 1869-75. [ Links ]
42. Gupta AK, Kohli Y, Summerbell RC, Faergemann J. Quantitative culture of Malassezia species from different body sites of individuals with or without dermatoses. Med Mycol 2001; 39: 243-51. [ Links ]
43. Hammer KA, Carson CF, Rileyl TV. In vitro activities of ketoconazole, econazole, miconazole, and melaleuca alternifolia (Tea tree) oil against Malassezia species. Antimicrob Agents Chemother 2000; 44: 467-9. [ Links ]
44. Hirai A, Kano R, Makimura K, Robson Duarte E, Soares Hamdan J, Lachance M, et al. Malassezia nana sp. nov., a novel lipid-dependent yeast species isolated from animals. Int J System Evol Microbiol 2004; 54: 623-7. [ Links ]
45. Ingham E, Cunningham C. Malassezia furfur. J Med Vet Mycol 1993; 31: 265-88. [ Links ]
46. Leeming JP, Notman FH. Improved methods for isolation and enumeration of Malassezia furfur from human skin. J Clin Microbiol 1987; 25: 2017-9. [ Links ]
47. Leeming JP, Sansom JE, Burton JL. Susceptibility of Malassezia furfur subgroups to terbinafine. Br J Dermatol 1997; 137: 754-67. [ Links ]
48. Leeming JP, Sutton T, Fleming P. Neonatal skin as reservoir of Malassezia species. Ped Infect Dis J 1995; 8: 719-21. [ Links ]
49. Mancianti F, Rum A, Nardoni S, Corazza M. Extracellular enzymatic activity of Malassezia spp. isolates. Mycopathol 2000; 149: 131-5. [ Links ]
50. Marimón JM, García-Arenzana JM, Gil A, Paisán L. Infección asociada a catéter por Malassezia furfur en un niño prematuro. Enf Inf Microbiol Clin 1995; 13: 572. [ Links ]
51. Mayser P, Haze P, Papavassilis C, Pickel M, Gruender K, Guého E. Differentiation of Malassezia species: selectivity of Cremophort EL, castor oil and ricinoleic acid for M. furfur. Br J Dermatol 1997; 137: 209-13. [ Links ]
52. Mayser P, Haze P, Pickel M. Polidocanol sensitivity – a possible tool in the differentiation of Malassezia species. Mycoses 1997; 40: 391-5. [ Links ]
53. Mayser P, Pickel M, Erdmann F, Papavassilis C, Schmidt R. Different utilization of neutral lipids by Malassezia furfur and Malassezia sympodialis. Med Mycol 1998; 36: 7-14. [ Links ]
54. Mayser P, Wille G, Imkampe A, Thoma W, Arnold N, Monsses T. Synthesis of fluorochromes and pigments in Malassezia furfur by use of tryptophan as single nitrogen source. Mycoses 1998; 41: 265-71. [ Links ]
55. Mickelsen PA, Viano-Paulson MC, Stevens DA, Diaz PS. Clinical and microbiological features of infection with Malassezia pachydermatis in high-risk infants. J Infect Dis 1998; 157: 1163-8. [ Links ]
56. Midgley G. The diversity of Pityrosporum (Malassezia) yeasts in vivo and in vitro. Mycopathol 1989; 106 :143-53. [ Links ]
57. Midgley G. The lipophilic yeast: state of the art and prospects. Med Mycol 2000; 38: 9-16. [ Links ]
58. Mirhendi H, Makimura K, Zomorodian K, Yamada T, Sugita T, Yamaguchi H. A simple PCR-RFLP method for identification and differentiation of 11 Malassezia species. J Microbiol Methods 2005; 61: 281-4. [ Links ]
59. Moreno Giménez JC. Pitiriasis versicolor. Monog Dermatol 1995; 7: 223-43. [ Links ]
60. Nakabayashi A, Sei Y, Guillot J. Identification of Malassezia species isolated from patients with seborrhoeic dermatitis, atopic dermatitis, pityriasis versicolor and normal subjects. Med Mycol 2000; 38: 337-41. [ Links ]
61. Nakamura Y, Kano R, Mural T, Watanabe S, Hasegawa A. Susceptibility of Malassezia species using the urea broth microdilution method. Antimicrob Agents Chemother 2000; 44: 2185-6. [ Links ]
62. Nakamura Y, Rui K, Mural T, Watanabe S, Hasegawa A. Susceptibility testing of Malassezia species using the urea broth microdilution method. Antimicrob Agents Chemother 2000; 44: 2185-6. [ Links ]
63. Nazzaro-Porro M, Passi S, Caprilli P. Induction of hyphae in cultures in Pityrosporum by cholesterol and cholesterol esters. J Invest Dermatol 1977; 69: 531-4. [ Links ]
64. Nell A, James SA, Bond CJ, Hunt B, Herrtage ME. Identification and distribution of a novel Malassezia species yeast on normal equine skin. Vet Rec 2002; 150: 395-8. [ Links ]
65. Payle B, Serrano L, Biele HC, Reyes BA. Albert’s solution versus potassium hydroxide solution in the diagnosis of tinea versicolor. Int J Dermatol 1994; 33: 182-3. [ Links ]
66. Redline RW, Dahms BB. Malassezia pulmonary vasculitis in a infant on long-term intralipid theraphy. N Engl J Med 1981; 305: 1395-8. [ Links ]
67. Riciputo RM, Oliveri S, Micali G, Sapuppo A. Phospholipase activity in Malassezia furfur pathogenic strains. Mycoses 1996; 39: 233-5. [ Links ]
68. Salkin IF, Gordon MA. Polymorphism of Malassezia furfur. Can J Microbiol 1977; 23: 471-5. [ Links ]
69. Savin R. Diagnosis and treatment of tinea versicolor. J Fam Pract 1996; 43: 127-32. [ Links ]
70. Senezek D, Siesenop U, Bohm KH. Characterization of Malassezia species by means of phenotypic characteristics and detection of electrophoresis karyotypes by pulsed-field gel electrophoresis (PFGE). Mycoses 1999; 42: 409-14. [ Links ]
71. Simmons RB, Guého E. A new species of Malassezia. Mycol Res 1990; 94: 1146-9. [ Links ]
72. Sizun J, Karangwa A, Giroux JD, Masure O, Simitzis AM, Alix D, De Parscau L. Malassezia furfur-related colonization and infection of central venous catheters. A prospective study in a pediatric intensive care unit. Intensive Care Med 1994; 20: 496-9. [ Links ]
73. Sugita T, Tajima M, Takashima M, Armaya M, Saito M, Tsuboi R, et al. A new yeast, Malassezia yamatoensis, isolated from patient with seborrhoeic dermatitis, and its distribution in patients and healthy subjects. Microbiol Immunol 2004; 48: 576-83. [ Links ]
74. Sugita T, Takashima M, Kodama M, Tsuboi R, Nishikawa A. Description of a new yeast species, Malassezia japonica, and its detection in patients with atopic dermatitis and heathy subjects. J Clin Microbiol 2003; 41: 4695-9. [ Links ]
75. Sugita T, Takashima M, Shinoda T, Suto H, Unno T, Tsuboi R, et al. New yeast species, Malassezia dermatis, isolated from patients with atopic dermatitis. J Clin Microbiol 2002; 40: 1363-7. [ Links ]
76. Tanaka M, Imamura S. Immunological studies on Pityrosporum genus and Malassezia furfur. J Invest Dermatol 1979; 73: 321-4. [ Links ]
77. Theelen B, Silvestrini M, Guého E, van Belkum A, Boekhout T. Identification and typing of Malassezia yeast using amplified fragment length polymorphism (AFLP), random amplified polymorphic DNA (RAPD) and denaturing gradient gel electrophoresis (DGGE). FEMS Yeast Res 2001; 1: 79-86. [ Links ]
78. Van Abbe NJ. The investigation of dandruff. J Soc Cosmetic Chem 1964; 15: 609-30. [ Links ]
79. Van Belkum A, Boekhout T, Bosboom R. Monitoring spread of Malassezia infections in a neonatal intensive care unit by PCR-mediated genetic typing. J Clin Microbiol 1994; 32: 2528-32. [ Links ]
80. Weiss R, Raabe P, Mayser P. Yeast of the genus Malassezia: taxonomic classification and significance in veterinary and clinical medicine. Mycoses 2000; 43: 69-72. [ Links ]
Recibido: 31/10/05
Aceptado: 20/03/06














