Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.2 Ciudad Autónoma de Buenos Aires ene./abr. 2006
Aislamientos de Histoplasma capsulatum con morfología aberrante obtenidos en la República Argentina
M.F. Zuiani1, M.C. Rivas1, W. Lee1, L. Guelfand2, G. Davel1, C.E. Canteros1*
1Departamento Micología, INEI (Instituto Nacional de Enfermedades Infecciosas) - ANLIS «Dr. Carlos G. Malbrán», Vélez Sarsfield 563 (1281), Ciudad Autónoma de Buenos Aires; 2Hospital General de Agudos
Juan A. Fernández, Cerviño 3356 (C1425AGP), Ciudad Autónoma de Buenos Aires, Argentina
*Correspondencia. E-mail: ccanteros@anlis.gov.ar
RESUMEN
Por primera vez en la Argentina se describe una cepa de Histoplasma capsulatum var. capsulatum con morfotipo aberrante, obtenida de un paciente con SIDA. En los primocultivos desarrollados en agar Sabouraud a 25-28 °C, las colonias de la fase micelial fueron blancas, glabras, umbilicadas, centralmente radiadas y de bordes regulares, más semejantes a las de hongos hialinos ambientales que a las de H. capsulatum. Al examen microscópico llamó la atención la ausencia de conidios característicos, la presencia de clamidoconidios solitarios, terminales e intercalares, de 4 µm de diámetro, y el engrosamiento de las hifas. La identificación del hongo se confirmó mediante la detección de exoantígenos específicos (H y M) en los sobrenadantes de cultivos de la fase micelial y por la reversión a la fase levaduriforme típica, obtenida al incubar en agar cerebro-corazón adicionado con cisteína a 37 °C. Mediante RAPD-PCR con los iniciadores 1281-1283, el perfil del ADN genómico coincidió con el genotipo de H. capsulatum predominante entre los aislamientos de pacientes argentinos.
Palabras claves: Histoplasma capsulatum, morfología aberrante, RAPD-PCR, identificación
ABSTRACT
Histoplasma capsulatum with aberrant morphology isolated in Argentina. For the first time in Argentina, we describe a strain of Histoplasma capsulatum var. capsulatum with an aberrant morphology that was isolated from a single patient with AIDS. Mycelial phase cultures on agar Sabouraud at 25-28 °C showed white, glabrous, umbilicated and centrally radiated colonies. Unusual microscopic findings were the absence of typical conidia, the presence of terminal/intercalary chlamydoconidia with a diameter of 4 µm and of thickened hyphae. Fungal identification was confirmed by the detection of bands H and M species specific antigens in mycelial culture supernatants and reversion to the typical yeast phase on agar brain-heart-cysteine at 37 °C. The genomic DNA profile obtained by RAPD-PCR with primers 1281-1283 coincided with the predominant profile of H.capsulatum among isolates from Argentine patients.
Key words: Histoplasma capsulatum, atypical morphology, RAPD-PCR, identification
La histoplasmosis o enfermedad de Darling, producida por el hongo termodimorfo Histoplasma capsulatum var. capsulatum, es la tercera micosis sistémica en frecuencia diagnosticada anualmente en la República Argentina, después de las fungemias por levaduras y la criptococosis (5). La forma clínica diseminada de esta enfermedad es considerada marcadora de SIDA, y la asociación SIDA-histoplasmosis en nuestro país oscila entre 5,3 y 6% (14, 17).
El diagnóstico de la enfermedad se realiza por examen microscópico directo, previa coloración de Giemsa, y por cultivo de los materiales clínicos. La observación directa, considerada presuntiva, permite visualizar levaduras intracelulares (forma parasítica) en macrófagos y otras células del sistema fagocítico. Esta técnica posee una sensibilidad limitada, dependiente de la cantidad de levaduras presentes en el espécimen estudiado. El aislamiento de H. capsulatum en cultivo es el método de diagnóstico definitivo y el más sensible, especialmente en muestras de sangre, líquidos de punción y biopsias. La fase micelial desarrolla a partir de especímenes clínicos entre los 5 y 10 días de incubación a 25-28 °C en agar Sabouraud (glucosa 2%, peptona 1%, agar 1,5%). La identificación de la especie se realiza considerando las características morfológicas de la fase micelial y la capacidad de convertirse en levaduras al incubar a 37 °C en medios enriquecidos con cisteína (9).
La macromorfología típica de las colonias a 25-28 °C en agar Sabouraud es inicialmente algodonosa y blanca, tornándose pulverulenta y parda con el tiempo. Al microscopio, se observan macroconidios esféricos, de pared gruesa con proyecciones digitiformes, de 8-15 µm de diámetro; microconidios ovales, de 1-4 x 2-6 mm de diámetro e hifas delgadas y ramificadas, de 1,2-1,5 µm (6). Algunas colonias pueden ser albinas y presentar macroconidios de pared lisa (1). En la Argentina, por lo general, los aislamientos clínicos de H. capsulatum en los primocultivos son típicos de la especie (4).
La existencia de aislamientos con características morfológicas poco sugestivas de H. capsulatum fue comunicada en escasas oportunidades por algunos investigadores. Se han descrito variantes morfológicas macroscópicas para este hongo, con colonias glabras y verrugosas e incluso aislamientos de suelo con pigmento rojo o rosado, características infrecuentes para la especie (13, 18). Sutton et al. (21) comunicaron aislamientos aberrantes de H. capsulatum con colonias húmedas, cerebriformes y pigmentadas a 25-28 °C, con escasos clamidoconidios al examen microscópico. Tian y Shearer (23) observaron hifas septadas, ligeramente engrosadas y flexuosas, en mutantes de laboratorio deficientes en un gen que codifica para una proteína de 21 kDa involucrada en el proceso de termodimorfismo. También fueron descritos aislamientos incapaces de convertirse in vitro en levaduras cuando se cultivaban a 37 °C, mientras que a 25-28 °C presentaban abundantes macroconidios, característicos de H. capsulatum. Estas variantes deben ser diferenciadas de Renispora flavissima, Sepedonium spp. y Chrysosporium spp. por el parecido morfológico de los macroconidios (7, 9, 10, 19).
Nuestro objetivo es comunicar la presencia de aislamientos de H. capsulatum con características morfológicas aberrantes para la especie en la Argentina.
Se estudiaron cinco aislamientos, cuatro provenientes de hemocultivos y uno de lavado broncoalveolar, recuperados en dos episodios diferentes de histoplasmosis asociada a un paciente con SIDA.
Los tres primeros aislamientos fueron recuperados de igual número de hemocultivos seriados, obtenidos entre el 23-7-02 y el 2-9-02. En el laboratorio de origen, los cultivos desarrollados en los medios de rutina a 25-28 °C presentaron características morfológicas atípicas. Ante la sospecha de H. capsulatum, se realizó la prueba de conversión dimórfica y se obtuvo la fase levaduriforme característica de este hongo. Los aislamientos fueron derivados al Departamento Micología del INEI - ANLIS “Dr. Carlos G. Malbrán” para corroborar la identificación.
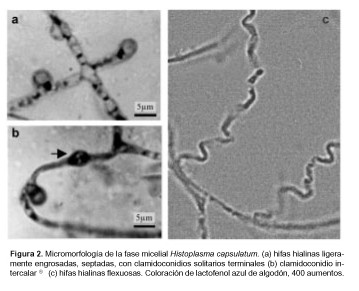
Los especímenes fúngicos fueron analizados fenotípicamente siguiendo la metodología indicada en el Manual de procedimientos del Departamento Micología del INEI - ANLIS “Dr. Carlos G. Malbrán” (3). A los 30 días de cultivo en agar Sabouraud a 25-28 °C desarrollaron colonias blancas, glabras, umbilicadas, centralmente radiadas, con márgenes regulares y sin pigmentación (Figura 1). En el examen microscópico se observaron hifas hialinas con clamidoconidios aislados terminales, subterminales e intercalares, de 4 µm de diámetro; hacia el centro de la colonia se observaron hifas ligeramente engrosadas y tortuosas. No se observaron macro ni microconidios (Figura 2). El crecimiento a 25-28 °C no fue inhibido por cicloheximida. En agar cerebro-corazón adicionado con cisteína, incubado a 37 °C, se obtuvo la fase levaduriforme típica. La identificación de H. capsulatum se confirmó por la presencia de los exoantígenos H y M específicos en cada uno de los aislamientos, mediante la técnica de inmunodifusión doble utilizando como control antígenos y antisueros comerciales (Histoplasma ID Antigen (H & M) H50110 e Histoplasma ID Control Serum (Anti-H & M) H60110, IMMY Immuno-Mycologics, INC. Norman, USA) (15).

Dos nuevos aislamientos del mismo paciente, provenientes de un hemocultivo y de un lavado broncoalveolar, fueron obtenidos luego de seis meses postratamiento con anfotericina B, e intratratamiento con itraconazol (ITZ). Estos eran fenotípicamente idénticos a los tres primeros y se identificaron como H. capsulatum.
Los cinco aislamientos mantuvieron las características descritas por el período de un año y no pudo demostrarse presencia de conidios, aun en medios que favorecen su formación .
Una vez caracterizados, los aislamientos fueron incluidos en la colección de cultivos del Departamento de Micología del INEI - ANLIS “Dr. Carlos G. Malbrán”, Buenos Aires, Argentina, con los números 031450 (acrónimo 1487/02, hemocultivo del 23 de julio del 2002), 021196 (acrónimo 1570/02, hemocultivo del 6 de agosto del 2002), 031451 (acrónimo 1742/02, hemocultivo del 2 de septiembre del 2002), 031846 (acrónimo 3162/03, hemocultivo postratamiento con anfotericina B e intra-tratamiento con ITZ, del 7 de marzo del 2003) y 031847 (acrónimo 3229/03, lavado broncoalveolar del 17 de marzo del 2003).
Los cinco aislamientos de H. capsulatum se compararon genéticamente utilizando una técnica de RAPD-PCR con los iniciadores 1281-1283 (5’-AACGCGCAAC-3’ y 5´-GCGATCCCCA-3’), técnica que permite identificar el origen geográfico de los aislamientos (4, 22).
La extracción y purificación del ADN se efectuó a partir de un cultivo de 84 h en agitación orbital (120 rpm) a 37 °C en GYE (glucosa 2%, extracto de levadura 1%), utilizando las técnicas descritas por Möller et al. (12) y Perrotta et al. (16). La PCR fue realizada en un volumen final de 25 µl con 2 mM cloruro de magnesio, 200 µM dNTPs, 1 U Taq polimerasa, 0,6 µM de cada iniciador y 2 ng de ADN genómico, en buffer de reacción 1X. La amplificación se realizó en un termociclador Perkin Elmmer Mod 9600 ver. 2.01 (Cetus Norwalk, CT). El programa de amplificación fue 94 °C 7 min, 35 ciclos de 94 °C 10 s, 36 °C 30 s, 72 °C 1 min y una extensión final de 72 °C 5 min. Los productos amplificados fueron sometidos a electroforesis en gel de agarosa 1,5% (Agarosa ultrapura, Gibco, Biological Co., NY) en buffer TAE 1X (Tris-acetato 40 mM, EDTA 2 mM pH 8,5) y teñidos con bromuro de etidio (10 µg/ml). Los perfiles de los fragmentos de ADN amplificados fueron capturados con un fotodocumentador (BioRad Gel Doc 1000, CA). Como estándar de pares de bases se utilizó 100 bp DNA Ladder (Invitrogen, Tech-line Life, CA).
Los perfiles electroforéticos de los aislamientos aberrantes obtenidos por PCR fueron comparados con ocho aislamientos clínicos de pacientes argentinos (sin antecedentes de haberse trasladado fuera del área endémica de histoplasmosis de la Argentina) y con cuatro aislamientos clínicos obtenidos en otros países americanos: Downs, de los Estados Unidos de América; G186B, de Panamá; y EH-46 y EH-325, ambos de México. Los perfiles de los cinco aislamientos atípicos resultaron idénticos entre sí y a los aislamientos obtenidos de los pacientes argentinos, pero diferían de los de otros países (Figura 3). Este análisis permite inferir que los aislamientos aberrantes estudiados son autóctonos y estarían circulando en la República Argentina.

Con frecuencia, las características macro y/o microscópicas de los primoaislamientos de H. capsulatum desarrollados a 25-28 °C sufren, a través de sucesivos cultivos in vitro, un cambio morfológico mal denominado “pleomorfismo”, que se traduce en la presencia de un micelio algodonoso y en la pérdida de la pigmentación y la conidiación. Algunos autores describen alteraciones en las estructuras microscópicas luego de tratamientos con antifúngicos (9). Sin embargo, los cinco aislamientos estudiados fueron atípicos desde su primocultivo, aun antes de iniciar el tratamiento antifúngico, lo que indicaría que las alteraciones morfológicas no se debieron a las causas antes mencionadas. Se ha postulado que los cambios en el fenotipo pueden interferir en la interacción hospedero-parásito, y en algunos casos los pacientes con SIDA pueden ser susceptibles a infecciones con microorganismos que comúnmente no causan enfermedad en otros grupos de pacientes (8, 20). El hecho de que este aislamiento aberrante haya producido enfermedad en un paciente con SIDA podría reafirmar este postulado; sin embargo, se han descrito previamente aislamientos atípicos obtenidos a partir de pacientes inmunocompetentes (10). Cabe mencionar que estamos estudiando otras cepas de estas características, provenientes de pacientes sin causa aparente de inmunocompromiso y sin antecedentes de tratamientos previos (datos no publicados).
Los sucesivos aislamientos de una misma cepa antes y durante el tratamiento específico podrían deberse a resistencia a los antifúngicos administrados. Esto no puede demostrarse y queda en el terreno de lo especulativo, porque hasta el momento no han sido estandarizadas las pruebas de sensibilidad a antifúngicos in vitro para H. capsulatum. Otra causa de la persistencia de la cepa podría ser la falta de adherencia del paciente al tratamiento, hecho que no surgió de la anamnesis.
Este es el primer informe de aislamientos aberrantes de H. capsulatum en la Argentina. Se desconoce la frecuencia de aparición de este tipo de cepas relacionadas con casos clínicos. Consideramos importante, desde el punto de vista epidemiológico, la comunicación de estos aislamientos para conocer su verdadera incidencia y alertar a los microbiólogos sobre la posibilidad de aparición de colonias atípicas de H. capsulatum, que pueden confundirse con hongos hialinos ambientales. Existen kits comerciales basados en técnicas moleculares para identificar H. capsulatum, como el AccuProbe (GenProbe, San Diego, CA) (19), pero son costosos para el sistema de salud argentino y se han detectado resultados falsos positivos (2). Actualmente se están desarrollando técnicas de PCR con iniciadores diseñados a partir de la secuencia que codifica para la proteína antigénica M y PCR en tiempo real, para la identificación rápida de aislamientos (7, 11). Hasta el momento, estas técnicas no han sido adaptadas como insumos comerciales para laboratorios, y su utilidad aún debe ser evaluada con un mayor número de aislamientos.
Debido a lo expuesto, la detección de exoantígenos específicos y la prueba de dimorfismo siguen siendo los estudios de elección en todos los casos que sea necesario confirmar la identidad de H. capsulatum; en especial, en aislamientos con características poco sugestivas para la especie obtenidos de pacientes con múltiples tratamientos o con inmunocompromiso grave, en los que cabe sospechar histoplasmosis.
Agradecimientos: los autores agradecen las sugerencias realizadas por la Dra. Viviana Ritacco para la elaboración de este manuscrito. Las cepas Downs, G186B, EH-46 y EH-325 fueron gentilmente cedidas por la Dra. Lucia Taylor.
BIBLIOGRAFÍA
1. Berliner MD. Primary subcultures of Histoplasma capsulatum. I. Macro and micro-morphology of the mycelial phase. Sabouraudia 1968; 6: 111-8. [ Links ]
2. Brandt ME, Gaunt D, Iqbal N, McClinton S, Hambleton S, Sigler L. False-positive Histoplasma capsulatum Gen-Probe Chemiluminescent test result caused by a Chrysosporium species. J Clin Microbiol 2005; 43: 1456-8. [ Links ]
3. Canteros C, Davel G, Rodero L. El laboratorio y el diagnóstico de las micosis sistémicas, 2003, INEI ANLIS «Carlos G. Malbrán», Buenos Aires, Argentina. [ Links ]
4. Canteros C, Zuiani MF, Rivas MC, Lee W, Tiraboschi IN, Guelfand L et al. Caracterización genotípica y fenotípica de aislamientos de Histoplasma capsulatum de pacientes de diferente regiones geográficas y con distinto grado de inmunocompromiso. XVII Congreso Latinoamericano de Microbiología, X Congreso Argentino de Microbiología, 2004, Resumen H-390, Buenos Aires, Argentina. [ Links ]
5. Davel G. Actualización en el diagnóstico y la epidemiología de las micosis. IX Congreso Argentino de Microbiología, 2001, Resumen MR 4, p. 15, Buenos Aires, Argentina. [ Links ]
6. de Hoog GS, Guarro J, Gene J, Figueras MJ. Atlas of Clinical Fungi, Centraalbureau voor Schimmelcultures, Utrecht, The Netherlands and Universitat Rovira i Virgili. Reus, Spain, 2000, p. 708-11. [ Links ]
7. de Matos Guedes HL, Guimaraes AJ, de Medeiros-Muniz M, Pizzini CV, Hamilton AJ, Peralta JM et al. PCR assay for identification of Histoplasma capsulatum based on the nucleotide sequence of the M antigen. J Clin Microbiol 2003; 41: 535-9. [ Links ]
8. Eissenberg LG, Goldman WE. Histoplasma variation and adaptive strategies for parasitism: new perspectives on histoplasmosis. Clin Microbiol Rev 1991; 4: 411-21. [ Links ]
9. Kwon-Chung KJ, Bennett JE. Histoplasmosis. En: Lea & Febiger (Ed). Medical Mycology, Philadelphia-London, 1992, p. 464-513. [ Links ]
10. Lacaz CD, Del Negro GM, Vidal MS, Heins-Vaccari EM, Santos RF, Martins MA et al. Atypical disseminated cutaneous histoplasmosis in an immunocompetent child, caused by an “aberrant” variant of Histoplasma capsulatum var. capsulatum. Rev Inst Med Trop Sao Paulo 1999; 41: 195-202 [ Links ]
11. Martagon-Villamil J, Shrestha N, Sholtis M, Isada CM, Hall GS, Bryne T et al. Identification of Histoplasma capsulatum from culture extracts by real-time PCR. J Clin Microbiol 2003; 41: 1295-8. [ Links ]
12. Möller EM, Bahnweg G, Sandermann H, Geiger HH. A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi, fruit bodies, and infected plant tissues. Nucleic Acids Res 1992; 20: 6115-6. [ Links ]
13. Morris PR, Terreni AA, DiSalvo AF. Red-pigmented Histoplasma capsulatum-an unusual variant. J Med Vet Mycol 1986; 24: 231-3. [ Links ]
14. Negroni R, Robles AM, Arechavala A. Histoplasmosis progresiva Estudio en un lapso de 10 años. Rev Argent Micología 1994; 17: 14-21. [ Links ]
15. Ouchterlony O, Nilsson LA. Immunodiffusion and immuno-electrophoresis. En: Weir DM, ed. Handbook of Experimental Immunology. Oxford, Blackwell Scientific Publications, 1978, p. 19.1-19.44. [ Links ]
16. Perrotta D, Abrantes R, Canteros C, Rodero L, Davel G. Caracterización molecular de aislamientos clínicos de Histoplasma capsulatum var. capsulatum mediante RAPD-PCR. Rev Argent Microbiol 2001; 33: 160-6. [ Links ]
17. Pietrobon D, Negro-Marquínez, Kilstein J, Galindez J, Greca A, Battagliotti C. Histoplasmosis diseminada y SIDA en un hospital argentino: manifestaciones clínicas, diagnós- tico y tratamiento. Enferm Infecc Microbiol Clin 2004; 22: 156-9. [ Links ]
18. Rippon WJ. Histoplasmosis (histoplasmosis capsulati). En: Tratado de Micología Médica. México, Nueva Editorial Interamericana-Mc Graw-Hill Inc, 1990, p. 411-56. [ Links ]
19. Sandin RL, Isada CM, Hall GS, Tomford JW, Rutherford I, Rogers AL et al. Aberrant Histoplasma capsulatum. Confirmation of identity by a chemiluminescence-labeled DNA probe. Diagn Microbiol Infect Dis 1993; 17: 235-8. [ Links ]
20. Spitzer ED, Keath EJ, Travis SJ, Painter AA, Kobayashi GS, Medoff G. Temperature-sensitive variants of Histoplasma capsulatum isolated from patients with acquired immunodeficiency syndrome. J Infect Dis 1990; 162: 258-61. [ Links ]
21. Sutton DA, Padhye AA, Standard PG, Rinaldi MG. An aberrant variant of Histoplasma capsulatum var. capsulatum. J Clin Microbiol 1997; 35: 734-5. [ Links ]
22. Taylor ML, Chavez-Tapia CB, Reyes-Montes MR. Molecular typing of Histoplasma capsulatum isolated from infected bats, captured in Mexico. Fungal Genet Biol 2000; 30: 207-12. [ Links ]
23. Tian X, Shearer G. The mold-specific Ms8 gene is required for normal hypha formation in the dimorphic pathogenic fungus Histoplasma capsulatum. Eukariotic Cell 2002; 1: 249-56. [ Links ]
Recibido: 12/12/05
Aceptado: 26/06/06














