Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.38 no.2 Ciudad Autónoma de Buenos Aires Jan./Apr. 2006
Mohos y levaduras en agua envasada y bebidas sin alcohol
E. G. Ancasi, L. Carrillo*, M. R. Benítez Ahrendts
Cátedra de Microbiología Agrícola, Facultad de Ciencias Agrarias, UNJu Alberdi 47, (4600) SS Jujuy, Argentina.
*Correspondencia. E-mail: lcarrillo@arnet.com.ar
RESUMEN
La aparición esporádica de alteraciones en algunos envases dentro de lotes de aguas carbonatadas y de bebidas con zumos frutales (carbonatadas y no carbonatadas) motivó la presente investigación, en la que se determinaron los microorganismos causantes del deterioro observado. También se estudiaron los contaminantes del azúcar utilizado en la elaboración de una de las bebidas analizadas. Se emplearon los métodos de Déak y Beuchat y de Pitt y Hocking para la identificación de levaduras y de mohos, respectivamente. Las levaduras causantes del deterioro de las bebidas fueron Debaryomyces hansenii, Debaryomyces polymorphus, Galactomyces geotrichum, Metschnikowia pulcherrima, Mucor circinelloides, Pichia anomala, Pichia jadinii, Pichia subpelliculosa, Rhodotorula glutinis y Zygosaccharomyces bailii. Los mohos y las levaduras encontrados en el azúcar fueron Aspergillus niger, Aspergillus penicilloides, Aspergillus versicolor, Cladosporium sphaerospermum, Mucor racemosus, Pichia anomala y Rhizopus stolonifer. En el agua carbonatada se encontraron los mohos Paecilomyces fulvus y Penicillium glabrum.
Palabras clave: levaduras, mohos, bebidas sin alcohol, agua carbonatada, azúcar
ABSTRACT
Moulds and yeasts in bottled water and soft drinks. Some damaged cartons of soft drinks and carbonated water were analyzed to detect the microorganisms that caused the damage. The contaminants of sugar used in the production of one of the drinks were also studied. The methods of Déak & Beuchat and Pitt & Hocking were used for the identification of yeasts and moulds, respectively. The agents of the spoilage of soft drinks were Debaryomyces hansenii, Debaryomyces polymorphus, Galactomyces geotrichum, Metschnikowia pulcherrima, Mucor circinelloides, Pichia anomala, Pichia jadinii, Pichia subpelliculosa, Rhodotorula glutinis and Zygosaccharomyces bailii. The microorganisms found in sugar were Aspergillus niger, Aspergillus penicilloides, Aspergillus versicolor, Cladosporium sphaerospermum, Mucor racemosus, P. anomala and Rhizopus stolonifer. Paecilomyces fulvus and Penicillium glabrum were observed in carbonated water.
Key words: yeasts, moulds, soft drinks, carbonated water, sugar
Los jugos de frutas usados en la preparación de bebidas sin alcohol son ácidos (pH entre 3 y 4) y tienen un contenido de azúcares de hasta 15° Brix. La microbiota que es posible encontrar en ellos está constituida por bacterias lácticas, mohos y levaduras. Los hongos que causan deterioro en estos productos toleran una alta presión osmótica y un bajo pH, y suelen crecer a las temperaturas de refrigeración, aunque la concentración inhibitoria mínima de benzoato de sodio y sorbato de potasio disminuye cuando la actividad del agua, el pH y la temperatura de incubación decrecen. Algunas levaduras son extraordinariamente resistentes a los conservantes (4).
Dado que esporádicamente se han observado alteraciones en algunos envases de lotes de bebidas carbonatadas y no carbonatadas que contenían zumos frutales, así como de aguas, se determinaron los microorganismos que causaron el deterioro. También se estudiaron los contaminantes presentes en el azúcar utilizada para la elaboración de una de las bebidas.
Para efectuar los análisis se seleccionaron unidades que presentaban aumento de la turbiedad o deformación del envase. Se analizaron 8 muestras compuestas (1 a 5 unidades tomadas del mismo lote) de bebidas sin alcohol a base de zumos frutales, carbonatadas y no carbonatadas. También se analizó una muestra de agua carbonatada y una muestra de azúcar formada por 4 subunidades provenientes de diferentes bolsas.
Para el aislamiento de las levaduras, se hicieron diluciones en una solución de sacarosa al 10% y Tween al 0,05% en el caso de los jugos concentrados, o de peptona al 0,5% y Tween al 0,05% para los otros productos. Se sembraron alícuotas en placas de agar triptona-glucosa-extracto de levadura-cloranfenicol (TGY) o agar extracto de malta-extracto de levadura-20% de glucosa (MG20G) (6), y se incubaron a 25 °C durante 3 a 10 días en ambiente húmedo. Se hizo el recuento y se observó bajo la lupa la micromorfología de las colonias. Se hicieron preparaciones en fresco y coloreadas según Wirtz (7). Se tomaron en cuenta el aspecto macroscópico (color, forma y tamaño de las colonias) y el microscópico (forma y tamaño celular, posición de los brotes, presencia o ausencia de ascosporas, tipo y número de las mismas) (6). Las colonias de levaduras basidiomicéticas se diferenciaron de las ascomicéticas inundando las placas con sal de azul de diazonio B al 1% en solución reguladora de fosfatos pH 7,2 (8).
Los equipos diseñados para la identificación rápida de levaduras en materiales clínicos, sobre la base del crecimiento y la acción enzimática, permiten identificar entre 76 y 86% de las cepas aisladas de alimentos. Sin embargo, con el empleo de las técnicas clásicas se reconocen el 89% de los géneros de levaduras y el 74% de las especies, mientras que los métodos basados en las secuencias de ácidos nucleicos, ajustados para incluir las cepas ambientales, permiten la correcta identificación del 98% de los géneros y del 94% de las especies (1). Con su método, Déak y Beuchat (3) lograron identificar el 91% de 166 cepas de jugos concentrados y bebidas a base de jugos, y dada su accesibilidad, fue el método elegido para el presente trabajo.
Se hicieron cultivos por duplicado en agar-glucosa-peptona-extractos de malta y levadura (3), y se incubaron unos a 25 °C y otros a 37 °C durante 5 días.
Con el fin de hacer la prueba de ureasa, se empleó un medio base al que se le agregó 2% de urea. Para evaluar la asimilación de nitrato y de cadaverina se usó el medio base carbonado, y el medio base nitrogenado se empleó para estudiar la utilización de azúcares (con 1% de celobiosa, eritritol, galactosa, inositol, lactosa, manitol, melezitosa, melibiosa, rafinosa, ramnosa, trehalosa o xilosa, y 0,02% de extracto de levadura como fuente de vitaminas). Para obtener los correspondientes testigos, se sembraron tubos sin nitrato y sin azúcar (3).
Para observar la fermentación de glucosa, se empleó el medio triptona-extracto de levadura (3) con azul de bromotimol y 2% de glucosa, distribuido en tubos con una campanita invertida. La resistencia a la cicloheximida se observó en el medio triptona-extracto de levadura-glucosa con 0,01% de cicloheximida (3).
El aislamiento de los mohos se hizo por cultivo directo sobre agar-extracto de malta-peptona-glucosa (MEA) (6) de los filamentos suspendidos en agua, los que se incubaron a 25 °C durante 5 días. Para el recuento de mohos y levaduras presentes en el azúcar, se hicieron diluciones con una solución de peptona al 0,5% y Tween al 0,05% y se sembraron alícuotas en MEA. Con el fin de identificar los mohos, se los sembró por punción en tres puntos en placas con MEA, con agar-Czapek-extracto de levadura (CYA) y con agar-base Czapek-25% de glicerol (G25N) (6), y se incubó a 25 °C durante 7 días en ambiente húmedo. Se hicieron otros cultivos sobre MEA, los que se incubaron a 5 °C y a 37 °C durante igual tiempo. Luego de la incubación, se midieron los diámetros de las colonias, se observaron las características del anverso y del reverso, y se hicieron preparados microscópicos. Con los datos registrados se consultaron las claves dadas por Pitt y Hocking (6).
En la Tabla 1 se indican las muestras analizadas y las especies de microorganismos aislados. En general, el número de colonias observado por ml de bebida osciló entre 4 x 102 y 3,5 x 106, y los mayores valores se encontraron en aquellos envases que presentaban deformación debido a la presión del dióxido de carbono generado durante la fermentación, como en el caso de la muestra 1 donde la alteración se observó después de 40 días. Esta muestra correspondía a una bebida carbonatada con 10% de jugo de naranjas, 8,6% de azúcares totales, ácido cítrico, benzoato sódico 353 ppm, tartrazina y rojo ponceau. Los valores de pH para las diferentes unidades fueron 3,78; 4,05; 4,08; 4,09 y 4,15. La cepa de Zygosaccharomyces bailii obtenida de la muestra 1 resultó ser muy resistente al conservante, pues creció en medio glucosa-peptona-extractos de malta y levadura con 0,1% de ácido benzoico.
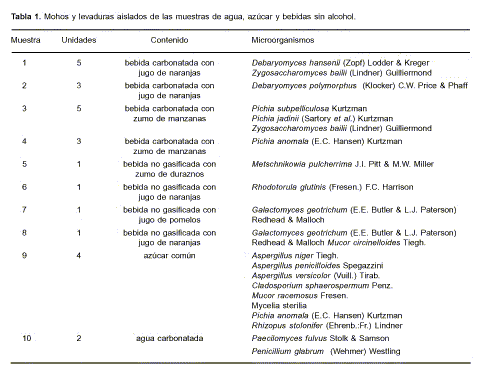
La muestra 2 era una bebida dietética gasificada con 10% de jugo de naranjas, 7,5% de azúcares totales, ácido cítrico, sacarina sódica, ciclamato sódico, benzoato sódico, esencia de naranja, tartrazina y rojo ponceau. Las muestras 3 y 4 eran de bebidas carbonatadas con zumo de manzanas. El pH de una de las unidades de la primera era 3,46 y el contenido de CO2 era 3,5 v/v (valor nominal 2,7 v/v). El pH de otra unidad analizada en dicha muestra fue 3,47 y el contenido de CO2 de 2,8 v/v.
La muestra 5 era una bebida no gasificada con 50% de zumo y pulpa de durazno, ácido cítrico, ciclamato de sodio, sacarina de sodio, benzoato de sodio, sorbato de potasio, eritorbato de sodio y ácido ascórbico. Las muestras 6, 7 y 8 eran bebidas no gasificadas con 10% de jugo de naranjas, 40% de jugo de pomelos y 20% de jugo de naranjas, respectivamente.
La muestra 9 fue tomada de bolsas de azúcar empleada en la elaboración de una de las bebidas. Los recuentos de mohos y levaduras oscilaron entre 400 y 8000 UFC/g. La muestra 10 era agua carbonatada y pertenecía a las primeras unidades del lote, que fueron las únicas que se encontraban alteradas después de un mes de almacenamiento a temperatura ambiente.
Las levaduras no sólo pueden causar alteraciones organolépticas sino también producir gran cantidad de CO2 durante la fermentación de los monosacáridos (como en el caso de Z. bailii) y el envase suele estallar o deformarse (2), como ocurrió en una de las muestras estudiadas. El rango de pH para una inhibición microbiana óptima por el ácido benzoico es 2,5-4,0 (4). Algunas levaduras alteran el ambiente cambiando el pH o degradando los conservantes ácidos. Otras, como Saccharomyces cerevisiae y Z. bailii, pueden crecer hasta pH 2,8 y además en jugos concentrados con 50° Brix porque tienen un sistema enzimático que produce solutos compatibles. Z. bailii no es capaz de fermentar sacarosa ni puede emplear los ácidos benzoico y sórbico como fuente de carbono (2), aunque suele crecer en concentraciones de hasta 700 mg/l de ácido sórbico o 1200 mg/l de ácido benzoico (4).
Las especies de levaduras presentes con mayor frecuencia en jugos y bebidas sin alcohol contaminados son Brettanomyces bruxellensis, Candida tropicalis, Candida stellata, Debaryomyces hansenii, Hanseniaspora uvarum, Issatchenkia orientalis, Pichia anomala, S. cerevisiae, Torulaspora delbrueckii, Z. bailii y Zygosaccharomyces rouxii (1, 5). Otras especies contaminantes son Citeromyces matritensis, Metschnikowia pulcherrima, Pichia jadinii, Pichia subpelliculosa y Rhodotorula glutinis (3), mientras que Debaryomyces polymorphus es un habitante del suelo (5). La mitad de estas especies fueron observadas en las muestras analizadas.
Los mohos y levaduras forman parte de la microbiota inicial de la caña de azúcar, se encuentran en las melazas y pueden permanecer en el producto cristalizado, según el proceso empleado. El azúcar refinado suele recontaminarse con los microorganismos suspendidos en el aire o por las superficies en contacto (4).
El agua carbonatada fue envasada luego del procesamiento de bebidas azucaradas, y se interpreta que el aerosol dejado en el ambiente por la actividad precedente proporcionó nutrientes suficientes como para permitir la proliferación de los mohos contaminates. Paecilomyces fulvus es un contaminante que puede crecer con 60% CO2 y 0,5% O2, mientras que Penicillium glabrum ha sido aislado de bebidas carbonatadas. El suelo constituye el reservorio de ambos (6).
Las pérdidas económicas debidas al deterioro de los jugos de frutas (naturales o concentrados) y de las bebidas que con ellos se preparan, se reducen mediante los buenos procedimientos higiénicos durante la obtención de los jugos y el envasado de las bebidas, y mediante el almacenamiento a baja temperatura (1).
BIBLIOGRAFÍA
1. Arias CR, Burns JK, Friedrich LM, Goodrich RM, Parish ME. Yeasts species associated with orange juice: evaluation of different identification methods. Appl Environ Microbiol 2002; 68: 1955-61. [ Links ]
2. Battey AS, Duffy S, Schaffner DW. Modeling yeast spoilage in cold-filled ready-to-drink beverages with Saccharomyces cerevisiae, Zygosaccharomyces bailii and Candida lipolytica. Appl Environ Microbiol 2002; 68: 1901-6. [ Links ]
3. Déak T, Beuchat LR. Handbook of Food Spoilage Yeasts. CRC Press, Boca Raton, 1996, p. 65-7, 126-40, 152-4. [ Links ]
4. International Commission on Microbiological Specifications for Foods. Microorganisms in Food. Vol. 6: Microbial Ecology of Food Commodities. Blackie Academic & Professional, London, 1998, p. 418-24, 440-57. [ Links ]
5. Kurtzman CP, Fell JW, editors. The Yeasts. A Taxonomic Study. 4° ed. Elsevier Science, New York, 1998, p. 167. [ Links ]
6. Pitt JI, Hocking AD. Fungi and Food Spoilage. Blackie Academic & Professional, London, 1997, p. 30-1, 44-6, 205-08, 242-44, 509-13. [ Links ]
7. Vanbreuseghem R. Guide Pratique de Mycologie. Masson et Cie, Paris, 1966, p. 181. [ Links ]
8. Van der Walt JP, Hopsu-Havu VK. A colour reaction for the differentiation of ascomycetous and hemibasidiomycetous yeasts. Antoine Van Leeuwenhoek 1976; 42: 157-63. [ Links ]
Recibido: 13/6/05
Aceptado: 3/7/06














