Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.3 Ciudad Autónoma de Buenos Aires jul./sep. 2006
Abiotrophia y Granulicatella
Horacio A. Lopardo
Servicio de Microbiología, Hospital de Pediatría "Prof. Dr. Juan P. Garrahan". Combate de los Pozos 1881, (1245) Ciudad Autónoma de Buenos Aires; Cátedra de Microbiología Clínica, Facultad de Ciencias Exactas, Universidad Nacional de La Plata, Argentina. Correspondencia. E-mail: hlopardo@garrahan.gov.ar
RESUMEN
Las antiguamente denominadas variantes nutricionales de estreptococos (VNS) pertenecen a dos géneros, Abiotrophia y Granulicatella, los que desarrollan en medios líquidos con el agregado de sangre humana o, mejor aún, de 0,001% de clorhidrato de piridoxal (ClHP) y 0,1% de clorhidrato de cisteína (ClHCys). Estas bacterias requieren de la ayuda de otros microorganismos para desarrollar en medios sólidos comunes (satelitismo). El satelitismo y la pirrolidonilarilamidasa (PYR) son pruebas indicadoras para VNS. También pueden desarrollar en forma de pátina en medios con base de agar Columbia, sin agregados, lo que puede inducir a confusiones. Las infecciones más frecuentemente documentadas han sido las endocarditis. Entre las infecciones extravasculares, las más frecuentes son las oculares. Para la realización de las pruebas de sensibilidad a los antibióticos se pueden usar el Etest y los métodos de dilución, siempre con el agregado de 0,001% de ClHP. Cualquiera sea el método utilizado, parecería no haber demasiada correlación in vitro / in vivo. La resistencia a penicilina es similar en porcentaje y valores de CIM a la observada en estreptococos del grupo viridans. Para el tratamiento de endocarditis por VNS se recomienda la utilización de penicilina más gentamicina durante 4 a 6 semanas, y en caso de falla terapéutica o alergia a ß-lactámicos, el uso de vancomicina sola o con agregado de gentamicina y/o rifampicina.
Palabras clave: variantes nutricionales de estreptococos, Streptococcus adjacens, Streptococcus defectivus, Abiotrophia, Granulicatella
ABSTRACT
Abiotrophia and Granulicatella. The nutritionally variant streptococci (NVS) belong to two genera: Abiotrophia and Granulicatella. NVS grow in culture media with 0.001% pyridoxal hydrochloride (PHC) and 0.1% cysteine hydrochloride (CysHC). These bacteria need the help of other organisms to grow on common solid media showing the effect known as "satellitism". Both, satellitism and the pyrrolidonilarilamidase test are the key tests for suspecting the presence of NVS. They can grow as a faint haze on blood agar or chocolate agar prepared with the Columbia agar base without adding any other substance. The most frequently documented infections are endocarditis. Among extravascular infections, ocular infections predominate. For antimicrobial susceptibility testing, the Etest and dilution methods with the addition of 0.001% PHC can be used. Whichever the method there does not seem to be much correlation in vitro / in vivo. The rate of penicillin resistance and the MICs were similar to those observed in viridans group streptococci. Four to six weeks of penicillin plus gentamicin is recommended for the treatment of VNS endocarditis. In cases of treatment failure or ß-lactam allergic susceptibility, vancomycin alone or with the addition of gentamicin and/or rifampin is used.
Key words: nutritionally variant streptococci, Streptococcus adjacens, Streptococcus defectivus, Abiotrophia, Granulicatella
INTRODUCCIÓN
Desde su primera descripción concreta a principios de los años 60, las mal llamadas variantes nutricionales de estreptococos (VNS) recibieron distintas denominaciones y despertaron la atención de clínicos, infectólogos y microbiólogos por los frecuentes fracasos de tratamiento, por las dificultades para su recuperación a partir de materiales clínicos y por las complicaciones para definir su sensibilidad a los antibióticos. Algunas revisiones sobre este tema fueron publicadas hace más de diez años en idioma inglés y sobre ellas basaremos parte de nuestra discusión (85-86). Sin embargo, creemos necesario retomar el tema teniendo en cuenta resultados más recientes, nuestras propias observaciones y los cambios taxonómicos que definieron los nuevos géneros Granulicatella y Abiotrophia. Por razones prácticas, utilizaremos la sigla VNS para referirnos en conjunto a los microorganismos incluidos en estos dos géneros.
Utilizando como palabras clave Granulicatella, Abiotrophia, nutritionally variant streptococci, Streptococcus defectivus y Streptococcus adjacens, se efectuó una búsqueda bibliográfica y posterior revisión de los artículos publicados acerca del tema. Hasta diciembre de 2005 se encontraban registradas 155 publicaciones referidas a VNS en la base de datos PubMed, y una adicional en la base LILACS. Veintinueve eran descripciones de casos de endocarditis o bacteriemia, 18 eran descripciones de infecciones extravasculares, 14 se referían a temas taxonómicos y/o métodos de identificación, 7 a características culturales, 15 a sensibilidad antibiótica y/o tratamiento de infecciones por VNS, 22 a propiedades metabólicas, inmunológicas o características patogénicas, 5 al rol de estos microorganismos en la cavidad oral, 9 eran de medicina veterinaria y 5 eran revisiones. Veinticuatro trabajos (de los cuales 10 trataban de endocarditis) eran de carácter general e incluían comentarios o casos correspondientes a VNS, 2 estaban referidos a variantes nutricionales de Streptococcus pyogenes y 5 no tenían vinculación directa con infecciones por VNS. Otras referencias fueron tomadas de la bibliografía citada en estos artículos y por consulta en medios no considerados en los buscadores utilizados (p.ej.: Clinical Microbiology Newsletter).
El objetivo de esta actualización es describir a estos microorganismos desde su morfología hasta su patogenia y su sensibilidad a los antimicrobianos.
HISTORIA Y CLASIFICACIÓN
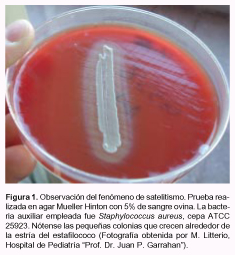
Unos microorganismos denominados "estreptococos difteroides alfa-hemolíticos" fueron mencionados por primera vez en 1909 por Babes y Manolescu en una publicación en idioma alemán, citada por Lamanna en su revisión de 1944 (52). Es probable que estos microorganismos fueran los mismos que Loewe et al. denominaron SBE en 1946 y que para Frenkel y Hirsch eran formas L de estreptococos (35). Se considera que esta última fue la primera descripción de las llamadas luego "variantes nutricionales de estreptococos", dado que los autores pusieron de manifiesto por primera vez el fenómeno de "satelitismo" (Figura 1) (35). Este consiste en la necesidad que tienen estas bacterias de ser auxiliadas por otros microorganismos para poder desarrollar en medios comunes (ver más adelante). Sus requerimientos nutricionales –dependencia de clorhidrato de piridoxal (ClHP)–, su variabilidad en la coloración de Gram, su pleomorfismo y su microaerofilia fueron destacados tiempo después por varios autores (16, 18, 62). Al principio se los consideró mutantes deficientes de especies ya conocidas dentro de los estreptococos del grupo viridans (16, 26, 80). Roberts et al. basaban su presunción de que se trataba de mutantes de Streptococcus mitis en resultados de pruebas de fermentación de azúcares y en los porcentajes de ramnosa hallados en su pared celular (80). Otros autores encontraron también similitud con esta especie en la respuesta inmune generada por los carbohidratos de su pared celular (102). Sin embargo más tarde, Bouvet et al., tras un exhaustivo análisis de un número relativamente grande de aislamientos, concluyeron que se trataba de un grupo diferente de bacterias (11). Se observó que daban positiva la prueba de pirrolidonilarilamidasa (PYR) y que bioquímicamente se comportaban en forma heterogénea, como para conformar tres biotipos distintos que fueron incluidos en dos especies: Streptococcus defectivus (biotipo 1) y Streptococcus adjacens (biotipos 2 y 3). Bouvet et al., estudiando los patrones de restricción del ARNr de S. defectivus y S. adjacens, demostraron variaciones intraespecie que sugerían la existencia de dos subespecies en S. adjacens (10).
El estudio de las secuencias del ARNr 16S de las cepas "tipo" o de referencia de estas especies permitió establecer un nuevo género, Abiotrophia, en el que ambas especies quedaban incluidas. Las especies fueron denominadas Abiotrophia defectiva y Abiotrophia adiacens (49).
Luego fueron agregadas nuevas especies: Abiotrophia elegans, cuya particularidad más notable era su requerimiento de clorhidrato de cisteína (ClHCys) en lugar de ClHP (81), Abiotrophia balaenopterae, aislada de ballenas (53), y la no del todo aceptada Abiotrophia para-adiacens, aislada de endocarditis humana (48).
Collins y Lawson propusieron la creación del género Granulicatella para abarcar las especies Granulicatella adiacens, Granulicatella balaenopterae y Granulicatella elegans, y así diferenciarlas de A. defectiva, que aparecía como filogenéticamente distinta (23). En la Figura 2 pueden observarse sus diferencias genéticas en la secuencia de sus respectivos ácidos ribonucleicos ribosomales de 16S respecto de otras bacterias relacionadas.

CARACTERÍSTICAS MORFOLÓGICAS Y CULTURALES
Morfología microscópica
La morfología microscópica de estas bacterias fue excelentemente documentada por Zierdt en 1992 (109). Formas gram-negativas aberrantes y cadenas de cocos normales o deformados coexistían en los extendidos, aunque en condiciones más permisivas para su desarrollo predominaban las formas regulares de cocos gram-positivos (Figura 3). Coincidentemente, Clark et al. señalaron que en los extendidos de bacterias desarrolladas en las proximidades de la bacteria helper, en una prueba de satelitismo, se veían cocos gram-positivos dispuestos en pares y en cadenas cortas. Por el contrario, en aquéllos correspondientes a colonias obtenidas de la parte más externa del desarrollo, se podían apreciar formas filamentosas y globulares que se coloreaban de rojo o violeta con la tinción de Gram. Más aún, variando las concentraciones de piridoxal desde 10 000 a 0,01 µg/ml se pasaba de formas normales cocáceas a formas aberrantes (22). Por microscopía electrónica se comprobó que las paredes celulares variaban desde ser estructuras inexistentes a otras anormalmente gruesas. Aparecían siempre con anomalías a nivel del septum y de la agregación ribosomal, entre otras. A veces se las podía observar como cadenas aplastadas en forma de pilas de monedas (Figura 4) (109).


Morfología de las colonias
Estas bacterias desarrollan en agar sangre ovina o en medios suplementados con ClHP formando colonias pequeñas, brillantes, frecuentemente alfa-hemolíticas, alrededor de colonias de estafilococos o de otras bacterias. Aproximadamente un 10% de las cepas son dimórficas y ese dimorfismo (colonias pequeñas y colonias más grandes) se perpetúa aun después de varios subcultivos (22).
Requerimientos nutricionales
Las VNS pueden ser una de las causas determinantes de ese porcentaje de casos de endocarditis bacterianas que quedan sin diagnóstico etiológico (5 - 30%). Este hecho podría deberse a dos factores principales:
a. dificultad en el desarrollo en las botellas de hemocultivos;
b. dificultad en el desarrollo de los subcultivos de esos caldos.
El agregado de sangre favorece el desarrollo de las VNS en medio líquido. Similarmente a la sangre humana, la sangre de conejo parece aportar buenos nutrientes para estas bacterias; la sangre de caballo es menos efectiva y menos aún las de oveja y buey (40). Roberts et al. afirmaban que no hacían falta mayores agregados a estos medios cuando se cultivaba sangre, porque la sangre humana contenía entre 20 y 45 µg/ml de ClHP (80).
Dado que son los eritrocitos y no el plasma o suero los que contienen cantidades significativas de piridoxal, es necesario agregar a los medios sangre entera y no solamente suero (40).
Tillotson describió la capacidad de varios medios líquidos para permitir el crecimiento de estas bacterias. Utilizó caldo infusión cerebro corazón (BHI, Lab M, Salford, UK), Fastidious Anaerobe Broth (FAB, Lab M, Salford, UK), caldo Todd-Hewitt (Difco, Detroit, USA) y Nutrient Broth (Oxoid, Basingktoke, UK). Estos medios se utilizaron con el agregado de ClHP (100 µg/ml finales) o 10% de sangre humana fresca, o sin adición. El FAB fue el único medio en el que desarrolló la cepa en estudio, en las tres condiciones. En los otros medios sólo desarrolló con el agregado de sangre fresca humana (98). Reimer y Reller, en forma coincidente, comprobaron que las VNS crecían en casi todos los medios líquidos a los que se agregaba sangre (78). Con este agregado, estos investigadores obtuvieron desarrollo visible en caldo tioglicolato (BBL o Gibco), caldo tiol (Difco), caldo suplementado con peptonas (BBL) y caldo Columbia (BBL). Por el contrario, obtuvieron resultados negativos con caldo tripteína de soja (BBL o Difco) y con caldo BHI (Difco). Otros medios, utilizados para el crecimiento de microorganismos anaerobios (p. ej. caldo Schaedler), también se comportaron en forma eficiente en la recuperación de VNS.
No obstante producir turbiedad en todos estos medios, las bacterias sólo permanecieron viables después de las 72 h en FAB y caldo tiol, probablemente por la acidificación de los otros medios, que contenían glucosa. Cooksey et al. obtuvieron resultados similares con los caldos tioglicolato y Schaedler, y destacaron las ventajas del agregado de sangre o de clorhidrato de piridoxal al caldo Todd-Hewitt (26).
Actualmente se sabe que los dos factores más importantes para el desarrollo de las VNS son el ClHP y el clorhidrato de cisteína (ClHCys). La respuesta a su aporte es dependiente de la especie y aun de la cepa. Se ha señalado que G. elegans desarrolla mejor con el agregado de ClHCys que con la adición de ClHP (81).
Los caldos del viejo BACTEC radiométrico contenían 0,05% de ClHCys y 0,001% de ClHP (33) y, por lo tanto, resultaban aptos para la recuperación de las VNS. Los caldos correspondientes a los equipos automatizados más modernos también contienen este tipo de nutrientes y, de este modo, el crecimiento de las VNS es detectado normalmente.
Peterson et al. ensayaron varias alternativas en medio sólido, de las cuales las más aceptables fueron agar sangre de oveja, agar chocolate con base de agar Columbia y agar sangre con base de agar Brucella. Estos investigadores no obtuvieron desarrollo en agar sangre con base tripteína de soja, ni en agar BHI o agar Mueller Hinton, si no se les efectuaba el agregado de piridoxal y/o cisteína (73). Se advirtieron diferencias en la capacidad de lotes de agar Columbia de diferente procedencia para la recuperación de microorganismos exigentes, como Streptococcus adjacens (probablemente G. adiacens): el agar base Columbia N° 2 y el agar base Columbia EH de Difco resultaron superiores a su similar de BBL (29).
Bouvet et al. idearon un medio semisintético (CDMT) en el que desarrollaban estas bacterias sin dificultad. No obstante, los tiempos de duplicación en ningún caso bajaron de 2 h, valor muy superior al registrado con los estreptococos del grupo viridans (12).
Dusch et al. (29) encontraron que S. adjacens (probablemente G. adiacens) desarrollaba mejor en agar sangre que en agar chocolate.
De toda la literatura consultada, se desprenden los siguientes conceptos:
1) las VNS desarrollan en medios líquidos con el agregado de sangre humana (p.ej.: caldos de hemocultivos adicionados con la sangre del paciente);
2) pueden desarrollar también en algunos caldos anaeróbicos, sin agregado de sangre o nutrientes especiales;
3) dada la variabilidad de requerimientos de las distintas cepas, se recomienda el agregado de 0,001% de ClHP y 0,1% de ClHCys a los medios de cultivo;
4) pueden desarrollar en forma de pátina en agar sangre o agar chocolate con base de agar Columbia, sin agregados. De este modo, el microbiólogo puede confundirse al iniciar su marcha de identificación, ya que parecen no tener requerimientos nutricionales por no observarse el típico satelitismo.
Satelitismo
Como ya se dijo previamente, Frenkel y Hirsch (35) describieron este fenómeno en 1961 (Figura 1). Este consistía en la provisión de nutrientes por parte de otra bacteria que crecía en forma concomitante, de modo que aparecían colonias "satélites" de estas VNS alrededor de las colonias de la otra bacteria (helper). Frenkel y Hirsch descubrieron este efecto en forma casual, por presencia de bacterias contaminantes en una placa donde se subcultivó un caldo de hemocultivo. A partir de allí, ensayaron la capacidad de diversas especies bacterianas e incluso de levaduras para aportar al medio los nutrientes necesarios para el desarrollo de las VNS. Sólo algunas cepas de Streptococcus pyogenes y Pseudomonas aeruginosa resultaron inefectivas (35). Mc Carthy y Bottone también ensayaron diversas bacterias y factores en la prueba de satelitismo (62) (Tabla 1).

El satelitismo resulta de gran utilidad en la separación de los géneros Abiotrophia y Granulicatella respecto de Gemella, un género poco emparentado genéticamente (Figura 2), pero con gran similitud en su perfil de pruebas bioquímicas (Tabla 2).

Sin embargo, estas no son las únicas bacterias que exhiben satelitismo. Dentro de los cocos gram-positivos catalasa negativos se han descrito cepas de S. pyogenes nutricionalmente deficientes que mostraban un satelitismo similar al de las VNS (51, 76). También cepas de Ignavigranum pueden requerir de bacterias helper para desarrollar en medios sólidos (24).
CARACTERÍSTICAS FENOTÍPICAS E IDENTIFICACIÓN
Se trata de cocos gram-positivos inmóviles, que desarrollan en cadenas en medios líquidos en condiciones nutricionalmente permisivas.
Algunos investigadores señalaron las dificultades que demandaba el reconocimiento de estas bacterias, incluso a nivel de género. Bottone et al. describieron cepas que no revertían a las formas cocáceas, consideradas normales, y que, por el contrario, permanecían bajo formas aberrantes (filamentosas o con protuberancias), que podían confundirse con Erysipelothrix rhusiopathiae o Streptobacillus moniliformis (6). La identificación a nivel de género resulta más sencilla cuando quedan claramente definidas como cocos gram-positivos catalasa negativos, que se disponen en cadenas al desarrollar en medios líquidos (Tabla 2).
La característica primaria de mayor utilidad en la identificación a nivel de grupo (Granulicatella + Abiotrophia) es el ya señalado satelitismo en medios no permisivos para el desarrollo per se de estas bacterias: agar tripteína de soja o agar Mueller Hinton, en ambos casos con el agregado de 5% de sangre ovina. Como bacteria auxiliar o helper, generalmente se utiliza cualquier cepa de estafilococo. Esta prueba no debe realizarse con medios preparados con base de agar Columbia puesto que, como antes se indicó, muchas cepas de Abiotrophia y Granulicatella pueden desarrollar en ellos en forma de una fina pátina, sin necesidad de contar con una bacteria auxiliar. Esto podría valorarse erróneamente como "satelitismo negativo" (58).
Las pruebas de PYR y LAP pueden dar resultados débilmente positivos, aunque son inconfundiblemente positivas en la batería de pruebas del API 20 Strep (13).
La especie G. adiacens da positiva la prueba de ß-glucuronidasa y negativa la de a-galactosidasa, y produce ácido a partir de tagatosa pero no de lactosa, trehalosa y pululano, reacciones que la diferencian de A. defectiva. La poco reconocida especie G. para-adiacens tampoco produciría ácido de tagatosa. A diferencia de las otras especies, G. elegans da positiva las pruebas de arginina deshidrolasa e hipurato, y no produce ácido de trehalosa, tagatosa ni pululano (Tabla 3) (21).

De acuerdo a nuestra experiencia y a la literatura consultada, se podrían hacer las siguientes sugerencias:
1) para llegar a la identificación a nivel de grupo (VNS), es necesario utilizar las pruebas básicas recomendadas para cocos gram-positivos catalasa negativos: bilis esculina, negativa; desarrollo en NaCl al 6,5%, negativo; pirrolidonilarilamidasa (PYR), positiva o débilmente positiva; leucinaminopeptidasa (LAP), positiva o débilmente positiva; resistencia a vancomicina, negativa (sensible); formación de cadenas en caldo tioglicolato, positiva;
2) la prueba de satelitismo positivo refuerza la identificación presuntiva de VNS y al observarse, dicha presunción debería ser informada al cuerpo médico;
3) los métodos miniaturizados API 20 Strep o Rapid ID32 Strep pueden ser utilizados para realizar pruebas adicionales que permitan identificar la especie. No es recomendable guiarse solamente por la identificación basada en el bionúmero que surge de la base de datos, sino que conviene consultar las tablas de identificación de la literatura y hacer un análisis más minucioso de las pruebas.
Pigmento
Una característica de las VNS, que comparten con algunas cepas de Streptococcus mitis, es la producción de un cromóforo rosado-rojo que se encuentra localizado en la pared celular. Este pigmento puede ponerse en evidencia por extracción con ácido en caliente (12, 95, 101). Aparentemente, se requiere una reacción de hidrólisis para su liberación, pues las condiciones de extracción son drásticas: elevada temperatura y pH = 2.
Stein y Libertin compararon la capacidad de tres medios de cultivo para poner en evidencia este cromóforo. El medio Todd-Hewitt adicionado con extracto de levadura y un medio semisintético con agregado de un dialisado de Todd-Hewitt fueron los más efectivos. En conjunto, tuvieron una sensibilidad del 95,8% en la producción del pigmento (93).
Este cromóforo tiene una absorbancia máxima entre 504 y 513 nm y un pKa de 3,6 (95).
Actividad bacteriolítica
Se ha descrito la producción de algunas sustancias antagónicas del desarrollo bacteriano de varias especies por parte de componentes habituales de la flora orofaríngea. Pompei et al. en 1990 describieron la actividad bacteriolítica de tres cepas de VNS, aisladas de endocarditis, sobre una bacteria indicadora (Micrococcus luteus AH-47) (74). Estos mismos autores encontraron que las VNS eran los únicos cocos gram-positivos catalasa negativos capaces de liberar enzimas proteolíticas. Según otros autores, las bacterias de la especie S. adjacens (probablemente G. adiacens) serían las únicas VNS aptas para desplegar actividad lítica sobre la nombrada cepa indicadora (96).
Métodos moleculares
Ohara-Nemoto et al. describieron un método de polimorfismo de las longitudes de los fragmentos obtenidos por restricción (RFLP) para identificar las dos principales especies de VNS, A. defectiva y A. (Granulicatella) adiacens (69). Los iniciadores estaban dirigidos para reproducir secuencias de la fracción 16S del ARN ribosomal de ambas especies. Las desventajas del método eran: (a) estos gérmenes no se podían detectar e identificar a partir de muestras polimicrobianas o cultivos mixtos, y (b) no permitía inferir la presencia de cepas atípicas ni de otras pertenecientes a especies relacionadas, como p.ej.: A. (Granulicatella) elegans. Un año más tarde, Roggenkamp et al. desarrollaron dos métodos de PCR simple, uno destinado a la identificación de lo que entonces era el género Abiotrophia (hoy Abiotrophia + Granulicatella), y el otro diseñado para poner en evidencia a A. (Granulicatella) elegans (82).
CARACTERÍSTICAS ANTIGÉNICAS Y FACTORES DE VIRULENCIA
Según estudios realizados antes de la última clasificación, el 97% de las VNS estaba incluido en dos serotipos, I y II. Tanto estos dos como el serotipo III estaban determinados por moléculas anfipáticas poliméricas. Las correspondientes al serotipo I estaban localizadas tanto intra como extracelularmente (37).
El peptidoglucano de la pared celular de estos microorganismos es similar al de los estreptococos, e incluye la presencia del dímero de D-alanina en la formación de los puentes (100). En su composición intervienen glucosamina, glucosa, galactosa, ribitol y pequeñas cantidades de ramnosa (100). Esta composición es similar para los diferentes serotipos. Su concentración varía según el estado de la bacteria: disminuye al llegar a la fase estacionaria.
Se describieron diferentes patrones electroforéticos de proteínas ligadoras de penicilina (PBP), probablemente correspondientes a dos de las especies ahora conocidas. Uno de los patrones mostraba 4 bandas entre 68 y 85 kD y una de menor peso molecular, mientras que el otro mostraba 5 bandas entre 62 y 188 kD (13).
La patogénesis de la endocarditis infecciosa comienza con la adherencia del microorganismo infectante a una válvula cardíaca dañada. Las estructuras que intervienen en esa adherencia son la matriz de fibronectina y la matriz extracelular del tejido dañado. S. defectivus, actualmente A. defectiva, parece tener avidez por esta última a través del gen emb, que codifica para una proteína fibrilar (61).
Veinticuatro cepas de VNS fueron ensayadas en pruebas de patogénesis sobre tejido cardíaco dañado en ratas cateterizadas. A. adiacens (probablemente G. adiacens) y A. defectiva demostraron una mayor capacidad invasiva que las diez cepas de A. para-adiacens (probablemente G. para-adiacens) y A. elegans (probablemente G. elegans). Las cepas de A. adiacens (G. adiacens) y A. defectiva demostraron poseer capacidad de unión a fibronectina grande y moderada, respectivamente. La baja o despreciable capacidad de unión de las otras dos especies permite suponer una posible relación entre la avidez de unión a fibronectina y la infectividad de las VNS (70).
IMPORTANCIA CLÍNICA
Hábitat
Las VNS fueron descritas como microorganismos comensales de la zona orofaríngea y de las mucosas urogenital y digestiva del hombre (80). Entre las 141 especies más frecuentes (de las más de 700 existentes como comensales de la cavidad oral humana) se encuentran las del género Granulicatella (1). A. adiacens (G. adiacens) y A. defectiva fueron aisladas de muestras de saliva y de placas dentales de 92 estudiantes sanos en un estudio de portación (97,8% de la población evaluada), con frecuencias de colonización de 87,1% y 11,8%, respectivamente (70). Otros investigadores verificaron el predominio de A. adiacens (G. adiacens) sobre otras VNS en la cavidad oral y, por otra parte, observaron que A. elegans (G. elegans) representaba un 8% de las VNS de la boca (89).
Tanto A. adiacens (G. adiacens) como A. defectiva y Gemella spp. son microorganismos predominantes en la placa dental precoz. Su capacidad de producir pequeñas cantidades de SH2 podría ser un factor de virulencia involucrado en la iniciación de la enfermedad periodontal (64). Sin embargo, en un estudio de 448 muestras de placas dentarias de pacientes pediátricos, se observó que A. defectiva no se encontraba asociada a caries dentales (27).
Parece razonable pensar que la cavidad oral pudo haber sido una frecuente puerta de entrada de las VNS en los casos de endocarditis infecciosa humana.
Estos microorganismos fueron aislados también de la cavidad oral de los perros (31).
Bacteriemia
La recomendación de efectuar la coloración de Gram en forma ciega de los frascos de hemocultivos procesados por el método clásico contribuyó, sin duda, a comprobar la existencia de estos microorganismos, de crecimiento dificultoso. Frecuentemente, los caldos de hemocultivo están adicionados con nutrientes, entre los que se encuentran el ClHP y el ClHCys. Estos componentes, actuando en forma sinérgica con la sangre del paciente, permiten el desarrollo de las VNS en los caldos de hemocultivo. En varios casos, los métodos automatizados han demostrado ser efectivos en el reconocimiento de estas bacterias (Berberián et al., resultados no publicados).
En bacteriemias por VNS es frecuente que se observen cocos gram-positivos en los extendidos realizados con gotas de caldos de hemocultivo, y que luego no se obtenga desarrollo en los subcultivos en medio sólido. Por ello, en estos casos se recomienda efectuar la prueba de satelitismo, además de realizar un cultivo en anaerobiosis para la búsqueda de cocos anaerobios.
Las VNS fueron predominantemente aisladas a partir de muestras de sangre en los laboratorios de Microbiología Clínica. En una revisión de 97 microorganismos recibidos en dos centros de referencia, Christensen y Facklam encontraron que 84 de ellos provenían de hemocultivos (21). Probablemente, la trascendencia de estos hallazgos (la mayoría de endocarditis) hayan sesgado esta estadística. Del mismo modo, la mayor facilidad de los microbiólogos para poner en evidencia la presencia de VNS en muestras de hemocultivos pudo haber contribuido a esta diferencia notable entre cepas aisladas de sangre y aquéllas aisladas de otros materiales clínicos.
En 1974, Mc Carthy y Bottone describieron cuatro casos de sepsis posparto y dos bacteriemias en pacientes con cirrosis hepática, producidas por bacterias que manifestaban el fenómeno de satelitismo (62).
Leonard et al., en el año 2001 describieron un caso de bacteriemia por Abiotrophia sp. en un drogadicto endovenoso de 42 años, que desarrolló un aneurisma micótico en la arteria braquial derecha (55).
Murray et al. reportaron un episodio de neutropenia y fiebre debido a una cepa multirresistente de A. (Granulicatella) elegans en un paciente de 61 años con miastenia gravis (65).
Recientemente, una confusa presentación de dos casos clínicos intentó poner en duda si el aislamiento de VNS en sangre podría ser la causa o la consecuencia de la enfermedad infecciosa de los pacientes allí descritos (54). La interpretación de los autores acerca de la posibilidad de que ciertos procedimientos en el tracto respiratorio pudieran haber sido el origen de bacteriemias, al menos en uno de los pacientes que tenía diagnóstico de endocarditis infecciosa, parece un tanto aventurada.
Endocarditis
Son raros los casos de endocarditis infecciosa en los que el agente causal no puede ser recuperado de las muestras de hemocultivo. La literatura refiere que entre 3 y 28% de los pacientes con diagnóstico clínico de endocarditis presentaban hemocultivos persistentemente negativos (30). Si bien los factores pueden ser diversos, la presencia de microorganismos de crecimiento dificultoso, como las VNS, puede ser uno de ellos (14).
Se calcula que estos microorganismos causan 3 a 5% de las endocarditis "estreptocócicas" (80).
Stein y Nelson revisaron 30 casos clínicos publicados hasta 1987 (91). En todos ellos los pacientes se presentaban con una enfermedad subaguda, de curso lento e indolente. El 90% de los pacientes eran portadores de alguna enfermedad cardíaca de base. Su evolución era más tórpida que la de las endocarditis producidas por estreptococos del grupo viridans: 27% presentó embolización, 17% sufrió recaídas y 17% falleció. Además, se registró falla bacteriológica en el 38% de los casos, a pesar de haberse suministrado una terapia antibiótica aparentemente adecuada (penicilina + aminoglucósidos) a 2/3 de ellos. Estos casos se resolvieron quirúrgicamente: 27% requirieron la colocación de válvulas protésicas. La muerte, generalmente, fue consecuencia de fenómenos de embolización o de la falla cardíaca congestiva incontrolable por insuficiencia valvular. Las edades oscilaron entre 6 y 88 años (8 de los 30 casos eran pediátricos). En 14 casos estaba comprometida la válvula aórtica, en nueve la mitral, en dos probablemente la mitral, en un caso estaban involucradas ambas válvulas y en cuatro no se describió la localización.
En una serie de 200 casos de endocarditis por estreptococos y enterococos, Bouvet encontró que 138 (69%) habían sido producidos por estreptococos del grupo viridans incluyendo a los estreptococos del grupo bovis, 38 (19%) por enterococos, 18 (9%) por estreptococos ß-hemolíticos y sólo 6 (3%) por VNS (8).
Hasta el 2001, en la literatura se habían descrito más de 100 casos de endocarditis por VNS (14). Sólo un 10% fueron endocarditis de válvula protésica. Recientemente se describió el caso de un paciente de 18 años con enfermedad cardíaca compleja, previamente corregida con múltiples injertos, incluyendo una válvula pulmonar de origen bovino. Este recibió tratamiento con vancomicina + gentamicina + rifampicina y se curó recién después del reemplazo valvular, al igual que en otros cuatro casos citados en el mismo trabajo (Tabla 4) (47).

La endocarditis, de por sí, es una enfermedad poco frecuente en pediatría. Los microorganismos más asiduamente aislados son Staphylococcus aureus y estreptococos del grupo viridans. En este grupo etáreo también suelen registrarse casos en que el cultivo resulta negativo (5-20%) (36). En el año 2002 se publicaron 13 casos de endocarditis por VNS que correspondían a niños (20). Lamentablemente, los autores incurrieron en errores y omisiones que descalifican sus conclusiones: incluyeron un caso no producido por este tipo de bacterias (72), desconocieron un accidente cerebrovascular en un paciente (34) y omitieron dos casos en los que se registró falla terapéutica (75, 103). Según nuestra revisión, el 72,2% de los casos pediátricos de endocarditis por VNS tenían alguna enfermedad cardíaca subyacente (Tabla 5). En la revisión de Chang et al., un paciente (8%) había recaído a pesar de un tratamiento de 24 días con vancomicina + gentamicina y otro (8%) había fallecido por falla cardíaca congestiva. Estos datos podrían haber hecho pensar que las VNS se comportarían de forma diferente en las endocarditis de los niños respecto de las de los adultos. Sin embargo, los trabajos revisados por nosotros y nuestra experiencia personal indican todo lo contrario: 5 casos de falla de tratamiento (27,7%), tres pacientes sometidos a cirugía (16,7%) y uno fallecido (5,6%), entre los 18 analizados. La puerta de entrada oral fue sospechada en tres casos en que los pacientes fueron sometidos previamente a maniobras dentales (Tabla 5).

Resumiendo, puede decirse que de acuerdo con Bouvet (9):
- las VNS son responsables de un 3-5% de las "endocarditis estreptocócicas";
- podrían ser responsables de una buena parte de las "endocarditis con cultivo negativo";
- se observa falla clínica y bacteriológica hasta en un 25 a 40% de los casos, tanto en niños como en adultos, a pesar de haberse efectuado un tratamiento adecuado según los ensayos in vitro;
- más del 25% de los pacientes requiere de un recambio valvular;
- la morbilidad y mortalidad exceden las de las endocarditis producidas por estreptococos del grupo viridans y enterococos.
Infecciones extravasculares
La mayor parte de la literatura relacionada con VNS está referida a casos de bacteriemia y/o endocarditis. Quizás la dificultad en evidenciar la presencia de estas bacterias en infecciones extravasculares pueda deberse a su apariencia pleomórfica en la coloración de Gram o a su incapacidad de desarrollar en varios medios sólidos no suplementados, como agar tripteína de soya con 5% de sangre ovina.
Según la literatura disponible, sólo 39 casos de infecciones extravasculares por VNS fueron publicados a lo largo de 44 años (1961-2005).
Frenkel y Hirsch, cuando en 1961 describieron por primera vez el satelitismo de estas bacterias, mencionaron que una de las cepas había sido aislada a partir de un paciente con otitis media (35). En 1974, George reportó casos de otitis externa, infecciones de heridas y secreción vaginal producidos por dichos microorganismos (38). En 1975 Carey et al. describieron las propiedades de VNS aisladas de un absceso pancreático (16).
Ciento un aislamientos de VNS (55 compatibles con G. adiacens, 43 con A. defectiva y 3 con G. elegans) fueron estudiados en el Statens Serum Institut de Dinamarca y en el CDC de Atlanta, Estados Unidos. Cincuenta y ocho por ciento de los 97 pacientes tenían el diagnóstico clínico de endocarditis y 26% eran bacteriemias o septicemias. Sólo dos aislamientos de A. defectiva y cuatro de G. adiacens habían sido obtenidos de sitios extra-vasculares. Los dos aislamientos de A. defectiva habían sido recuperados a partir de infecciones oculares y los cuatro de G. adiacens habían sido obtenidos de senos paranasales, médula ósea, absceso escrotal y úlcera ocular (21). Las características clínicas de otros 27 pacientes con infecciones extravasculares debidas a VNS se describen en la Tabla 6. En ella se incluyeron un hematoma infectado, un absceso pulmonar, cuatro abscesos cerebrales, un absceso epidural posterior a una meningitis, una meningitis iatrogénica, dos infecciones de rodilla postquirúrgicas (artritis posprotésicas), una artritis séptica primaria, tres posibles osteomielitis vertebrales, una sacroileítis acompañada de discitis, diez infecciones oculares (una conjuntivitis neonatal, tres endoftalmitis y seis queratitis), una infección urinaria asintomática en un paciente pediátrico con uropatía compleja y una sinusitis en una niña inmunocomprometida (2, 3, 19, 32, 33, 42, 44, 46, 50, 58, 63, 67, 71, 79, 83, 84, 90, 106, 107). Se excluyeron de la tabla aquellos casos que no estuvieran acompañados de suficiente información.


En las infecciones extravasculares no se observaron tantas fallas terapéuticas como se han relatado en casos de endocarditis por VNS.
Resumiendo:
- dentro de las infecciones extravasculares, las más numerosas fueron las oculares;
- las infecciones extravasculares por VNS pueden ponerse de manifiesto por el desarrollo concomitante fortuito de una bacteria helper o por el uso de agar Columbia como base para el agar sangre y/o el agar chocolate. Raramente se han detectado por la observación de microorganismos en el examen directo que luego no desarrollaban en los cultivos;
- son infecciones clínicamente significativas, pero aparentemente responden mejor a los tratamientos convencionales que las endocarditis.
SENSIBILIDAD A LOS ANTIBIÓTICOS (ENSAYOS IN VIVO E IN VITRO)
Pruebas de sensibilidad in vitro
Gephart y Washington (39) ensayaron 17 aislamientos de VNS por microdilución empleando el caldo Todd-Hewitt suplementado con 0,001% de ClHP y sólo le agregaron sangre lisada de caballo (LHB), a una concentración final de 5%, a la serie de tubos que contenía trime-toprima-sulfametoxazol. El inóculo fue calculado considerando que una suspensión con turbiedad equivalente a la del tubo N°1 de la escala de McFarland correspondía aproximadamente a 108 UFC/ml. En forma estimativa, la concentración final fue de 105 UFC/ml.
Otros autores utilizaron caldo Mueller Hinton con 3% de LHB y 0,001% de ClHP, o caldo Schaedler suplementado con 0,001% de ClHP o sin suplementar para las pruebas de microdilución (25, 65). En estos estudios no se efectuaron comparaciones con otros medios.
El método de Etest parece ser de utilidad para efectuar pruebas de sensibilidad con estos microorganismos exigentes, pues desarrollan mejor en medio sólido. Douglas et al. compararon las pruebas de Etest empleando varios medios de cultivo con los métodos convencionales de dilución en medio líquido y en medio sólido (28). El inóculo utilizado fue de 105 UFC/ml para el método de macrodilución, de 105 UFC/gota para el método de dilución en medio sólido y de 108 UFC/ml para el método de Etest. En este último caso, en lugar de diseminar los inóculos con hisopo, se los volcó sobre las placas con medio de cultivo y se eliminó el exceso. Estos autores probaron 14 microorganismos por dilución en caldo Todd-Hewitt suplementado con 0,001% de ClHP, por dilución en agar Mueller Hinton suplementado con 5% de LHB y 0,001% de ClHP y Etest en diversos medios: (i) agar Co-lumbia + 5% de LHB+ 0,001% ClHP, (ii) agar Isosensitest + 5% de LHB+ 0,001% ClHP, (iii) agar Isosensitest + 5% de LHB+ 0,001% ClHP + 0,01% de ClHCys, (iv) agar Mueller Hinton + 5% de sangre equina desfibrinada + 0,001% ClHP, (v) agar Mueller Hinton + 5 de sangre equina desfibrinada + 5% de LHB+ 0,001% ClHP + 0,01% de ClHCys y (vi) agar Mueller Hinton + 5% de LHB+ 0,001% ClHP. De todos estos medios, los que contenían Isosensitest, el (iv) y el (i) tuvieron menos porcentaje de error al compararse con los métodos de referencia.
El agregado de cisteína puede interferir con la actividad de la penicilina (66), aunque en concentraciones menores de 0,01% su actividad parecería ser despreciable.
La incubación fue realizada en 5% de CO2 a 35 °C para los métodos de microdilución en medio líquido, Etest y dilución en medio sólido, y en atmósfera normal para macrodilución en medio líquido (28, 39). El tiempo de incubación fue de 18 h para Douglas et al. (28) y 24-48 h para Gephart y Washington (39).
La macrodilución en medio líquido en Todd-Hewitt con 0,001% de ClHP también fue utilizada por otros autores, que además lo emplearon para efectuar curvas de muerte (92).
El método de dilución en medio sólido fue empleado por Cooksey y Swenson (25). Estos autores utilizaron agar Schaedler suplementado con 5% de sangre desfibrinada de conejo y 0,001% de ClHP. Este método, lamentablemente, no fue comparado con otros y se lo consideró como método de referencia para evaluar ensayos en medio líquido en los que se utilizó caldo Schaedler (25).
Varios investigadores encontraron una importante divergencia entre los resultados obtenidos in vitro y los resultados experimentales en modelos animales (9), e incluso con la respuesta obtenida en los pacientes tratados (56). Tal vez la condición de microorganismos defectivos impida una buena actividad in vivo de los antibióticos que actúan alterando la biosíntesis de la pared celular, como son los glucopéptidos y los ß-lactámicos.
Varios autores comprobaron en VNS el fenómeno de tolerancia para penicilina (9, 34, 39, 45) y vancomicina (34), según la definición de Sabath (CBM/CIM ≥32) (88). La importancia de este fenómeno, en este caso como en otros, es incierta por cuanto estaría influenciado por las condiciones de trabajo (45).
Resumiendo, podemos decir que:
1. para la realización de pruebas de sensibilidad in vitro es necesario incorporar al medio 0,001% de ClHP. El agregado de ClHCys al 0,01% debería considerarse sólo en aquellas cepas que lo requieran específicamente;
2. para Etest el mejor medio parecería ser agar Isosensitest con agregado de 5% de sangre. En países como la Argentina, en que no se comercializa el agar Isosensitest, podrían resultar de utilidad el agar Mueller Hinton con 5% de sangre equina desfibrinada y 0,001% de ClHP, o el agar Columbia con 5% de sangre equina lisada y 0,001% de ClHP;
3. para métodos de dilución serían apropiados el caldo Mueller Hinton o el caldo Todd-Hewitt con agregado de 5% de sangre equina lisada y 0,001% de ClHP. Deberían utilizarse inóculos estándar de 105-106 UFC/ml;
4. la incubación de las pruebas debe hacerse en presencia de 5% de CO2, excepto para el método de macrodilución en medio líquido, en el que la incubación se debe realizar en atmósfera normal;
5. cualquiera sea el método utilizado, parecería no haber demasiada correlación in vitro / in vivo.
Con posterioridad al envío de este manuscrito, se publicó una nueva guía del CLSI destinada a pruebas de sensibilidad de microorganismos fastidiosos (Clinical and Laboratory Standards Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; Approved Guideline, M45-A, Vol 26, N° 19, 2006). Las indicaciones se confeccionaron sólo para el método de microdilución en caldo Mueller Hinton con 2,5 a 5% de sangre equina lisada y 1 µg/ml de ClHP. En esta guía se propone efectuar la incubación a 35 °C al aire por 20 a 24 horas. Los puntos de corte para sensibilidad y resistencia son equivalentes a los que el CLSI recomienda para estreptococos del grupo viridans, a excepción de imipenem y ciprofloxacina, que no están contemplados para estos últimos. Para especies de Abiotrophia y Granulicatella, el límite superior para considerar resistencia a cloranfenicol, sería de 8 µg/ml en lugar de los 16 µg/ml recomendados para estreptococos del grupo viridans.
Prevalencia de resistencia in vitro a los antimicrobianos
En un estudio de 17 aislamientos de VNS publicado en 1982, Gephart y Washington encontraron que tres de ellos presentaban una CIM de penicilina ≥0,12 µg/ml, pero en ningún caso una CIM mayor de 1 µg/ml (39). Coincidentemente con Bosley y Facklam (5), un estudio más reciente de Tuohy et al. verificó una mayor tendencia a la resistencia a penicilina que en años anteriores, con cepas que presentaban CIMs de penicilina superiores a 4 µg/ml (99), (Tabla 7).

Zheng et al. trabajaron utilizando métodos de microdilución y Etest con 15 aislamientos pediátricos (6 G. adiacens, 3 G. elegans y 6 A. defectiva). Estos investigadores observaron porcentajes de resistencia aun mayores (20% para penicilina y 60% para ceftriaxona) (108).
La resistencia a macrólidos y clindamicina fue variable entre los diferentes estudios (Tabla 7) y llegó, en algunos casos, al 50%. Sobre ocho aislamientos resistentes a eritromicina, Zheng et al. identificaron a cinco de ellos como portadores del gen mefA (3 G. adiacens y 2 A. defectiva), dos portaban el gen ermB expresado en forma constitutiva (G. adiacens), y uno era portador de ambos genes (G. elegans) (108).
Aún no se han observado cepas con resistencia de alto nivel a los aminoglucósidos, aunque en algunos estudios no se ensayaron concentraciones adecuadas para detectarla (39, 65, 99). En algunos casos no se obtuvo sinergia bactericida al combinar penicilina con estreptomicina en cepas con bajos valores de CIM para el aminoglucósido (8). Más aún, una cepa fue recuperada de hemocultivos de un paciente que había recibido dos semanas de tratamiento con dicha combinación (18). En estos casos paradójicos, al menos según lo publicado, no se intentó la detección de enzimas inactivantes de aminoglucósidos. Es posible que estos microorganismos defectivos se comporten como algunas cepas de estreptococos del grupo viridans o Streptococcus agalactiae estudiadas por nosotros, que a pesar de poseer la enzima bifuncional AAC (6') - APH (2''), no mostraban CIMs superiores a 128 µg/ml (60, 104).
La resistencia a quinolonas fue observada en una sola cepa resistente a levofloxacina, con una CIM = 16µg/ml, en un paciente que había recibido profilaxis previa con dicho antibiótico (65).
La resistencia a tetraciclina fue de alrededor de 10% en dos estudios (65, 108). A esta resistencia, mediada por el gen tet(M), se la encontró asociada a la resistencia a eritromicina (ermB) y localizada en un transposón similar al Tn916, denominado Tn3872, ubicado en el cromosoma. Esto indica que es posible la diseminación conjunta de esas resistencias a través de elementos conjugativos (75).
Todas las cepas ensayadas hasta el momento fueron sensibles a rifampicina y quinupristina/dalfopristina (39, 65, 99). La primera de estas drogas fue exitosamente ensayada in vitro (92) e in vivo (9), en combinación con vancomicina. El valor de las estreptograminas, sin embargo, tendrá que ser evaluado.
No se observó resistencia a vancomicina (CIM < 2 µg/ml) y sólo en el trabajo de Gephert y Washington se encontraron cepas con resistencia a cloranfenicol (39).
Concluyendo, la resistencia a penicilina es similar en porcentaje y valores de CIM a la observada en estreptococos del grupo viridans (59).
Hasta el momento, no se han detectado cepas de VNS con resistencia a vancomicina, rifampicina ni quinupristina-dalfopristina. Tampoco se ha observado resistencia a altos niveles de aminoglucósidos, aunque se describieron cepas para las cuales no se lograba sinergia bactericida con penicilina. La resistencia a quinolonas parece ser rara, la resistencia a cloranfenicol fue observada sólo en un trabajo de principios de los 80 (39) y la resistencia a tetraciclinas parece rondar el 10%. La resistencia a macrólidos puede llegar a ser tan elevada como en estreptococos del grupo viridans (aproximadamente 30-50%).
Estudios experimentales en animales
Un estudio basado en el empleo de cilindros contaminados con VNS e implantados intraperitonealmente en ratones demostró que la actividad sinérgica de penicilina y estreptomicina observada in vitro no se correspondía con los resultados obtenidos in vivo (18).
En 1977 se publicaron estudios donde se demostró la actividad sinérgica in vivo de la penicilina con estreptomicina, en un modelo de endocarditis experimental (15). Otros estudios que avalan el uso de esta combinación mostraron que ésta era más activa que cualquiera de los dos antibióticos por separado (9, 43). En 1985, Bouvet et al. estudiaron en conejos la actividad de la penicilina y la vancomicina, solas y en combinación con gentamicina y amicacina (9). Estos autores comprobaron que la penicilina sola no producía una reducción significativa de los microorganismos implantados en las vegetaciones. No obstante, su combinación con aminoglucósidos, similarmente a lo observado por Carey et al. (15), demostró tener un efecto sinérgico. En este estudio, la vancomicina fue más efectiva que la penicilina y al menos tan efectiva como su combinación con aminoglucósidos. A diferencia de la penicilina, su actividad bactericida no fue aumentada con el agregado de gentamicina ni amicacina.
En otro trabajo se verificó que en combinaciones con ß-lactámicos resultaba más efectivo el uso de gentamicina, incluso en dosis bajas, que la utilización de estreptomicina en altas dosis (43).
Pautas de tratamiento
Es importante volver a remarcar que en el caso de las VNS las pruebas de sensibilidad a los antibióticos in vitro no tienen el mismo valor predictivo que para otros microorganismos.
En 1989, el American Heart Association's Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease recomendó el tratamiento de las endocarditis por VNS con penicilina endovenosa durante cuatro semanas y un aminoglucósido por la misma vía durante dos semanas (4). A la vista de las frecuentes fallas terapéuticas con la utilización de este régimen, Stein y Libertin propusieron en el mismo año el uso de cuatro a seis semanas de terapia combinada (penicilina más gentamicina) (94).
Aun con este régimen, se han observado fallas terapéuticas microbiológicamente comprobadas. Es por ello que cada paciente debe ser monitoreado en forma constante con hemocultivos, y en caso de falla terapéutica se debe apelar a tratamientos alternativos, como los ensayados en animales por Bouvet et al. (9): vancomicina o vancomicina más rifampicina. Estos tratamientos también han resultado efectivos en algunos casos de endocarditis en humanos (Berberian et al., resultados no publicados, 97).
Concluyendo, se recomienda la utilización de penicilina más gentamicina durante 4 a 6 semanas para el tratamiento de endocarditis por VNS y, en caso de falla terapéutica o alergia a ß-lactámicos, el uso de vancomicina sola o con agregado de gentamicina y/o rifampicina.
Consideraciones finales
Las mal llamadas VNS representan un verdadero desafío tanto para microbiólogos como para médicos infectólogos. Para los primeros, existe la dificultad para recuperarlos de materiales clínicos, la posibilidad de confundirlos con otras bacterias en la coloración de Gram o por la identificación bioquímica, la dificultad de no contar con inóculos adecuados debido a su pobre crecimiento, la necesidad de agregar factores nutricionales a los medios, la falta de estandarización de los métodos destinados a la evaluación de la actividad in vitro de los antibióticos y el inconveniente de su escasa correlación con la evolución de los tratamientos. Para los infectólogos, el desafío consiste en evaluar correctamente a los pacientes con endocarditis por VNS, a fin de administrarles las drogas menos tóxicas y más efectivas, dado que se ha registrado hasta un 30% de casos de fallas de tratamiento aun con los regímenes recomendados como de primera elección. En esos casos, obviamente, deberá evaluarse la falla hemodinámica que determinará la necesidad de efectuar un reemplazo valvular.
Agradecimientos: el autor agradece a Richard Facklam, PhD, por su invalorable apoyo y por la confirmación de la identificación a nivel de especie de las VNS enviadas. También agradece muy especialmente a Anne Bouvet, del Centre National de Reference des Streptocoques, Hotel Dieu, Assistance Publique Hopitaux de París, Francia, por su importante aporte bibliográfico.
BIBLIOGRAFÍA
1. Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol 2005; 43: 5721-32. [ Links ]
2. Barrios H, Bump CM. Conjunctivitis caused by a nutritionally variant streptococcus. J Clin Microbiol 1986; 23: 379-80. [ Links ]
3. Bierman C, Fries G, Jehnichen P, Bhakdi S, Husmann M. Isolation of Abiotrophia adiacens from brain abscess which developed in a patient after neurosurgery. J Clin Microbiol 1999; 37: 769-71. [ Links ]
4. Bisno AL, Dismukes WE, Durack DT, Kaplan EL, Karchmer AW, Kaye D, et al. Antimicrobial treatment of infective endocarditis due to viridans streptococci, enterococci and staphylococci. JAMA 1989; 261: 1471-7. [ Links ]
5. Bosley GS, Facklam RR. Biochemical and antimicrobial testing of nutritionally variant streptococci. 90th Annual Meeting American Society for Microbiology, 1990, Resumen C-307, p.395, Anaheim, California, Estados Unidos. [ Links ]
6. Bottone EJ, Thomas CA, Lindquist D, Janda M. Difficul-ties encountered in identification of a nutritionally deficient streptococcus on the basis of its failure to revert to streptococcal morphology. J Clin Microbiol 1995; 33: 1022-4. [ Links ]
7. Bouvet A. Endocardite infectieuse: enquête en France 1990-1991. Sensibilité aux antibiotiques des streptocoques et entérocoques. Méd Mal Infect 1992; 22, Spécial: 987-92. [ Links ]
8. Bouvet A. Human endocarditis due to nutritionally variant streptococci: Streptococcus adjacens and Streptococcus defectivus. Eur Heart J 1995; 16 (Supl.B): 24-7. [ Links ]
9. Bouvet A, Cremieux AC, Contrepois A, Vallois J-M, Lamesch C, Carbon C. Comparison of penicillin and vancomycin, individually and in combination with gentamicin and amikacin, in the treatment of experimental endocarditis induced by nutritionally variant streptococci. Antimicrob Agents Chemother 1985; 28: 607-11. [ Links ]
10. Bouvet A, Grimont F, Grimont PA. Intraspecies variations in nutritionally variant streptococci: rRNA gene restriction patterns of Streptococcus defectivus and Streptococcus adjacens. Int J Syst Bacteriol 1991; 41: 483-6. [ Links ]
11. Bouvet A, Grimont F, Grimont PAD. Streptococcus defectivus sp. nov. and Streptococcus adjacens sp. nov. nutritionally variant streptococci from human clinical specimens. Int J Syst Bacteriol 1989; 39: 290-4. [ Links ]
12. Bouvet A, van de Rijn I, Mc Carthy M. Nutritionally variant streptococci from patients with endocarditis: growth parameters in a semisynthetic medium and demonstration of a chromophore. J Bacteriol 1981; 146: 1075-82. [ Links ]
13. Bouvet A, Villeroy F, Cheng F, Lamesch C, Williamson R, Gutmann L. Characterization of nutritionally variant streptococci by biochemical tests and penicillin-binding proteins. J Clin Microbiol 1985; 22: 1030-4. [ Links ]
14. Brouqui P, Raoult D. Endocarditis due to rare and fastidious bacteria. Clin Microbiol Rev 2001; 14: 177-207. [ Links ]
15. Carey RB, Brause BD, Roberts RB. Antimicrobial therapy of vitamin B6-dependent streptococcal endocarditis. Ann Intern Med 1977; 87: 150-4. [ Links ]
16. Carey RB, Gross KC, Roberts RB. Vitamin B6-dependent Streptococcus mitior (S. mitis) isolated from patients with systemic infections. J Infect Dis 1975; 131: 722-6. [ Links ]
17. Casalta JP, Habib G, La Scola B, Drancourt M, Caus T, Raoult D. Molecular diagnosis of Granulicatella elegans on the cardiac valve of a patient with culture-negative endocarditis. J Clin Microbiol 2002; 40: 1845-7. [ Links ]
18. Cayeux P, Acar JF, Chabbert YA. Bacterial persistence in streptococcal endocarditis due to thiol-requiring mutants. J Infect Dis 1971; 124: 247-54. [ Links ]
19. Cerceo E, Christie JD, Nachamkin I, Lautenbach E. Central nervous system infections due to Abiotrophia and Granulicatella. Diagn Microbiol Infect Dis 2004; 48: 161-5. [ Links ]
20. Chang HH, Lu CY, Hsueh PR, Wu MH, Wang JK, Huang LM. Endocarditis caused by Abiotrophia defectiva in children. Pediatr Infect Dis J 2002; 21: 697-700. [ Links ]
21. Christensen JJ, Facklam RR. Granulicatella and Abiotrophia species from human clinical specimens. J Clin Microbiol 2001; 39: 3520-3. [ Links ]
22. Clark RB, Gordon RE, Bottone EJ, Reitano M. Morphological aberrations of nutritionally deficient streptococci: association with pyridoxal (vitamin B6) concentration, and potential role in antibiotic resistance. Infect Immun 1983; 42: 414-7. [ Links ]
23. Collins MD, Lawson PA. The genus Abiotrophia (Kawamura et al.) is not monophyletic: proposal of Granulicatella gen. nov., Granulicatella adiacens comb.nov., Granulicatella elegans comb. nov., and Granulicatella balaenopterae comb.nov. Int J Syst Evol Microbiol 2000; 50: 365-9. [ Links ]
24. Collins MD, Lawson PA, Monasterio R, Falsen E, Sjödén B, Facklam RR. Ignavigranum ruoffiae sp. nov., isolated from human clinical specimens. Int J Syst Bacteriol 1999; 49: 97-101. [ Links ]
25. Cooksey RC, Swenson JM. In vitro antimicrobial inhibition patterns of nutritionally variant streptococci. Antimicrob Agents Chemother 1979; 16: 514-8. [ Links ]
26. Cooksey RC, Thompson FS, Facklam RR. Physiological characterization of nutritionally variant streptococci. J Clin Microbiol 1979; 10: 326-30. [ Links ]
27. Corby PM, Lyons-Weiler J, Bretz WA, Hart TC, Aas JA, Boumenna T, et al. Microbial risk indicators of early childhood caries. J Clin Microbiol 2005; 43: 5753-9. [ Links ]
28. Douglas CP, Siarakas S, Gottlieb T. Evaluation of Etest as a rapid method for determining MICs for nutritionally variant streptococci. J Clin Microbiol 1994; 32: 2318-20. [ Links ]
29. Dusch H, Zbinden R, Von Graevenitz A. Growth differences of Capnocytophaga canimorsus and some other fastidious organisms on various Columbia-based blood agar media. Zentralbl Bacterial 1995; 282: 362-6. [ Links ]
30. Editorial. Culture negative endocarditis. Lancet 1977; ii: 1164-5. [ Links ]
31. Elliott DR, Wilson M, Buckley CM, Spratt DA. Cultivable oral microbiota of domestic dogs. J Clin Microbiol 2005; 43: 5470-6. [ Links ]
32. Esteban J, Ramos JM, Cuenca Estrella M, Jiménez Castillo P. Infecciones extravasculares por Streptococcus adjacens. A propósito de dos casos. Enferm Infecc Microbiol Clin 1994; 12: 468-9. [ Links ]
33. Esteban J, Montero Sánchez R, Ortiz A, Yáñez F. Endoftalmitis posquirúrgica debida a Abiotrophia defectiva. Enferm Infecc Microbiol Clín 2005; 23: 455. [ Links ]
34. Feder HM, Olsen N, McLaughlin JC, Barlett RC, Chameides L. Bacterial endocarditis caused by vitamin B6-dependent viridans group streptococcus. Pediatrics 1980; 66: 309-12. [ Links ]
35. Frenkel A, Hirsch W. Spontaneous development of L forms of streptococci requiring secretions of other bacteria or sulphy-dryl compounds for normal growth. Nature 1961; 191: 728-30. [ Links ]
36. Fukushige J, Igarashi H, Ueda K. Spectrum of infective endocarditis during infancy and childhood: 20-year review. Pediatr Cardiol 1994; 15: 127-31. [ Links ]
37. George M, van de Rijn I. Purification of serotype I antigen from nutritionally variant streptococci. Infect Immun 1988; 56: 1222-31. [ Links ]
38. George RH. The isolation of symbiotic streptococci. J Med Microbiol 1974; 7: 77-83. [ Links ]
39. Gephart JF, Washington JA II. Antimicrobial susceptibilities of nutritionally variant streptococci. J Infect Dis 1982; 146: 536-9. [ Links ]
40. Gross KC, Houghton MP, Roberts RB. Evaluation of blood culture media for isolation of pyridoxal-dependent Streptococcus mitior (mitis) J Clin Microbiol 1981; 14: 266-72. [ Links ]
41. Handrick W, Köhler W, Spencker FB, Schneider P. Endocarditis due to nutritionally variant streptococci. Infection 1988;16: 371-2. [ Links ]
42. Heath CH, Bowen SF, McCarthy JS, Dwyer B. Vertebral osteomyelitis and discitis associated with Abiotrophia adiacens (nutritionally variant streptococcus) infection. Aust N Z J Med 1998; 28: 663. [ Links ]
43. Henry NK, Wilson WR, Roberts RB, Acar JF, Geraci JE. Antimicrobial therapy of experimental endocarditis caused by nutritionally variant viridans group streptococci. Antimicrob Agents Chemother 1986; 30: 465-7. [ Links ]
44. Hepburn MJ, Fraser SL, Rennie TA, Singleton CM, Delgado B Jr. Septic arthritis caused by Granulicatella adiacens: diagnosis by inoculation of synovial fluid into blood culture bottles. Rheumatol Int 2003; 23: 255-7. [ Links ]
45. Holloway Y, Dankert J. Penicillin tolerance in nutritionally variant streptococci. Antimicrob Agents Chemother 1982; 22: 1073-5. [ Links ]
46. Ince A, Tiemer B, Gille J, Boos C, Russlies M. Total knee arthroplasty infection due to Abiotrophia defectiva. J Med Microbiol 2002; 51: 899-902. [ Links ]
47. Jeng A, Chen J, Katsivas T. Prosthetic valve endocarditis from Granulicatella adiacens (nutritionally variant streptococci). J Hosp Infect 2005; 51: e125-e9. [ Links ]
48. Kanamoto T, Sato S, Inoue M. Genetic heterogeneities and phenotypic characteristics of strains of the genus Abiotrophia and proposal of Abiotrophia para-adiacens sp. nov. J Clin Microbiol 2000; 38: 492- 8. [ Links ]
49. Kawamura Y, Hou XG, Sultana F, Liu S, Yamamoto H, Ezaki T. Transfer of Streptococcus adjacens and Streptococcus defectivus to Abiotrophia gen. nov. as Abiotrophia adiacens comb. nov. and Abiotrophia defectiva comb. nov. respectively. Int J Syst Bacteriol 1995; 45: 798- 803. [ Links ]
50. Keay L, Harmis N, Corrigan K. Infiltrative keratitis associated with extended wear of hydrogel lenses and Abiotrophia defectiva. Cornea 2000; 19: 864-9. [ Links ]
51. Kocka FE, Chittom AL, Sanders L, Hernández L, Soriano E, Jacobs N, et al. Nutritionally variant Streptococcus pyogenes from a periorbital abscess. J Clin Microbiol 1987; 25: 736-7. [ Links ]
52. Lamanna C. A non-life cycle explanation of the difteroid Streptococcus from endocarditis. J Bacteriol 1944; 47: 327- 34. [ Links ]
53. Lawson PA, Foster G, Falsen E, Sjöden B, Collins MD. Abiotrophia balaenopterae sp. nov. isolated from the minke whale (Balaenoptera acutorostrata). Int J Syst Bacteriol 1999; 49: 503-6. [ Links ]
54. Lejbkowicz F, Kassis I. Granulicatella and Abiotrophia species: cause or consequence? Clin Microbiol Newsl 2002; 24: 125-7. [ Links ]
55. Leonard MK, Pox CP, Stephens DS. Abiotrophia species bacteremia and a mycotic aneurysm in an intravenous drug abuser. N Engl J Med 2001; 344: 233-4. [ Links ]
56. Levine JF, Hanna BA, Pollock AA, Simberkoff MS, Rahal JJ Jr. Penicillin sensitive nutritionally variant streptococcal endocarditis: relapse after penicillin therapy. Am J Med Sci 1983; 286: 31-6. [ Links ]
57. Liao CH, Teng LJ, Hsueh PR, Chen YC, Huang LM, Chang SC, et al. Nutritionally variant streptococcal infections at a University Hospital in Taiwan: disease emergence and high prevalence of beta-lactam and macrolide resistance. Clin Infect Dis 2004; 38: 452-5. [ Links ]
58. Lopardo H, Hernández C. Extravascular infections due to Granulicatella adiacens: two case-reports and review. Clin Microbiol Newsl 2004; 26: 78-80. [ Links ]
59. Lopardo H, Vidal P, Bottero D, Moviglia AM, Gobet LM. Is the diffusion method appropriate to determine the susceptibility to penicillin of viridans group streptococci? Resumen T-287. Rev Esp Quimioter 2000; 13 (Supl. 2): 104. Third European Congress of Chemotherapy, Madrid, España. [ Links ]
60. Lopardo H, Vidal P, Jeric P, Centrón D, Paganini H, Facklam R, The Argentinian Streptococcus Study Group, Elliott J. Six-month multicenter study on invasive infections due to group B streptococci in Argentina. J Clin Microbiol 2003; 41: 4688-94. [ Links ]
61. Manganelli R, van de Rijn I. Characterization of emb, a gene encoding the major adhesin of Streptococcus defectivus. Infect Immun 1999; 67: 50-6. [ Links ]
62. Mc Carthy LR, Bottone EJ. Bacteremia and endocarditis caused by satelliting streptococci. Am J Clin Pathol 1974; 61: 585-91. [ Links ]
63. Michelow IC, Mc Cracken Jr. GH, Luckett PM, Krisher K. Abiotrophia spp. brain abscess in a child with Down's syndrome. Pediatr Infect Dis J 2000; 19: 760-3. [ Links ]
64. Mikkelsen L, Teilade E, Poulsen K. Abiotrophia species in early dental plaque. Oral Microbiol Immunol 2000; 15: 263-8. [ Links ]
65. Murray CK, Walter EA, Crawford S, MC Elmeel ML, Jorgensen JH. Abiotrophia bacteremia in a patient with neutropenic fever and antimicrobial susceptibility testing of Abiotrophia isolates. Clin Infect Dis 2001; 32: e140-e2. [ Links ]
66. Murray PR, Niles AC. Inactivation of penicillin by thiol broth. J Clin Microbiol 1982; 16: 982-4. [ Links ]
67. Namdari H, Kintner K, Jackson BA, Namdari S, Hughes JL, Peairs RR, et al. Abiotrophia species as a cause of endophtalmitis following cataract extraction. J Clin Microbiol 1999; 37: 1564-6. [ Links ]
68. Narasimhan SL, Weinstein AJ. Infective endocarditis due to a nutritionally deficient streptococcus. J Pediatr 1980; 96: 61-2. [ Links ]
69. Ohara-Nemoto Y, Tajika S, Sasaki M, Kaneko M. Identification of Abiotrophia adiacens and Abiotrophia defectiva by 16S rRNA gene PCR and restriction fragment length polymorphism analysis. J Clin Microbiol 1997; 35: 2458-63. [ Links ]
70. Okada Y, Kitada K, Takagaki M, Ito HO, Inoue M. Endocardiac infectivity and binding to extracellular matrix proteins of oral Abiotrophia species. FEMS Immunol Med Microbiol 2000; 27: 257-61. [ Links ]
71. Ormerod LD, Ruoff KL, Meisler DM, Wasson PJ, Kintner JC, Dunn SP, et al. Infectious cristalline keratopathy. Role of nutritionally variant streptococci and other bacterial factors. Ophtalmol 1991; 98: 159-69. [ Links ]
72. Parrillo JE, Borst GC, Mazur MH, Iannini P, Klempner MS, Moellering RC, et al. Endocarditis due to resistant viridans streptococci during oral penicillin chemoprophylaxis. N Engl J Med 1979; 300: 296-300. [ Links ]
73. Peterson CE, Cook JL, Burke JP. Media-dependent sub-culture of nutritionally variant streptococci. Am J Clin Pathol 1981; 75: 634-6. [ Links ]
74. Pompei R, Caredda E, Piras V, Serra C, Pintus L. Production of bacteriolytic activity in the oral cavity by nutritionally variant streptococci. J Clin Microbiol 1990; 28: 1623-7. [ Links ]
75. Poyart C, Quesne G, Acar P, Berche P, Trieu-Cuot P. Characterization of the Tn916-like transposon Tn3872 in a strain of Abiotrophia defectiva (Streptococcus defectivus) causing sequential episodes of endocarditis in a child. Antimicrob Agents Chemother 2000; 44: 790-3. [ Links ]
76. Pulvirenti J, Dorigan F, Chittom AL, Kallick C, Kocka FE. Vaginitis caused by nutritionally variant Streptococcus pyogenes Eur J Microbiol Infect Dis 1988; 7: 56-7. [ Links ]
77. Raff GW, Gray BM, Torres A, Hasselman TE. Aortitis in a child with Abiotrophia defectiva endocarditis. Pediatr Infect Dis J 2004; 23: 574-6. [ Links ]
78. Reimer LG, Reller LB. Growth of nutritionally variant streptococci on common laboratory and 10 commercial blood culture media. J Clin Microbiol 1981; 14: 329-2. [ Links ]
79. Riede U, Graber P, Ochsner PE. Granulicatella (Abiotrophia) adiacens infection associated with a total knee arthroplasty. Scand J Infect Dis 2004; 36: 761-4. [ Links ]
80. Roberts RB, Kriege AG, Schiller NL, Gross KC. Viridans streptococcal endocarditis: the role of various species including pyridoxal-dependent streptococci. Rev Infect Dis 1979; 1: 955-66. [ Links ]
81. Roggenkamp A, Abele-Horn M, Trebesius K, Tretter U, Autenrieth IB, Heesemann J. Abiotrophia elegans sp. nov., a possible pathogen in patients with culture-negative endocarditis. J Clin Microbiol 1998; 36: 100-4. [ Links ]
82. Roggenkamp A, Leitritz L, Baus K, Falsen E, Heesemann J. PCR for detection and identification of Abiotrophia spp. J Clin Microbiol 1998; 36: 2844-6. [ Links ]
83. Rosenthal O, Woywodt A, Kirschner P, Haller H. Vertebral osteomyelitis and endocarditis of a pacemarker lead due to Granulicatella (Abiotrophia) adiacens. Infection 2002; 30: 317-9. [ Links ]
84. Rudolph T, Welinder-Olsson C, Lind-Brandberg L, Stenevi U. 16S rDNA PCR analysis of infectious keratitis: a case series. Acta Ophthalmol Scand 2004; 82: 463-7. [ Links ]
85. Ruoff K. Update on nutritionally variant streptococci (Streptococcus defectivus and Streptococcus adjacens). Clin Microbiol Newsl 1990; 12: 97-9. [ Links ]
86. Ruoff K. Nutritionally variant streptococci. Clin Microbiol Rev 1991; 4: 184-90. [ Links ]
87. Ruoff K. Aerococcus, Abiotrophia, and other infrequently isolated aerobic catalase-negative, gram-positive cocci. En: Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of Clinical Microbiology. ASM Press, Washington D.C., 2003, p.434-44. [ Links ]
88. Sabath LD. Staphylococcal tolerance to penicillins and cephalosporins. En: Schlessinger D, editor. Microbiology. ASM Press, Washington D.C., 1979, p. 299-303. [ Links ]
89. Sato S, Kanamoto T, Inoue M. Abiotrophia elegans strains comprise 8% of the nutritionally variant streptococci isolated from the human mouth. J Clin Microbiol 1999; 37: 2553-6. [ Links ]
90. Schlegel L, Merlet C., Laroche JM, Frémaux A, Geslin P. Iatrogenic meningitis due to Abiotrophia defectiva after myelography. Clin Infect Dis 1999; 28: 155-6. [ Links ]
91. Stein DS, Nelson KE. Endocarditis due to nutritionally variant streptococci: therapeutic dilemma. Rev Infect Dis 1987; 9: 908-16. [ Links ]
92. Stein DS, Libertin CR. Time kill curve analysis of vancomycin and rifampin alone and in combination against nine strains of nutritionally deficient streptococci. Diagn Microbiol Infect Dis 1988; 10: 139-44. [ Links ]
93. Stein DS, Libertin CR. A double-blinded comparative evaluation of three media for chromophore testing with viridans and nutritionally variant (deficient) streptococci. Am J Clin Pathol 1989; 91: 589-93. [ Links ]
94. Stein DS, Libertin CR. Antibiotics in endocarditis due to nutritionally deficient streptococci. JAMA 1989; 262: 618. [ Links ]
95. Stein DS, Libertin CR. Enzymatic extraction and spectral analysis of the cromophore from cell walls of nutritionally deficient streptococci. J Clin Microbiol 1989; 27: 207-9. [ Links ]
96. Tagg JR, van de Rijn I. Inverse correlation in nutritionally variant streptococci between the production of bacteriolytic activity and sensitivity to a Streptococcus pyogenes bacteriocin-like inhibitory substance. J Clin Microbiol 1991; 29: 848-9. [ Links ]
97. Tantimavanich S, Nilakul C, Sukroongreung S. Modified antimicrobial disc susceptibility testing for nutritionally-variant streptococci. Southeast Asian J Trop Med Public Health 2002; 33:151-4. [ Links ]
98. Tillotson GS. Evaluation of ten commercial blood culture systems to isolate a pyridoxal-dependent streptococcus. J Clin Pathol 1981; 34: 930-4. [ Links ]
99. Tuohy M, Procop GW, Washington JA. Antimicrobial susceptibility of Abiotrophia adiacens and Abiotrophia defectiva. Diagn Microbiol Infect Dis 2000; 38: 189-91. [ Links ]
100. van de Rijn I. Quantitative analysis of cell walls of nutritionally variant streptococci grown under various growth conditions. Infect Immun 1985; 49: 518-22. [ Links ]
101. van de Rijn I, Bouvet A. Characterization of a pH-dependent cromophore from nutritionally variant streptococci. Infect Immun 1984; 43: 28-31. [ Links ]
102. van de Rijn I, George M, Bouvet A, Roberts RB. Enzymelinked immunosorbent assay for the detection of antibodies to nutritionally variant streptococci in patients with endocarditis. J Infect Dis 1986; 153: 116-21. [ Links ]
103. Verhaegen J, Vandepitte J. Endocarditis caused by nutritionally deficient streptococci. Acta Clin Belg 1983; 38: 12-8. [ Links ]
104. Vigliarolo L. Influencia de la concentración inhibitoria mínima de penicilina y aminoglucósidos sobre la actividad sinérgica de sus combinaciones frente a estreptococos del grupo viridans. Tesis de Maestría. Facultad de Ciencias Exactas, Universidad Nacional de La Plata, 2004. [ Links ]
105. Whyman RA, Mac Fadyen EE. Dens in dente associated with infective endocarditis. Oral Surg Oral Med Oral Pathol 1994; 78: 47-50. [ Links ]
106. Wilhelm N, Sire S, Le Costumier A, Loubinoux J, Beljerd M, Bouvet A. First case of multiple discitis and sacroiliitis due to Abiotrophia defectiva. Eur J Clin Microbiol Infect Dis 2005; 24: 76-8. [ Links ]
107. Zenone T, Durand DV. Brain abscesses caused by Abiotrophia defectiva: complication of immunosuppressive therapy in a patient with connective-tissue disease. Scand J Infect Dis 2004; 36: 497-9. [ Links ]
108. Zheng X, Freeman AF, Villafranca J, Shortridge D, Beyer J, Kabat W, et al. Antimicrobial susceptibilities of invasive pediatric Abiotrophia and Granulicatella isolates. J Clin Microbiol 2004; 42: 4323-6. [ Links ]
109. Zierdt CH. Light-microscopic morphology, ultrastructure, culture and relationship to disease of the nutritional and cell-wall-deficient a-hemolytic streptococci. Diagn Microbiol Infect Dis 1992; 15: 185-94. [ Links ]
Recibido: 17/04/06
Aceptado: 11/09/06














