Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.39 no.2 Ciudad Autónoma de Buenos Aires Apr./June 2007
Influencia de la concentración inhibitoria mínima de penicilina en la acción sinérgica de su combinación con gentamicina frente a estreptococos del grupo viridans
L. Vigliarolo1, M. S. Ramírez2, D. Centrón2, H. Lopardo3*
1 Servicio de Laboratorio, Hospital Zonal Gral. de Agudos "San Roque", Gonnet;
2 Facultad de Medicina, Universidad de Buenos Aires;
3 Servicio de Microbiología, Hospital de Pediatría "Prof. Dr. Juan P. Garrahan". Combate de los Pozos 1881 (1245) Ciudad Autónoma de Buenos Aires, Argentina.
*Correspondencia. E-mail: hlopardo@garrahan.gov.ar
RESUMEN
Los porcentajes de resistencia a penicilina entre los estreptococos del grupo viridans han llegado a niveles superiores al 60% en algunos estudios realizados en la década pasada, y en recientes trabajos se los encontró asociados a un mayor índice de mortalidad en las bacteriemias. Aún no se conoce cuál es el nivel de concentración inhibitoria mínima de penicilina para el cual resulta imposible lograr un efecto sinérgico con algún aminoglucósido. Con este propósito, se estudió la sensibilidad a penicilina de 28 cepas de estreptococos del grupo viridans aisladas de materiales clínicamente significativos en el Hospital de Pediatría "Prof. Dr. Juan P. Garrahan". Se seleccionaron siete aislamientos pertenecientes al grupo mitis con distintas características de sensibilidad, y con ellos se ensayó la curva de muerte frente a penicilina, gentamicina y penicilina más gentamicina, con concentraciones de penicilina por encima y por debajo de su concentración inhibitoria mínima. En ningún caso se observó sinergia cuando la concentración de penicilina fue inferior a la concentración inhibitoria mínima, al menos en este grupo particular de estreptococos que presentaron concentraciones inhibitorias mínimas de gentamicina ³ 16 µg/ml. Se encontró sinergia en cinco de las siete cepas cuando se trabajó con concentraciones de penicilina superiores a la concentración inhibitoria mínima. En las otras dos, se detectaron enzimas modificadoras de aminoglucósidos.
Palabras clave: Sinergia; Penicilina; Gentamicina; Streptococcus; Grupo viridans
ABSTRACT
Influence of penicillin minimal inhibitory concentration in the synergy between penicillin and gentamicin in viridans group streptococci. Penicillin resistance rates higher than 60% have been recorded in viridans group streptococci by some authors during the 90's and recently such resistance was associated with higher levels of mortality in bacteremia. The lowest minimal inhibitory concentration of penicillin for which synergy with aminoglycosides is not yet possible is still unknown. In order to try to dilucidate this puzzle, a study on the susceptibility to penicillin of 28 strains of viridans group streptococci isolated from significant samples in the Hospital de Pediatría "Prof. Dr. Juan P. Garrahan" was carried out. Seven mitis group isolates presenting different susceptibility patterns were selected for performing time-killing curves with penicillin, gentamicin, and penicillin plus gentamicin, using higher and lower penicillin concentrations than their minimal inhibitory concentrations. Synergy was not observed when the penicillin concentration was lower than the minimal inhibitory concentration, at least in these strains with minimal inhibitory concentrations of gentamicin ³ 16 µg/ml. When using penicillin in higher concentrations than the minimal inhibitory concentration, synergy was found in five of the seven strains. Aminoglycoside-modifying enzymes were found in the two other streptococci.
Key words: Synergy; Penicillin; Gentamicin; Streptococcus; Viridans group
INTRODUCCIÓN
Los estreptococos del grupo viridans (EGV) son parte importante de la flora colonizante de las zonas orofaríngea, vaginal e intestinal en los seres humanos (8). En la actualidad han dejado de considerarse bacterias de escaso interés clínico, por cuanto se las halló involucradas en diversas infecciones graves: son agentes causales de entre un 30% y un 40% de las endocarditis infecciosas (EI) subagudas, tanto en válvula nativa como en prótesis valvulares (12), y además son capaces de causar bacteriemia en pacientes neutropénicos con cáncer, especialmente con malignidad hematológica (3, 4, 22).
Durante muchos años la penicilina (PEN) fue el agente antimicrobiano de elección para el tratamiento de dichas infecciones, pero varias publicaciones demostraron la emergencia de cepas resistentes con significativa frecuencia, especialmente entre los pacientes sometidos a quimioterapia y/o profilaxis con antibióticos (1, 7, 24, 28). Incluso se han aislado cepas con valores de concentración inhibitoria mínima (CIM) superiores a 32 µg/ml (7).
Recientemente, en un estudio de 120 casos de bacteriemia por EGV, se encontró una diferencia notable en la evolución de los pacientes infectados con cepas sensibles a PEN respecto de los infectados con cepas resistentes (22,5% vs. 71% de mortalidad) (20).
La aparición y diseminación de esta resistencia estuvo relacionada con mutaciones de los genes que codifican para las proteínas ligadoras de penicilina (PBP) y su transferencia entre especies relacionadas (2, 6, 16).
El uso de combinaciones de PEN con aminoglucósidos demostró un comportamiento sinérgico frente a estas bacterias (26), aunque se han descrito algunos casos de resistencia a los aminoglucósidos en los que la sinergia desaparecía (10, 23).
Cuando la CIM de PEN es igual o mayor a 0,125 µg/ml o a 0,5 µg/ml, en caso de EI por EGV se recomienda el agregado de gentamicina (GEN) o estreptomicina, para intentar lograr un efecto sinérgico (18). En nuestro medio, aproximadamente dos tercios de la población de EGV estarían comprendidos en esa categoría de resistentes (R) o con sensibilidad intermedia (I) (14). En el caso de los enterococos, está comprobado que cuando la concentración de PEN es igual o mayor a la CIM la sinergia es posible, a menos que la bacteria presente resistencia a altos niveles del aminoglucósido acompañante (15).
El objetivo de este trabajo fue verificar si este hecho se manifestaba también en EGV, a pesar de que algunos autores han sugerido que en este caso podrían operar mecanismos diferentes (17).
MATERIALES Y MÉTODOS
Microorganismos
Se estudió la sensibilidad a PEN y GEN por dilución en medio líquido de 28 aislamientos significativos de EGV no consecutivos, aislados de muestras clínicas procesadas en el Servicio de Microbiología del Hospital de Pediatría "Prof. Dr. Juan P. Garrahan" de la Ciudad Autónoma de Buenos Aires. Nueve eran sensibles (CIM ≤ 0,125 µg/ml), doce presentaban sensibilidad intermedia (CIM entre 0,25 y 2 µg/ml) y siete eran resistentes (CIM ≥ 4 µg/ml). A los efectos de este trabajo se seleccionaron siete aislamientos del grupo mitis con distintas CIMs de PEN (Tabla 1).
Tabla 1. Resultados de las curvas de muerte para 7 aislamientos de estreptococos del grupo viridans(1)

Para el control de las pruebas de sensibilidad se usaron las cepas Enterococcus faecalis ATCC 29212, E. faecalis ATCC 51299 y Streptococcus pneumoniae ATCC 49619.
Identificación a nivel de grupo viridans y de grupos de especies
I. Método clásico. Se utilizaron las pruebas de bilis esculina (-/+), cloruro de sodio al 6,5% (-), pirrolidonil arilamidasa (PYR) (-), leucinamino peptidasa (LAP) (+), sensibilidad a vancomicina (S) y observación de cadenas en caldo tioglicolato (+) para incluir a las cepas g-hemolíticas en el grupo viridans. Con las cepas a-hemolíticas se ensayaron las pruebas de optoquina (-) y solubilidad en bilis (-), para diferenciarlas de S. pneumoniae. Siguiendo las recomendaciones de Ruoff (25), adicionalmente identificamos los distintos grupos de especies con las pruebas de arginina deshidrolasa, sorbitol, manitol, esculina, Voges- Proskauer y ureasa.
II. Método miniaturizado. Se empleó el Rapid ID 32 Strep (bioMérieux, Argentina) y se consideraron los resultados obtenidos recurriendo a la correspondiente base de datos o, en casos dudosos, apelando a la evaluación de las pruebas individuales.
Pruebas de sensibilidad
I. Etest. Las pruebas de Etest se realizaron según las indicaciones del fabricante, en agar Mueller-Hinton (Britania, Argentina) con el agregado de 5% de sangre ovina (Laboratorio Alfredo Gutiérrez SRL, Bs. As.). Los inóculos se realizaron a partir de cultivos en medio sólido de 18-24 h de incubación, por resuspensión de las colonias en caldo Mueller-Hinton. La concentración bacteriana se ajustó a una turbiedad equivalente a la del tubo N° 0,5 de la escala de Mac Farland. Se efectuaron estrías en tres direcciones en placas de agar sangre. Se aplicaron tiras de Etest (AB Biodisk, Solna, Suecia) para penicilina (0,006-32 µg/ml) y gentamicina (0,016-256 µg/ml). Las placas se incubaron 24 h a 35 °C. La lectura se efectuó estrictamente a las 24 h y con la ayuda de una lupa, para poder detectar colonias dentro de los halos de inhibición.
II. Macrodilución en medio líquido. Se utilizó caldo Mueller- Hinton adicionado de 2% de sangre equina desfibrinada y lisada, según normas del NCCLS (actualmente CLSI) (21). Se prepararon diluciones al medio de penicilina y gentamicina en tubos de vidrio. Se incorporó luego un inóculo preparado como en el caso de Etest pero diluido 1/200, de modo que la concentración final en el caldo Mueller-Hinton fuera de aproximadamente 5 x 105 UFC/ml. El volumen final en cada tubo fue de 1 ml. La incubación se efectuó a 35 °C, en atmósfera normal y durante 24 horas.
III. Curvas de muerte. Se efectuaron curvas de muerte para PEN, GEN y PEN + GEN, utilizando concentraciones de PEN por encima y por debajo de la CIM. El medio de cultivo usado fue caldo Mueller-Hinton adicionado de 2% de sangre equina lisada. El inóculo bacteriano se preparó a partir de un desarrollo en medio sólido de no más de 24 horas. La suspensión se efectuó en caldo Mueller-Hinton, ajustando la turbiedad a la del tubo 0,5 de la escala de Mac Farland. En cada tubo de ensayo con 5 ml de caldo Mueller-Hinton suplementado con sangre equina lisada se agregaron las soluciones de los antibióticos, y luego 0,05 ml del inóculo. La concentración de bacterias alcanzada en los tubos fue controlada por recuento de colonias (aproximadamente 1 x 106 UFC/ml). Los tubos se incubaron a 35 °C en atmósfera normal durante 24 horas.
Se probaron PEN y GEN por separado en las concentraciones deseadas frente a la cepa en estudio, y combinaciones de estos antibióticos en las mismas concentraciones que se utilizaron por separado, en un volumen final de 5 ml del caldo citado. La concentración del aminoglucósido empleada fue dos o más veces menor que su CIM, por tratarse de un antibiótico de alto poder bactericida, generalmente administrado en defecto, mientras que la PEN se probó en concentraciones superiores e inferiores a su CIM.
A las 0, 4 y 24 h, o a las 0, 3, 6 y 24 h de incubación se tomaron muestras de cada uno de los tubos y se diluyeron 1/10, 1/100, 1/1000, etc. De estos tubos se tomaron alícuotas de 0,05 ml y se depositaron en la superficie de placas de agar sangre. Luego se diseminaron con ayuda de una espátula de Drigalski. A las 48 horas de incubación a 35 °C en atmósfera de CO2 al 5%, se efectuó el recuento de colonias.
El efecto sinérgico de la combinación de drogas se definió como la disminución en 2 log de UFC/ml respecto de la lograda por su componente más activo a las 24 horas y, a la vez, del inóculo original (tubo control a t = 0) (19).
El efecto carry over fue minimizado por dilución y por dejar que la gota de cada una de las diluciones se absorbiera durante aproximadamente 30 segundos, antes de que el líquido remanente fuera distribuido en cada una de las placas de agar sangre.
Determinación de la presencia de enzimas modificadoras de GEN
I. Amplificación. La presencia del gen aac(6')-aph(2''), que codifica la resistencia a GEN, kanamicina, tobramicina, netilmicina y amicacina, fue determinada mediante la técnica de reacción en cadena de la polimerasa (PCR) utilizando cebadores de la región interna de la secuencia de los genes de resistencia: F: 5'-CCAAGAGCAATAAGGGCATA-3'; R: 5'-CACTATTATAA CCACTACCG-3' (5, 27). La amplificación se realizó en un ciclador Mastercycler/ Mastercycler gradiente Eppendorf, en un volumen final de 50 µl que contenía 10 µl de ADN (100 ng/ml), 20 µl de cada cebador (10 pmol/µl), 5 µl de cada desoxinucléotido trifosfato (200 µM) (dNTPs) y 2,5 µl de enzima Taq DNA polimerasa (1,25 U) en solución tampón de amplificación 1X (10 mM Tris- HCl pH 8,3; 50 mM KCl; 1,5 mM MgCl2). El protocolo de PCR consistió en un paso de desnaturalización de 2 minutos a 94 °C, seguido por 35 ciclos de amplificación de un minuto a 94 °C, 30 segundos a 55 °C y 1 minuto de extensión a 72 °C. Esto fue seguido por un paso de extensión final de 10 minutos a 72 °C. El producto esperado es de 220 pb (N° de acceso al Gen Bank = M18086, Van de Klundert, 1993).
II. Electroforesis en gel de agarosa. Se prepararon geles de agarosa al 1,2% en TBE 1X, con agregado de 20 µl de bromuro de etidio (1 µg/µl). Se utilizó una cuba de electroforesis Gibco BRL modelo H5 con fuente de poder EC 105, que contenía TBE 1X. Las muestras se prepararon con azul de bromofenol en una proporción 5:1 y se sembraron junto con el marcador de peso molecular, 100pb (Gibco, BRL). Las condiciones de la corrida electroforética fueron de 5 V/cm durante 40 minutos, hasta que el azul de bromofenol presente en las muestras alcanzó los 2/3 del gel. Las bandas de ADN fueron visualizadas y fotografiadas con luz UV, en un UVP Laborato EPI-CHEMI DARKROOM.
RESULTADOS
Se estudió la sensibilidad a PEN de 28 aislamientos no consecutivos de EGV por Etest y dilución en medio líquido: 9 eran sensibles (CIM £ 0,125 µg/ml), 12 presentaban sensibilidad intermedia (CIM entre 0,25 y 2 µg/ml) y 7 eran resistentes (CIM ³ 4 µg/ml).
Para efectuar los ensayos de sinergia se seleccionaron 7 cepas del grupo mitis con distintas CIMs de PEN (Tabla 1). Cuando se usaron concentraciones de PEN inferiores a su CIM, no se observó sinergia en ninguno de los casos (Tabla 1, Figura 1). Cuando se emplearon concentraciones de PEN por encima de su CIM, se logró efecto sinérgico con 5 cepas (Tabla 1, Figura 2). En los 2 aislamientos restantes se detectó la presencia de la enzima bifuncional modificadora de GEN, aac(6')-aph(2'') (Tabla 1, Figura 3).
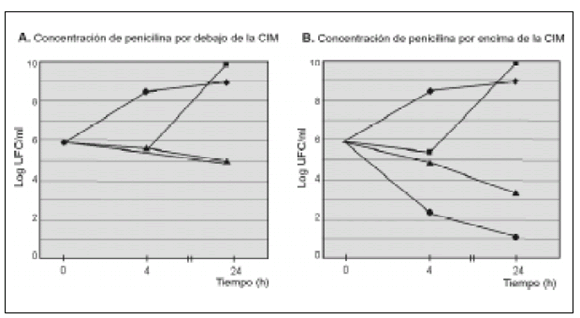
Figura 1. Ejemplo del efecto de la penicilina sola y combinada con gentamicina frente al aislamiento 738, en concentraciones inferiores (A) y superiores (B) a la CIM. Se observa sinergia en B pero no en A. : ![]()

Figura 2. Efecto de la penicilina en concentraciones superiores a la CIM frente a los aislamientos 141 (A) y 43-2 (B), sola y combinada con gentamicina. No se observa sinergia en ninguno de los dos casos. : ![]()

Figura 3. Electroforesis en gel de agarosa que muestra la presencia del gen aac(6')-aph(2'') en los aislamientos 43-2 y 141.
DISCUSIÓN
No existe suficiente evidencia científica como para poder sacar conclusiones acerca de la oportunidad del uso de tratamientos combinados vs. tratamientos con droga única en endocarditis por EGV (9). No obstante, la British Society for Antimicrobial Chemotherapy y la American Heart Association elaboraron recomendaciones terapéuticas, tal vez basadas en casos puntuales y en el sentido común (11). Estas recomendaciones son claras y tienen suficiente aval clínico para el caso de EI con cepas de EGV con CIMs menores de 4 µg/ml. El uso de PEN + GEN en EI por EGV con CIMs mayores de 4 µg/ml es controvertido, ya que los pocos casos publicados fueron tratados exitosamente con vancomicina o vancomicina + GEN (13).
En el presente trabajo se vio que, al igual que en el caso de Enterococcus, es posible obtener sinergia PEN + GEN frente a los EGV siempre que se utilicen concentraciones de PEN superiores o iguales a su CIM, al menos en este grupo particular de EGV que presentaron CIMs de GEN ³ 16 µg/ml.
El número de aislamientos estudiados fue bajo y sólo se trabajó con el grupo mitis, por tratarse del grupo de especies que exhibe mayores niveles de resistencia a penicilina. Estos hechos limitan, en cierta medida, el valor de nuestras conclusiones. Por otra parte, se utilizaron concentraciones acotadas de los antibióticos en función de nuestra conveniencia práctica y de lo hallado en la literatura para el caso de los enterococos. No obstante, consideramos que este estudio permite establecer para EGV una tendencia similar a la observada en estos últimos. Se requerirá de estudios más exhaustivos para lograr conocer posibles diferencias entre grupos de especies y para poder establecer más claramente las pautas que se deben seguir en el tratamiento de cada caso en particular.
Como dato interesante, hemos encontrado dos cepas resistentes a la sinergia PEN + GEN por presencia de la enzima bifuncional. Una de ellas presentaba una CIM de GEN = 128 µg/ml, como la descrita por Potgieter et al. (23), y la otra, sorprendentemente, exhibía una CIM de 16 µg/ml. Observando con cuidado la curva de crecimiento, resulta evidente que la bacteria pierde rápidamente viabilidad cuando alcanza el estado estacionario. Este hecho es compatible con un marcado efecto autolítico, que pudo ser parcialmente revertido con el agregado de colina, lo que llevó la CIM a 64 µg/ml (resultados preliminares no mostrados).
Si bien la mortalidad en la EI por EGV actualmente es baja, tanto la resistencia a los b-lactámicos como, con menor frecuencia, a los aminoglucósidos, se ha convertido en un problema para el tratamiento de algunos casos de endocarditis infecciosa, en los que inexorablemente se requiere de la actividad bactericida.
Poco se conoce de la actividad in vivo de la PEN frente a cepas de EGV con CIMs superiores a 4 µg/ml. Los casos publicados de endocarditis producidas por ese tipo de microorganismos fueron, por lo general, tratados con vancomicina. Se requerirá de modelos animales para poder conocer la eficacia de su combinación con gentamicina, en comparación con su actividad per se y con los tratamientos alternativos. Es por ésto que se impone un continuo seguimiento del comportamiento de estas bacterias frente a los antibióticos en los casos de endocarditis bacteriana.
Agradecimientos: los autores agradecen a la Bioq. María Alejandra Blanco por su desinteresada colaboración en la realización de las curvas de muerte.
BIBLIOGRAFÍA
1. Alcaide F, Liñares J, Pallares R, Carratalá J, Benítez MA, Gudiol F, et al. In vitro activities of 22 b-lactam antibiotics against penicillin-resistant and penicillin-susceptible viridans group streptococci isolated from blood. Antimicrob Agents Chemother 1995; 39: 2243-7.
2. Amoroso A, Demares D, Mollerach M, Gutkind G, Coyette J. All detectable high molecular-mass penicillin-binding proteins are modified in a high-level beta-lactam resistant clinical isolate of Streptococcus mitis. Antimicrob Agents Chemother 2001; 45: 2075-81.
3. Bochud PY, Eggiman PH, Calandra TH, van Melle G, Saghafi L, Francioli P. Bacteremia due to viridans streptococcus in neutropenic patients with cancer: clinical spectrum and risk factors. Clin Infect Dis 1994; 18: 25-31.
4. Carratalá J, Alcaide F, Fernandez-Sevilla A, Corbella X, Liñares J, Gudiol F. Bacteremia due to viridans streptococci that are highly resistant to penicillin: increase among neutropenic patients with cancer. Clin Infect Dis 1995; 20: 1169-73.
5. Clark NC, Olsvik O, Swenson JM, Spiegel CA, Tenover FC. Detection of a streptomycin/spectinomycin adenylyltranferase gene ( aadA) in Enterococcus faecalis. Antimicrob Agents Chemother 1999; 43: 157-60.
6. Coffey TJ, Dowson CG, Daniels M, Spratt BG. Genetics and molecular biology of beta- lactam-resistant pneumococci. Microb Drug Resist 1995; 1: 29-34.
7. Doern GV, Ferraro MJ, Brueggemann AB, Ruoff KL. Emergence of high rates of antimicrobial resistance among viridans group streptococci in United States. Antimicrob Agents Chemother 1996; 40: 891-4.
8. Donnelly JP. Viridans streptococci and allogeneic bone marrow transplant recipients. Tesis. Universidad de Nijmegen, Holanda, 1993.
9. Falagas ME, Matthaiou DK, Bliziotis IA. The role of aminoglycosides in combination with a b-lactam for the treatment of bacterial endocarditis: a meta-analysis of comparative trials. J Antimicrob Chemother 2006; 57: 639-47.
10. Farber BF, Eliopoulos GM, Ward JI, Ruoff KL, Syriopoulou V, Moellering RC Jr. Multiply resistant viridans streptococci: susceptibility to b-lactam antibiotics and comparison of penicillin-binding protein patterns. Antimicrob Agents Chemother 1983; 24: 702-5.
11. Graham JC, Gould FK. Role of aminoglycosides in the treatment of bacterial endocarditis. J Antimicrob Chemother 2002; 49: 437-44.
12. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn WC, editors. Diagnóstico Microbiológico, 5ta edición. Buenos Aires, Editorial Médica Panamericana, 1999, p. 563-630.
13. Le T, Bayer AS. Combination antibiotic therapy for infective endocarditis. Clin Infect Dis 2003; 36: 615-21.
14. Lopardo H, Moviglia AM, Bottero D, Viegas Caetano J. Resistencia a macrólidos, lincosamidas y estreptograminas en estreptococos del grupo viridans aislados de infecciones clínicamente significativas. Infect & Microbiol Clin 2000; 12: 62-5.
15. Lopardo H, Venuta ME, Rubeglio EA. Penicillin-resistance and aminoglycoside-penicillin synergy in enterococci. Chemotherapy 1995; 41: 165-71.
16. Malouin F, Bryan LE. Modification of penicillin-binding proteins as mechanisms of b-lactam resistance. Antimicrob Agents Chemother 1986; 30: 1-5.
17. Miller MH, el-Sokkary MA, Feinstein SA, Lowy FD. Penicillininduced effects on streptomycin uptake and early bactericidal activity differ in viridans group and enterococcal streptococci. Antimicrob Agents Chemother 1986; 30: 763-8.
18. Moellering RC Jr, Wennersten CB, Weinberg AN. Studies on antibiotic synergism against enterococci. II. Effect of various antibiotics on the uptake of C14-labelled streptomycin by enterococci. J Clin Invest 1971; 50: 2580-4.
19. Moellering RC Jr, Korzeniowski OM, Sande MA, Wennersten CB. Species-specific resistance to antimicrobial synergism in Streptococcus faecium and Streptococcus faecalis. J Infect Dis 1979; 141: 203-6.
20. Mrazova M, Docze A, Buckova E, Bucko L, Kacmarikova M, Grey E, et al. Prospective national survey of viridans streptococcal bacteraemia risk factors, antibacterial susceptibility and outcome of 120 episodes. Scand J Infect Dis 2005; 37: 637-41.
21. National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved standard, sixth edition, 2003; M7-A6. Wayne, Pa, USA.
22. Paganini H, Staffolani V, Zubizarreta P, Casimir L, Lopardo H, Luppino V. Viridans streptococci bacteremia in children with fever and neutropenia: a case-control study of predisposing factors. Eur J Cancer 2003; 39: 1284-9.
23. Potgieter E, Carmichael M, Koornhof HJ, Chalkley LJ. In vitro antimicrobial susceptibility of viridans streptococci isolated from blood cultures. Eur J Clin Microbiol Infect Dis 1992; 11: 543-6.
24. Quinn P, DiVicenzo C, Lucks D, Luskin L, Shatzer K, Lerner S. Serious infections due to penicillin-resistant strains of viridans streptococci with altered penicillin-binding proteins. J Infect Dis 1988; 157: 764-8.
25. Ruoff KL. Miscelaneous catalase-negative, gram-positive cocci: emerging opportunists. J Clin Microbiol 2002; 40: 1129-33.
26. Sande MA, Irvin RG. Penicillin-aminoglycoside synergy in experimental Streptococcus viridans endocarditis. J Infect Dis 1974; 129: 572.
27. Shaw KJ, Rather PN, Hare RS, Miller GH. Molecular genetics of aminoglycoside resistance genes and familial relationships of the aminoglycoside-modifying enzymes. Microbiol Rev 1993; 57:138-63.
28. Venditti M, Baiocchi P, Santini C, Brandimarte C, Serra P, Gentile G, et al. Antimicrobial susceptibilities of Streptococcus species that cause septicemia in neutropenic patients. Antimicrob Agents Chemother 1989; 33: 580-2. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 11/09/06
Aceptado: 26/03/07














