Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.39 no.2 Ciudad Autónoma de Buenos Aires Apr./June 2007
Actividad antimicrobiana de mieles del sudeste de la provincia de Buenos Aires frente a Escherichia coli
M.F. Fangio, M.O. Iurlina y R. Fritz*
Departamento de Química, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata. Funes 3350 (7600) Mar del Plata, Argentina.
* Correspondencia. E-mail: rfritz@mdp.edu.ar
RESUMEN
En este trabajo se estudió la sensibilidad de Escherichia coli frente a mieles mediante diferentes técnicas de evaluación de la actividad antimicrobiana. Empleando mieles del sudeste de la provincia de Buenos Aires en concentraciones de 0, 1, 5, 10, 25 y 50% (p/v) se analizó la actividad antimicrobiana de este producto natural frente a Escherichia coli ATCC 25922. La concentración inhibitoria mínima (CIM) se determinó por el test de dilución en serie, en medio líquido (caldo Mueller-Hinton y caldo Mac Conkey). La concentración bactericida mínima (CBM) se evaluó en agar nutritivo y en agar Mac Conkey. Además, se midió la actividad antibacteriana total por el método de difusión en agar en placa. Se observó una reducción del crecimiento promedio del 96% en caldo Mueller-Hinton y del 90% en caldo Mac Conkey, coincidiendo con CIMs de 50 y 25% (p/v), respectivamente. Para las concentraciones evaluadas, en agar nutritivo no se observó acción bactericida, mientras que en agar Mac Conkey se obtuvo una CBM promedio de 25% (p/v). Con el método de difusión en agar en placa, todas las mieles al 50% (p/v) inhibieron el crecimiento de E. coli y una de ellas presentó actividad aún a concentraciones menores (25, 10 y 5% p/v). Las diferentes metodologías resultaron adecuadas para medir la magnitud de la actividad antibacteriana y mostraron que las mieles son activas frente a E. coli a concentraciones de 25 y 50% (p/v). Los métodos de dilución en caldo Mueller-Hinton y de difusión en agar en placa arrojaron valores de inhibición concordantes.
Palabras clave: Escherichia coli; Miel; Actividad antimicrobiana
ABSTRACT
Antimicrobial activity of honey against Escherichia coli. This study assessed the susceptibility of Escherichia coli to the antimicrobial activity of honeys by different techniques. Honeys used were from the southeast region of Buenos Aires province. In order to evaluate antimicrobial activity against Escherichia coli ATCC 25922, solutions containing 0, 1, 5, 10, 25 and 50% (w/v) of honey were prepared. Liquid media (Mueller-Hinton and Mac Conkey broths) were used to assess the Minimal Inhibitory Concentration (MIC) by the serial dilution test. The minimal bactericidal concentration (MBC) was determined by counting on nutritive and Mac Conkey agar. In addition, for the evaluation of total antibacterial activity, the agar diffusion method was used. A reduction of microbial growth of 96% in Mueller-Hinton broth and of 90% in Mac Conkey broth by honey solutions containing 50% and 25% (w/v), was respectively observed. The bactericide action of honey in nutritive agar proved negative. The MBC value in Mac Conkey agar was 25% (w/v) of honey. The methods used for measuring the antibacterial activity in the present work were adequate to prove that honeys are active against E. coli at 25 and 50% (w/v) concentrations. The results obtained by the dilution method with Mueller- Hinton broth and the agar diffusion method were both concordant.
Key words: Escherichia coli; Honey; Antibacterial activity
Desde tiempo atrás, ha habido evidencia creciente de la capacidad antimicrobiana de la miel, la cual fue reconocida hace más de un siglo y ha sido extensivamente estudiada (6). Algunas investigaciones realizadas in vitro han sugerido la efectividad de la miel frente a bacterias patógenas, tales como Escherichia coli, Staphylococcus aureus y Salmonella enterica (4, 14). Por otro lado, también han sido descritas variaciones en la actividad antibacteriana de mieles de diferente origen floral frente a distintas especies de bacterias causantes del deterioro de los alimentos (1). La actividad antibacteriana ha sido atribuida a compuestos específicos presentes en la miel, cuya naturaleza y mecanismo de acción no han sido aún totalmente elucidados (2, 10). La actividad de la miel se debe principalmente a su acidez, a su osmolaridad y a la generación enzimática de peróxido de hidrógeno vía glucosa oxidasa (6). Sin embargo, otros componentes de la miel, como ácidos aromáticos o compuestos fenólicos, también pueden contribuir a su actividad antibacteriana (12).
El objetivo del presente trabajo fue determinar la sensibilidad de Escherichia coli frente a mieles de origen polifloral mediante el empleo de distintas técnicas de evaluación de la actividad antimicrobiana. A este fin, se utilizó la cepa de Escherichia coli ATCC 25922.
Se consideraron para su estudio 30 mieles de producción orgánica de la región sudeste de la provincia de Buenos Aires, procedentes de distintos apiarios de las siguientes localidades: Mar del Plata (6 muestras), Balcarce (3 muestras), Ayacucho (3 muestras), Tres Arroyos (2 muestras), Mar Chiquita (4 muestras) y Miramar (12 muestras). La recolección de las mieles correspondió a la cosecha de los años 2003 y 2004 . Las muestras fueron obtenidas por centrifugación de los panales, colectadas en recipientes estériles y almacenadas a 10 °C hasta el momento de su estudio.
Debido a que con anterioridad, las mieles habían sido caracterizadas microbiológicamente (5) y se había determinado la presencia de Bacillus spp., Paenibacillus larvae y otras bacterias que podrían ejercer efectos antagónicos frente a Escherichia coli, previo a los ensayos se procedió a filtrar las mieles por filtros millipore estériles (GSWP025, 0,22 µm de poro, MF-Millipore). Los ensayos para la determinación de la CIM y la CBM fueron realizados adaptando la metodología descrita por el NCCLS (7) para sustancias antimicrobianas. A partir de soluciones de miel, se evaluó la CIM por la prueba de dilución en serie en caldo Mueller-Hinton y la CBM sobre agar nutritivo. En paralelo se determinaron la CIM y la CBM empleando caldo y agar Mac Conkey, respectivamente. Las soluciones de miel se prepararon en caldo Mueller- Hinton, caldo Mac Conkey y en agua destilada estéril. En el método de dilución seriada, se partió de soluciones de miel al 50% (p/v) y se prepararon diluciones al 25, 10, 5, 1 y 0% (p/v), con las que se determinó la CIM en caldo Mueller-Hinton y en caldo Mac Conkey. Para el método de difusión en agar, se prepararon soluciones de miel a las mismas concentraciones en agua estéril, las que luego se sembraron en los pocillos del agar.
Para el ensayo por dilución, se partió de la cepa pura de Escherichia coli y se sembró en caldo cerebro corazón, se incubó a 35 ± 0,5 °C durante no más de 18 h, para obtener un cultivo en fase estacionaria temprana. Se preparó la suspensión bacteriana en solución fosfatada de Butterfield (0,25 M KH2PO4 ajustado a pH 7,2 con NaOH) (3) y se estandarizó comparando con la escala de Mc Farland hasta alcanzar la turbidez de 0,5, equivalente a una concentración de bacterias del orden de 107-108 células/ml. Se prepararon las distintas concentraciones de miel directamente en los caldos de cultivo (Mueller-Hinton y Mac Conkey) colocados en dos series de tubos. A estos se les adicionó la suspensión microbiana (104 células/ml) y se incubó a 35 ± 0,5 °C, 48 h. En caldo Mueller-Hinton, los resultados se determinaron midiendo la densidad óptica de los cultivos a 615 nm con un espectrofotómetro (UV-visible-2101-PC-Scanning spectrophotometer-Shimadzu, Japón), utilizando una curva de calibración de absorbancia a 615 nm vs. concentración del microorganismo (9). En este caso se evaluó la disminución del crecimiento bacteriano respecto de un control sin miel. En caldo Mac Conkey se observó el viraje de color del medio y el desprendimiento de gas, y se determinó la CIM como la menor concentración de miel en la que no se registró crecimiento.
Para determinar la CBM se repicó a partir de los tubos negativos de cada serie (desde caldo Mueller-Hinton a agar nutritivo y desde caldo Mac Conkey a agar Mac Conkey) y se incubó en las mismas condiciones de temperatura y tiempo. Se consideró como CBM a la concentración más baja de miel que produjo la muerte bacteriana, en la cual no se observó crecimiento.
Con fines comparativos se evaluó la actividad antibacteriana total por el método de difusión en agar en placa, según Allen et al. (1). Se prepararon una serie de diluciones de cada miel en agua destilada estéril. De un cultivo de E. coli en caldo tripticasa soja incubado a 37 °C durante 18 h, se tomó una alícuota de 100 µl y se inoculó en 150 ml de agar nutritivo estéril enfriado a 45 °C. Una vez homogeneizada, la suspensión fue vertida en placas estériles, las cuales se almacenaron a 4 °C durante 24 h antes de ser utilizadas. En cada placa se cortaron pocillos de 8 mm de diámetro. Cada pocillo se completó con un volumen de 100 µl de la dilución de miel. Las placas fueron incubadas a 37 °C durante 18 h y luego examinadas para evaluar la presencia de zonas de inhibición del crecimiento del microorganismo. La sensibilidad de las distintas soluciones de miel fue clasificada según el diámetro de inhibición como: no sensible, para diámetros menores de 8 mm; sensible, para diámetros de 8 a 14 mm; muy sensible, para diámetros de 15 a 19 mm; y extremadamente sensible, para diámetros ³ 20 mm (9).
A fin de medir la actividad antimicrobiana debido a componentes fenólicos, flavonoides, ácidos aromáticos, etc., se evaluó la actividad antimicrobiana de las mieles en ausencia de peróxido de hidrógeno para las concentraciones de miel que presentaron actividad antimicrobiana, realizando tratamientos de las muestras con catalasa (Sigma, C-10: 4000 U/mg). Los tratamientos con catalasa se realizaron siguiendo la metodología propuesta por Allen et al. (1). La actividad antimicrobiana se detectó por el método de difusión en agar, según se describió anteriormente. Este ensayo permitió diferenciar la actividad antimicrobiana debida a la presencia de peróxido de hidrógeno de la atribuida a componentes fitoquímicos presentes en la miel.
Los datos obtenidos en la evaluación de la actividad antimicrobiana se analizaron mediante el programa de Análisis Estadístico Discriminante (SPSS 7.5, 1997). Se utilizó el análisis de varianza entre los valores hallados. El nivel de significancia elegido para la probabilidad fue de 0,05 (15).
Los ensayos en caldo Mueller-Hinton mostraron que para todas las mieles la CIM fue 50% (p/v), entendiéndose por CIM la concentración que produjo una reducción mínima de 90% en el crecimiento del microorganismo. Los valores promedio de inhibición del crecimiento en relación con los cultivos control (en los cuales no se adi cionó miel y se midió el máximo crecimiento del microorganismo) fueron de 96%. Por otro lado, no fue posible establecer en agar nutritivo las CBMs, esto es, las menores concentraciones de miel que producen una reducción del crecimiento microbiano del 99,9%, ya que en todas las placas se observó crecimiento. La siembra en caldo y en agar Mac Conkey mostró que tanto la CIM como la CBM se obtuvieron con soluciones al 25% (p/v) de miel. Estos resultados representaron diferencias significativas (p < 0,05) con respecto a los valores de CIM y CBM obtenidos en caldo Mueller-Hinton y agar nutritivo, respectivamente.
Con el método de difusión en agar en placa se observó la presencia de halos de inhibición del crecimiento de E. coli para todas las mieles, cuyos valores pueden observarse en la Tabla 1. Los valores de los halos, superiores a 20 mm de diámetro, reflejarían que E. coli sería extremadamente sensible a las soluciones de miel. La actividad antimicrobiana debida a compuestos no peróxido de hidrógeno se detectó principalmente en la muestra 4. En este caso, los halos de inhibición fueron los siguientes: 35, 28, 15 y 10 mm para las concentraciones de 50, 25, 10 y 5% (p/v) de miel, respectivamente.
Tabla 1. Halos de inhibición de mieles procedentes de distintas zonas geográficas frente a E. coli, expresados en mm.
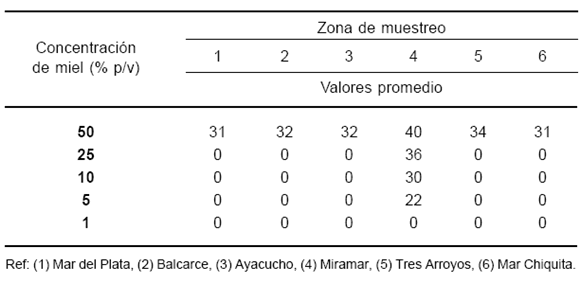
La sensibilidad de distintas especies de microorganismos a la miel es de gran interés. Algunos trabajos han mostrado que tanto mieles como también otros productos de la colmena tienen actividad antimicrobiana frente a bacterias gram positivas y gram negativas (8). Otros trabajos han evidenciado diferencias en la actividad antimicrobiana de mieles de acuerdo con sus orígenes geográficos y florales (11, 14). En la bibliografía se encuentran publicados valores considerablemente diferentes de la sensibilidad de cepas de E. coli frente a la acción antibacteriana de la miel. Estas variaciones se han observado tanto en las concentraciones de miel necesarias para una inhibición completa del crecimiento como para aquellas que producen inhibiciones parciales (6). Estas diferencias podrían deberse a las distintas cepas de E. coli consideradas, como también a diferencias en la potencia antibacteriana de las mieles evaluadas.
En nuestro estudio, E. coli mostró susceptibilidad frente a todas las mieles evaluadas por los métodos de dilución en serie y difusión en agar. Por este último método, se observó claramente que la muestra 4 al 50% (p/v) tuvo la máxima actividad inhibitoria frente a E. coli, y fue además la única miel que presentó actividad con soluciones al 25, 10 y 5% (p/v). La actividad antimicrobiana total determinada por el método de difusión en agar muestra que E. coli es sensible a todas las mieles en concentraciones de 50% (p/v). Esto podría deberse a que altos niveles de la actividad antimicrobiana se asocian particularmente a los contenidos de peróxido de hidrógeno, como resultado de una mayor actividad de glucoxidasa que de catalasa. El contenido de peróxido de hidrógeno (H2O2) es atribuido a la acción de la glucoxidasa, una enzima que las abejas adicionan al néctar. Parte de este componente puede perderse naturalmente en presencia de catalasa (13).
Todas las muestras presentaron actividad diferente a la del peróxido de hidrógeno. La acción antibacteriana más pronunciada de la muestra 4 podría asociarse al predominio de determinados componentes fitoquímicos del néctar, los cuales brindarían una mayor actividad frente a E. coli.
Por otro lado, los resultados indican que los métodos empleados serían apropiados para la medición antimicrobiana en mieles. Por el método de difusión en agar se obtuvieron halos de inhibición extendidos, aunque dentro de ellos se observó el desarrollo de algunas colonias. Estos resultados mostrarían una concordancia con la inhibición parcial observada en la determinación de la CIM y CBM, particularmente en caldo Mueller-Hinton y en agar nutritivo. Resulta interesante señalar que las zonas de inhibición obtenidas en nuestro estudio para las soluciones de miel al 50% (p/v) fueron mayores que las encontradas por Nzeako y Hadmi (8), quienes también evaluaron mieles frente a E. coli ATCC 25922.
Los diferentes métodos mostraron que todas las mieles presentaron actividad antimicrobiana en soluciones concentradas (25 y 50% (p/v)). La sensibilidad de E. coli frente a soluciones de miel concentradas puede ser evaluada mediante las metodologías ensayadas, y los métodos en caldo Mueller-Hinton y de difusión en placa muestran valores de inhibición concordantes.
BIBLIOGRAFIA
1. Allen KL, Molan PC, Reid GM. A survey of the antibacterial activity of some New Zealand honeys. J Pharm Pharmacol 1991; 43: 817-22.
2. Bergman A, Yanai J, Weiss J, Bell D, David MP. Acceleration of wound healing by topical application of honey: an animal model. Am J Surg 1983; 145: 374-6.
3. Butterfield CT. A selection of dilution water for bacteriological examination. J Appl Bacteriol 1932; 23: 355-67.
4. Cooper RA, Molan PC, Harding KG. The sensitivity to honey of gram-positive cocci of clinical significance isolated from wounds. J Appl Microbiol 2002; 93: 857-63.
5. Iurlina MO, Fritz R. Characterization of microorganisms in Argentinean honeys from different sources. Int J Food Microbiol 2005; 105: 297-304.
6. Molan PC. The antibacterial activity of honey: the nature of the antibacterial activity. Bee World 1992; 73: 5-28.
7. National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically (6th Ed), 2003; Approved Standard M7-A6, NCCLS.
8. Nzeako BC, Hadmi J. Antimicrobial potential of honey on some microbial isolates. Med Sci 2000; 2: 75-9.
9. Ponce AG, Fritz R, Del Valle C, Roura SI. Antimicrobial activity of essential oils on the native microflora of organic swiss chard. Lebensm-Wiss Technol 2003; 36: 679-84.
10. Radwan SS, El-Essawy AA, Sarhan MM. Experimental evidence for the occurrence in honey of specific substances against microorganisms. Zentralblatt fur Mikrobiologie 1984; 139: 249-55.
11. Taormina PJ, Niemira BA, Beuchat LR. Inhibitory activity of honey against foodborne pathogens as influenced by the presence of hydrogen peroxide and level of antioxidant power. Int. J Food Microbiol 2001; 69: 217-25.
12. Weston RJ. Antibacterial phenolic components of New Zealand manuka honey. Food Chem 1999; 64: 295-301.
13. Weston RJ, Brocklebank LK, Lu Y. Identification and quantitative levels of antibacterial components of some New Zealand honeys. Food Chem 2000; 70: 427-35.
14. Willix DJ, Molan PC, Harfoot CG. A comparison of the sensitivity of wound-infecting species of bacteria to the antibacterial activity of manuka honey and other honey. J Appl Bacteriol 1992; 73: 388-94.
15. Zar JH. Biostatistical Analysis. Prentice-Hall, Englewood Cliffs, 1984, p. 718. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 23/10/06
Aceptado: 23/04/07














