Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.39 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2007
Multiplicación de Brucella abortus y producción de óxido nítrico en dos líneas celulares de macrófagos de distinto origen
J. Serafino, S. Conde, O. Zabal, L. Samartino*
Instituto Nacional de Tecnología Agropecuaria, INTA - CICVyA - Castelar, Instituto de Patobiología, Área Bacteriología, Sección Brucelosis, CC 25 (1712) Castelar, Buenos Aires, Argentina
*Correspondencia. E-mail: lsanma@cnia.inta.gov.ar
RESUMEN
Brucella abortus es una bacteria que causa abortos e infertilidad en el ganado y fiebre ondulante en el hombre. Se multiplica en el citoplasma celular evadiendo los mecanismos de muerte intracelular. El óxido nítrico (NO) es importante en la regulación de la respuesta inmune. En el presente trabajo estudiamos la habilidad de tres cepas de B. abortus para sobrevivir intracelularmente en dos líneas celulares de macrófagos. La multiplicación de bacterias en ambas líneas celulares fue determinada a distintos tiempos en número de UFC/ml, también fue observada al microscopio de campo claro y de fluorescencia utilizando Giemsa y naranja de acridina, respectivamente. La tinción de ambas líneas celulares inoculadas con B. abortus mostró un resultado concordante con el encontrado en la determinación del número de UFC. Fue confirmada la presencia de B. abortus por microscopía electrónica. Para medir la producción de NO se utilizó el reactivo de Griess. La multiplicación de la cepa rugosa RB51 disminuyó en ambas líneas celulares y los niveles de NO fueron mayores en células inoculadas con dicha cepa que cuando fueron inoculadas con las cepas lisas (S19 y 2308). Estos resultados sugieren que probablemente la ausencia de cadena O en el lipopolisacárido afecta el crecimiento intracelular de B. abortus.
Palabras clave: B. abortus; Macrófagos; Óxido nítrico
ABSTRACT
Multiplication of Brucella abortus and production of nitric oxide in two macrophage cell lines of different origin. Brucella abortus is a bacterium which causes abortions and infertility in cattle and undulant fever in humans. It multiplies intracellularly, evading the mechanisms of cellular death. Nitric oxide (NO) is important in the regulation of the immune response. In the present work, we studied the ability of three B. abortus strains to survive intracellularly in two macrophage cell lines. The bacterial multiplication in both cell lines was determined at two different times in UFC/ ml units. Moreover the inoculated cells were also observed under light-field and fluorescence microscopy stained with Giemsa and acridine orange, respectively. The stain of both cellular lines showed similar results with respect to the UFC/ml determination. The presence of B. abortus was confirmed by electronic microscopy. In both macrophage cell lines inoculated with RB51, the multiplication diminished and the level of NO was higher, compared with cells inoculated with smooth strains (S19 and 2308). These results suggest that the absence of O-chain of LPS probably has affects the intracellular growth of B. abortus.
Key words: B. abortus; Macrophages; Nitric oxide
INTRODUCCIÓN
El género Brucella está compuesto por bacterias de forma cocobacilar, gram negativas, intracelulares, facultativas, capaces de producir brucelosis en una gran variedad de animales. Dado que estos microorganismos pueden transmitirse ocasionalmente al hombre, la brucelosis es considerada una zoonosis (10). Estas bacterias ingresan en el organismo por las mucosas del tracto digestivo, genital o nasal, por la conjuntiva ocular o por soluciones de continuidad de la piel. En los rumiantes, la principal puerta de entrada es la mucosa orofaríngea del aparato digestivo superior, de allí son llevadas hasta los linfonódulos y fagocitadas, principalmente por macrófagos. Estas bacterias tienen afinidad por los órganos reproductivos en los animales domésticos y en el hombre (1). Uno de los desafíos que debe enfrentar esta bacteria, que se multiplica en trofoblastos o macrófagos, es adaptarse al nuevo compartimento intracelular y, al mismo tiempo, resistir las condiciones severas generadas por el sistema inmune, incluyendo la activación de la fagocitosis (9).
Los fagocitos han desarrollado varios mecanismos de defensa antimicrobianos para eliminar este tipo de patógenos, por ejemplo, estallido oxidativo, acidificación de fagosomas o fusión de fagosomas con lisosomas. A su vez, Brucella ha desarrollado estrategias para impedir la acción de las sustancias defensivas de las células huéspedes, lo que le permite sobrevivir dentro del macrófago. Estudios realizados en células HeLa (no fagocíticas) demostraron que las brucelas inhiben la fusión fagolisosoma dirigiéndose hacia compartimentos intracelulares que serían autofagosomas. Sin embargo, este fenómeno se demostró sólo utilizando brucelas virulentas (8).
En los últimos años se han realizado estudios que describen la internalización y movimiento de Brucella dentro de células fagocíticas, preferentemente macrófagos peritoneales de ratón o líneas celulares tales como J774 (monocitos de ratón) o HeLa (línea celular no fagocitaria). En la mayoría de los estudios se utilizaron cepas virulentas de Brucella abortus o Brucella suis para asegurar la infección de las células empleadas (2).
Como en otras bacterias gram negativas, el lipopolisacárido (LPS) de Brucella es un importante componente de la membrana externa compuesto por el lípido A hidrofóbico y un core de oligosacárido densamente compacto, asociado (LPS-liso) o no (LPS-rugoso) con una cadena de polisacárido O hidrofílico (Cadena O) (10). El LPS de Brucella posee un brazo de diaminoglucosa y grupos acil largos, y solamente se unen al core por uniones amidas. Esta estructura confiere al LPS de Brucella características que lo hacen un factor de virulencia que altera el modelo molecular asociado al patógeno (PAMP) y reduce las propiedades típicas relacionadas con la endotoxina de LPS. Al contrario del LPS de varias enterobacterias, el LPS de Brucella es unas 100 veces menos activo y tóxico que el LPS de Escherichia coli (10). En las cepas lisas de B. abortus, el LPS está implicado en la virulencia bacteriana, a diferencia de las cepas rugosas donde el LPS pierde su virulencia debido a la ausencia de cadena O; de esto se infiere que la cadena O es un componente clave del LPS para la invasión y desarrollo de la bacteria (5).
El óxido nítrico (NO) posee un rol importante en diversas funciones, incluyendo vasorregulación, neurotransmisión, regulación de la respuesta inmune y actividad citotóxica contra células tumorales y una variedad de patógenos mediada por macrófagos. El NO es derivado de la L-arginina en una reacción catalizada por la óxido nítrico sintetasa (NOS), para la cual tres isoformas se identificaron. La isoforma inducible (NOSi) ha sido involucrada en la producción de NO durante la actividad antimicrobiana (11). La NOSi puede ser activada por varias moléculas, tales como IFN-g/LPS, TNF-a e IL-1. El LPS de Brucella no es tan potente como el LPS de Escherichia coli para incrementar la producción de NO (10). Dado que el NO es importante en la eliminación de ciertos patógenos, la potencia del LPS influye en la sobrevida del patógeno (16). Este trabajo pretende comparar la capacidad de distintos tipos de macrófagos para procesar cepas de B. abortus virulentas y atenuadas y el efecto de la producción de NO en macrófagos inoculados con estas cepas con respecto a macrófagos no inoculados.
MATERIALES Y MÉTODOS
Cepas bacterianas: B. abortus 2308 (lisa), B. abortus S19 (lisa) y B. abortus RB51 (rugosa) obtenidas del cepario del Laboratorio de Brucelosis del IP-CICV. Todas fueron crecidas en agar triptosa (AT) durante 3 días a 37 °C. Se realizó conteo en placa para determinar las unidades formadoras de colonias (UFC/ml). Se mantuvieron a -70 °C en medio para congelar con glicerol, hasta el momento de su uso.
Líneas celulares: macrófagos bovinos BoMac y macrófagos de ratón J774. Ambas líneas celulares se mantuvieron a 37 °C con 5% de CO2 en medio RPMI 1640 adicionado con 10% de suero fetal bovino (SFB).
Inoculación y conteo de células de B. abortus intracelulares: los macrófagos fueron sembrados en placas de cultivo de tejidos de 96 pocillos. Una vez que alcanzaron el 80-90% de confluencia, fueron inoculados con cada una de las cepas (2 x 107 UFC/ml) e incubados durante 4 horas. Se lavaron todos los pocillos con PBS 1X estéril. Para remover las bacterias extracelulares residuales que no fueron fagocitadas, se adicionaron 200 µl de medio RPMI 1640 con 50 µg de gentamicina y se incubó 30 minutos en las condiciones mencionadas en el ítem anterior; se consideró este momento el tiempo 0. Para detectar la posible presencia de bacterias extracelulares, se sembraron 10 µl del sobrenadante en AT. Posteriormente se lavó con PBS estéril y se lisaron las células utilizando ácido dioxicólico 0,1% durante 15 minutos. Este lisado se realizó a las 0, 4, 24 y 48 horas del tratamiento con gentamicina. Se tomaron 10 µl de cada uno de los pocillos, se hicieron las diluciones necesarias para permitir el conteo y se sembró en placas de AT. Las células se mantuvieron en estufa a 37 °C con 5% de CO2. Para ambas líneas celulares se prepararon controles sin inóculo. En todos los casos el conteo de bacterias fue realizado a las 48 horas. Todos los resultados de los conteos en UFC/ml fueron normalizados transformándolos en logaritmo en base 10. Los ensayos fueron realizados por triplicado.
Tinciones con Giemsa y naranja de acridina (NA): ambas líneas celulares fueron tratadas en las condiciones establecidas anteriormente. Luego del tratamiento con RPMI 1640 con 50 µg de gentamicina y tomando este punto como T'0, se descartó el medio, se adicionaron 150 µl de PBS pH 7,4 con 10% de SFB y se llevó a agitación constante por 1 hora a 37 °C. Luego se lavó 3 veces con PBS y se incorporaron 100 µl de metanol para fijar las células, se dejó actuar 5 minutos, se descartó y se adicionó Giemsa a una fila, y a la otra naranja de acridina. Se lavó con H2O y se observó al microscopio óptico (Nikon E200) en el caso de Giemsa y de fluorescencia (Olympus BX55) para los preparados con NA. Estos pasos se realizaron a tiempo 0 y tiempo 24 horas. En ambas líneas celulares se emplearon controles sin inóculo.
Microscopía electrónica: se utilizó esta técnica con el objetivo de verificar que las células de Brucella habían sido internalizadas. Para tal fin, ambas líneas celulares, contenidas en frascos T25, fueron inoculadas con B. abortus RB51, S19 y 2308 en las condiciones anteriormente mencionadas. Una vez descartado el medio RPMI con gentamicina, se adicionó a cada uno 2 ml de glutaraldehído 2% en buffer Millonig para fijar las células. Luego se realizó una posfijación con tetróxido de osmio al 1%, para finalmente empaquetar en agar. Se produjo la deshidratación con alcoholes ascendentes y acetona, y se realizó una preinclusión en spurr/acetona seguida de una inclusión en spurr, que se dejó en estufa a 72 °C por 48 horas. Por último, se realizaron cortes ultrafinos (70 nm) con ultramicrótomo Sorvall MT2-B y se procedió a colorear con uranilo (solución de acetato de uranilo al 2% en agua) y solución de Reynolds (nitrato de plomo 0,266 g y citrato de sodio 0,352 g disueltos en 1,6 ml de NaOH 1N y llevado a 10ml con agua desionizada) para la observación al microscopio electrónico de transmisión Jeol 1200 EX - II.
Medición de la producción de óxido nítrico: se utilizó el sobrenadante obtenido antes de cada lisado, conservado a -70 °C hasta el momento de su uso. Se tomaron 100 µl de muestra y se preparó la mezcla con los reactivos de Griess (dihidrocloruro de N- (1-Naftil)etillenediamina; ácido sulfanílico en 5% H3PO4 y solución de nitrito estándar), se incubó durante 30 minutos a temperatura ambiente y luego se midió la absorbancia a 548 nm en un espectrofotómetro Thermo Spectronic Helios 3. Previamente se realizó una curva estándar de soluciones de nitrito de sodio con concentraciones entre 1 y 100 µM, diluyendo la solución estándar de nitrito (componente del kit de Griess de Molecular Probes, Carlsbad, CA, USA) con agua desionizada.
Análisis estadístico: para realizar el procesamiento de los datos de multiplicación de Brucella abortus y producción de óxido nítrico se utilizó el software R versión 4.1. Se realizó un análisis de varianza (ANOVA). Todas las comparaciones se realizaron adoptando un nivel de significancia del 5% (p=0,05). Se hallaron los estadísticos descriptivos media, error estándar y R2, para efectuar comparaciones entre las variables.
RESULTADOS
Crecimiento intracelular de diferentes cepas de B. abortus en macrófagos bovinos y murinos
El log del número de UFC a T´4 disminuyó con respecto a T´0 en todos los casos, en ambas líneas celulares (Tabla 1). Cuando se aplicó el análisis de varianza, esta diferencia resultó no ser significativa (P<0,5).
Tabla 1. Crecimiento intracelular de tres cepas de B. abortus en dos líneas celulares de macrófagos.

A medida que el tiempo de incubación se extendió, se encontraron diferencias entre la multiplicación intracelular de las cepas lisas y la rugosa de B. abortus. En las dos líneas celulares ensayadas se observó una disminución del log de las UFC para la cepa rugosa RB51 en función del tiempo, en contraposición a lo observado para las cepas lisas 2308 y S19, en las que este valor aumentó a partir de las 4 horas. Esta diferencia fue significativa cuando se realizaron los contrastes en función del tiempo (P<0,0001).
Tanto en la l ínea celular J774 como en la BoMac (Tabla 1), se observó similitud en las curvas de crecimiento de las distintas cepas. Las diferencias encontradas no fueron significativas (P<0,1). Para observar la internalización y localización de las distintas cepas de B. abortus, los macrófagos fueron infectados con B. abortus S19, RB51 y 2308. Se realizó la tinción, tanto con Giemsa como con NA, a T'0 y T'24. Se pudo observar una marcada diferencia entre células control y células infectadas. Fue detectada también una diferencia en cuanto a macrófagos infectados con RB51 y macrófagos infectados con S19 y 2308. A T'0, los macrófagos infectados con RB51 mostraron gran cantidad de bacterias en su interior, mientras que a las 24 horas posinfección la proporción de bacterias intracelulares disminuyó (Figura 1). En cuanto a las cepas S19 y 2308, observamos que, de acuerdo a la cantidad de bacterias intracelulares presentes, el aumento de las mismas en el interior de los macrófagos fue proporcional al tiempo posinfección. También se pudo observar que a las 24 horas, las distintas cepas de B. abortus parecen estar concentradas dentro de vacuolas o separadas individualmente en el interior del citoplasma de la célula huésped.
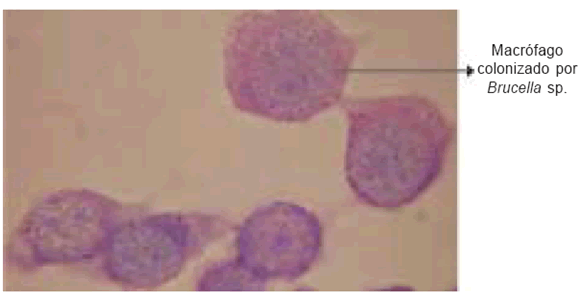
Figura 1. Foto de microscopía óptica de macrófagos inoculados con Brucella sp., tinción con Giemsa a T'24. Se observó marcada diferencia entre células control (sin inocular) y células infectadas. Las imágenes fueron similares a las obtenidas con la tinción de NA. Aumento 1000X.
Para determinar la presencia de B. abortus en el interior de los macr ófagos y evaluar si hubo alteraciones en su morfología, se utilizó la técnica de microscopía electrónica. Se tomó un cultivo de 24 horas de células J774 y BoMac inoculadas con B. abortus RB51, S19 y 2308, y sin inocular. Se pudo observar que B. abortus es eficientemente internalizada por los macrófagos (Figura 2). A pesar de que el conteo de UFC/ml de B. abortus RB51 fue disminuyendo desde el tiempo 0 a las 24 horas, se confirmó la presencia de esta cepa rugosa de Brucella en el interior celular (Figura 2). Similares estudios fueron realizados utilizando la línea celular BoMac y las cepas B. abortus S19 y 2308, los cuales confirmaron, por el contrario, crecimiento y multiplicación de ambas cepas en ambas líneas celulares en función del tiempo (dato no mostrado).

Figura 2. Imagen de la internalización y presencia de B. abortus RB51 en macrófagos J774 por microscopía electrónica. Células inoculadas con Brucella sp., procesadas para su visualización al microscopio electrónico. Fueron observadas imágenes semejantes en ambas líneas celulares inoculadas con las distintas cepas de Brucella sp. Aumento 30.000X.
Producción de óxido nítrico
Para determinar si la inducción de la NOSi estuvo correlacionada con la producción de NO, se midió la acumulación de NO2 - en el sobrenadante de células infectadas (Tabla 2). Con respecto a las células no inoculadas (controles), en ambas líneas celulares de macrófagos (BoMac y J774), la producción de NO2 - a los distintos tiempos fue significativamente mayor (P<0,0001).
Tabla 2. Liberación de nitrito en dos líneas celulares de macrófagos infectadas con B. abortus.

Como se indicó anteriormente, el recuento de viables para la cepa rugosa de B. abortus RB51 fue disminuyendo, mientras que el de las cepas lisas fue incrementándose con el tiempo. La producción de NO aumentó hasta las 4 h o 24 h posinfección y luego se mantuvo estable.
Tambi én se observó una diferencia destacable en la acumulación de NO2 - en las distintas líneas celulares (P<0,0001), puesto que el NO2 - promedio acumulado fue aproximadamente 7 veces mayor en células BoMac que en J774, lo que constituye una diferencia altamente significativa (P<0,0001).
Encontramos que la mayor acumulaci ón de NO2 - en células BoMac fue a las 4 horas, con valores promedio de 32,3; 40,6; 40,8 y 39,2 mM en células no inoculadas e inoculadas con B. abortus S19, RB51 y 2308, respectivamente (Tabla 2); también en células J774 fue detectada a las 4 horas, donde la acumulación promedio de NO2 - fue de 4,4; 8,31; 9,43 y 8,9 mM en células controles e infectadas con B. abortus S19, RB51 y 2308, respectivamente (Tabla 2).
DISCUSIÓN
Los macrófagos son células fagocíticas efectoras, destruyen una gran variedad de patógenos bacterianos que son ingeridos y expuestos a un medio ambiente perjudicial. No todos los microorganismos que entran en un fagocito profesional son expuestos a este medio perjudicial y muchos tampoco son realmente fagocitados por estas células; los microorganismos invaden las células y forman una vacuola especializada con características que son controladas por las bacterias patógenas y no por la célula fagocítica (2). Estudios previos demostraron que microorganismos intracelulares, como es el caso de B. abortus, desarrollan una serie de estrategias para sobrevivir en el interior celular.
Para este trabajo se utilizaron diferentes cepas de B. abortus, como la cepa virulenta 2308 empleada en estudios similares y la cepa vacunal S19. Ambas cepas son lisas y poseen un LPS completo; mientras que la cepa RB51, también empleada en este trabajo, es una cepa rugosa derivada de la cepa virulenta 2308, que no expresa cantidad suficiente de la cadena O del LPS por disrupción del gen wboA.
Nuestros estudios indicaron que el número de células internalizadas a T´4 disminuyó con respecto a T´0 en ambas líneas celulares inoculadas con las distintas cepas de Brucella. Aunque esta diferencia resultó no ser significativa, esto podría deberse a un breve periodo de adaptación de las bacterias al nuevo ambiente, con la consecuente muerte bacteriana producida en el fagosoma. Fueron encontradas diferencias entre las cepas de B. abortus lisas y la cepa rugosa, y entre ambas líneas celulares al ser inoculadas con estas cepas. La cepa rugosa RB51 fue fagocitada y su crecimiento disminuyó o bien fue eliminada por los macrófagos, mientras que las cepas lisas S19 y 2308 parecen evadir la fagocitosis y lograr multiplicarse con el correr del tiempo. A pesar de que las líneas celulares utilizadas lograron una multiplicación eficiente de las distintas cepas de B. abortus, pudo observarse que la línea celular de macrófagos bovinos internalizó mayor cantidad de bacterias que la línea celular de macrófagos murinos, aunque esta diferencia no fue significativa.
Cuando las células fueron teñidas con ambos colorantes (Giemsa y naranja de acridina), pudimos observar la presencia y multiplicación de las distintas cepas de B. abortus en el interior de los macrófagos infectados. Para confirmar estas observaciones se utilizó microscopía electrónica, a través de la cual pudimos corroborar la presencia de B. abortus en el interior celular. Se pudo observar la habilidad que posee B. abortus RB51 para invadir y proliferar en ambas líneas celulares en las primeras horas de contacto huésped-bacteria, con disminución de su presencia a las 48 horas. La morfología bacteriana no sufrió ninguna alteración detectable durante este proceso.
Ha sido descrito que el LPS de muchas bacterias gram negativas inducen intermediarios activos del oxígeno, intermediarios de nitrógeno bactericidas y producción de citoquinas (TNF, IFN), como así también expresión de GTPasa p-47 (10). Un elemento clave en la actividad antimicrobiana de macrófagos activados es la síntesis de óxido nítrico sintetasa inducible (NOSi), una enzima que cataliza la conversión de arginina a citrulina y óxido nítrico (7). El NO es considerado el mayor componente que contribuye al sistema de inmunidad innata y puede ser inducido aun cuando se despertó la inmunidad adquirida (7).
La contribución del NO en la actividad microbiana no es uniforme para todos los patógenos: Staphylococcus aureus o Burkholderia pseudomallei sobreviven unas dos horas cuando se exponen a NO, pero son eliminadas cuando se exponen 24 horas (13). Algunas bacterias como E. coli o Salmonella enterica serovariedad Typhimurium son más sensibles al peroxinitrito, un producto de la reacción del NO con superóxido, y son eliminadas por compuestos generados por peroxinitrito y no por compuestos generados por NO (3, 4). En estudios anteriores se demostró que Rickettsia prowazekii es muy sensible al NO y que el daño mediado por NO en la ricketsiosis es responsable de la inhibición de la infección en células L929 y RAW (15). Estudios previos indicaron que el LPS de B. abortus es un débil inductor de la producción de NO, lo cual fue confirmado en este trabajo ya que el LPS de B. abortus mostró ser pobre en la inducción de NO en las dos líneas celulares empleadas.
Se demostró también que la regulación de la NOSi mediada por citoquinas en macrófagos bovinos y murinos es distinta, y que los monocitos adquieren la habilidad de responder al estímulo bacteriano por medio de la síntesis de NO durante su diferenciación en macrófagos in vitro (6).
De acuerdo con nuestros resultados, el NO fue producido en mayor cantidad por células infectadas por la cepa rugosa en comparación con las infectadas con las cepas lisas. Esto sugiere que existen diferencias en las reactividades del LPS de las distintas cepas de B. abortus y podría explicar las discrepancias en la capacidad de estas bacterias de inducir la liberación de NO. También cabe destacar que la cantidad acumulada de NO2 - fue aproximadamente 7 veces superior en células BoMac que en J774, lo que podría deberse a la especificidad de las bacterias por los macrófagos bovinos. La acumulación de NO a las 24-48 horas, con el consecuente incremento del número de UFC/ml de B. abortus lisas y disminución o inhibición del número de la UFC/ml de B. abortus RB51, indicaría que un ambiente con alto porcentaje de NO jugaría un rol importante en la adaptación de cepas lisas de B. abortus pero no de cepas rugosas.
En conclusión, la multiplicación de B. abortus rugosa puede ser inhibida al ser fagocitada por ambas líneas de macrófagos, mientras que en B. abortus lisas no sucede lo mismo. Un ambiente con altos niveles de NO puede inhibir la multiplicación de cepas rugosas de B. abortus pero no la de cepas lisas, ya que éstas podrían escapar al efecto del NO a través de la posible activación de mecanismos que serán objeto de futuras investigaciones.
Agradecimientos: al personal de Microscopía Electrónica del CICVyA - INTA Castelar. Al personal de Cultivos de tejidos del CICVyA - INTA Castelar. Al Lic. Aldo Monti del CICVyA - INTA Castelar, por su importante colaboración en el análisis estadístico de los datos obtenidos.
Este trabajo fue financiado por el subsidio INTA BID 1728/ OC-AR PICT N° 08-12221.
BIBLIOGRAFÍA
1. Acha P, Szyfres B. Zoonosis y enfermedades transmisibles comunes al hombre y los animales. Tercera edición. Bacteriosis y micosis. Organización Panamericana de la Salud. Publicación científica y técnica. 2003; N° 580 p. 28-53.
2. Arenas N, Staskevich S, Avallay A, Mayorga L. Intracellular trafficking of Brucella abortus in J774 macrophages. Infect Immun 2000; 68: 4255-63.
3. Brunelli L, Crow J, Beckman J. The comparative toxicity of nitric oxide and peroxynitrite to Escherichia coli. Arch Biochem Biophys 1995; 316: 327-34.
4. De Groote M, Granger Y, Campbell G, Prince R. Genetic and redox determinants of nitric oxide cytotoxicity in a Salmonella typhimurium model. Proc Natl Acad Sci USA 1995; 92: 6399-403.
5. Jiménez de Bagues MP, Terraza A, Gross A, Dornand J. Different responses of macrophages to smooth and rough Brucella spp.: relationship to virulence. Infect Immun 2004; 72: 2429-33.
6. Jungi T, Adler H, Adler B, Thony M, Krampe M, Peterhans E. Inducible nitric oxide synthase of macrophages. Present knowledge and evidence for species-specific regulation. Vet Immunol Immunopathol 1996; 54: 323-30.
7. Jungi T, Weigand P, Brcic M. Differential induction of NO synthesis by Gram-positive and Gram-negative bacteria and their components in bovine monocyte-derived macrophages. Microb Pathog 1999; 27: 43-53.
8. Köhler S, Porte F, Jubier-Maurin V, Ouahrani-Bettache S, Teyssier J, Liautard JP. The intramacrophagic environment of Brucella suis and bacterial response. Vet Microbiol 2002; 90: 299-309.
9. Köhler S, Michaux-Characho S, Porte F, Ramuz M, Liautard JP. What is the nature of the replicative niche of a stealthy bug named Brucella?. Trends Microbiol 2003; 11: 215-9.
10. Lapaque N, Moriyon I, Moreno E, Gorvel JP. Brucella lipopolysaccharide acts as a virulence factor. Curr Opin Microbiol 2005; 8: 60-6.
11. López-Urrutia L, Alonso A, Nieto ML, Bayon Y, Orduna A, Sánchez Crespo M. Lipopolysaccharides of Brucella abortus and Brucella melitensis induce nitric oxide synthesis in rat peritoneal macrophages. Infect Immun 2000; 68: 1740-5.
12. Maruta K, Miyamoto H, Hamada T, Ogawa M, Taniguchi H, Yoshida S. Entry and intracellular growth of Legionella dumoffii in alveolar epithelial cells. Am J Respir Crit Care Med 1998; 157: 1967-74.
13. Musso T, Badolato R, Ravarino D, Stornello S, Panzanelli P, Merlino Ch, et al. Interaction of Bartonella henselae with the murine macrophage cell line J774: infection and proinflammatory response. Infect Immun 2001; 69: 5974-80.
14. Price R, Templeton J, Smith R, Adams L. Ability of mononuclear phagocytes from cattle naturally resistant or susceptible to brucellosis to control in vitro intracellular survival of Brucella abortus. Infect Immun 1990; 58: 879-86.
15. Turco J, Liu H, Gottlieb F, Winkler H. Nitric oxide-mediated inhibition of the ability of Rickettsia prowazekii to infect mouse fibroblasts and mouse macrophagelike cells. Infect Immun 1998; 66: 558-66.
16. Wang M, Qureshi N, Soeurt N, Splitter G. High levels of nitric oxide production decrease early but increase late survival of Brucella abortus in macrophages. Microb Pathog 2001; 31: 221-30. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 24/07/06 - Aceptado: 14/08/07














