Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.41 n.3 Ciudad Autónoma de Buenos Aires jul./sep. 2009
Evaluación microbiológica y epidemiológica de los clones de Acinetobacter baumannii resistentes a los carbapenemes aislados en la unidad de cuidados intensivos de un Hospital Universitario de la ciudad de Buenos Aires
C. H. Rodriguez*, K. Bombicino, G. Granados, C. Vay, A. Famiglietti
Laboratorio de Bacteriología, Departamento de Bioquímica Clínica, Hospital de Clínicas, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Av. Córdoba 2351 (1120), Ciudad Autónoma de Buenos Aires, Argentina.
*Correspondencia. E-mail: carlos_hernanrodriguez@hotmail.com.ar
Resumen
Entre junio y diciembre de 2004 se estudiaron 33 aislamientos de Acinetobacter baumannii resistentes a los carbapenemes, aislados de materiales clínicos de 29 pacientes internados en la unidad de cuidados intensivos del Hospital de Clínicas de la Universidad de Buenos Aires. La distribución clonal de esos aislamientos fue la siguiente: clon I (n = 14), clon IV (n = 7), clon III (n = 6), clon VI (n = 3), clon II (n = 2) y clon X (n = 1).Veintiún aislamientos se recuperaron de materiales del tracto respiratorio inferior, 11 de ellos pertenecieron al clon I. Casi todos los aislamientos pertenecientes al clon III (5/6) se recuperaron de materiales no respiratorios, y todos los del clon IV se recuperaron de pacientes que no recibieron imipenem. En los aislamientos pertenecientes a los clones I y III se observó una mayor adherencia a catéteres, principalmente en los asociados con bacteriemias. La mayoría de los aislamientos de los clones I y IV sobrevivieron en materiales inertes durante un período superior a los 5 días. La totalidad de los aislamientos del clon III fueron sensibles a colistina, gentamicina y levofloxacina, mientras que los del clon I y la mayoría de los del clon IV sólo fueron sensibles a colistina y tetraciclinas.
Palabras clave: Acinetobacter baumannii; Resistencia a carbapenemes; Unidad de cuidados intensivos; Clones; Adherencia
ABSTRACT
Microbiological and epidemiological evaluation of carbapenem-resistant Acinetobacter baumannii clones isolated at an intensive care unit of a University Hospital in Buenos Aires city. From June to December 2004, thirty-three carbapenem-resistant Acinetobacter baumannii isolates recovered from twenty nine patients at the intensive care unit in Hospital de Clínicas, Universidad de Buenos Aires, were studied. The isolates were categorized by molecular methods as: clone I (n = 14), clon IV (n = 7), clone III (n = 6), clone VI (n = 3), clone II (n = 2) and clone X (n = 1). Twenty one isolates were recovered from lower respiratory tract samples, 11 of which belonged to clon I. Clone III isolates were mainly recovered from non-respiratory samples (5/6). Clone IV isolates were recovered from patients not receiving previous imipenem therapy. The majority of the isolates belonging to clones I and IV were able to survive on inert materials for more than 5 days, whereas adhesion to catheters was observed in isolates belonging to clones I and III, especially in those related to bacteremia. Clone III isolates showed colistin, gentamicin and levofloxacin susceptibility, whereas clone I isolates and most from clone IV were only susceptible to colistin and tetracyclines.
Key words: Acinetobacter baumannii; Carbapenem resistance; Intensive care unit; Clones; Adherence
INTRODUCCIÓN
En los últimos años, las infecciones nosocomiales causadas por Acinetobacter baumannii en los diferentes centros asistenciales de Argentina han pasado de causar brotes esporádicos a ser hiperendémicas, sobre todo en las unidades de cuidados intensivos (UCI) (1, 2, 14). En nuestra institución, A. baumannii es el bacilo gram negativo (BGN) más frecuentemente aislado y el principal agente etiológico de las neumonías intrahos-pitalarias (22).
Mediante estudios de macrorrestricción, Catalano et al. (3) documentaron en 1999 la presencia de 15 clones diferentes de A. baumannii en hospitales de la Ciudad de Buenos Aires; los más frecuentes fueron los denominados clones I, III y IV. En el año 2004 describimos los mismos clones en la UCI de nuestro hospital, hecho que confirma su excelente adaptación al ambiente hospitalario (15).
El objetivo de este trabajo fue analizar la distribución en los materiales clínicos, las características microbio-lógicas (relacionadas con la adherencia a catéteres y supervivencia en medios inanimados) y el perfil de resistencia a los antimicrobianos de los diferentes clones de A. baumannii resistentes a los carbapenemes aislados de pacientes internados en la UCI de un hospital universitario.
Materiales y Métodos
Se estudiaron 33 aislamientos de A. baumannii recuperados de materiales clínicos de 29 pacientes adultos internados en la UCI del Hospital de Clínicas, Universidad de Buenos Aires, en el período julio-diciembre de 2004. A la totalidad de los pacientes se les elaboró una ficha clínica en donde se incluyeron los siguientes datos: edad, sexo, fecha de ingreso a la UCI, fecha de toma del material clínico, localización de la infección, enfermedad de base, diagnóstico presuntivo de la infección y terapia antibiótica previa con carbapenemes. Los aislamientos fueron identificados mediante pruebas bioquímicas y la genomoespecie fue determinada mediante la técnica ARDRA (amplified ribosomal DNA restriction analysis) (18). La relación clonal entre los aislamientos se investigó mediante electroforesis en campo pulsado (PFGE) de ADN digerido con ApaI, de acuerdo con Seifert et al. (16). La interpretación de los patrones de restricción obtenidos se realizó siguiendo los criterios de Tenover et al. (17). Para la identificación de los clones se utilizó la nomenclatura establecida por Catalano et al. (3). Los estudios de sensibilidad a los antimicrobianos se realizaron mediante la técnica de dilución seriada en agar, de acuerdo a las normas establecidas por el CLSI (Clinical and Laboratory Standards Institute) (7). Los antibióticos evaluados fueron los siguientes: imipenem (IMI), meropenem (MER), gentamicina (GEN), amikacina (AKA), doxiciclina (DOX), minociclina (MIN), tigeciclina (TIG), rifampicina (RIF), levofloxacina (LEV) y colistina (COL). Se determinó la supervivencia en medios inanimados a través de la siguiente metodología: de un cultivo fresco de 18-24 h se realizó una suspensión con una turbidez comparable al tubo 0,5 de la escala de Mc Farland. Cinco discos de papel de filtro estériles fueron inoculados con 20 µl de dicha suspensión y se dejaron a temperatura ambiente. Al cabo de 1, 2, 5, 9 y 14 días, un disco se colocó en 3 ml de solución fisiológica y se agitó durante 1 min, luego se sembraron 20 µl de la solución en agar sangre y tras 48 h de incubación se contaron las colonias desarrolladas (21).
La adherencia a catéteres fue evaluada mediante la siguiente metodología: de un caldo tripticasa de soja de 24 h de incubación se transfirió una alícuota de 50 µl a 3 ml de solución fisiológica que contenía una porción de 1 cm de un catéter y se incubó 30 min a 35 °C. Luego, se retiró el catéter con pinza estéril y se lavó por inmersión en 10 ml de solución fisiológica estéril; posteriormente, el catéter se sembró por rotación (12).
La cepa A. baumannii ATCC19606 se utilizó como control de los experimentos antes mencionados y los resultados obtenidos se compararon con los publicados por otros autores (12, 21).
Resultados
La mayoría de los aislamientos (81,8%) se agruparon en los clones I, III y IV (Tabla 1). El 63,6% de los materiales clínicos correspondían al tracto respiratorio inferior (TRI) (Tabla 1), el 92% de los pacientes estaban sometidos a asistencia respiratoria mecánica (ARM). El 50% de esos aislamientos pertenecieron al clon I, lo que indica una clara asociación entre este clon y la colonización/infección en esta clase de pacientes.
Tabla 1. Distribución de los clones de A. baumannii resistentes a carbapenemes en los distintos materiales clínicos.

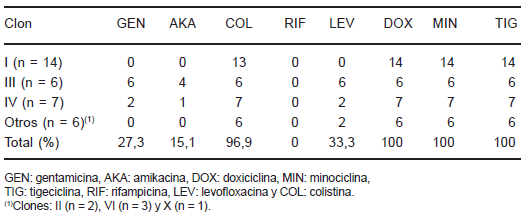
Las principales características microbiológicas y epidemiológicas de los distintos clones de A. baumannii se muestran en la Tabla 2. El 42,4% de los aislamientos pertenecieron al clon I y se caracterizaron por presentar altos recuentos bacterianos en el estudio de la adhesión a catéteres y por sobrevivir en medios inanimados durante más de 14 días. El clon III se recuperó casi exclusivamente de materiales no respiratorios; sólo 1 de 6 aislamientos se recuperó del TRI y 3 de las 4 bacteriemias documentadas en este trabajo correspondieron a aislamientos de este clon, el cual presentó también altos recuentos bacterianos en la prueba de adhesión a catéteres, pero perdió la viabilidad en medios inanimados en menos de 48 h. Las características primordiales de los aislamientos del clon IV fueron: recuperación de pacientes con un menor tiempo de internación en la UCI y que no habían recibido imipenem con anterioridad, y la habilidad de mantener la viabilidad en medios inanimados durante varios días. Los antimicrobianos más activos fueron la minociclina y la tigeciclina. Sólo un aislamiento perteneciente al clon I fue resistente a colistina. Si bien se observó variación intraclonal de la sensibilidad a los antimicrobianos, el clon I sólo fue sensible a tetraciclinas y colistina, mientras que el clon III fue sensible, además, a gentamicina y levofloxacina. El clon IV presentó sensibilidad variable a dichos antibióticos (Tabla 3).
Tabla 2. Características microbiológicas y epidemiológicas de los distintos clones de A. baumannii resistentes a carbapenemes aislados en la UCI del Hospital de Clínicas, Universidad de Buenos Aires

Tabla 3. Sensibilidad a los antimicrobianos de los distintos clones de A. baumannii resistentes a los carbapenemes aislados en la UCI del Hospital de Clínicas, Universidad de Buenos Aires
Discusión
Las infecciones por A. baumannii son endémicas en las UCI en muchos centros asistenciales de la Argentina. En estas circunstancias, la importancia de los reservorios ambientales es relativa, y los pacientes ya colonizados constituyen los principales focos de diseminación (11). Los clones involucrados son de comportamiento epidémico y se caracterizan por su habilidad de transmitirse rápidamente entre pacientes y entre el paciente y su entorno, colonizar la piel, resistir la desecación en superficies inanimadas y presentar resistencia a los antimicro-bianos y desinfectantes (5, 20).
La diseminación interhospitalaria, la policlonalidad y la permanencia en el tiempo de esta clase de clones han sido observadas por varios autores (6, 8, 19).
En nuestro país, esta situación ha sido documentada por Limanski et al. (9) en la provincia de Santa Fe y por Catalano et al. en la ciudad de Buenos Aires (3). Sin embargo, pocos autores han centrado su atención en las características propias de cada clon coexistente en la endemia y si éstas condicionan el tipo de infección que causan.
El desarrollo de la infección por A. baumannii en los pacientes con ARM surge luego de la colonización de los sitios reutilizables del respirador o de las manos del personal de salud (5, 10). Debido a ello, la capacidad de adherirse y colonizar superficies inanimadas favorecería la contaminación de los equipos biomédicos (4, 13). En nuestro estudio, este hecho fue evidenciado principalmente por los aislamientos del clon I; aunque el clon III, que es el único que no prevaleció en las infecciones y colonizaciones respiratorias (Tabla 1), también mostró elevada adherencia a catéteres (Tabla 2). En los pacientes hospitalizados, la presencia de vías para diagnóstico y tratamiento (catéteres centrales y periféricos, sondas y ARM) es habitual. En nuestro trabajo, éstos se observaron en más del 90% de los pacientes. Por lo tanto, la capacidad de algunos microorganismos –entre ellos A. baumanni– para adherirse a tales superficies es un factor de virulencia que favorece el desarrollo de ciertas infecciones. En el clon III se observan aislamientos con alto número de microorganismos viables unidos a los catéteres, sobre todo en aquellos que se aislaron de hemocultivos, circunstancia que fortalece la idea del catéter como puerta de entrada de la bacteriemia. En el clon IV predominaron los aislamientos con bajo número de viables adheridos a catéteres, mientras que en el clon I se observaron resultados intermedios.
Otra característica que permitiría a estos clones tener comportamiento epidémico es la capacidad de resistir la desecación y permanecer viables durante largos períodos de tiempo en materiales inertes convirtiéndolos en vehículos de diseminación, junto con las manos del personal de salud. Todos los microorganismos del clon I permanecieron viables en materiales inanimados durante períodos superiores a 14 días, capacidad que facilitaría su diseminación y su carácter de clon predominante. En cambio, en la mayoría de los aislamientos del clon III, el número de viables disminuyó notablemente después de las 48 h.
Aunque esto depende del grado de colonización (presión de colonización) de las unidades sanitarias, la mayoría de las infecciones ocurren en los primeros 10 días (10). No obstante, nosotros observamos que la adquisición de las infecciones fue, en general, después de periodos más largos. En términos comparativos, el clon IV se aisló antes que los otros clones, y en esta característica probablemente influyó el hecho de que ninguno de los pacientes involucrados en esos aislamientos recibió imipenem como tratamiento previo(Tabla 2). Si bien, por definición, todos los aislamientos son resistentes a carbapenemes, el clon I es el que presenta mayor nivel de resistencia a los antimicrobianos, lo que permitió la colonización/infección de los pacientes que recibieron como tratamiento, al comienzo de su internación, cefalosporinas de tercera generación. En cambio, en virtud de la sensibilidad del clon III a dichos agentes, sólo un paciente que fue tratado con este antimicrobiano se colonizó con dicho clon. El clon IV y otros clones con menor número de aislamientos (II, VI), que poseen un perfil de resistencia a las cefalosporinas igual que el clon I, se recuperaron de algunos pacientes que recibieron ceftriaxona. Por lo tanto, la multirresistencia permite a algunos clones estar mejor adaptados para colonizar/infectar a pacientes que reciben múltiples tratamientos antibióticos, aunque no sería éste el único factor.
Pocos estudios centraron su atención en encontrar diferencias de virulencia o adaptación al medio hospitalario entre clones endémicos que coexisten en un mismo hospital durante más de 10 años. Wroblewska et al. no hallaron relación entre las cepas productoras de biopelí-culas y los sitios de infección, la resistencia a los antimi-crobianos y los clones (23), mientras que un trabajo más extenso de Rodríguez-Baño et al. informa vínculos entre los aislamientos productores de biopelículas y el tipo de infección, el tratamiento previo y la resistencia a los antibióticos (13).
Si bien el presente estudio cuenta con un número escaso de cepas estudiadas para delinear conclusiones definitivas y se detecta variación intraclonal, ciertas características parecen ser más observadas en unos clones que en otros y éstas influirían en el tipo de infecciones/colonizaciones que provocan y en la dinámica interre-lación que existe entre ellos, que permite a unos prevalecer sobre otros en el medio hospitalario.
1. Bantar C, Famiglietti A, Goldberg M. Three-year surveillance study of nosocomial bacterial resistance in Argentina. Intern J Infect Dis 2000; 4: 85-90. [ Links ]
2. Bantar C, Famiglietti A, Radice M, Quinteros M, SIR Participants Group. A 7-year national survey on bacterial resistance in bronchoalveolar lavage from patients hospitalized in Argentina. Diagn Microbiol Infect Dis 2007; 60: 65-9. [ Links ]
3. Barbolla RE, Centrón D, Di Martino A, Maimone S, Salgueira C, Famiglietti A, et al. Identification of an epidemic carbapenem-resistant Acinetobacter baumannii strain at hospitals in Buenos Aires City. Diag Microbiol Inf Dis 2003; 45: 261-4. [ Links ]
4. Benítez L, Ricart M. Pathogenesis and environmental factors in ventilator-associated pneumonia. Enferm Infecc Microbiol Clin 2005; 23: 23-7. [ Links ]
5. Catalano M, Quelle L, Jeric P, Di Martino A, Maimone S. Survival of Acinetobacter baumannii on bed rails during an outbreak and during sporadic cases. J Hosp Infect 1999; 42: 27-35. [ Links ]
6. Cisneros JM, Rodríguez-Baño J, Fernández-Cuenca F, Ribera A, Vila J, Pascual A, et al. Risk-factors for the acquisition of imipenem-resistant Acinetobacter baumannii in Spain: a nationwide study. Clin Microbiol Infect 2005; 11: 874-9. [ Links ]
7. Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically. Approved standard M7-A7. 2006; Wayne, Pa, USA. [ Links ]
8. Dijkshoorn L, Aucken H, Gerner-Smidt P, Janssen P, Kaufmann M, Garaizar J, et al. Comparison of outbreak and nonoutbreak Acinetobacter baumannii strains by genotypic and phenotypic methods. J Clin Microbiol 1996; 34: 1519-25. [ Links ]
9. Limansky A, Marchiaro P, Cera G, Mussi A, Guardati C, Gregorini E, et al. Epidemiología molecular y resistencia a antibióticos en A. baumannii multirresistentes. IV Actividad Científica Anual de la Sociedad Argentina de Bacteriología Clínica, 2006, Resumen 16419, p. 30. Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
10. Marchaim D, Navon-Venezia S, Schwartz D, Tarabeia J, Fefer I, Schwaber M, et al. Surveillance cultures and duration of carriage of multidrug-resistant Acinetobacter baumannii. J Clin Microbiol 2007; 45: 1551-5. [ Links ]
11. Martínez-Pellus A, Ruiz Gómez J, Sánchez F, Córdoba E, Fernández Lozana J. Incidence of colonization and infection by Acinetobacter baumannii in an endemic setting (ICU). Analysis of risk factors by means of a surveillance study. Enferm Infecc Microbiol Clin 2002; 5: 194-9. [ Links ]
12. Moura Costa GF, Tognim MC, Cardoso CL, Carrara-Marrone FE, Garcia LB. Preliminary evaluation of adherence on abiotic and cellular surfaces of Acinetobacter baumannii strains isolated from catheter tips. Braz J Infect Dis 2006; 10: 346-51. [ Links ]
13. Rodríguez-Baño J, Martí S, Soto S, Fernández-Cuenca F, Cisneros JM, Pachón J, et al. Biofilm formation in Acinetobacter baumannii: associated features and clinical implications. Clin Microbiol Infect 2008; 14: 276-8. [ Links ]
14. Rodríguez CH, Juárez J, de Mier C, Pugliese ML, Blanco G, Vay C, et al. Resistencia a antibióticos de bacilos gram-negativos aislados en unidades de cuidados intensivos. Análisis comparativo de dos años (1998-2001). Medicina (Buenos Aires) 2003; 63: 21-7. [ Links ]
15. Rodríguez CH, Bombicino K, Granados G, Vay C, Famiglietti A. Epidemiología molecular de aislamientos de Acinetobacter baumannii de la unidad de cuidados intensivos del Hospital Universitario. Medicina (Buenos Aires) 2008; 68 Supl 1: 26. [ Links ]
16. Seirfert H, Dolzani L, Bressan R, van der Reijden T, van Strijen B, Stefanik D, et al. Standardization and interlaboratory reproducibility assessment pulsed-field electrophoresis generated fingerprints of Acinetobacter baumannii. J Clin Microbiol 2005; 43: 4328-35. [ Links ]
17. Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995; 33: 2233-9. [ Links ]
18. Vaneechoutte M, Dijkshoorn L, Tjernberg I, Elaichouni A, de Vos P, Claeys G, et al. Identification of Acinetobacter genomic species by amplified ribosomal DNA restriction analysis. J Clin Microbiol 1995; 33:11-5. [ Links ]
19. Villari P, Iacuzio L, Vozzella F, Bosco U. Unusual genetic heterogeneity of Acinetobacter baumannii isolates in a university hospital in Italy. Am J Infect Control 1999; 27: 247-53. [ Links ]
20. Villegas MV, Harstein A. Acinetobacter outbreaks, 1977-2000. Infect Control Hosp Epidemiol 2003; 24: 284-95. [ Links ]
21. Wendt C, Dietze B, Dietz E, Ruden H. Survival of Acinetobacter baumannii on dry surfaces. J Clin Microbiol 1997; 35: 1394-7. [ Links ]
22. Weyland B, Perazzi B, Rodríguez C, Capdevilla A, Luna C, Lasala M, et al Etiología de la neumonía intrahospitalaria (NIH) en la unidad de cuidados intensivos y evaluación de la resistencia a los antimicrobianos. Medicina (Buenos Aires) 2006; 66: 9-10. [ Links ]
23. Wroblewska MM, Sawicka-Grzelak A, Marchel H, Luczak M, Sivan A. Biofilm production by clinical strains of Acinetobacter baumannii isolated from patients hospitalized in two tertiary care hospitals. FEMS Immunol Med Microbiol 2008; 53: 140-4. [ Links ]
Recibido: 07/04/09
Aceptado: 26/06/09














