Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.41 no.3 Ciudad Autónoma de Buenos Aires July/Sept. 2009
Mieles del sistema serrano de Ventania: evaluación de la calidad microbiológica dentro del circuito de la planta de extracción
L. M. Gallez*, L. A. Fernández
Departamento de Agronomía (UNS), San Andrés 850 (8000) Bahía Blanca, Argentina
*Correspondencia. E-mail: lgallez@uns.edu.ar
RESUMEN
La miel es un producto natural que presenta una carga microbiana muy baja. No obstante, durante el procesamiento empleado para transformarla en un producto comercial, que incluye una etapa de extracción, puede contaminarse. El objetivo de este trabajo fue evaluar la contaminación microbiológica en diferentes puntos del circuito dentro de las plantas de extracción de miel. En 50 muestras se cuantificó el número de hongos filamentosos y levaduras, así como el de coliformes totales, y se determinó la presencia de Salmonella spp. Todas las muestras provenientes de los panales y de los extractores centrífugos presentaron un recuento de hongos filamentosos y levaduras ≤ 10 UFC/g de miel, y ausencia de coliformes. Sin embargo, se evidenciaron problemas de contaminación en la etapa de separación cera-miel de los opérculos, con indicios de que el sistema en frío implicaría mayores riesgos. De un total de 30 muestras procedentes de la bomba o de los tambores, 4 presentaron recuentos de hongos filamentosos y levaduras entre 10 y 50 UFC/g de miel. El presente trabajo muestra la importancia de prevenir contaminaciones provenientes de la separadora cera-miel y también la necesidad de realizar estudios microbiológicos en las plantas de extracción, ya que éstos podrían contribuir a determinar los puntos críticos en los sistemas de control de calidad.
Palabras clave: Calidad microbiológica; Miel; Sistema de Ventania; Planta de extracción
ABSTRACT
Honeys from Ventania system: microbiological quality evaluation at different points of honey-processing. One stage of honey production is extraction. Honey is a product with minimal types and levels of microorganisms; however it could be contaminated during its manipulation. The aim of this work was to evaluate the microbiological contamination of honey at different processing points. Mould and yeast, total coliform number as well as the presence of Salmonella spp. were determined in 50 samples. All comb and centrifugal honey-extractor samples showed low levels of mould and yeast (≤10 CFU/g of honey) and an absence of total coliforms. Contamination problems were observed at the uncapping stage of beeswax-capped honey separation, showing that the unheated honey process would imply more risks. Ten to fifty CFU/g of honey of mould and yeast were observed in four out of 30 samples from the honey pump and drums. The present work shows the importance of preventing contamination at the beeswax-honey separation stage, and also highlights the need to perform microbiological studies in the honeyhouse, which would contribute to determine critical points in control quality systems.
Key words: Microbiological quality; Honey; Ventania system; Honeyhouse
INTRODUCCIÓN
Durante la última década, la República Argentina se ha posicionado entre los tres primeros exportadores mundiales de miel, siendo el total exportado durante el año 2008 de 68.940 t (8). En el mismo año, la contribución de la provincia de Buenos Aires a la producción nacional, que fue de 72.000 t, representó más del 40% (18).
La producción de miel consta de varias etapas. Durante la primera, las abejas acopian el néctar dentro de la colmena y lo modifican para transformarlo en miel. Una vez que la miel está madura, el apicultor retira los cuadros que enmarcan los panales y los lleva a una planta de extracción o sala de extracción. Esta segunda etapa productiva consta de varios pasos y no está estandarizada, razón por la cual los diseños de las plantas y los equipos son variados.
Para extraer la miel de los panales es necesario previamente cortar o romper los opérculos de cera. Este proceso de desoperculado y la posterior separación de la miel que quedó en los opérculos pueden llevarse a cabo con la utilización de calor o sin ella. La temperatura de fusión de la cera es 62-66 °C (3) y por tanto, en la separación comúnmente denominada en caliente, la miel de los opérculos permanece a temperaturas superiores a 70 °C durante un lapso de varias horas, dependiendo del manejo de la sala. Esto conduce a un aumento indeseable del contenido de hidroximetilfurfural en la miel (4, 17, 20), razón por la cual este sistema está siendo progresivamente reemplazado por la separación en frío, por extrusión o por centrifugado de los opérculos. En estos sistemas, los cuadros desoperculados se colocan en el extractor, que actúa por centrifugación, y la miel cae en una batea o una fosa (11). En los circuitos estudiados, la miel de los opérculos se reúne con la que sale del extractor y luego, por medio de una bomba, es elevada para cargar los tanques decantadores y/o los tambores.
La miel presenta una carga muy baja de microorganismos debido a su baja actividad de agua (aW) y su bajo pH (4, 15); no obstante, como cualquier otro alimento, puede sufrir contaminaciones durante su manipulación. La presencia ocasional o accidental de microorganismosen la miel proviene de locales inapropiados, de insectos y animales domésticos en las instalaciones y del uso de material sometido a un deficiente proceso de desinfección, entre otros (16). Los análisis microbiológicos de la miel permiten determinar falencias en los procesos de extracción, envasado, transporte y almacenamiento (21).
La tendencia a diseñar e implementar programas de control de la calidad de los alimentos en la cadena de producción es ampliamente conocida. Éstos involucran el análisis físico, químico y microbiológico, así como la determinación de los puntos críticos de control (9, 14). Como ejemplos pueden mencionarse la producción de huevos de consumo y la de leche, en las que De Reu et al. (5) y Bonfoh et al. (1), respectivamente, analizaron la calidad microbiológica. No se han encontrado estudios similares referidos a la producción de la miel; por lo tanto, se planteó como objetivo de este trabajo evaluar la contaminación microbiológica de este producto en diferentes puntos del circuito dentro de las plantas de extracción de miel.
MATERIALES Y MÉTODOS
El estudio se realizó sobre 50 muestras de miel procedentes de plantas de extracción localizadas en la región serrana de Ventania, al sur de la provincia de Buenos Aires (Figura 1), de las cuales 30 fueron tomadas durante los meses de febrero y marzo de 2007 y 20 en febrero y marzo de 2008. Las muestras se tomaron asépticamente en potes de plástico de 100 ml de capacidad y se agruparon en series de acuerdo con su origen. La primera muestra de cada serie consistió en trozos de panales operculados provenientes del campo y almacenados en las alzas, a la espera de la extracción. Del lote que se estaba extrayendo en el momento de la toma de muestras se cortaron asépticamente tres fragmentos de panal (antes de ser desoperculado) de 8 por 5 cm aproximadamente, que fueron colocados en un frasco estéril de boca ancha. Las siguientes muestras fueron tomadas de distintos puntos dependiendo del diseño de la planta de extracción. El número de muestras tomadas del tambor fue superior al de las tomadas de otros puntos de la cadena debido a que aquel constituye el envase para la exportación de la miel y el punto de toma de muestras de mayor relevancia comercial.
Figura 1. Sistema serrano de Ventania (Provincia de Buenos Aires), mostrando la zona de procedencia de las 50 muestras de miel.
Los estudios microbiológicos consistieron en la determinación del número de hongos filamentosos y levaduras, así como el de coliformes totales y la presencia de Salmonella spp., parámetros microbiológicos establecidos en el CAA-Anexo MERCOSUR (2). Se siguió la metodología descrita por la Comisión Internacional sobre Especificaciones Microbiológicas para los Alimentos (ICMSF, su sigla en inglés) (10). Para ello se diluyeron 10 g de miel en 90 ml de agua peptonada (Britania, CABA, Argentina) y se hizo una dilución más en un tubo con 9 ml de agua destilada estéril. Luego se tomó 1 ml de cada dilución y se sembró en placas de Petri por duplicado mediante la técnica de agar volcado. La miel de las muestras de panal se obtuvo prensando los fragmentos envueltos en gasa estéril en un instrumento metálico estéril.
Los hongos filamentosos y levaduras se analizaron en medio de cultivo para hongos y levaduras (HyL, Britania) con cloranfenicol. Las cajas sembradas se incubaron a 20-24 °C durante 3-5 días.
La presencia de bacterias coliformes se estudió en el medio agar bilis y rojo violeta (BARV, Britania). Las cajas sembradas se incubaron a 37 °C durante 24 h.
La presencia de Salmonella spp. se estudió sólo en las muestras que presentaron recuentos superiores a los límites permitidos de hongos filamentosos y levaduras o de bacterias coliformes. Para ello, se trabajó realizando un enriquecimiento previo a partir de una dilución de 25 g de miel en 225 ml de agua peptonada (Britania). Luego se realizó un enriquecimiento selectivo, para lo cual se tomó 1 ml del preenriquecimiento y se colocó en tubos de ensayo de vidrio con 10 ml de caldo selenito cistina (Britania) y otro ml se colocó en caldo tetrationato (Britania). Los tubos se incubaron durante 24 h a 43 °C. El enriquecimiento selectivo en placas consistió en la siembra en estrías en los medios agar verde brillante, agar EMB y agar Salmonella-Shigella (Britania) a partir de los tubos previamente descritos. La identificación de colonias sospechosas se realizó mediante pruebas bioquímicas en tubos de ensayo con agar triple azúcar hierro (TSI, Britania) y agar hierro lisina (Britania). Las placas del enriquecimiento selectivo, así como los tubos de las pruebas bioquímicas, se incubaron en estufa a 35-37 °C durante 24-48 h.
RESULTADOS
Los resultados de los análisis microbiológicos se presentan en la Tabla 1. Todas las muestras provenientes del panal, así como las del extractor centrífugo, mostraron una carga microbiana muy baja de hongos filamenosos y levaduras (≤10 UFC/g de miel) y ausencia de organismos coliformes.
En la etapa de separación de la miel de los opérculos, 3 de las 5 muestras obtenidas presentaron altos niveles de contaminación por hongos filamentosos y levaduras (13,5; 135,0 y 300,0 UFC/g de miel) (Tabla 1). En las 2 muestras cuyos recuentos superaron 100 UFC/g de miel se observaron colonias de Escherichia coli (Tabla 1) y de Acinetobacter spp. y en una de ellas, colonias sospechosas de Salmonella spp. Esta muestra fue conservada para confirmar la presencia bacteriana mediante identificación serológica.
Tabla 1. Resultados de los análisis microbiológicos efectuados en distintos puntos de control del circuito de la miel dentro de las plantas de extracción
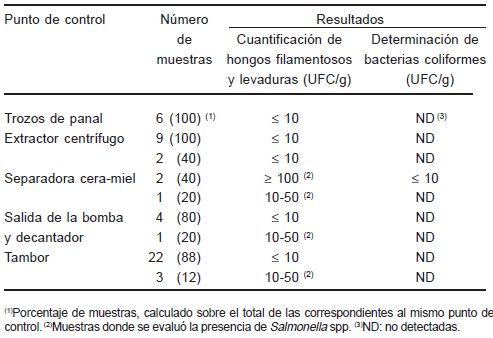
De un total de 30 muestras procedentes de la salida de la bomba y de los tambores, en 4 se observaron entre 10 y 50 UFC/g de miel de hongos filamentosos y levaduras. Se descartó la presencia de Salmonella spp. por haber resultado negativo el enriquecimiento selectivo en tubos.
DISCUSIÓN
La Secretaría de Agricultura, Ganadería, Pesca y Alimentos indica a través de su guía (16) que la implementación de buenas prácticas durante la cosecha y el transporte de alzas desde el colmenar hasta la sala de extracción tiende a minimizar los riesgos de contaminación. Los panales, de acuerdo con los resultados obtenidos, no presentaron más de 10 UFC/g de miel de hongos filamentosos y levaduras, como tampoco organismos coliformes. Esto permite inferir que en aquellos casos en los que se detectaron contaminaciones en los tambores de miel, éstas serían atribuibles a problemas de higiene y sanidad en el circuito dentro de la planta de extracción.
Los resultados de las muestras provenientes del extractor indican que el riesgo de contaminación en esta etapa no fue relevante. En coincidencia con la bibliografía (13, 17), más del 75% de la miel que producen las plantas estudiadas procede del extractor, razón por la cual es muy importante que no presente contaminación microbiológica.
Dadas las diferencias con respecto a los resultados de las etapas recién descritas, los hallazgos referidos a la etapa de separación de la miel de los opérculos requieren un análisis más detallado. Son esperables mayores niveles de contaminación en la miel de los opérculos que en la del extractor, debido a que los opérculos constituyen la superficie de los panales, expuesta a posibles fuentes de contaminación de la misma colmena y del transporte hasta la sala de extracción, sumado al hecho de que los fragmentos de panales rotos y con cría suelen verterse en la separadora de opérculos. Las tres muestras provenientes de plantas con sistema de separación en frío presentaron bacterias indeseables y altos recuentos de hongos filamentosos y levaduras. En contraposición, las dos muestras que mostraron bajos niveles de hongos filamentosos y levaduras correspondieron al sistema de separación en caliente, por fusión de la cera. Las diferencias encontradas podrían ser atribuidas, por un lado, a que las altas temperaturas que alcanza la miel en la batea separadora reducen la carga de microorganismos (4). Por otro lado, la maquinaria utilizada para la separación en frío en las salas estudiadas utiliza la fuerza centrífuga y moviliza un gran volumen de aire cuyas partículas quedan retenidas en la miel; esto genera una fuente adicional de contaminación de la miel de los opérculos separada en frío.
El uso de separadoras en caliente deteriora la calidad de la miel de los opérculos, al modificar los aromas y sabores originales, provocar su oscurecimiento, reducir su actividad enzimática y aumentar el contenido de hidroximetilfurfural (4, 17, 20). Por estas razones se recomienda darle usos alternativos al de la miel de mesa; no obstante, en la mayor parte de las salas de extracción se la mezcla con la miel que sale del extractor. El reemplazo de los equipos que utilizan calor por otros en frío tiene como objetivo evitar el deterioro de la miel de los opérculos. Sin embargo, los resultados de este trabajo indican que las separadoras en frío presentan una problemática diferente de las separadoras en caliente, que se relaciona con los riesgos de contaminación microbiológica.
Dado que la miel de los opérculos representa una pequeña fracción del total y que la miel del extractor no presentó niveles cuantificables de hongos filamentosos y levaduras, los problemas de contaminación surgidos en la separadora de opérculos se reducirían por un efecto de dilución. Esto permite explicar los resultados de los siguientes pasos en el circuito de extracción: bomba, decantador y tambor, en los cuales 13% de las muestras presentaron recuentos de hongos filamentosos y levaduras entre 10 y 50 UFC/g de miel. Es importante destacar que estas muestras correspondieron a las series en las que la miel de la separadora presentó niveles superiores a 100 UFC/g de miel, lo que proporciona evidencias de que la separación cera-miel constituye el paso de mayor riesgo de contaminación microbiológica.
En cuanto a las muestras de tambores, es posible comparar los resultados con los de otros investigadores (6, 7, 12, 19). La ausencia de Salmonella spp. y de bacterias coliformes en el total de las muestras de la cosecha 2007 y en el 90% de las de la cosecha 2008 coincidió con los resultados obtenidos en mieles procedentes de Resistencia (Prov. de Chaco) (6), de varias localidades de las provincias de Río Negro y Neuquén (7), y de la zona de Tandil (Prov. de Buenos Aires) (19). Con respecto a la cuantificación de mohos y levaduras, la proporción de tambores que superaron las 10 UFC/g en las muestras analizadas fue 12%, mientras que otros autores informaron niveles de 2% (19), 5% (7) y 90% (12).
El presente trabajo muestra la importancia de prevenir contaminaciones provenientes de la separadora cera-miel. También plantea la necesidad de realizar estudios microbiológicos en el circuito dentro de las plantas de extracción, los que podrían contribuir a determinar los puntos críticos en los sistemas de control de calidad y, en consecuencia, a mejorar el diseño de los equipos.
Agradecimientos: Los autores agradecen a la Secretaría General de Ciencia y Tecnología de la UNS el financiamiento del proyecto Mieles del sistema serrano de Ventania: identidad y calidad y la importante colaboración de los productores apícolas. Además, agradecen a Elian Tourn y a Marcelo Sagardoy por la lectura del manuscrito.
1. Bonfoh B, Wasem A, Traoré AN, Fané A, Spillmann H, Simbé CF, et. al. Microbiological quality of cow milk taken at different intervals from the udder to the selling point in Bamako (Mali). Food Control 2003; 14: 495-500. [ Links ]
2. Código Alimentario Argentino. Cap. X, p. 11-4 http://www.anmat.gov.ar/codigoa/caa1.htm (consultado el 12 de marzo de 2009). Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, Ministerio de Salud de la Nación (República Argentina). [ Links ]
3. Coggshall WL, Morse RA. Beeswax Production, Harvesting, Processing and Products. Cheshire Connecticut, U.S.A., Wicwas Press, 1995, p. 192. [ Links ]
4. Crane E. Bees and Beekeeping. Science, Practice and World Resources. Oxford, Heinemann News Press, 1990, p. 614. [ Links ]
5. De Reu K, Grijspeerdt K, Heyndrickx M, Uyttendaele M, Herman L. The use of total aerobic and Gram-negative flora for quality assurance in the production chain of consumption eggs. Food Control 2005; 16: 147-55. [ Links ]
6. Douthat de Toledo L, Chamorro E, Sequeiro A, Velasco G. Aislamiento e identificación de hongos en mieles, equipamiento y medio ambiente en una sala de extracción de la zona apícola de la provincia de Chaco. Revista Conexiones Parte II (Universidad de la Cuenca del Plata, Argentina) 2006; 1-4. [ Links ]
7. Esponda JC, Álvarez R, Milanesi I, Carreño V, Cervantes J. Evaluación de la calidad físico-química y microbiológica de mieles cosechadas en las provincias de Río Negro y Neuquén. Alimen Latinoam 2006; 263: 62-8. [ Links ]
8. Graham JM. World honey market. Am Bee J 2009; 149: 201-4. [ Links ]
9. Hathaway SC, Cook RL. A regulatory perspective on the potential uses of microbial risk assessment in international trade. Int J Food Microbiol 1997; 36: 127-33. [ Links ]
10. ICMSF. Segunda Edición. Microorganismos de los alimentos Volumen I: su significado y métodos de enumeración. Zaragoza, Ed. Acribia S.A., 2000, p. 137, 165-79. [ Links ]
11. Morse RA, Hooper T. Enciclopedia ilustrada de Apicultura. Buenos Aires, Ed. El Ateneo, 1992, p. 386. [ Links ]
12. Mouteira MC, Leveratto D, Pérez R, Moldes C. Mejoramiento de la calidad de miel. Ciencia y Abejas 2004; 47: 2-6. [ Links ]
13. Oksmann M. Lecciones de Apicultura. Práctica del colmenar. Buenos Aires, Ed. Mattone H., 1990, p. 351. [ Links ]
14. Opara LU. Traceability in agriculture and food supply chain: a review of basic concepts, technological implications, and future prospects. Food Agric Environ 2003; 1: 101-6. [ Links ]
15. Piana G, Ricciardelli D´Albore G, Isola A. La Miel. Madrid, Ed. Mundi-Prensa, 1989, p. 107. [ Links ]
16. Secretaria de Agricultura, Ganadería, Pesca y Alimentos. Guía de aplicación de buenas prácticas apícolas y de manufactura. 2003, Buenos Aires, p. 34. [ Links ]
17. Root AI. ABC y XYZ de la Apicultura. Enciclopedia de la cría científica y práctica de las abejas. Buenos Aires, Ed. Hachette S.A., 1976, p. 670. [ Links ]
18. Secretaría de Agricultura, Ganadería, Pesca y Alimentos. Distribución de producción de miel por provincia. http://www.alimentosargentinos.gov.ar/apicola/ (consultado el 2 de marzo de 2009). Área Apícola, Dirección Nacional de Agroindustria (República Argentina). [ Links ]
19. Tabera AE, Libonatti CC, Díaz M. Relevamiento de muestras de mieles procedentes de la zona de Tandil. Boletín Apícola de la SAGPyA 2002; 20: 13-7. [ Links ]
20. Tosi E, Ciappini M, Re E, Lucero H. Honey thermal treatment effects on hydroxymethylfurfural content. Food Chem 2002; 77: 71–4. [ Links ]
21. Zamora Fallas LG, Arias ML. Análisis microbiológicos de la miel de la abeja Apis mellifera para uso terapeútico. Actas, VIII Congreso Nacional de Apicultura: inocuidad de los productos apícolas, 2005, p. 41-8, San José, Costa Rica. [ Links ]
Recibido: 12/05/09
Aceptado: 08/07/09














